不同GI与CBI组合饲粮对牦牛瘤胃和直肠细菌区系的影响
2022-05-31郝文君夏洪泽崔占鸿刘书杰周玉青
郝文君,夏洪泽,焦 洋,崔占鸿,刘书杰,周 磊,周玉青
(1.青海大学畜牧兽医科学院,西宁 810016;2.青海省牦牛工程技术研究中心,西宁 810016;3.青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁 810016;4.海北藏族自治州高原生态畜牧业科技示范园管委会,海北 812200)
牦牛是青藏高原地区特有的放牧家畜,对高寒、高海拔环境具有较强的适应性[1]。碳水化合物为牦牛生长发育和消化道微生物提供重要营养物质且影响瘤胃和肠道细菌区系构成[2]。碳水化合物平衡指数(CBI)是评价饲粮中碳水化合物组成的重要指标,物理有效中性洗涤纤维(peNDF)和瘤胃可降解淀粉(RDS)对CBI起到决定性作用,CBI在一定条件下会随着peNDF水平的升高而升高[3],而RDS水平会影响到饲粮中性洗涤纤维(NDF)与非纤维性糖类(NFC)的水平,进而影响CBI[4]。反刍动物饲草类型和品种繁多且品质参差不一,评价饲草品质的标准不一[5]。2001年,卢德勋[6]首次提出粗饲料分级指数(GI)的概念,即校正粗饲料中粗蛋白质(CP)和NDF含量,得到粗饲料可利用能的随意采食量。GI被广泛用来评价粗饲料品质。不同GI和不同CBI组合饲粮对反刍动物的营养物质养分表观消化率、生长性能以及泌乳量的影响均有差异[7-8]。瘤胃和肠道中存在大量细菌等微生物,其分泌的消化酶是帮助反刍动物消化饲粮和提供营养物质的关键因素之一[9-10],而饲粮结构是影响瘤胃和肠道细菌区系的重要因素之一[11]。
前期研究发现,基于表观消化率以及生长性能等指标得出:玉米青贮-苜蓿干草组合中GI=7.19时组合效果最优,玉米青贮-燕麦干草组合中GI=1.31时组合效果最优,玉米青贮-小麦秸秆组合中GI=0.96时组合效果最优;CBI=2.45的饲粮相较于CBI=1.17、5.67的饲粮更有利于舍饲牦牛瘤胃发酵和对饲料养分的消化吸收[12-13],且不同饲粮组合对牦牛的发育影响各有优劣[14]。目前关于不同GI与CBI组合饲粮对牦牛瘤胃和肠道细菌区系的研究鲜有报道,本研究以成年舍饲牦牛为研究对象,配制不同GI和CBI组合的全混合饲粮(TMR),基于16S rRNA测序技术,分析不同类型饲粮对牦牛瘤胃和直肠细菌区系组成的影响,为生产实践中舍饲牦牛营养物质消化吸收的调控以及饲粮合理配制提供理论参考。
1 材料与方法
1.1 试验动物及饲养管理
选用12头3.5岁健康、体重为256.0 kg±15.0 kg的公牦牛,随机分为3组,分别饲喂3种TMR饲粮,即玉米青贮-苜蓿干草-精料(CAC)、玉米青贮-小麦秸秆-精料(CWC)和玉米青贮-燕麦干草-精料(COC)。 CAC组饲粮GI=7.19、CBI=2.45;CWC组饲粮GI=0.96、CBI=2.45;COC组饲粮GI=1.31、CBI=2.45,3种饲粮的组成及其营养水平见表1。
试验地点在青海省湟中丰泰种养殖专业合作社,试验期28 d,其中预饲期7 d,正式期21 d,试验牛为单栏饲养,试验圈舍卫生通风良好、阳光充足并定期消毒。牦牛每天分早晚两次饲喂(08:00和17:00),自由饮水。
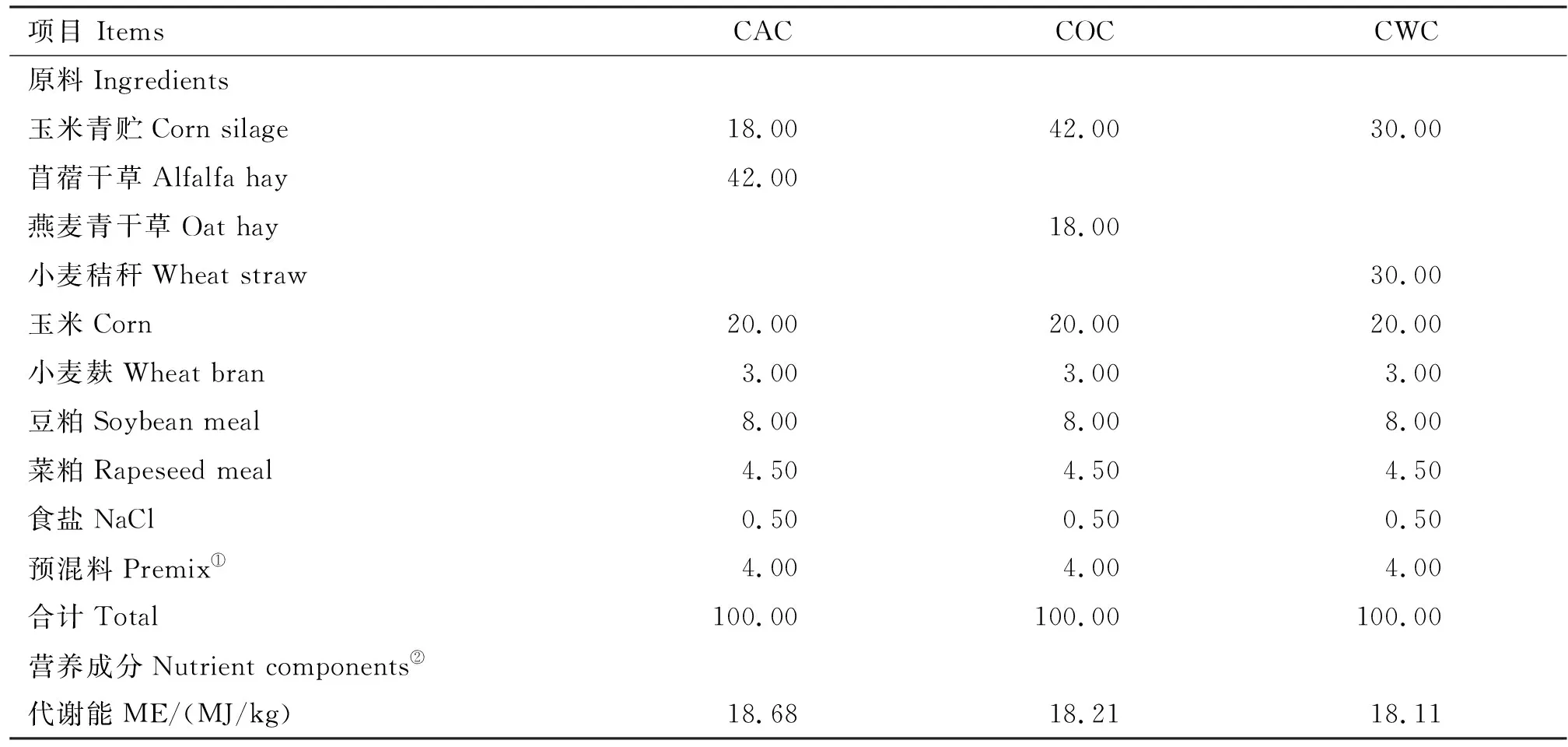
表1 试验饲粮组成及营养水平(干物质基础)
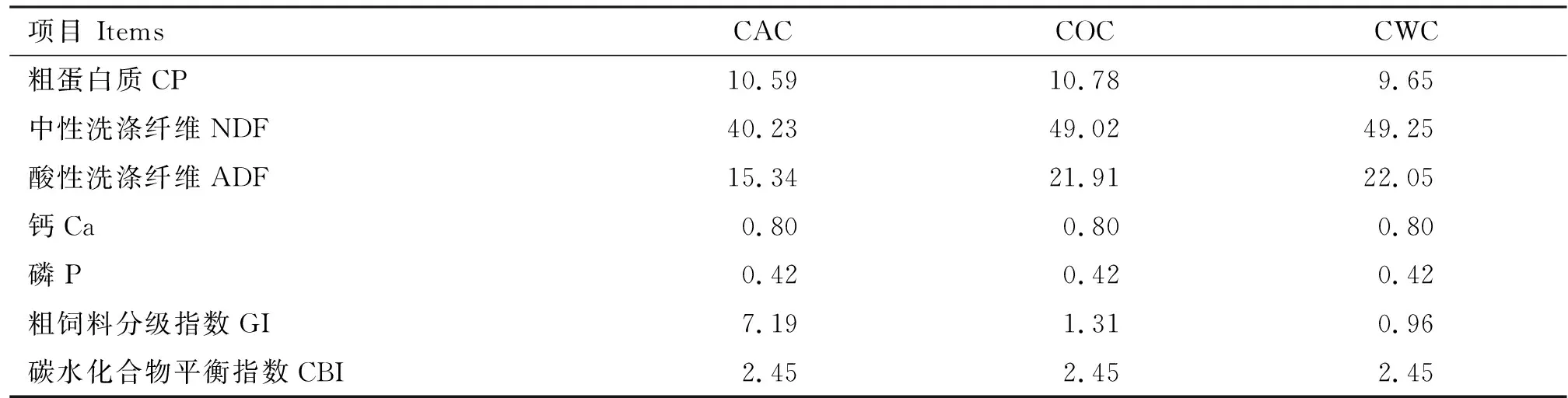
续表
1.2 样品采集和贮存
试验最后1天晨饲2 h后,将试验牛固定在饲喂栏上,通过胃管法采集牦牛瘤胃液,分装于15 mL无菌冻存管,于液氮中保存待测;从牦牛直肠中掏取粪样,分装于5 mL无菌冻存管中,于液氮中保存待测。
1.3 测定指标及方法
1.3.1 DNA 提取及16S rRNA测序 采用SDS方法提取样本基因组DNA,2.0%琼脂糖凝胶电泳检测DNA纯度和完整性。使用Barcode特异引物,以1 ng/mL基因组DNA为模板,进行PCR扩增,引物对应区域:通用引物V338F(5′-ACTCC-TACGGGAGGCAGCAG-3′)和V806R(5′-GGAC-TACHVGGGTWTCTAAT-3′)。PCR反应体系20 μL:模板DNA 10 μL,上、下游引物各0.8 μL,2.5 mmol/L dNTPs 2.0 μL,FastPfu 聚合酶0.4 μL,5×FastPfu缓冲液4 μL,最后加ddH2O至20 μL。扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸5 min,2.0%琼脂糖凝胶电泳检测其产物。用胶回收试剂盒(Qiagen 公司)回收目的条带,利用Illumina MiSeq平台(北京诺禾致源科技股份有限公司)对细菌扩增子进行测序。
1.3.2 测序数据处理 根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数,截去Barcode和引物序列后,使用FLASH对每个样本的reads进行拼接得到Raw Tags,过滤处理得到高质量的Tags数据,去除嵌合体序列得到最终的Effective Tags。采用Uparse软件(v 7.0.1001)以97%的一致性将序列聚类成为操作分类单元(OTUs)并筛选代表序列,用Mothur方法与SILVA 132的SSUrRNA数据库进行物种注释分析,并统计在门和属水平上的群落组成。应用QIIME 1.7.0进行α多样性分析,计算 Chao1、Shannon、Simpson、Ace等指数,分析样本物种多样性的复杂性。用β多样性分析评价物种复杂度的差异,用QIIME 1.7.0计算Unifrac 距离,进行PCoA分析,以R软件V 2.15.3绘制PCoA图。
1.3.3 功能分析 通过提取KEGG数据库原核全基因组16S rRNA基因序列,使用BLASTN算法(BLAST Bitscore>1 500)将其与SILVA SSU Ref NR数据库对齐建立相关矩阵,将通过UProC和PAUDA注释的KEGG数据库的原核全基因组功能信息对应SILVA数据库,得到功能注释。
1.4 数据统计分析
通过SPSS 20.0软件的ANOVA程序进行单因素方差分析,存在显著差异时,采用Duncan氏SSR法进行多重比较。结果以平均值±标准差表示,以P<0.05作为差异显著的判断标准。
2 结 果
2.1 牦牛瘤胃和直肠细菌区系α多样性分析
瘤胃微生物共得到4 258个OTUs,其中CAC组独有309个,COC组独有256个,CWC组独有886个。直肠微生物共得到3 889个OTUs,其中CAC组独有1 799个,COC组独有143个,CWC组独有227个(图1)。
由表2可知,3组牦牛瘤胃和直肠细菌区系的Chao1指数、Ace指数、Simpson指数和Shannon指数差异均不显著(P>0.05)。
2.2 牦牛瘤胃和直肠细菌区系β多样性分析
基于样本的OTU信息,计算样本之间的加权遗传距离矩阵并进行PCoA分析,结果见图2。CAC组与COC组的瘤胃细菌区系有PC1差异(P<0.05),直肠细菌区系差异不显著(P>0.05)。

A、B和C,分别表示CAC、COC和CWC组瘤胃样品;E、F和G,分别表示CAC、COC和CWC组直肠样品。下同A,B and C,Indicated the rumen samples of CAC,COC and CWC groups, respectively.E,F and G,Indicated the rectal samples of CAC,COC and CWC groups, respectively.The same as below图1 3组牦牛瘤胃和直肠细菌区系OTU韦恩图Fig.1 OTU Venn diagram of rumen and rectum bacterial flora of yak in 3 groups

表2 3组牦牛瘤胃和直肠细菌区系α多样性分析

图2 3组牦牛瘤胃和直肠细菌区系PCoA分析Fig.2 PCoA analysis of rumen and rectal bacterial flora of yaks in 3 groups
2.3 牦牛瘤胃和直肠细菌区系在门水平上的组成差异
经分类学分析,本试验共检测到50个菌门。分别选择样品微生物在门水平上相对丰度排名前十的物种进行比较。
瘤胃细菌区系最丰富的门包括拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)(图3)。CAC、COC、CWC组瘤胃细菌拟杆菌门占比分别为52.05%、59.25%、52.90%,厚壁菌门分别为40.49%、33.49%、35.40%,变形菌门(Verrucomicrobiota)分别为0.53%、1.02%、1.98%,螺旋体门(Spirochaetes)分别为0.51%、0.88%、0.77%,广古菌门(Euryarchaeota)分别为1.61%、0.95%、1.14%。CWC组瘤胃放线菌门(Actinobacteriota)与CAC、COC组存在显著差异(P<0.05)。
直肠细菌区系中最丰富的门包括拟杆菌门、厚壁菌门、螺旋体门、疣微菌门(Euryarchaeota)、变形菌门(图3)。 CAC、COC、CWC组直肠细菌拟杆菌门占比分别为33.45%、30.62%、25.83%,厚壁菌门分别为48.52%、50.94%、55.21%,螺旋体门分别为6.55%、5.92%、7.45%,变形菌门分别为1.46%、1.78%、2.29%,疣微菌门分别为1.65%、2.71%、0.90%。3组牦牛直肠细菌区系在门水平上差异不显著(P>0.05)。
2.4 牦牛瘤胃和直肠细菌区系在属水平上的组成差异
在属水平上对牦牛瘤胃和直肠细菌区系相对丰度>1%的细菌群落种类进行统计(图4),瘤胃细菌区系中相对丰度>1%的菌属有5个,相对丰度最高的为理研菌科-RC9-gut-group(Rikenellaceae-RC9-gut-group)、普雷沃氏菌属(Prevotella)和琥珀酸菌属(Succiniclasticum)。3组牦牛瘤胃细菌区系在属水平上差异不显著(P>0.05)。
直肠细菌区系中相对丰度>1%的菌属有6个,其中丰度最高的为瘤胃球菌科-UCG-005(Ruminococcaceae-UCG-005),其次为理研菌科-RC9-gut-group。3组牦牛直肠细菌区系在属水平上差异不显著(P>0.05)。

图3 3组牦牛瘤胃和直肠细菌区系在门水平上的相对丰度(前十)Fig.3 Relative abundance of microbial community at phylum level of rumen and rectum bacterial flora in yaks of 3 groups (top 10)

图4 3组牦牛瘤胃和直肠细菌区系在属水平上的相对丰度(前十)Fig.4 Relative abundance of microbial community at genus level of rumen and rectum bacterial flora in yaks of 3 groups (top 10)
2.5 细菌基因功能预测分析
本试验共匹配到39个KEGG二级代谢通路(图5),基因分类为细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢、生物系统,大多数基因功能属于膜转运、碳水化合物代谢、氨基酸代谢、复制与修复、翻译、能量代谢和核苷酸代谢等。
对39个代谢通路的相对丰度进行3组间比较(图6)。在瘤胃细菌区系中,复制与修复、原核细胞群体、细胞信号传递、环境适应通路在CAC与COC组存在显著差异(P<0.05);复制与修复、转录、核苷酸代谢、脂质代谢、原核细胞群体和老化通路在CAC与CWC组存在显著差异(P<0.05),脂质代谢、其他氨基酸代谢和老化通路在CWC组和COC组存在显著差异(P<0.05)。在直肠细菌区系中,与能量代谢有关的KEGG二级代谢通路在CAC与COC组间存在显著差异(P<0.05);膜转运、能量代谢、聚糖生物合成和代谢、辅助因子和维生素的新陈代谢、细胞运动、折叠降解、翻译和环境适应通路在CAC与CWC组存在显著差异(P<0.05);脂质代谢通路在CWC和COC组间存在显著差异(P<0.05)。
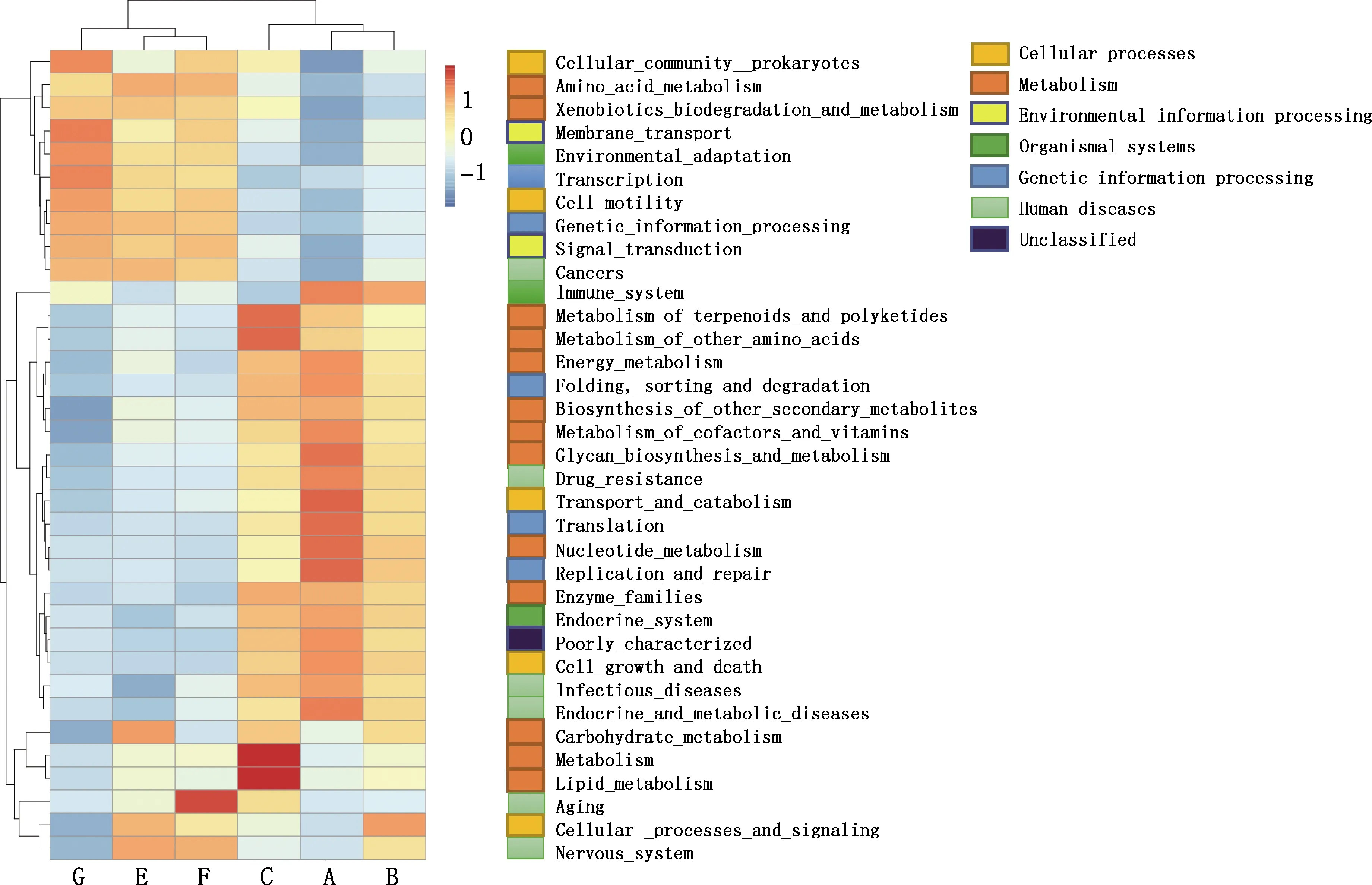
图5 功能基因预测热图Fig.5 Heat map of predicted function of microbiota
3 讨 论
3.1 不同GI与CBI组合饲粮对牦牛瘤胃细菌区系组成的影响
反刍动物瘤胃中含有种类繁多的细菌群落[15],瘤胃细菌对于降解饲料营养成分、维持瘤胃稳态及增强机体免疫力具有重要意义[16]。细菌区系的α多样性反映样品中细菌种类的多样性和丰富度,物种丰富度由Chao1指数和Ace指数来体现,二者数值越大,细菌群落丰富度越高。本试验中3组牦牛瘤胃细菌区系Chao1指数和Ace指数差异不显著,说明粗饲料品质对牦牛瘤胃微生物区系丰富度影响并不显著,但随着GI降低,Chao1指数和Ace指数均升高,说明在CBI相同的情况下,粗饲料品质差(GI小)有增加瘤胃细菌群落丰富度的趋势[17]。 物种多样性可由Shannon指数和Simpson指数体现,Shannon指数越高,群落多样性越丰富,Simpson指数越高,群落多样性越低[18]。本研究结果显示3组牦牛瘤胃细菌区系的Simpson指数和Shannon指数无显著差异,且数值基本接近一致,表明粗饲料品质的优劣对瘤胃细菌区系的影响并不显著,该试验结果与林波等[19]研究结论不同,可能与饲粮精粗比及试验动物种类不同有关。
大量研究表明,反刍动物瘤胃微生物中相对丰度较高的优势菌门为拟杆菌门和厚壁菌门[20],本研究结果与此相同。据报道厚壁菌门和拟杆菌门的比值越高越易造成肥胖[21],本研究中GI最高的饲粮组合的牦牛瘤胃中厚壁菌门和拟杆菌门的比值较大,说明粗饲料品质越高,可能更易造成牦牛脂肪沉积。放线菌门能分解植物来源的碳水化合物[22],本试验中 GI最低的组合饲粮的牦牛瘤胃液中放线菌门较高,可能与饲粮小麦干草中纤维成分较高有关,也可能与粗饲料来源有关,即不同的纤维水平与不同的纤维来源饲粮均会影响纤维降解菌种类和丰度。在属水平上,牦牛瘤胃中丰度较高的菌群为普雷沃氏菌属、理研菌科-RC9-gut-group和瘤胃球菌-UCG-005,与钟港等[23]研究结果一致,其中普雷沃氏菌属能降解淀粉、蛋白质[24-25];瘤胃球菌科与纤维饲料的发酵密切相关。本试验中3种不同GI和CBI饲粮组合牦牛瘤胃3种优势菌属无显著差异,表明粗饲料品质的差异对牦牛瘤胃在属水平上的细菌群落结构无显著影响,可能是因为本试验中饲粮营养水平基本一致,而且试验牦牛均已成年,瘤胃优势菌属细菌趋于稳定,相对不易受到粗饲料品质的影响。

图6 3组牦牛瘤胃和直肠细菌区系差异显著的功能基因Fig.6 Microbial functional genes with significant differences in rumen and rectum of yaks in 3 groups
3.2 不同GI与CBI组合饲粮对牦牛直肠细菌区系组成的影响
肠道是牦牛吸收营养物质的重要场所之一,肠道菌群种类和丰度直接影响肠道吸收和免疫功能,肠道菌群通过参与糖类、脂肪、蛋白质以及氨基酸等的代谢活动影响动物健康,且不同菌群会造成肠道吸收营养物质效率差异[26-27]。饲粮纤维影响肠道细菌区系组成,复杂的碳水化合物可作为大量肠道微生物消耗的底物[28]。 本研究发现3组牦牛直肠细菌区系Chao1指数、Ace指数、Simpson指数和Shannon指数均无显著差异,说明粗饲料品质优劣对牦牛直肠细菌区系丰富度和多样性均无显著影响,3种组合的饲粮均可使直肠细菌区系保持较稳定水平,且随着GI降低,直肠细菌区系多样性也有增加的趋势。李蒋伟等[29]研究发现,给早期断奶藏羊饲喂不同精粗比饲粮,其小肠细菌多样性和丰度均呈现不同程度变化,这与本研究结果不一致,可能是本试验饲粮中营养物质水平、碳水化合物水平一致,且两个试验中动物种类不同且采样部位不同造成的。
本试验研究表明,在门水平上不同组合饲粮肠道细菌区系丰度最高的为厚壁菌门,其次为拟杆菌门,这与以往的研究结果一致[30]。厚壁菌门中的大多数细菌能降解纤维素,拟杆菌门中的细菌可提高碳水化合物利用率[31],本试验中3组间细菌区系门水平丰度无显著差异,可能是3组试验饲粮纤维水平相近且碳水化合物平衡指数一致的原因。瘤胃球菌属中的某些细菌可合成并分泌大量的纤维素酶和半纤维素酶[32],降解饲料中的纤维素和半纤维素。 本试验中,在属分类水平上,直肠中瘤胃球菌-UCG-005、理研菌科-RC9-gut-group丰度最高;3组间直肠细菌区系在属水平上差异不显著。瘤胃中相对丰度较高的厚壁菌门和拟杆菌门可降解碳水化合物和纤维素,破坏植物细胞壁,从而实现对纤维素的分解发酵导致到达直肠的纤维素较少。Wang等[33]发现在大肠中瘤胃球菌属的相对丰度要显著高于其他胃肠道部位,这与本研究结果一致。
3.3 牦牛瘤胃和直肠细菌功能预测
瘤胃菌群与肠道细菌区系的丰度、功能与宿主紧密联系,瘤胃细菌与肠道细菌分解纤维素与淀粉等物质,参与机体代谢并为宿主提供养分[34-35]。本试验中,细菌基因功能主要富集在代谢、遗传信息处理、细胞过程和环境处理四大功能类群上。GI为7.19的玉米青贮-苜蓿干草-精料组合饲粮有利于牦牛直肠能量代谢、聚糖生物合成和代谢,可能会促进宿主脂肪沉积;GI为1.31的玉米青贮-燕麦干草-精料组合饲粮组牦牛瘤胃脂质代谢通路富集显著,说明饲喂燕麦干草可促进牦牛瘤胃微生物脂质代谢。而直肠粪便微生物更趋向于氨基酸代谢、膜转运、脂质代谢、信号转导等功能通路的富集,这与已报道的奶牛胃肠道微生物功能研究结果相符[36]。本试验结果表明,在CBI一致的情况下,GI最高组的牦牛直肠细菌功能在能量代谢通路上富集,说明粗饲料品质越好,对牦牛能量代谢影响越大。
4 结 论
不同GI与CBI组合饲粮对瘤胃细菌区系组成有显著影响,但是直肠细菌区系组成多样性却不受其影响;随着GI的降低有增加瘤胃细菌群落丰富度的趋势,GI越高越有利于牦牛脂肪沉积。在保持CBI一致的情况下,在实际生产中可以考虑将苜蓿干草部分替换为燕麦秸秆和小麦秸秆,以降低舍饲成年牦牛的养殖成本和提高瘦肉率。
