白木香种质资源ISSR标记的遗传多样性分析
2022-05-31何梦玲李嘉惠欧晓华刘晓莹高晓霞马文哲张宏意严寒静
何梦玲,林 丹,李嘉惠,欧晓华,刘晓莹,高晓霞,马文哲,张宏意,严寒静*
• 药材与资源 •
白木香种质资源ISSR标记的遗传多样性分析
何梦玲1, 2,林 丹1,李嘉惠1,欧晓华1,刘晓莹1,高晓霞3,马文哲4,张宏意1, 2,严寒静1, 2*
1. 广东药科大学中药学院,广东 广州 510006 2. 国家中医药管理局中药材生产与开发重点实验室,广东 广州 510006 3. 广东药科大学药学院,广东 广州 510006 4. 广东农工商职业技术学院,广东 广州 510507
白木香是中国特有的、具有极高经济价值的珍稀濒危药用植物,由于人类对其自然资源的长期过度开发和生态破坏,白木香现仅有零星散生的野生资源,为更好地保护和利用白木香,现对其进行遗传多样性分析。采集了中国14个地区的232份白木香样本,并利用ISSR标记对其进行遗传多样性评价。ISSR标记具有较高的多态性(100%),表明ISSR是检测白木香遗传多样性的有效方法。对所有样本进行遗传分析,在相似系数为0.71时,可将其聚为4个类群。期望杂合度(H)、Shannon’s信息指数()在XL群体中最高,而61.84%的遗传变异发生在群体之间。种群结构分析表明,14个种群能够按照区域和来源进行严格划分,说明种群间的基因交换很少。白木香种源有较好的遗传多样性,但野生资源大幅减少,需加强白木香资源的保护、繁育和利用。
沉香;白木香;ISSR;遗传多样性;资源保护
白木香(Lour.) Gilg来源于瑞香科,主要分布于我国广东、广西、海南、云南、香港及澳门等地[1],其茎干受伤后产生的含树脂的木材即是我国和东南亚国家的传统名贵药材——沉香。沉香性微温,味辛、苦,归脾、胃、肾经,具有行气止痛、温中止呕、纳气平喘之效,主治胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等疾病[2],并为治胃病特效药[1],白木香是国产沉香的唯一植物来源,也是“十大广药”之一,具有很高的经济价值。随着市场对沉香需求量的增长,沉香价格不断攀升,人们对白木香野生资源展开无节制的开发和掠夺性的采伐,致使白木香的生存环境严重恶化,种群更新受阻,野生资源加速枯竭[3]。然而,由于长期的生境破坏和过度开发,白木香数量迅速减少,已被列为珍稀濒危三级保护植物[4]。
ISSR是一种基于SSR的分子标记技术。与SSR标记相比,ISSR引物可以在不同的物种间通用,不像SSR标记一样具有较强的种特异性,而且揭示的多态性较高,检测非常方便。ISSR标记已广泛应用于植物品种鉴定[5]、遗传作图[6]、中药真伪鉴定[7]、遗传多样性[8-9]等研究中,为药用植物的保护和发展提供了重要的参考。
本研究利用ISSR标记分析14个种群232份样本的遗传多样性,以期为白木香种质资源的保存和开发利用提供实验基础。
1 材料与仪器
1.1 材料
供试材料为采自广东、海南、云南3省地理相对隔离的14个居群的白木香种质,共计232份,经广东药科大学严寒静教授鉴定为白木香(Lour.) Gilg,样品来源信息如表1所示。从每株白木香树上釆集10~20片生长良好、无病虫害的白木香叶片,硅胶干燥并放入−20 ℃冰柜中保存备用。
表1 白木香种质资源地理信息
Table 1 Geographic information of 14 populations of A. sinensis
样品编号数量采集地点纬度(N)经度(E) MM1-1010广东茂名电白区沉香山21.69°111.18° ZS1-2020广东中山五桂山生态保护区22.52°113.38° CC1-2222广东惠州博罗县泰美镇车村23.30°114.51° XL1-2222广东惠州惠东县巽寮湾22.69°114.76° GQ1-9 9广东惠州惠阳区沙田镇冈齐岭22.85°114.58° SZ1-2323广东深圳银湖山郊野公园22.58°113.08° YC1-6 6广东阳江阳春市春湾镇幸福村22.37°112.02° DH1-4 4广东肇庆鼎湖山23.18°112.54° DG1-2424广东东莞大岭山沉香基地22.91°113.78° YZS1-1313海南省海口市万宁药植所19.99°110.25° SJ1-1414海南省海口市美兰区三江镇19.86°110.61° BWL1-2222海南省昌江黎族自治县霸王岭19.10°109.20° NYY1-2222云南省景洪市南药园22.01°100.79° MS1-2121云南省景洪市勐宋乡满金山22.13°100.68°
1.2 试剂与仪器
植物基因组DNA提取试剂盒(GMbiolab Co.,TW),PCR premix购自Takara(T)或Zoman(Z)。DL-600C型电泳仪(北京东林昌盛生物科技有限公司);BG-subMIDI型水平电泳槽(北京百晶生物技术有限公司);Nanodrop ND-1000型分光光度计(Thermo公司,美国);3K15型台式高速冷冻离心机(美国Sigma公司);MJ-54A型高压蒸汽灭菌锅(美国施都凯仪器设备有限公司)。
2 方法
2.1 白木香基因组DNA的提取与检测
从每份白木香样品中取100 mg叶片,经液氮冷冻后研磨成粉末,使用植物基因组DNA提取试剂盒依次提取白木香基因组DNA。采用0.8%琼脂糖凝胶电泳检测DNA样品的质量,并在260 nm/280 nm和230 nm/260 nm波长下检测DNA的浓度和纯度,符合要求的样品于−20 ℃下保存备用。
2.2 ISSR-PCR反应和检测
PCR扩增体系(20 μL)中,各因素浓度为:DNA模板10 ng/20 μL,引物(5 μmol/L)1.5 μL,dNTP 0.6 mmol/L,Mg2+3 mmol/L,Taq DNA聚合酶2.4 U/20 μL,引物0.2 μmol/L。
PCR扩增程序为:94 ℃预变性4 min,94 ℃变性30 s,引物m值下退火45 s,72 ℃延伸2 min,进行34个循环,72 ℃延伸10 min,最后4 ℃保存。
PCR结束后,取5~6 μL PCR产物加入2%琼脂糖凝胶点样孔中,电泳缓冲液为1×TAE,将凝胶在100 V恒定电压下电泳45 min,染色,随后在凝胶成像系统下观察。
2.3 ISSR多态引物的筛选
选择加拿大哥伦比亚大学(UBC)公布的100条ISSR通用引物进行筛选,以获得多态性好、稳定的ISSR引物。同时筛选了各引物适合的PCR Premix和适合的退火温度。
2.4 数据分析
使用Quantity One分析软件识别和计算琼脂糖凝胶电泳图上各泳道条带的有无及其迁移率,根据分析结果给条带赋值,条带清晰稳定记为“1”,条带模糊或无条带则记为“0”,于Excel 2010中建立二元数据矩阵,用于进一步数据分析。
运用NTSYS-PC统计软件计算相似系数(DICE系数),并且按照遗传距离进行UPGMA聚类分析,通过Dcenter变换得到二维主坐标分析图(PCoA)。利用软件STRUCTURE v.2.3.4对白木香种质资源进行群体结构分析。
运用POPGENE 32 ver.1.32软件计算扩增产物的观测等位基因数(a)、有效等位基因数(e)、Nei’s遗传多样性()、Shannon’s信息指数()、多态性位点数、多态位点百分率、遗传一致性和遗传距离等参数。此外,利用群体间总遗传多样性(t)、群体内平均遗传多样性(s)、遗传分化系数(st)和基因流(m)对白木香的种群结构和种群规模进行了评价。
3 结果与分析
3.1 多态引物筛选及多态性分析
随机选择3个省份的3份白木香种质资源基因组DNA作为模板,对100条ISSR引物进行筛选,最终筛选出12条稳定性高,重复性好、条带清晰的引物。
利用这12条ISSR引物对232份种质资源进行遗传多样性研究,共扩增出357条条带,每条引物检测到的条带数介于18~49,平均每条引物检测到的条带数为30条,条带片段大小基本上集中在200~2500 bp。扩增条带数最多的引物为UBC856,多达49条,扩增条带数最少的为UBC826和UBC887,仅有18条。357条条带均为多态性条带,多态性条带比率为100%。每条引物的筛选结果见表2。
表2 12条引物的筛选结果
Table 2 Sequences and amplification results of 12 ISSR primers
引物引物序列(5’-3’)扩增出的条带数多态性条带数PCR premix退火温度/℃ UBC807(AG)8 T3232T48.5 UBC808(AG)8 C2929T53.0 UBC809(AG)8 G3636Z52.0 UBC810(GA)8 T3131Z51.2 UBC811(GA)8 C2020Z52.0 UBC826(AC)8 C1818T51.2 UBC827(AC)8 G2121T47.9 UBC834(AG)8YT4343Z53.3 UBC840(GA)8 YT2222T49.9 UBC856(AC)8 YA4949Z55.5 UBC886VDV (CT)73838T49.8 UBC887DVD (TC)71818T49.8 平均值 29.7529.75−− 总计 357357−−
T-Takara公司的PCR引物 Z-Zoman公司引物
T-PCR premix from Takara Z-PCR premix from Zoman
3.2 基于ISSR分子标记的白木香遗传多样性分析
14个居群白木香的遗传多样性指数见表3。t为0.260 5±0.016 5,s为0.112 7±0.016 5。st为0.567 6(>0.5),表明种群间存在高度的遗传分化。m为0.381 0,说明种群间基因流动较弱。
值在0.089 6~0.147 9(表3)。在14个种群中,巽寮湾(XL)的多态性最高(43.98%),鼎湖山(DH)和深圳银湖山(SZ)最低(23.53%)。种群大小与遗传多样性和百分比多态性无显著相关。6个群体的遗传多样性指数均高于平均水平,分别是巽寮湾(XL)、车村(CC)、东莞大岭山(DG)、海南药用植物研究所(YZS)、海南三江镇(SJ)和云南勐宋乡(MS)。
表3 14个居群白木香的遗传多样性
Table 3 Genetic diversity in 14 populations of A. sinensis
居群样本数量NaNeHI多态性位点(NPL)多态性位点比率(PPL)/% M101.282 91.175 10.100 70.149 810128.29 ZS201.369 71.187 90.111 50.169 913236.97 CC221.409 01.230 30.135 90.204 214640.90 XL221.439 81.254 80.147 90.221 415743.98 GQ 91.246 51.187 00.102 90.148 5 8824.65 SZ231.235 31.163 20.091 90.134 4 8423.53 YC 61.243 71.176 10.098 00.142 7 8724.37 DH 41.235 31.157 30.089 60.132 3 8423.53 DG241.336 11.208 40.120 80.179 512033.61 YZS131.364 11.215 10.124 30.185 913036.41 SJ141.364 11.205 60.120 40.181 513036.41 BWL221.285 71.194 20.109 50.160 410228.57 NYY221.296 91.179 90.106 20.158 710629.69 MS211.366 91.198 10.117 70.178 213136.69 平均值171.319 71.195 20.112 70.167 711431.97
采用分子方差分析(AMOVA)对白木香群体间的分子变异进行分析(表4),总体遗传多样性中,群体间遗传多样性为61.84%,群体内遗传多样性为38.16%。
表4 白木香群体遗传变异的AMOVA分析
Table 4 Analysis of molecular variance (AMOVA) for population of A. sinensis
变异来源自由度平方和方差分量变异比例/%P值 居群内218 4 375.6120.07 38.16<0.001 居群间 13 7 180.1532.53 61.84<0.001 总计23111 555.7652.60100.00
3.3 聚类分析
利用UPGMA方法进行聚类,并构建出232份白木香种质的系统聚类图。从图1中可以看出,遗传距离的取值范围从0.66到0.96,当阈值为0.71时,14个白木香居群被聚为4组。将广东5个居群(MM、CC、XL、GQ和SZ)组成一个聚类,将7个居群(3个海南、3个广东和1个云南)组成一个大聚类。
此外,当遗传距离的取值介于0.66~0.68时,云南南药园NYY的种群聚在一起,而其他210个个体聚成第2支。聚类结果的主坐标分析结果如图2所示。这表明种群没有明显地聚集在一起。
利用STRUCTURE软件对232个白木香种质资源进行了遗传结构分析。当=13时△值最大(图2)。根据分析结果,当=13时可以得到合理的种群结构(图3)。不同的颜色代表不同的组,每条颜色的垂线代表一份材料。种群结构几乎严格按照地区和来源进行划分。
4 讨论
多年生木本植物通常遗传多样性值高, 常表现出小群体之间的分化[10],这一点在本研究中也有体现。白木香的期望杂合度(e)值为0.231 8,高于双子叶植物的均值(0.190 0)和区域性植物(0.220 0)可能是因为(1)白木香的地理分布在物种多样性丰富的热带和低纬度亚热带地区;(2)花期长,主要繁殖方式为异花授粉;(3)果实成熟后,种子悬挂在裂开的果皮上,种子悬挂可以通过重力或昆虫的长距离取食进行传播,这些环境因素和自身特性都有助于白木香群体之间进行基因交流。

图1 232份白木香种质的聚类图

图2 K值曲线图
与其他木本植物的H和相比较,如红豆杉(Pilger) Rehd.(0.205 8,0.325 9)[11]和黄檗Rupr.(0.224 3,0.262 8)[12],白木香的和均值分别为0.112 7、0.167 7,反映出白木香种群的遗传多样性相对较低。究其原因,可能是白木香的种子属于顽拗性种子,水分和贮藏温度高,代谢旺盛,在自然环境中容易脱水和失活。白木香的花期为4月,恰逢雨季,阴雨天气会导致花粉败育,阻止昆虫异花传粉,增加自花传粉的概率,减少种群间的基因交换。基因流又称基因迁移,是基因从一个种群迁移到另一个种群的机制[13]。基因流可以减弱群体间的遗传差异,提高群体间的遗传相似性。本研究中白木香的m值只有0.381 0,表明白木香种群间很少基因交流,这一结果和白木香种质的遗传结构图一致,各种群间相对独立。但这一数值小于广东中山市五桂山土沉香中(0.534)[14]的研究结果,可能因为本研究中白木香种质来源地区较多,野生植株的种子传播率低,种群之间也有较大地理隔离的原因。
作为一种具有很高经济价值的珍稀濒危植物,白木香比其他物种受到更严重的人为干扰和破坏,直接导致种群个体数量的急剧减少、居群片段化严重和遗传漂变加剧。一旦下一代个体不产生后代或没有将所有等位基因传给后代,就很容易导致某些基因的消失[15]。在本研究中,白木香14个种群的st值为0.567 5,低于大多数被子植物种群的平均水平(st=0.637)[16],这一点与贾文杰等[15]和Zou等[17]的结果一致。珍稀濒危植物由于生存环境狭窄,种群数量少,随机漂变和近交衰退常导致个体和群体变异性较低,往往表现出较低的遗传多样性水平。濒危会导致遗传多样性水平的下降,而低水平的遗传多样性会使其更加濒危。
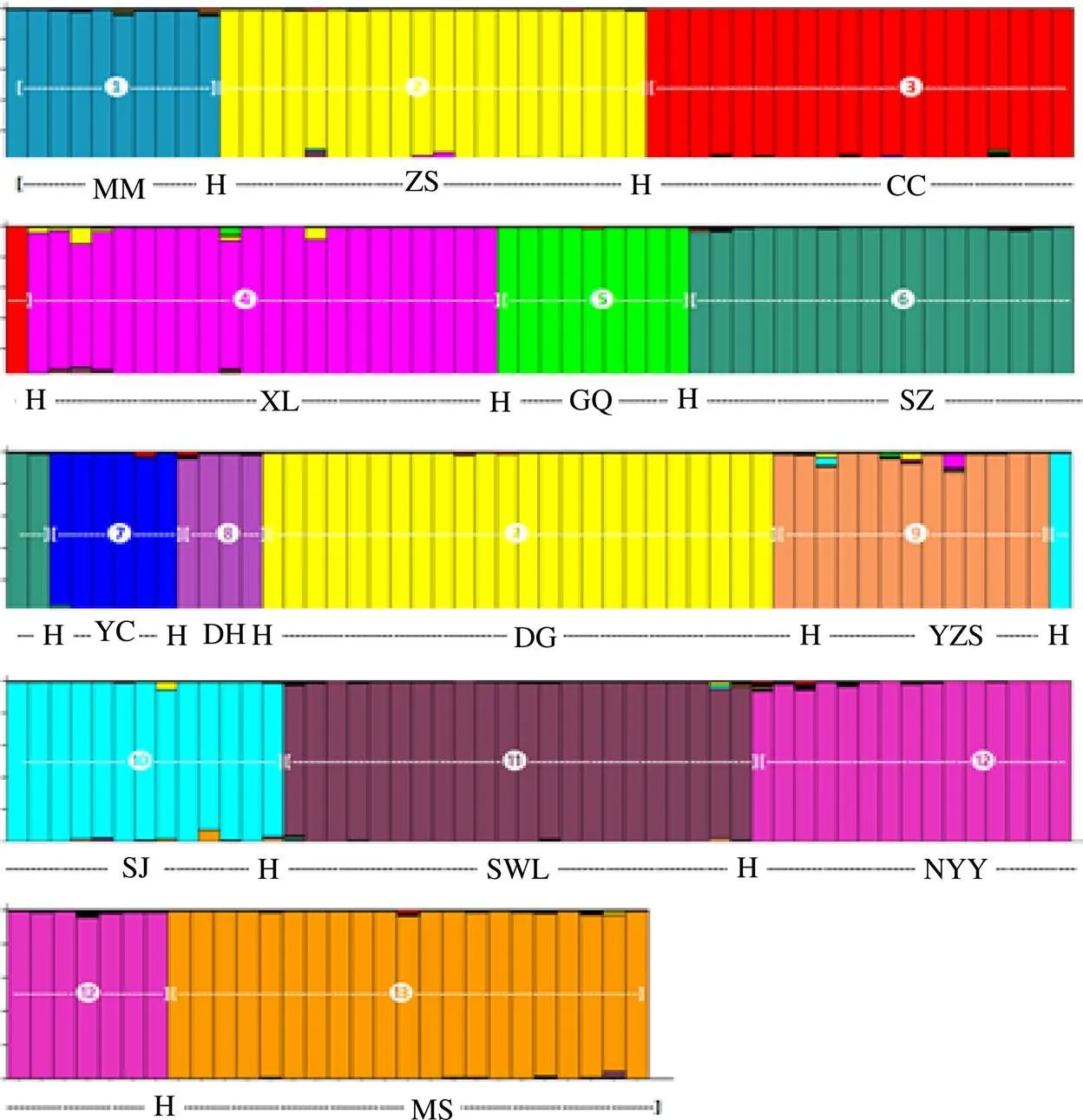
图3 232份白木香种质种群结构分析(K=13)
AMOVA分析显示群体内遗传变异为38.16%,群体间遗传变异为61.84%,这与蒋开彬应用SRAP标记进行研究的结果相反[18]。可能是因为2项研究所用遗传标记不同的缘故。
STRUCTURE的分析结果表明,白木香的种群结构几乎严格按照区域和来源进行划分,说明白木香种群之间没有广泛的基因交换,这与m值和PCoA分析结果基本一致。究其原因,可能是因为非法砍伐导致白木香个体数量锐减。
因此,对白木香的保护策略应包括就地保护和迁地保护。就地保护应加强对原生境的关注,保持种群的有效规模,避免个体数量的减少,这主要依赖于自然保护区的建立。为扩大白木香种群,有必要组织人力进行种子采集和引种试验。为了进行迁地保护,需要精心设计保护策略,从不同地点/种群收集种子,并将不同种群的幼苗转移到合适的生境,以建立该物种的种质库;从而人为增加种群间的基因流动。广泛开展科普宣传教育,提高公众保护珍稀濒危树种及其生存环境的意识。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物委员会. 中国植物志[M]. 北京:科学出版社, 1999, 52 (1): 289.
[2] 中国药典 [S]. 一部. 2020: 253.
[3] Wang Y Z, Nevling L I, Gilbert M G.[M]. Beijing: Science Press & St. Louis: Missouri Botanical Garden Press, 2009: 213-214.
[4] 傅立国. 中国植物红皮书—稀有濒危植物(第一册)[M]. 北京: 科学出版社, 1992: 263.
[5] Safaei M, Sheidai M, Alijanpoor B,. Species delimitation and genetic diversity analysis inwith the use of ISSR molecular markers [J]., 2016, 75(1): 45-52.
[6] 王晓敏, 吕瑞娜, 李长田. 应用SRAP、ISSR和TRAP标记构建金针菇分子遗传连锁图谱 [J]. 分子植物育种, 2020, 18(13): 4377-4383.
[7] 段媛媛, 卢超, 郭杰, 等. 铁皮石斛及霍山石斛ISSR鉴定体系的建立与优化 [J]. 分子植物育种, 2019, 17(13): 4360-4366.
[8] Shahabzadeh Z, Mohammadi R, Darvishzadeh R,. Genetic structure and diversity analysis of tall fescue populations by EST-SSR and ISSR markers [J]., 2020, 47(1): 655-669.
[9] 李翠翠, 胡赛文, 夏至. 基于ISSR的地黄栽培品种与野生群体遗传多样性研究[J]. 中草药, 2020, 51(23): 6054-6061.
[10] Hamrick J L, Godt M J W. Effects of life history traits on genetic diversity in plant species [J]., 1996, 351(1345): 1291-1298.
[11] 李乃伟, 贺善安, 束晓春, 等. 基于ISSR标记的南方红豆杉野生种群和迁地保护种群的遗传多样性和遗传结构分析 [J]. 植物资源与环境学报, 2011, 20(1): 25-30.
[12] 杨洪升, 李富恒, 王长宝, 等. 珍稀濒危植物黄檗种群遗传多样性ISSR分析 [J]. 东北农业大学学报, 2016, 47(6): 26-32.
[13] Slarkin M. Gene flow in natural populations [J]., 2003, 16(1): 393-430.
[14] 刘盼盼, 廖浩斌, 蒋谦才, 等. 广东省中山市五桂山土沉香空间遗传结构 [J]. 热带亚热带植物学报, 2019, 27(1): 65-73.
[15] 贾文杰, 李恩香, 杨柏云, 等. 白木香遗传多样性研究 [J]. 热带亚热带植物学报, 2010, 18(2): 159-164.
[16] Petit R J, Hampe A, Cheddadi R. Climate changes and tree phylogeography in the Mediterranean [J]., 2005, 54(4): 877-885.
[17] Zou M L, Xia Z Q, Lu C,. Genetic diversity and differentiation of(lour.) gilg revealed by ISSR and SRAP markers [J]., 2012, 52(5): 2304-2313.
[18] 蒋开彬, 祝文娟, 潘文, 等. 基于SRAP标记的土沉香遗传多样性分析 [J]. 中南林业科技大学学报, 2020, 40(1): 131-136.
Evaluation of genetic diversity ofgermplasm resources using ISSR markers
HE Meng-ling1, 2, LIN Dan1, LI Jia-hui1, OU Xiao-hua1, LIU Xiao-ying1, GAO Xiao-xia3, MA Wen-zhe4, ZHANG Hong-yi1, 2, YAN Han-jing1, 2
1. College of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. Key Laboratory of Production & Development of Cantons Medicinal Materials, State Administration of Traditional Chinese Medicine, Guangzhou 510006, China 3. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China 4. Guandong Aib Polytechnic, Guangzhou 510507, China
, a precious medicinal plant with high economic value, has been driven to the brink of depletion due to the long-term overexploitation of natural resources and ecological destruction by anthropogenic activities. There are only scattered wild resources of. In order to better protect and utilize schistosomiaceae, the genetic diversity ofwas analyzedA total of 232 samples ofwere collected from 14 areas in China and its genetic diversity was evaluated with ISSR markers.High levels of polymorphism (100%) were observed, indicating that ISSR was an efficient method to detect genetic diversity of wild. All samples were genetically analyzed and divided into four major clusters at the similarity coefficient of 0.71. The highestandvalues were observed in XL population and most genetic variations occurred among populations. The analysis of population structure showed that 14 populations were strictly divided by region and source, indicating that there was little gene exchange amongresources.There was a good genetic diversity inresources. Due to the sharp decrease of wild resources, the protection, breeding and utilization ofresources should be strengthened.
agarwood;(Lour.) Gilg; ISSR; genetic diversity; materials protection
R282.12
A
0253 - 2670(2022)11 - 3441 - 07
10.7501/j.issn.0253-2670.2022.11.021
2021-11-09
国家自然科学基金资助项目(81773829);广东省重点领域研发计划(2020B020221002);广东省科技项目(2015A030302084);广东省科技项目(2017A030303082);广东省科技项目(2017A030303081);广东省中管局项目(20163010)
何梦玲,女,博士,副教授,硕士研究生导师,从事中药资源开发与品质评价研究工作。E-mail: hmldf@126.com
严寒静,女,博士,教授,硕士研究生导师,从事中药资源开发与品质评价研究工作。E-mail: yanhanjing1211@163.com
[责任编辑 时圣明]
