基于MAPK信号通路研究艾柱燃烧产物减轻蓝光诱导ARPE-19细胞损伤的作用机制
2022-05-31陈如一徐文静赵鑫钰夏道宗
陈如一,黄 妍,徐文静,赵鑫钰,夏道宗
基于MAPK信号通路研究艾柱燃烧产物减轻蓝光诱导ARPE-19细胞损伤的作用机制
陈如一,黄 妍,徐文静,赵鑫钰,夏道宗*
浙江中医药大学药学院,浙江 杭州 310053
探讨艾柱燃烧产物(moxa smoke extract,MSE)对蓝光诱导人视网膜色素上皮(adult retinal pigment epithelium-19,ARPE-19)细胞损伤的保护作用及其作用机制。体外培养ARPE-19细胞,CCK-8法检测不同质量浓度(0.25、0.50、1.00、2.00、4.00、5.00、10.00、50.00、100.00、150.00 μg/mL)MSE对ARPE-19细胞活力的影响。设置对照组、对照+MSE高剂量组、蓝光组、蓝光+叶黄素组、蓝光+MSE低剂量组和蓝光+MSE高剂量组。对照组和蓝光组加入空白培养基,其余4组分别加入相应的含药培养基干预24 h后,除对照组以及对照+MSE高剂量组外,各组均在蓝光(430 nm,96.1 W/m2)下刺激1 h。建立ARPE-19细胞损伤模型后,采用乳酸脱氢酶(lactate dehydrogenase,LDH)法检测质膜完整性;采用倒置荧光显微镜观察细胞形态学变化;采用流式细胞仪检测细胞内活性氧(reactive oxygen species,ROS)水平;采用试剂盒检测细胞内氧化应激指标丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)水平和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)以及超氧化物歧化酶(superoxide dismutase,SOD)活性;采用Western blotting法检测丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路相关蛋白表达。与对照组相比,MSE(0.25~4.00 μg/mL)对ARPE-19细胞活力没有显著影响。与蓝光组相比,MSE可以显著降低培养上清中的LDH活性(<0.01),减轻质膜损伤以及细胞形态学变化,调节MAPK信号通路关键蛋白Ras、磷酸化c-Raf(phosphorylated c-Raf,p-c-Raf)、磷酸化细胞外调节蛋白激酶1/2(phosphorylated extracellular regulated protein kinase 1/2,p-Erk1/2)、磷酸化丝裂原活化的细胞外信号调节激酶1/2(phosphorylated mitogen-activated extracellular signal-regulated kinase 1/2,p-MEK1/2)和p-p38 MAPK表达(<0.05、0.01),调节细胞内SOD、CAT、GSH-Px活性以及GSH、MDA、ROS水平(<0.05、0.01),改善ARPE-19细胞氧化应激反应。MSE可能通过调控ROS介导的MAPK信号通路相关蛋白的表达,对蓝光诱导的ARPE-19细胞氧化应激损伤起保护作用。
艾柱燃烧产物;ARPE-19;蓝光;氧化应激;丝裂原活化蛋白激酶信号通路
视频终端视疲劳综合征(visual display terminal symptom,VDTS)是一种使用智能手机、平板电脑等视频终端进行工作或学习时,出现不自觉的短暂性斜视或自觉的包括眼睛酸痛、视物模糊和眨眼频繁等眼部症状的综合征[1]。研究表明,视频终端在使用过程中会产生大量蓝光,进而诱发视网膜色素上皮(retinal pigment epithelial,RPE)细胞产生大量活性氧(reactive oxygen species,ROS),导致蛋白质、脂质以及核酸的氧化损伤和视网膜细胞形态的改变[2-4]。近年来,由于国家对新型冠状病毒肺炎(corona virus disease 2019,COVID-19)流行病的防控布控,区域之间的封锁导致人们对数字设备的使用时长急剧增加[5],由此带来的眼部健康问题亟待解决。本课题组前期研究表明,艾柱燃烧产物(moxa smoke extract,MSE)中的主要成分为苯酚(3.01%)、3-呋喃甲醇(2.77%)和豆甾醇(2.18%)等小分子化合物,具有较好的体外抗氧化作用[6]。然而,目前对于MSE保护成人视网膜色素上皮(adult retinal pigment epithelium-19,ARPE-19)细胞损伤的调控机制尚不明确。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)是细胞内激酶的成员之一,能够感受并传导外界环境的变化,进而调节多种细胞生理过程。近来研究发现,MAPK信号通路能够抑制由过氧化氢、白细胞介素-1β以及高浓度葡萄糖等因素诱导的RPE细胞损伤,通过抑制p38 MAPK的表达对RPE细胞产生保护作用[7-9]。本研究通过制备蓝光诱导ARPE-19细胞损伤模型,以MAPK信号通路调控ROS生成,抑制ARPE-19细胞氧化应激损伤为切入点,探讨MSE是否可通过调控ARPE-19细胞内的氧化还原平衡,减少氧化应激损伤,从而发挥对ARPE-19细胞的保护作用。
1 材料
1.1 细胞
ARPE-19细胞购自广州吉妮欧生物科技有限公司。
1.2 药物
艾柱(批号20190415)购自浙江乾一生物科技有限公司;叶黄素(批号F10J10M92153)购自上海源叶生物科技有限公司。
1.3 试剂
CCK-8试剂盒(批号71011500)购自白鲨生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自南京建成生物工程研究所,批号分别为20201119、20200815、20200819、20200820、20200822、20200820;ROS检测试剂盒(批号061521210723)购自碧云天生物技术有限公司;BCA蛋白定量试剂盒(批号030321210621)购自上海碧云天生物技术有限公司;Ras抗体、c-Raf抗体、磷酸化c-Raf(phosphorylated c-Raf,p-c-Raf)抗体、细胞外调节蛋白激酶1/2(extracellular regulated protein kinase 1/2,Erk1/2)抗体、磷酸化Erk1/2(phosphorylated Erk1/2,p-Erk1/2)抗体、丝裂原活化的细胞外信号调节激酶1/2(mitogen-activated extracellular signal-regulated kinase 1/2,MEK1/2)抗体、磷酸化MEK1/2(phosphorylated MEK1/2,p-MEK1/2)抗体、p38 MAPK抗体、磷酸化p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国CST公司,批号分别为5、1、10、28、24、2、18、9、13、8;荧光标记的山羊抗兔IgG抗体(批号C70428-05)、荧光标记的山羊抗小鼠IgG抗体(批号C70124-05)购自美国LI-COR公司。
1.4 仪器
RE52CS-1型旋转蒸发器(上海亚荣生化仪器厂);SHB-Ⅲ型循环水式真空泵(巩义市予华仪器有限公司);W201B型数控恒温水浴锅(上海申胜生物技术有限公司);BSA224S-CW型电子天平(德国Sartorius公司);超净台、CO2培养箱(美国Thermo Fisher Scientific公司);5427R型高速冷冻离心机(德国Eppendorf公司);PL-LED100F型光源(北京普林塞斯科技有限公司);数字式照度计(深圳聚茂源科技有限公司);Synergy H1MFD型多功能酶标仪(美国BioTek公司);Mini-PROTEAN Tetra System垂直电泳槽、PowerPacTM HC型高电流电源(美国Bio-Rad公司);Odyssey CLx型双色红外激光成像系统(美国LI-COR公司);ECLIPSE Ti-S型倒置荧光显微镜(日本Nikon公司);CytoFLEX流式细胞仪(美国Beckman Coulter公司)。
2 方法
2.1 MSE的制备
称取200 g艾柱于自制燃烧装置中暗火燃烧,在吸收瓶中加入适量无水乙醇作为烟雾吸收溶剂,缓冲瓶与真空泵连接。通过调节循环水泵控制艾柱的燃烧速度,使艾烟能够被充分吸收。将饱和的艾烟吸收溶剂过滤,减压蒸馏直到无馏分馏出,得到MSE[6]。称定质量,用无水乙醇稀释到35 mg/mL备用。
2.2 ARPE-19细胞培养和处理
ARPE-19细胞以含10%胎牛血清和100 U/mL青霉素/链霉素的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养,待细胞融合至70%~80%时用胰酶消化收集细胞,调整细胞密度为2×105个/mL,铺板/皿适应12 h后,按照以下分组处理:对照组和蓝光组更换新鲜培养基培养;对照+MSE高剂量组和蓝光+MSE高剂量组,换用含2 μg/mL MSE的培养基培养;蓝光+MSE低剂量组,换用含1 μg/mL MSE的培养基培养;蓝光+叶黄素组换用含30 μmol/L叶黄素[10]的培养基培养。药物预保护24 h后,根据Park等[11]方法稍作修改建立蓝光诱导ARPE-19细胞损伤模型:从CO2培养箱中取出细胞恢复室温,加入适量PBS补充光照导致的水分蒸发。在室温下将对照和对照+MSE高剂量组置于桌面避光放置,其余分组均置于桌面用LED蓝光源(430 nm,96.1 W/m2)从正上方均匀光照1 h,即得蓝光诱导ARPE-19细胞损伤模型。
2.3 CCK8检测细胞存活率
取处于对数生长期的ARPE-19细胞,调整细胞密度为5×104个/mL,以每孔100 μL接种于96孔板中,置于5% CO2、37 ℃培养箱中培养12 h。设置空白组、对照组和给药组(分别加入MSE至终质量浓度为0.25、0.50、1.00、2.00、4.00、5.00、10.00、50.00、100.00、150.00 μg/mL),孵育24 h后小心吸走培养液,加入预混的CCK8工作液(每100 μL新鲜基础培养液+10 μL CCK8),37 ℃避光孵育45 min,采用多功能酶标仪测定450 nm处的吸光度()值,计算细胞存活率,以对细胞无毒性的质量浓度作为后续实验用浓度范围。
细胞存活率=(MSE-空白)/(对照-空白)
2.4 LDH活性的测定
取处于对数生长期的ARPE-19细胞,接种于96孔板中,按照“2.2”项下方法进行分组及处理后,收集上清液,按试剂盒说明书检测细胞上清液中LDH活性。
2.5 MSE对蓝光诱导的ARPE-19细胞形态的影响
取处于对数生长期的ARPE-19细胞,接种于6 cm细胞培养皿中,按照“2.2”项下方法进行分组及处理后,小心吸走培养液,用PBS缓冲液清洗1遍,加入2 mL PBS缓冲液后,于倒置荧光显微镜下观察各组细胞状态,并拍照记录。
2.6 流式细胞术和倒置荧光显微镜观察ARPE-19细胞ROS水平
取处于对数生长期的ARPE-19细胞,接种于6 cm细胞培养皿中,按照“2.2”项下方法进行分组及处理后,小心吸走培养液,用PBS缓冲液清洗1遍,每孔加入1 mL用RPMI 1640培养基稀释的终浓度为20 µmol/L的DCFH-DA荧光染色液,于37 ℃、5% CO2培养箱培养60 min,小心吸走DCFH-DA荧光染色液,用PBS缓冲液清洗3遍,以充分去除未进入细胞内的DCFH-DA荧光探针,于倒置荧光显微镜下观察各组ARPE-19细胞中ROS表达情况,并拍照记录。随后,收集ARPE-19细胞,加入0.4 mL PBS缓冲液混匀。冰浴避光,30 min内在流式细胞仪上检测细胞中ROS水平。
2.7 ARPE-19细胞中MDA、GSH水平及GSH-Px、CAT、SOD活性检测
取处于对数生长期的ARPE-19细胞,接种于10 cm细胞培养皿中,按照“2.2”项下方法进行分组及处理后,收集细胞。ARPE-19细胞冰上匀浆后用于后续分析抗氧化参数。采用BCA法对各组细胞匀浆进行蛋白定量。随后,按照试剂盒说明书操作,SOD活性使用WST-1法检测,CAT、GSH-Px活性使用可见光法测定,GSH水平使用微量酶标法检测,MDA水平测定使用硫代巴比妥酸法。
2.8 Western blotting检测MAPK信号通路相关蛋白的表达
取处于对数生长期的ARPE-19细胞,接种于10 cm细胞培养皿中,按照“2.2”项下方法进行分组及处理后,收集细胞。细胞裂解后提取总蛋白,采用BCA法进行蛋白定量,加入适量上样缓冲液后,100 ℃恒温金属浴变性10 min,得到蛋白样品。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中室温封闭1 h,分别加入Ras、c-Raf、p-c-Raf、Erk1/2、p-Erk1/2、MEK1/2、p-MEK1/2、p38和p-p38抗体(1∶1000),4 ℃冰箱内摇床上孵育过夜,以GAPDH(1∶5000)作为内参,3次TBST缓冲液洗膜后,加入荧光标记的二抗(1∶10 000),室温避光孵育2 h;3次TBST洗膜后,用Odyssey CLx 双色红外激光成像系统显影成像,用Image J软件分析条带灰度值。
2.9 统计学分析
所有数据均采用Graphpad Prism 8.0软件进行统计学处理并作图表示,统计变量以表示,多组间比较采用单因素方差分析。
3 结果
3.1 MSE对ARPE-19细胞存活率的影响
不同质量浓度的MSE处理ARPE-19细胞24 h,如图1所示,0.25~4.00 μg/mL质量浓度的MSE对细胞活力没有显著影响,说明MSE在0.25~4.00 μg/mL对ARPE-19细胞无细胞毒性;当MSE质量浓度超过4.00 μg/mL时,细胞活力明显下降(<0.05、0.01),说明超过4.00 μg/mL的质量浓度不宜作为实验浓度,为了保持细胞处于最佳的活力,因此在后续实验中MSE低、高剂量组分别设置为1、2 μg/mL。
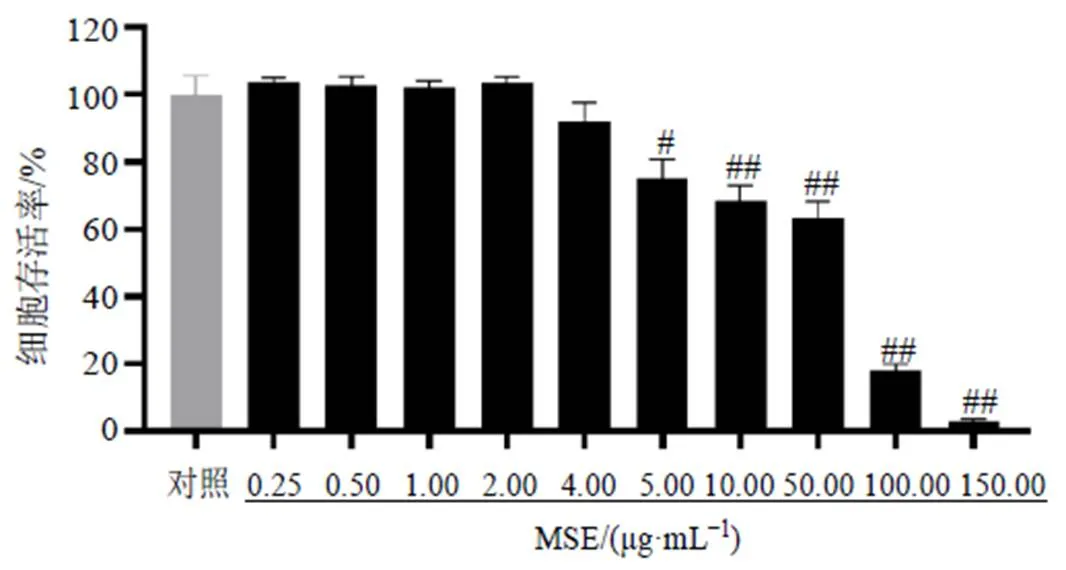
与对照组比较:#P<0.05 ##P<0.01
3.2 MSE对蓝光诱导ARPE-19细胞损伤的影响
在蓝光(430 nm,96.1 W/m2)下光照ARPE-19细胞1 h,如图2所示,高剂量的MSE对于对照组细胞并无显著影响;而蓝光组细胞上清液中LDH活性显著升高(<0.01);给予30 μmol/L叶黄素之后LDH活性显著下降(<0.01);给予MSE后,上清液中的LDH活性显著下降(<0.01),且呈剂量相关性。表明蓝光诱导的ARPE-19细胞损伤模型成功成立,MSE对蓝光诱导的ARPE-19细胞损伤有显著的保护作用,且呈剂量相关性。
3.3 MSE对蓝光诱导ARPE-19细胞形态学的影响
如图3所示,对照组ARPE-19细胞之间具有明显的网状连接;与对照组相比,对照+MSE高剂量组无显著变化,网状连接明显;而蓝光组中ARPE-19细胞间网状连接明显消失,细胞间距增大,呈分散趋势,由此说明蓝光照射对于ARPE-19细胞造成了损伤。与蓝光组相比,随着给予叶黄素以及MSE浓度的增大,细胞间的网状连接得到保护,蓝光+MSE高剂量组基本接近对照组。表明MSE能够显著改善蓝光诱导下受损的ARPE-19细胞形态。
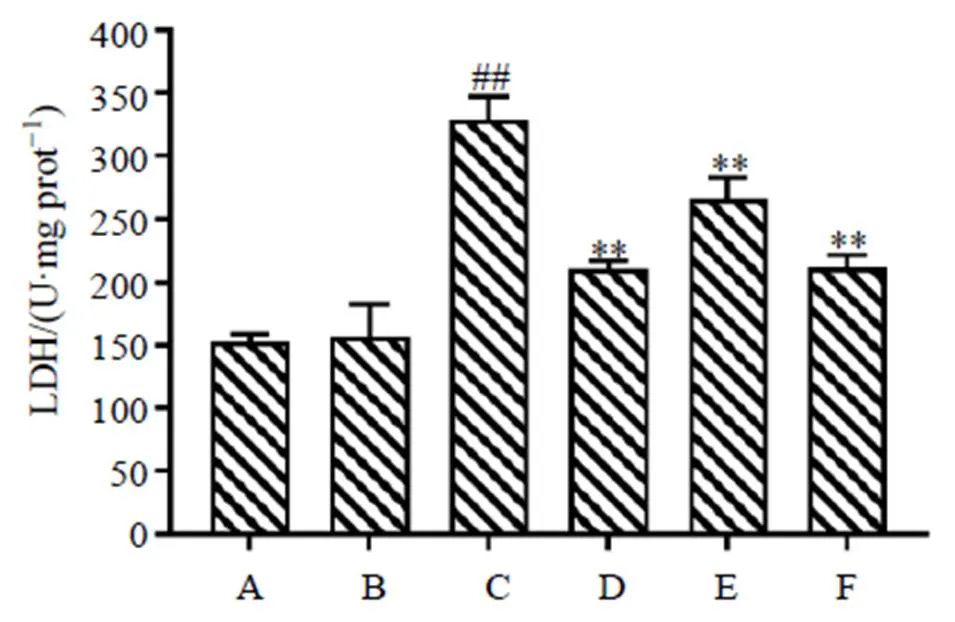
A-对照组 B-对照+MSE高剂量组 C-蓝光组 D-蓝光+叶黄素组 E-蓝光+MSE低剂量组 F-蓝光+MSE高剂量组 与对照组比较:##P<0.01;与蓝光组比较:*P<0.05 **P<0.01,下图同
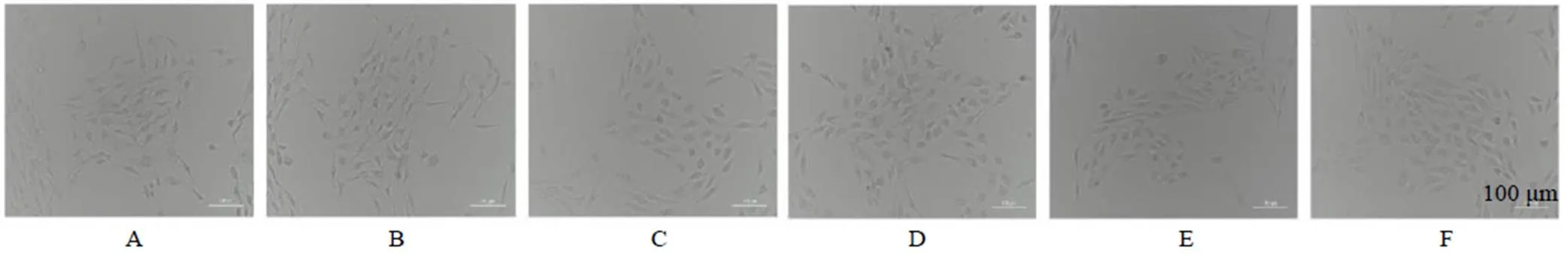
图3 MSE对蓝光诱导ARPE-19细胞形态的影响 (×200)
3.4 MSE对蓝光诱导ARPE-19细胞ROS水平的影响
采用流式细胞仪,以DCFH-DA作为荧光探针对ARPE-19细胞内ROS水平进行检测,如图4所示,对照+MSE高剂量组的ROS荧光水平较对照组显著降低(<0.01),说明MSE不仅针对受损细胞,对正常ARPE-19细胞亦具有一定的保护作用;而蓝光组较对照组ROS水平显著上升(<0.01),且随着MSE浓度的增加,细胞内ROS荧光水平显著降低(<0.01);在给予叶黄素预保护24 h后,ARPE-19细胞中ROS荧光水平显著降低(<0.01)。倒置荧光显微镜下的结果(图5)与上述结果一致。
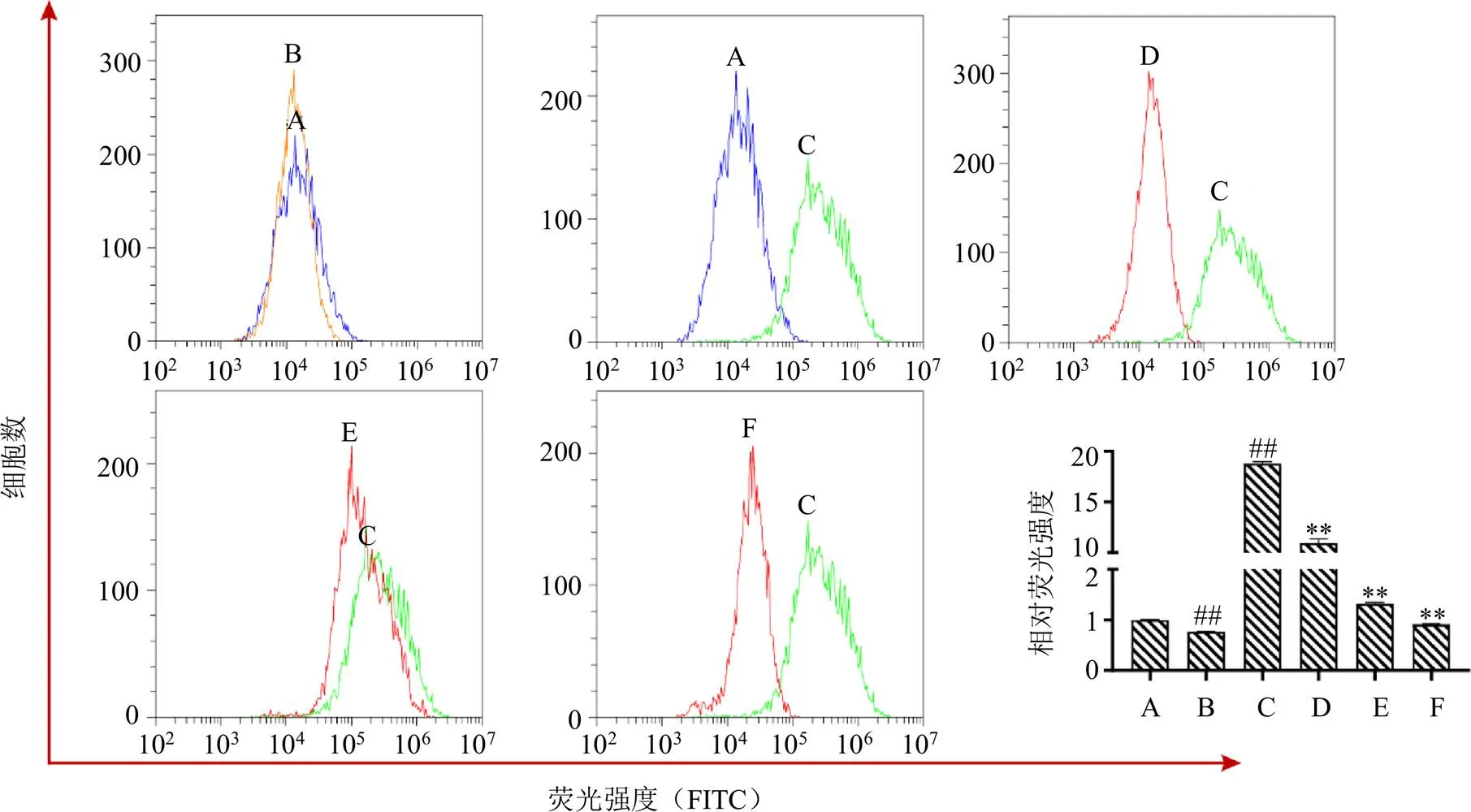
图4 流式细胞术检测MSE对蓝光诱导ARPE-19细胞中ROS水平的影响(, n = 3)
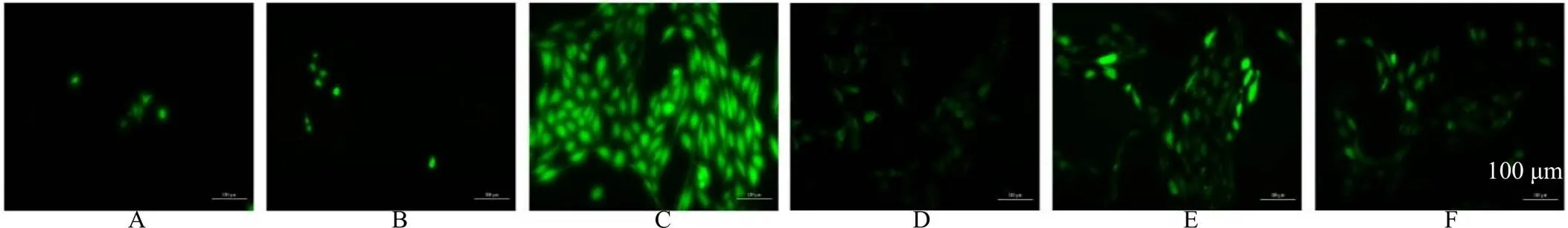
图5 倒置荧光显微镜法检测MSE对蓝光诱导ARPE-19细胞ROS水平的影响(×200)
3.5 MSE对蓝光诱导ARPE-19细胞MDA、GSH水平及GSH-Px、CAT、SOD活性的影响
如图6所示,与对照组相比,对照+MSE高剂量组MDA、GSH水平及GSH-Px、CAT、SOD活性未见明显改变;蓝光组细胞内MDA水平显著升高(<0.01),GSH水平和GSH-Px、CAT、SOD抗氧化酶活性显著下降(<0.01);与蓝光组相比,MSE组细胞内GSH水平和SOD、CAT、GSH-Px活性均显著升高(<0.05、0.01),MDA水平显著降低(<0.01),呈剂量相关性;给予叶黄素后,各项指标均有所改善。
3.6 MSE对蓝光诱导ARPE-19细胞中MAPK通路相关蛋白表达的影响
如图7所示,与对照组相比,对照+MSE高剂量组细胞MAPK通路相关蛋白表达并无显著差异;而经蓝光诱导后的ARPE-19细胞中的Ras、p-Raf、p-MEK1/2、p-Erk1/2、p-p38蛋白表达水平均显著升高(<0.01);叶黄素能显著降低细胞Ras、p-Raf、p-MEK1/2、p-Erk1/2、p-p38蛋白表达水平(<0.01);MSE组细胞上述蛋白表达水平均显著降低(<0.05、0.01),并呈剂量相关性。
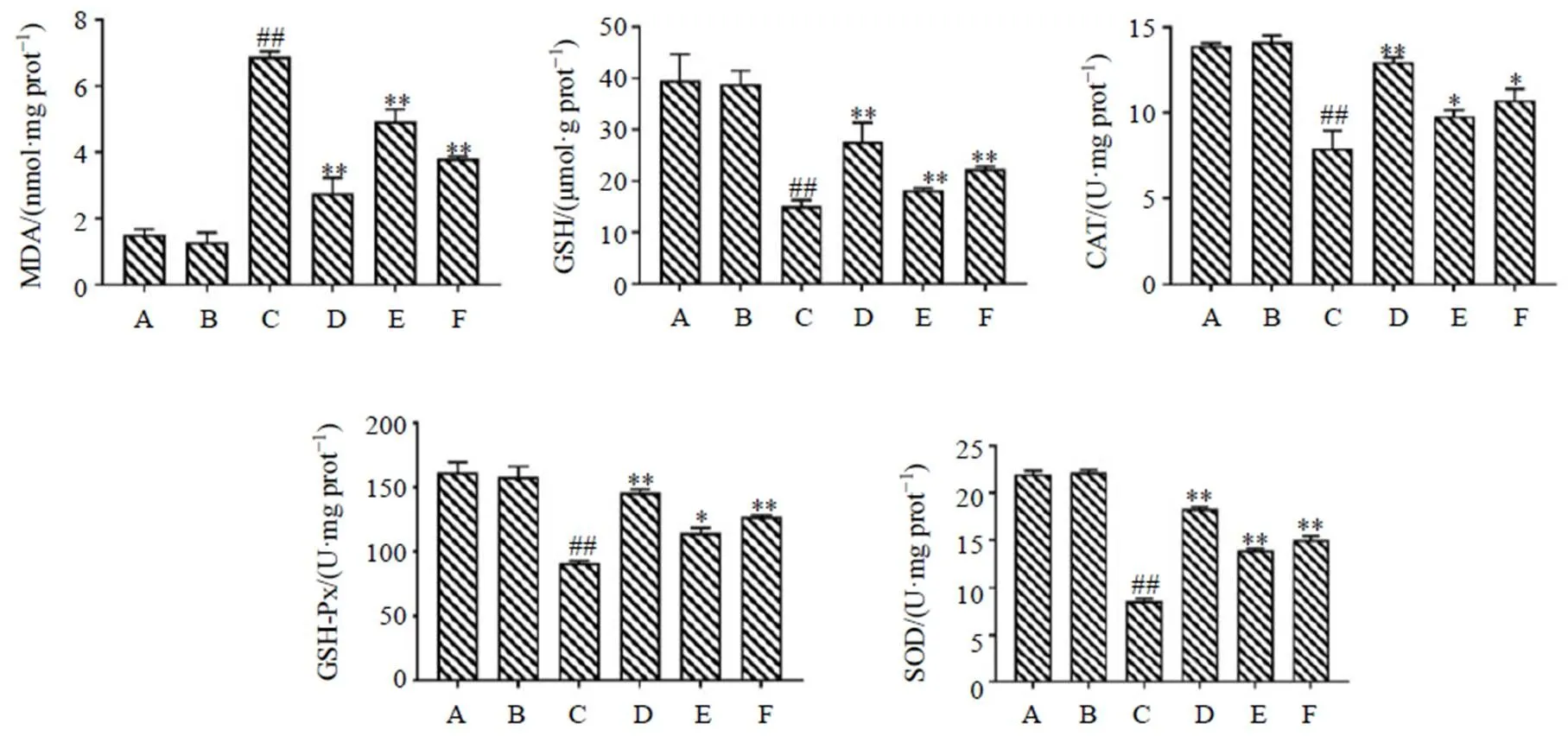
图6 MSE对蓝光诱导ARPE-19细胞中MDA、GSH水平及CAT、GSH-Px、SOD活性的影响(, n = 3)
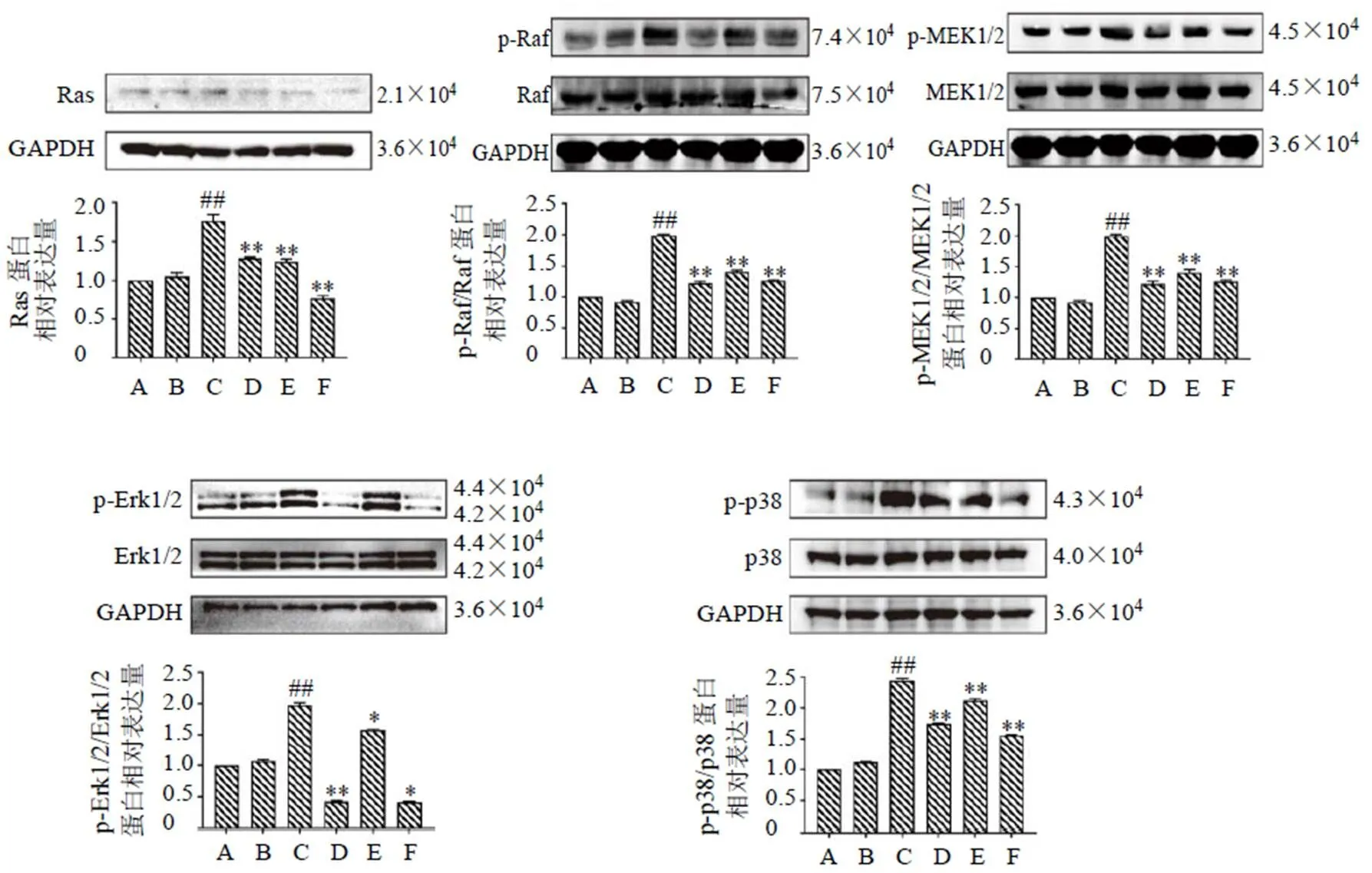
图7 MSE对蓝光诱导ARPE-19细胞MAPK信号通路相关蛋白表达的影响(, n = 3)
4 讨论
本课题组前期研究已经在体外验证了MSE较艾柱挥发油具有更好的抗氧化性能。为了阐明MSE保护蓝光诱导ARPE-19细胞损伤作用的具体机制,从其对抑制ARPE-19细胞内氧化应激反应以及MAPK信号通路相关蛋白表达2方面的影响进行探索。1985年,“氧化应激”作为氧化还原生物学和医学中的1个概念被正式提出,其有2部分组成:有氧代谢以氧化还原平衡稳态的形式存在以及用专业的术语表达了这种平衡之间潜在的张力,即生物体的应激反应[12]。视网膜是人体中耗氧量最高的组织之一[13]。高强度的有氧代谢以及持续的光照都会诱导视网膜中产生过量的ROS[14-15]。研究证明,400~500 nm波长的蓝光可诱导RPE细胞产生过量的ROS[16],过量的ROS与细胞内脂质反应产生MDA,进而破坏细胞膜完整性及流动性,引起细胞膜损伤[17]。同时,过量的ROS会导致线粒体功能的破坏,此过程往往伴随着细胞内酶(包括LDH)的大量释放,而与其他所有酶相比,LDH在这一过程中增加地更多[18]。因此,本研究通过检测LDH活性证明了蓝光暴露能够诱导ARPE-19细胞损伤模型。通过对蓝光照射前后ARPE-19细胞形态学的观察,进一步确认了蓝光照射对ARPE-19细胞造成了损伤,使细胞间的网状连接消失,细胞间距增大。研究证明,机体内部的抗氧化防御的主要作用是由抗氧化酶实现的,而不是小分子的抗氧化物[12]。如在GSH-Px的催化下,GSH向ROS提供1个质子以稳定氧自由基,并转换为氧化型谷胱甘肽(glutathione disulfide,GSSG)[19]。
叶黄素是一种在人类脑组织中占主导地位的类胡萝卜素[20-21],能够自由地穿过血视网膜屏障[22],并通过过滤高能短波的光线来减弱视网膜处的光化学损伤。叶黄素通过清除过量的ROS、超氧化物和羟基自由基,避免视网膜磷脂的过氧化,减少脂褐素的形成,进而减轻光诱导的相关损伤[23]。以叶黄素为阳性对照药物,本研究发现MSE能够有效降低ARPE-19细胞中ROS和MDA水平,提高GSH水平;显著提高细胞内抗氧化酶GSH-Px、CAT和SOD活性,MSE高剂量组在部分实验指标上甚至优于阳性对照药物。由此推测MSE保护ARPE-19细胞免受蓝光损伤的机制可能在于其中含有某种脂溶性成分能够渗透血视网膜屏障,进而恢复细胞内的氧化还原稳态,提高细胞活力。
另一方面,由于方法学的重大进展,将这种生物体内的氧化还原转换同磷酸化与去磷酸化信号联系起来的重要性得到了充分的认识[12]。MAPK级联反应信号通路是最关键的细胞内信号途径之一[24-25]。环境应激会引起MAPK信号通路相关蛋白活性的改变[26],其激活状态依赖相关蛋白激酶与其磷酸化蛋白的共同调节,这种调节是可逆的,机体会根据体内环境的变化而进行动态调整,使其处于一种动态平衡的状态[27]。Ras和Raf是最早被报道的癌蛋白[28-29],Ras的激活会将Raf或Raf/MEK异二聚体募集到质膜,随后Raf和MEK组装瞬时四聚体,通过背对背二聚化促进Raf的激活[30]。Raf一旦被激活,就会对217和221位MEK1/2上丝氨酸残基进行磷酸化,进一步导致Erk1/2的磷酸化[31]。本研究结果显示,蓝光组Ras、p-c-Raf/c-Raf、p-MEK1/2/MEK1/2、p-ERK1/2/ERK1/2及p-p38/p38均显著高于对照组,说明氧化应激导致了Ras、Raf、MEK1/2、Erk1/2、p38信号通路的级联反应,这与以往的研究结果一致[32-33]。研究表明,UV诱导的Erk1/2-MAPK的激活是通过ROS的生成介导的[34],ROS在激活Erk1/2-MAPK信号通路中起核心作用[35]。而MSE在有效降低蓝光诱导的ARPE-19细胞中ROS含量的同时,显著降低了Ras蛋白以及Raf、MEK1/2、Erk1/2、p38磷酸化蛋白的表达。这说明MSE可能是通过抑制ROS介导的氧化应激反应来保护蓝光诱导的ARPE-19细胞损伤。
综上,MSE对蓝光诱导的ARPE-19细胞损伤具有显著的保护作用,其机制可能与改善细胞内氧化还原稳态,抑制MAPK信号通路有关,然而蓝光诱导的ARPE-19细胞损伤是否经由铁死亡途径诱发,MSE能否在调节MAPK信号通路的基础上进一步通过核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11,也称为xCT)信号通路减轻ARPE-19细胞铁死亡有待进一步研究。本课题组将在今后继续围绕Nrf2/xCT信号通路结合分子对接技术对MSE中的药效物质成分展开研究,深入探讨MSE基于调控Nrf2/xCT信号通路保护ARPE-19防治视疲劳的作用机制。
利益冲突 所有作者均声明不存在利益冲突
[1] 朱然, 梁舒.视频终端视疲劳综合征的治疗进展 [J]. 中华临床医师杂志: 电子版, 2019, 13(9): 702-706.
[2] Margrain T H, Boulton M, Marshall J,. Do blue light filters confer protection against age-related macular degeneration? [J]., 2004, 23(5): 523-531.
[3] Mantha N, Burra S, Rajagopal K,. Protein stability and photostability undervitreal conditions-implications for long acting delivery of protein therapeutics for ocular disease [J]., 2020, 37(5): 85.
[4] Yacout S M, Gaillard E R. The anthocyanins, oenin and callistephin, protect RPE cells against oxidative stress [J]., 2017, 93(2): 590-599.
[5] Bahkir F A, Grandee S S. Impact of the COVID-19 lockdown on digital device-related ocular health [J]., 2020, 68(11): 2378-2383.
[6] 陈如一, 史悦悦, 张晓熙, 等. 艾柱挥发油和燃烧产物成分GC-MS分析及抗氧化活性比较 [J]. 中成药, 2021, 43(12): 3507-3512.
[7] Liu X Y, Zheng F, Li S,. Malvidin and its derivatives exhibit antioxidant properties by inhibiting MAPK signaling pathways to reduce endoplasmic reticulum stress in ARPE-19 cells [J]., 2021, 12(16): 7198-7213.
[8] Maugeri G, Bucolo C, Drago F,. Attenuation of high glucose-induced damage in RPE cells through p38 MAPK signaling pathway inhibition [J]., 2021, 12: 684680.
[9] Cheng S C, Huang W C, Pang J H S,. Quercetin inhibits the production of IL-1β-induced inflammatory cytokines and chemokines in ARPE-19 cells via the MAPK and NF-κB signaling pathways [J]., 2019, 20(12): 2957.
[10] Kim J, Jin H L, Jang D S,. Quercetin-3--α-l-arabinopyranoside protects against retinal cell death via blue light-induced damage in human RPE cells and Balb-c mice [J]., 2018, 9(4): 2171-2183.
[11] Park S I, Jang Y P. The protective effect of brown-, gray-, and blue-tinted lenses against blue LED light-induced cell death in A2E-laden human retinal pigment epithelial cells [J]., 2017, 57(2): 118-124.
[12] Sies H. Oxidative stress: A concept in redox biology and medicine [J]., 2015, 4: 180-183.
[13] Yu D Y, Cringle S J. Retinal degeneration and local oxygen metabolism [J]., 2005, 80(6): 745-751.
[14] Hanus J, Anderson C, Wang S S. RPE necroptosis in response to oxidative stress and in AMD [J]., 2015, 24(Pt B): 286-298.
[15] Kim J, Cho K, Choung S Y. Protective effect ofvar. L extract against blue light induced damages in ARPE-19 cells and mouse retina [J]., 2020, 152: 622-631.
[16] Scimone C, Alibrandi S, Scalinci S Z,. Expression of pro-angiogenic markers is enhanced by blue light in human RPE cells [J]., 2020, 9(11): 1154.
[17] Chan T C, Wilkinson Berka J L, Deliyanti D,. The role of reactive oxygen species in the pathogenesis and treatment of retinal diseases [J]., 2020, 201: 108255.
[18] Jurisic V, Radenkovic S, Konjevic G. The actual role of LDH as tumor marker, biochemical and clinical aspects [J]., 2015, 867: 115-124.
[19] Suárez-Barrio C, del Olmo-Aguado S, García-Pérez E,. Antioxidant role of PRGF on RPE cells after blue light insult as a therapy for neurodegenerative diseases [J]., 2020, 21(3): E1021.
[20] Jeon S, Neuringer M, Johnson E E,. Effect of carotenoid supplemented formula on carotenoid bioaccumulation in tissues of infant rhesus macaques: A pilot study focused on lutein [J]., 2017, 9(1): E51.
[21] Lieblein-Boff J C, Johnson E J, Kennedy A D,. Exploratory metabolomic analyses reveal compounds correlated with lutein concentration in frontal cortex, hippocampus, and occipital cortex of human infant brain [J]., 2015, 10(8): e0136904.
[22] Snodderly D M. Evidence for protection against age-related macular degeneration by carotenoids and antioxidant vitamins [J]., 1995, 62(6): 1448S-1461S.
[23] Jia Y P, Sun L, Yu H S,. The pharmacological effects of lutein and Zeaxanthin on visual disorders and cognition diseases [J]., 2017, 22(4): E610.
[24] Mathien S, Tesnière C, Meloche S. Regulation of mitogen-activated protein kinase signaling pathways by the ubiquitin-proteasome system and its pharmacological potential [J]., 2021, 73(4): 263-296.
[25] Guo Y J, Pan W W, Liu S B,. ERK/MAPK signalling pathway and tumorigenesis [J]., 2020, 19(3): 1997-2007.
[26] Hotamisligil G S, Davis R J. Cell signaling and stress responses [J]., 2016, 8(10): a006072.
[27] 孙琪, 郭维, 陈晓梅, 等. 逍遥散对慢性应激大鼠海马组织DUSP14基因表达及对MAPK信号通路的影响 [J]. 新中医, 2020, 52(23): 21-24.
[28] Zhou B Y, der C J, Cox A D. The role of wild type RAS isoforms in cancer [J]., 2016, 58: 60-69.
[29] Holderfield M, Deuker M M, McCormick F,. Targeting RAF kinases for cancer therapy: BRAF-mutated melanoma and beyond [J]., 2014, 14(7): 455-467.
[30] Degirmenci U, Wang M, Hu J C. Targeting aberrant RAS/RAF/MEK/ERK signaling for cancer therapy [J]., 2020, 9(1): 198.
[31] Fang J Y, Richardson B C. The MAPK signalling pathways and colorectal cancer [J]., 2005, 6(5): 322-327.
[32] Diniyah N, Alam M B, Choi H J,.protects HaCaT cells from oxidative stress-induced cell death through Nrf2-mediated heme oxygenase-1 expression via the activation of p38 and ERK1/2 [J]., 2020, 21(22): E8583.
[33] Katiyar S K, Meeran S M. Obesity increases the risk of UV radiation-induced oxidative stress and activation of MAPK and NF-kappaB signaling [J]., 2007, 42(2): 299-310.
[34] Busch M, Wasmuth S, Spital G,. Activation of the ERK1/2-MAPK signaling pathway by complement serum in UV-POS-pretreated ARPE-19 cells [J]., 2018, 239(4): 215-224.
[35] 都研文, 郑瑞芳, 曾诚, 等. 香青兰总黄酮对阿霉素心肌毒性的保护机制研究 [J]. 中草药, 2019, 50(24): 6045-6051.
Mechanism of moxa smoke extract on attenuating blue light induced ARPE-19 cell injury based on MAPK signaling pathway
CHEN Ru-yi, HUANG Yan, XU Wen-jing, ZHAO Xin-yu, XIA Dao-zong
School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China
To investigate the effect and mechanism of moxa smoke extract (MSE) on blue light-induced ARPE-19 cells injury.ARPE-19 cells were cultured, and effect of MSE at different concentrations (0.25, 0.50, 1.00, 2.00, 4.00, 5.00, 10.00, 50.00, 100.00, 150.00 μg/mL) on viability of ARPE-19 cells was detected by CCK-8 method. Control group, control + MSE high-dose group, blue-light group, blue-light + lutein group, blue-light + MSE low-dose group and blue-light + MSE high-dose group were set. Blank medium was added to control group and blue light group, and corresponding drug-containing medium was added to the other four groups, after intervention for 24 h, except for control group and control + MSE high-dose group, all groups were stimulated under blue light (430 nm, 96.1 W/m2) for 1 h. After ARPE-19 cell injury model was established, integrity of plasma membrane was detected by lactate dehydrogenase (LDH) method; Morphological changes of cells were observed by inverted fluorescence microscope; Intracellular reactive oxygen species (ROS) level were detected by flow cytometry species; Kits were used to detect intracellular oxidative stress indicators malondialdehyde (MDA), glutathione (GSH) levels and glutathione peroxidase (GSH-Px), catalase (CAT) and superoxide dismutase (SOD) activities; Western blotting was used to detect mitogen-activated protein kinases (MAPK) signaling pathway-related proteins expressions.Compared with control group, MSE (0.25—4.00 μg/mL) had no significant effect on viability of ARPE-19 cells. Compared with blue light group, MSE significantly reduced LDH activity in culture supernatant (< 0.01), alleviated the damage of plasma membrane and cell morphological changes, regulated key proteins expressions of MAPK signaling pathway such as Ras, phosphorylated c-Raf (p-c-Raf), phosphorylated extracellular regulated protein kinase 1/2 (p-Erk1/2), phosphorylated mitogen-activated extracellular signal-regulated kinase 1/2 (p-MEK1/2) and p-p38 MAPK (< 0.05, 0.01), regulated intracellular SOD, CAT, GSH-Px activities and GSH, MDA, ROS levels (< 0.05, 0.01), and improved the oxidative stress response of ARPE-19 cells.MSE may protect ARPE-19 cells from blue light-induced oxidative stress injury by regulating the expression of ROS-mediated MAPK signaling pathway-related proteins.
moxa smoke extract; ARPE-19 cells; blue light; oxidative stress; mitogen-activated protein kinases signaling pathway
R285.5
A
0253 - 2670(2022)11 - 3376 - 09
10.7501/j.issn.0253-2670.2022.11.013
2022-02-09
国家自然科学基金资助项目(82074085);浙江省自然科学基金资助项目(LY21H280006)
陈如一(1996—),男,硕士研究生,研究方向为中药药理学。Tel: 15700068486 E-mail: 498996135@qq.com
夏道宗,博士生导师,教授,主要从事中药药理学研究。Tel: (0571)86633361 E-mail: xiadaozong@zcmu.edu.cn
[责任编辑 李亚楠]
