雪胆素片联合阿霉素增强细胞免疫原性死亡的抗肝癌作用研究
2022-05-31戴婷婷钟荣玲罗利霞
王 森,戴婷婷,钟荣玲,夏 智,罗利霞,宁 青,宋 捷*,谢 林
雪胆素片联合阿霉素增强细胞免疫原性死亡的抗肝癌作用研究
王 森1, 2,戴婷婷3,钟荣玲2,夏 智2,罗利霞1, 2,宁 青2,宋 捷1, 2*,谢 林1, 4*
1. 南京中医药大学附属中西医结合医院 第三临床医学院,江苏 南京 210028 2. 江苏省中医药研究院 国家中医药管理局中药释药系统重点研究室,江苏 南京 210028 3. 东部战区总医院肿瘤内科,江苏 南京 210002 4. 南京中医药大学附属中西医结合医院 骨伤科,江苏 南京 210028
研究雪胆素片联合阿霉素协同抗肝癌的作用,以及对细胞免疫原性死亡相关蛋白表达的调控。采用高效液相色谱法对雪胆素片主要成分进行分析;采用MTT法考察雪胆素片与阿霉素联合使用对人肝癌HepG2细胞存活率的影响;采用平板克隆观察雪胆素片与阿霉素联合使用对HepG2细胞集落形成的影响;采用流式细胞仪分析雪胆素片与阿霉素联合使用对HepG2细胞凋亡率和细胞周期的影响;采用免疫荧光检测免疫原性细胞死亡关键指标钙网蛋白(calreticulin,CRT)和高迁移率蛋白1(high mobility group protein B1,HMGB1)表达;采用ELISA法检测细胞内外三磷酸腺苷(adenosine triphosphate,ATP)浓度。建立小鼠肝癌H22细胞皮下移植瘤模型观察雪胆素片与阿霉素联合使用的体内抗肿瘤效果;采用免疫组化法检测小鼠肿瘤组织CRT和HMGB1表达;采用苏木素-伊红(HE)染色法观察雪胆素片与阿霉素联合使用对小鼠心肌毒性的影响。雪胆素片联合阿霉素对HepG2细胞具有浓度相关性的细胞毒性和促凋亡作用,可促进CRT膜外暴露,HMGB1向胞外分泌,ATP胞外浓度增加;雪胆素片联合阿霉素可抑制H22细胞小鼠皮下移植瘤的生长,提高免疫能力,延长其生存期,增加小鼠皮下肿瘤组织内CRT和HMGB1蛋白阳性表达的细胞数量。雪胆素片联合阿霉素的抗肝癌作用可能与调节免疫原性死亡相关蛋白表达有关。
雪胆素片;阿霉素;免疫原性死亡;钙网蛋白;高迁移率蛋白1;三磷酸腺苷
肝细胞癌是一种常见的致命恶性肿瘤,也是全球第5大癌症死亡原因,具有复发率高、预后较差的特点[1]。目前在肝癌的治疗方式中,化疗占据重要位置[2]。研究发现,蒽环类等[3-8]传统化疗药物在诱导细胞凋亡的同时,还能够促进钙网蛋白(calreticulin,CRT)、高迁移率蛋白B1(high mobility group protein B1,HMGB1)、三磷酸腺苷(adenosine triphosphate,ATP)等损伤相关分子(damage-associated molecule patterns,DAMPs)的释放,促进抗原提呈到树突状细胞(dendritic cell,DC),激活细胞毒性T细胞(cytotoxic T cells,CTL),从而诱导细胞免疫原性死亡(immunogenic cell death,ICD)[9-10],ICD可将濒死或死亡的癌细胞转化为免疫“疫苗”,增强抗肿瘤免疫的能力[11],通过上调CD8+、CD4+T细胞的表达,以及下调免疫抑制细胞的表达,最终改善免疫微环境[12]。因此,ICD的合理运用有望在肿瘤治疗领域发挥巨大作用。
阿霉素是一种能够诱导ICD的代表性蒽环类化疗药物。研究发现,阿霉素与淫羊藿素、紫草素等药物联合使用可增强细胞免疫原性,从而发挥更有效的抗肿瘤作用[12-14]。雪胆素片是一类具有清热解毒作用的中成药,由葫芦科雪胆属植物提取的雪胆素制成。雪胆素的主要成分雪胆甲素和雪胆乙素对多种恶性肿瘤均有明显的抑制作用[15]。本课题组前期研究发现,雪胆素片能够增强阿霉素的抗肿瘤作用,同时伴随细胞膜外CRT表达的上调,但其作用机制尚不明确。因此本研究探究雪胆素片联合阿霉素对肝癌细胞增殖、集落形成、凋亡和ICD相关蛋白表达的影响以及潜在的作用机制,以期提供一种有效的肝癌治疗策略。
1 材料
1.1 动物
SPF级雄性ICR小鼠,体质量18~22 g,4周龄,购自蚌埠依诺佳生物科技有限公司,动物许可证号SCXK(苏)2021-0025。动物饲养于江苏省中医药研究院动物实验室,独立通风屏障系统,自由进食饮水。动物实验经江苏省中西医结合医院伦理委员会批准(批准号AEWC-20210426-139)。
1.2 细胞
人肝癌HepG2细胞购自中国科学院上海生命科学研究院细胞资源中心;小鼠肝癌H22细胞购自上海拜力生物技术有限公司。
1.3 药品与试剂
二甲基亚砜(dimethyl sulfoxide,DMSO,批号C11078099)购自上海麦克林生化科技有限公司;MTT(批号H25N11B130393)购自上海源叶生物科技有限公司;雪胆素片(批号20042201,10 mg/片)购自云南一枝蒿制药有限公司;盐酸阿霉素(批号25316-40-9)购自南京康满林化工实业有限公司;DMEM不完全高糖培养液、胰蛋白酶、细胞周期检测试剂盒(批号20190505)、DAPI凋亡试剂盒(批号KGA215)购自江苏凯基生物技术股份有限公司;PBS购自武汉塞维尔生物科技有限公司;胎牛血清(批号21051001)购自Cell Biologics公司;色谱级甲醇(批号21010355)购自Tedia公司;结晶紫染料(批号20170525)购自凯基生物技术股份有限公司;Annexin V-FITC/碘化丙啶(PI)凋亡试剂盒(批号A91231)购自杭州联科生物技术股份有限公司;乙醇(批号20210908)购自国药集团化学试剂有限公司;雪胆甲素对照品(批号HAO62805198,质量分数≥98%)购自Herbest公司;雪胆素乙对照品(批号RFS-X03502002012,质量分数≥98%)购自成都瑞芬思德丹生物科技有限公司;4%多聚甲醛(批号71033600)购自Biosharp公司;牛血清白蛋白(bovine serum albumin,BSA,批号EZ4567D106)购自BioFroxx公司;CRT兔单克隆抗体(批号ab92516)、HMGB1兔单克隆抗体(批号ab79823)购自英国Abcam公司;羊抗兔IgG抗体(批号AA44181)购自Bioworlde公司;增强型ATP试剂检测盒(批号052421210390)购自碧云天生物技术公司。
1.4 仪器
培养板、细胞培养瓶(美国Corning公司);SPECTRA MAX 190型酶标仪(Molecular Devices公司);普通光学显微镜、倒置荧光显微镜(日本Olympus公司);HH-4型水浴锅(上海维诚仪器公司);台式离心机(德国Heraeus公司);Agilent 1260型高效液相色谱仪;KQ5200型超声清洗器(昆山市超声仪器有限公司);Fresco 21型冷冻离心机(美国Thermo Fisher Scientific公司);Synergy H1型酶标仪(美国BioTek公司)。
2 方法
2.1 雪胆素片和阿霉素溶液的制备
称取5 mg阿霉素粉末溶于1 mL DMSO中,配制成质量浓度为5 mg/mL的母液,于4 ℃保存,临用时将母液用培养基稀释1000倍配制成质量浓度为5 mg/L的溶液,随后使用培养基逐级稀释到所需浓度。雪胆素片研磨粉碎后,称取40 mg溶于1 mL DMSO-完全培养基(1∶9)的溶液中,随后逐级稀释到所需浓度,给药体系中DMSO的终质量分数不超过0.1%。
2.2 高效液相色谱定性分析雪胆素片主要成分
2.2.1 色谱条件 Agilent Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为水(A)-甲醇(B),梯度洗脱:0~23 min,25%~45% B;23~35 min,45% B;体积流量为1 mL/min;检测波长为210 nm;进样量为10 μL;柱温为20 ℃。通过与已知对照品相匹配的保留时间(R)和光谱来识别成分。
2.2.2 混合对照品的制备 取雪胆甲素、雪胆乙素置于5 mL量瓶中,加甲醇定容至5 mL,分别制备雪胆甲素对照品溶液、雪胆乙素对照品溶液、混合对照品溶液,临用时用0.45 μm微孔滤膜滤过,于4 ℃保存。另以甲醇配制阴性对照1瓶。
2.2.3 供试品溶液的制备 取雪胆素片,研细,精密称定0.14 g,精密加入甲醇5 mL,超声处理10 min,放冷,用甲醇补足减失质量,摇匀,用0.45 μm微孔滤膜滤过,于4 ℃保存。
2.3 MTT法检测雪胆素片联合阿霉素对HepG2细胞存活率的影响
HepG2细胞用含10%胎牛血清的DMEM不完全高糖培养基,于5% CO2、37 ℃的恒温培养箱中培养。取处于对数生长期的HepG2细胞,接种于96孔板,每孔8000个。培养24 h后分别给予不同质量浓度雪胆素片(20、40、80、120、160、200 mg/L)、阿霉素(0.05、0.10、0.50、1.00、2.50、5.00 mg/L)及雪胆素片(20~200 mg/L)+阿霉素(0.05 mg/L)处理细胞,以不含药液的培养基作为对照,以不含细胞的培养基作为调零孔,培养24 h后,每孔加入10 μL MTT溶液(5 mg/L),37 ℃孵育4 h后,每孔加入100 μL DMSO溶液,振荡10 min后置于酶标仪中测定490 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(给药-调零)/(对照-调零)
2.4 平板克隆检测雪胆素片联合阿霉素对HepG2细胞增殖的影响
取处于对数生长期的HepG2细胞,接种于6孔板中,每孔1000个。在培养箱中培养6 d后换液,分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L)处理细胞,以不含药液的培养基作为对照,在培养箱中培养3 d后吸弃旧培养液,用PBS洗2遍,甲醇固定20 min后,按照结晶紫染色试剂盒说明书操作,干燥后观察增殖情况并拍照记录。
2.5 流式细胞术检测HepG2细胞凋亡和细胞周期
取处于对数生长期的HepG2细胞,接种于6孔板上,每孔1×106个,培养24 h后分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),进行细胞周期实验给药时增加雪胆素片(40 mg/L)组及雪胆素片(40 mg/L)与阿霉素(0.05 mg/L)联合给药组,以不含药液的培养基作为对照,孵育24 h后收集细胞,用冷的PBS洗涤细胞2遍,根据Annexin V-FITC/PI凋亡试剂盒和细胞周期试剂盒说明书操作,利用流式细胞仪检测细胞凋亡和周期。
2.6 免疫荧光检测HepG2细胞ICD相关蛋白表达
取处于对数生长期的HepG2细胞,接种于24孔板中,每孔5×104个,培养24 h后分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),以不含药液的培养基作为对照,继续孵育24 h后吸弃培养基,PBS漂洗3次,4%多聚甲醛固定20 min;1% BSA封闭30 min,分别滴加CRT和HMGB1单克隆抗体稀释液50 µL,4 ℃避光孵育过夜;第2天滴加二抗,避光孵育60 min;按照DAPI凋亡试剂盒说明书进行核染。染色完毕后滴加封片液50 µL于24孔板中,于激光共聚焦显微镜上进行荧光检测并拍照。
2.7 ELISA检测HepG2细胞ATP分泌
取处于对数生长期的HepG2细胞,接种于6孔板上,每孔5×105个,置于5% CO2培养箱中过夜培养,分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),以不含药液的培养基作为对照,孵育24 h后根据ATP检测试剂盒说明书操作,利用多功能酶标仪的化学发光功能进行检测。
2.8 H22肝癌细胞小鼠皮下移植瘤模型的建立
收集处于对数生长期的H22细胞,用高糖培养基调整细胞浓度至2×107个/mL。用一次性注射器注射到小鼠右侧腋下,每只注射0.1 mL,注射24 h后将小鼠随机分为4组,分别为模型组、雪胆素片(500 mg/kg)组、阿霉素(3 mg/kg)组和联合给药组,给药剂量同单用组保持一致,常规饲养,每天记录小鼠生存状况。雪胆素片溶于0.9%氯化钠溶液中,小鼠ig给药,1次/d;阿霉素溶于0.9%氯化钠溶液中,尾iv给药,每3天1次;联合组给药方式与周期均同单用组保持一致。小鼠共分为2批,第1批每组5只,12 d后脱颈椎法处死,剥离移植瘤组织、脾脏、心脏,称取瘤体与脾脏质量。另一批每组7只,每3天使用游标卡尺测量1次肿瘤体积,共测量5次,记录小鼠60 d内的生存情况
肿瘤体积=长×宽2/2
脾脏指数=脾脏质量/体质量
2.9 免疫组化检测小鼠皮下移植瘤模型肿瘤组织ICD相关蛋白表达
将各组小鼠瘤组织保存于福尔马林中,组织用石蜡包埋,切片脱蜡,0.3% H2O2孵育30 min。使用PBS冲洗切片3次,转移至柠檬酸盐抗原修复液中高压加热,室温冷却,加入CRT和HMGB1单克隆抗体后4 ℃孵育过夜。第2天,切片用PBS洗涤,加入经生物素标记的二抗,室温孵育1 h[16]。切片用DAB显色后苏木素复染,脱水后用中性树脂封片,于显微镜下观察CRT和HMGB1表达情况。
2.10 小鼠皮下移植瘤模型心脏病理HE染色
取各组小鼠心脏组织,用10%中性缓冲福尔马林固定,石蜡包埋,连续切成4 μm切片,65 ℃烘箱中烘烤3 h后用二甲苯洗3次,梯度乙醇冲洗2次,苏木素染色,流水冲洗后用盐酸-乙醇溶液分化,氨水返蓝,流水洗后用伊红复染,浸入梯度乙醇中,二甲苯透明,中性树脂封片[17],风干后拍照观察小鼠心肌毒性。
2.11 统计学分析
3 结果
3.1 雪胆素片主要有效成分的定性分析
本研究选择210 nm为检测波长,利用高效液相色谱对雪胆素片主要成分进行定性分析。如图1所示,雪胆素片的主要成分为雪胆甲素和雪胆乙素。
3.2 雪胆素片联合阿霉素对HepG2细胞存活率的影响
如图2所示,阿霉素和雪胆素片抑制HepG2细胞增殖,呈剂量相关性。单独给药时,雪胆素片(80 mg/L)抑制率为21.37%,阿霉素(0.05 mg/L)抑制率为0.52%,而雪胆素片(80 mg/L)联合阿霉素(0.05 mg/L)抑制率则达到51.15%,呈现较强的协同抗肝癌作用,差异具有统计学意义(<0.01)。因此后续体外实验选择80 mg/L雪胆素片联合0.05 mg/L阿霉素。

1-雪胆甲素 2-雪胆乙素

与对照组比较:**P<0.01
3.3 雪胆素片联合阿霉素对HepG2细胞集落形成的影响
如图3-A所示,与对照组相比,阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合给药组细胞集落形成数量均有减少,其中联合组的抑制作用最明显,表明雪胆素片联合阿霉素抑制肿瘤能力最强。
3.4 雪胆素片联合阿霉素对HepG2细胞凋亡和周期的影响
如图3-B所示,不同组别药物处理HepG2细胞24 h后,对照组、阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合给药组细胞凋亡率分别为17.31%、19.86%、48.8%、61.6%,说明雪胆素片与阿霉素联用后诱导HepG2细胞凋亡的能力增强。
如图3-C所示,不同组别药物处理HepG2细胞24 h后,各组G2/M期细胞数量均高于对照组;与阿霉素组相比,雪胆素片(40 mg/L)联合阿霉素(0.05 mg/L)组G2/M期的细胞数量明显增多,雪胆素片(80 mg/L)联合阿霉素(0.05 mg/L)组G2/M期细胞数虽然没有增加,但出现凋亡亚峰。上述结果提示低质量浓度(40 mg/L)的雪胆素片与阿霉素联用可诱导HepG2细胞有丝分裂停滞在G2/M期,高质量浓度(80 mg/L)的雪胆素片与阿霉素联用诱导HepG2细胞凋亡。

图3 雪胆素片联合阿霉素对HepG2细胞集落形成(A)、细胞凋亡(B) 和细胞周期(C) 的影响
3.5 雪胆素片联合阿霉素对HepG2细胞CRT和HMGB1蛋白表达的影响
CRT在ICD早期转位到细胞膜上,同时细胞释放HMGB1。免疫荧光检测结果(图4)显示,雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合处理后HepG2细胞CRT明显暴露于细胞膜;同样,联合组处理过的HepG2细胞中HMGB1向外分泌。说明雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合处理后促使CRT暴露于细胞膜,并促进HMGB1向胞外分泌。
3.6 雪胆素片联合阿霉素对HepG2细胞ATP释放的影响
如图5所示,阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合组胞内ATP浓度均低于对照组,其中雪胆素片组和联合组有统计学意义(<0.01)。与对照组相比,联合组胞外ATP浓度显著升高(<0.01),提示雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合使用促进ATP由胞内向胞外分泌。

图4 雪胆素片联合阿霉素对HepG2细胞CRT (A) 和HMGB1 (B) 蛋白表达的影响

与对照组比较:**P<0.01
3.7 雪胆素片联合阿霉素对小鼠皮下移植瘤模型移植瘤生长及生存周期的影响
小鼠sc H22细胞建立异位移植瘤模型,模型组小鼠肿瘤体积持续增大,小鼠逐渐出现运动迟缓、食欲不佳、立毛等症状。在给药12 d后取小鼠肿瘤组织并拍照(图6-A),雪胆素片(500 mg/kg)、阿霉素(3 mg/kg)以及联合给药组小鼠移植瘤体积生长速度比模型组明显减缓,联合组肿瘤体积抑制程度最大,抗肿瘤作用显著增强(图6-B,<0.01),并且在一定程度上改善阿霉素单用所致的小鼠脾脏指数降低现象(表1)。60 d生存期观察结果(图6-C)显示,联合组小鼠生存质量最高,死亡率最低。
3.8 雪胆素片联合阿霉素对小鼠皮下移植瘤模型肿瘤组织CRT和HMGB1蛋白表达的影响
如图7所示,与模型组相比,雪胆素片(500 mg/kg)与阿霉素(3 mg/kg)联合给药组CRT和HMGB1蛋白阳性表达的细胞数量明显增多,与体外实验中对HepG2细胞调控作用一致。
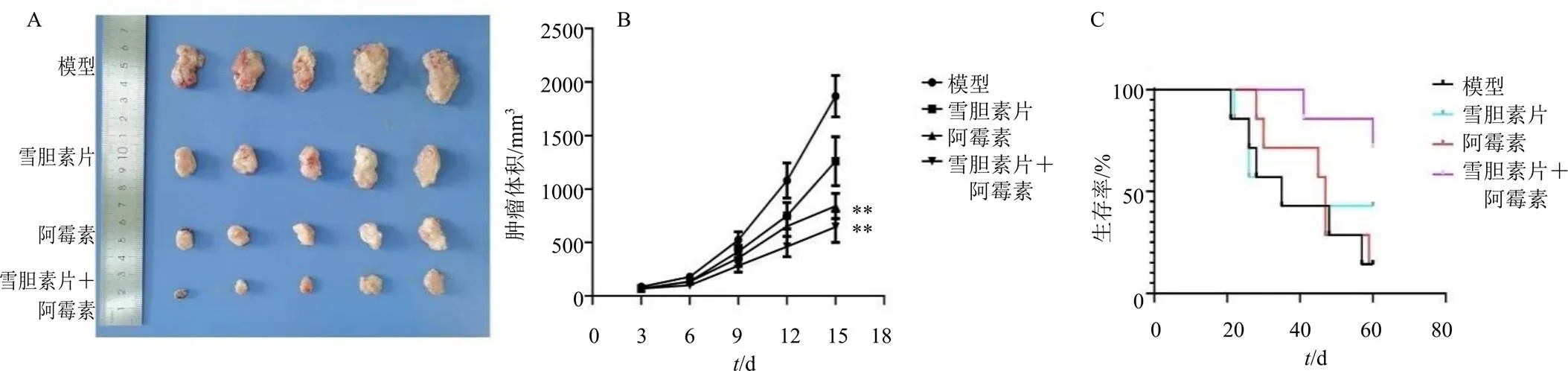
与模型组比较:**P<0.01
表1 雪胆素片联合阿霉素对小鼠皮下移植瘤模型瘤质量和脾脏指数的影响(, n = 5)
Table 1 Effect of Xuedansu Tablets combined with doxorubicin on tumor weight and spleen index of subcutaneous tumor mice model (, n = 5)
组别剂量/(mg·kg−1)瘤质量/g脾脏指数 模型—1.959±0.4967.832±0.180 雪胆素片5001.569±0.3146.596±0.169 阿霉素30.965±0.354*4.321±0.039* 雪胆素片+阿霉素500+30.366±0.249**5.429±0.049
与模型组比较:*<0.05**<0.01
*< 0.05**< 0.01model group
3.9 雪胆素片联合阿霉素对小鼠皮下移植瘤模型心肌毒性的影响
如图8所示,模型组和雪胆素片(500 mg/kg)组小鼠心肌细胞未见明显病理变化;阿霉素(3 mg/kg)组小鼠心肌细胞坏死及空泡样变化明显;阿霉素与雪胆素片联合使用后,小鼠心肌细胞坏死及空泡样变化有显著改善,表明雪胆素片与阿霉素联合使用后能够减轻阿霉素的心肌毒性。
4 讨论
雪胆素片是由葫芦科雪胆属植物提取的“雪胆素”制成的口服片剂,雪胆素主要成分为雪胆甲素和雪胆乙素,以雪胆甲素为主[18],是葫芦素类化合物的一种。雪胆素对胃癌、肺癌、乳腺癌等恶性肿瘤均有抑制作用[19-28]。目前文献报道的关于雪胆素抗肿瘤作用机制主要有:抑制细胞增殖和侵袭能力;阻滞细胞周期在G2/M期;诱导细胞凋亡;干扰表皮生长因子受体(epidermal growth factor receptor,EGFR)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路[19,26];破坏肌动蛋白细胞骨架等[20,27]。此外,研究发现,雪胆甲素还可以通过保护免疫系统和调节免疫功能抑制二甲基苯蒽诱导的小鼠乳腺肿瘤[21];通过抑制Aurora A、信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)以及Cofilin等信号通路多靶点协同抑制人肺癌细胞系NCI-H460和A549增殖并促进细胞凋亡[22];通过抑制Wnt/β-连环蛋白(β-catenin)通路激活,从而抑制胃癌细胞SGC-7901的增殖及其迁移能力[23]。同时,研究发现葫芦素类化合物不仅在单独用药时表现出良好的抗肿瘤活性[24],而且在药物联用方面也表现出一定优势,如葫芦素B与吉西他滨等联用治疗胰腺癌等肿瘤,低剂量的葫芦素E加强顺铂对乳腺癌细胞的抑制作用等[29]。尽管雪胆素在肿瘤治疗中表现出一定的潜力,但是对于雪胆素及雪胆素片对肿瘤的治疗缺乏系统的体内外研究,对于其是否能作为化疗辅助药物从而减少化疗药物的使用剂量和不良反应尚未有报道。本研究发现雪胆素片可以抑制HepG2细胞活力,与阿霉素联用有效抑制细胞集落的形成;细胞凋亡和周期结果显示,联用时低质量浓度雪胆素片阻滞细胞周期,高质量浓度时导致凋亡,提示雪胆素片联合阿霉素能够提高抗肿瘤效果。

图7 雪胆素片联合阿霉素对小鼠皮下移植瘤模型肿瘤组织CRT和HMGB1蛋白表达的影响

图8 雪胆素片联合阿霉素对小鼠皮下移植瘤模型心肌毒性的影响
在阿霉素等化疗药物诱导ICD激发机体免疫系统抗肿瘤的过程中,DAMPs的表达起到了至关重要的作用,DAMPs通过与免疫细胞上的模式识别受体(pattern recognition receptors,PRRs)结合增强机体抗肿瘤免疫反应[30]。CRT、HMGB1、ATP是细胞免疫原性死亡的3种关键DAMPs。肿瘤细胞免疫原性死亡释放的CRT,能够被抗原呈递细胞识别[31],可作为一种“eat me”信号被DC细胞吞噬[32]。HMGB1能够与DC细胞表面的Toll样受体4(Toll-like receptor 4,TLR4)结合,激活促炎细胞因子的产生,阻止DC吞噬的肿瘤抗原降解[33]。细胞外ATP被视为凋亡细胞释放的一种“find me”的信号,既可以作为归巢信号,也可以作为NOD样受体热蛋白结构域3(NOD-like receptors family pyrin domain containing 3,NLRP3)炎症体的激活剂,快速募集DC细胞到肿瘤组织[34]。通过药物联用增强化疗药物的ICD已成为未来肿瘤研究的重要课题之一,然而雪胆素是否能够通过与阿霉素联用增强免疫原性死亡提高抗肿瘤活性尚未有报道。本研究中雪胆素片与阿霉素联合处理后CRT在细胞膜表面的暴露程度与HMGB1向外分泌的程度远高于阿霉素单用组,胞外ATP浓度也显著增加。免疫组化结果显示小鼠肿瘤组织内CRT与HMGB1蛋白表达上调,提示雪胆素片与阿霉素联合使用增强细胞ICD。
综上所述,本研究发现雪胆素片与阿霉素联用能够促进细胞凋亡,阻滞细胞周期,以及诱导CRT与HMGB1的表达;同时增强抗肿瘤活性,提高小鼠皮下移植瘤模型脾脏指数,延长小鼠生存时间,减弱阿霉素对小鼠的心肌毒性,上调肿瘤组织内CRT与HMGB1蛋白表达,其机制可能与促进细胞ICD有关。后续研究将聚焦于雪胆素片与阿霉素联合使用诱导HepG2细胞的ICD过程,及其对DC细胞吞噬作用和T淋巴细胞活化程度的影响。
利益冲突 所有作者均声明不存在利益冲突
[1] Liu H T, Jiang M J, Deng Z J,. Immune checkpoint inhibitors in hepatocellular carcinoma: Current progresses and challenges [J]., 2021, 11: 737497.
[2] 田塬, 唐贵菊, 王继婷, 等. 化疗药治疗肝细胞癌的研究进展 [J]. 国际药学研究杂志, 2020, 47(12): 1088-1093.
[3] Krysko O, Aaes T L, Bachert C,. Many faces of DAMPs in cancer therapy [J]., 2013, 4(5): e631.
[4] Krysko O, Aaes T L, Kagan V E,. Necroptotic cell death in anti-cancer therapy [J]., 2017, 280(1): 207-219.
[5] Kepp O, Senovilla L, Vitale I,. Consensus guidelines for the detection of immunogenic cell death [J]., 2014, 3(9): e955691.
[6] Hou W, Zhang Q, Yan Z,. Strange attractors: DAMPs and autophagy link tumor cell death and immunity [J]., 2013, 4(12): e966.
[7] Garg A D, Martin S, Golab J,. Danger signalling during cancer cell death: Origins, plasticity and regulation [J]., 2014, 21(1): 26-38.
[8] Ahmed A, Tait S W G. Targeting immunogenic cell death in cancer [J]., 2020, 14(12): 2994-3006.
[9] Garg A D, Dudek-Peric A M, Romano E,. Immunogenic cell death [J]., 2015, 59(1/2): 131-140.
[10] Garg A D, Agostinis P. Cell death and immunity in cancer: From danger signals to mimicry of pathogen defense responses [J]., 2017, 280(1): 126-148.
[11] Galluzzi L, Vacchelli E, Pedro J M B S,. Classification of current anticancer immunotherapies [J]., 2014, 5(24): 12472-12508.
[12] Yu Z, Guo J F, Hu M Y,. Icaritin exacerbates mitophagy and synergizes with doxorubicin to induce immunogenic cell death in hepatocellular carcinoma [J]., 2020, 14(4): 4816-4828.
[13] Li J B, Zhou S, Yu J,. Low dose shikonin and anthracyclines coloaded liposomes induce robust immunogenetic cell death for synergistic chemo-immunotherapy [J]., 2021, 335: 306-319.
[14] de Lima L I, Faria R S, Franco M S,. Combined paclitaxel-doxorubicin liposomal results in positive prognosis with infiltrating lymphocytes in lung metastasis [J]., 2020, 15(28): 2753-2770.
[15] 张金芳, 张晓瑞, 郑敏思, 等. 葫芦素类化合物的药理作用研究进展 [J]. 医药导报, 2020, 39(12): 1710-1716.
[16] 丁文波, 宁青, 夏智, 等. 双丹胶囊联合5-FU对肝癌细胞Huh-7及荷瘤小鼠协同抗肿瘤作用研究 [J]. 中国中药杂志, 2020, 45(23): 5762-5769.
[17] 刘博佳, 宁青, 钟荣玲, 等. 羽扇豆醇对人肝癌细胞HepG2和SK-HEP-1侵袭、转移的影响及机制研究 [J]. 中国中药杂志, 2020, 45(24): 6028-6035.
[18] 苏健. 高效液相色谱法测定雪胆素片中雪胆素甲的含量 [J]. 云南中医学院学报, 2014, 37(2): 21-23.
[19] Zhang J, Song Y F, Liang Y,. Cucurbitacin IIa interferes with EGFR-MAPK signaling pathway leads to proliferation inhibition in A549 cells [J]., 2019, 132: 110654.
[20] Boykin C, Zhang G, Chen Y H,. Cucurbitacin IIa: A novel class of anti-cancer drug inducing non-reversible actin aggregation and inhibiting survivin independent of JAK2/STAT3 phosphorylation [J]., 2011, 104(5): 781-789.
[21] 吴璐璐, 田瑜, 龚令熙, 等. 雪胆素甲对小鼠乳腺肿瘤的抑制作用及其机制 [J]. 医药导报, 2020, 39(11): 1471-1476.
[22] 陈育林, 咸婧, 肖翠, 等. 雪胆素甲诱导非小细胞肺癌系NCI-H460和A549的凋亡效应及其作用机制初探 [J]. 中国药理学通报, 2017, 33(7): 922-927.
[23] 曹淑君, 初向华, 李宗莉, 等. 雪胆素甲对胃癌细胞SGC-7901增殖和侵袭能力的影响 [J]. 精准医学杂志, 2020, 35(6): 540-544.
[24] Cai Y E, Fang X F, He C W,. Cucurbitacins: A systematic review of the phytochemistry and anticancer activity [J]., 2015, 43(7): 1331-1350.
[25] Torres-Moreno H, Marcotullio M C, Velázquez C,. Cucurbitacin IIb, a steroidal triterpene frominduces antiproliferative and apoptotic effects on cervical and lung cancer cells [J]., 2020, 157: 108597.
[26] Liang Y, Zhang T H, Ren L,. Cucurbitacin IIb induces apoptosis and cell cycle arrest through regulating EGFR/MAPK pathway [J]., 2021, 81: 103542.
[27] 任帅. 雪胆素乙对人前列腺癌细胞增殖的抑制作用及其分子机制研究 [D]. 广州: 暨南大学, 2013.
[28] Zeng Y J, Wang J, Huang Q W,. Cucurbitacin IIa: A review of phytochemistry and pharmacology [J]., 2021, 35(8): 4155-4170.
[29] 王文雪, 牟艳玲, 姚庆强. 葫芦素类化合物的抑瘤作用及其作用机制和联合用药研究进展 [J]. 中国药房, 2017, 28(19): 2712-2717.
[30] Zitvogel L, Kepp O, Kroemer G. Decoding cell death signals in inflammation and immunity [J]., 2010, 140(6): 798-804.
[31] Orr A W, Pedraza C E, Pallero M A,. Low density lipoprotein receptor-related protein is a calreticulin coreceptor that signals focal adhesion disassembly [J]., 2003, 161(6): 1179-1189.
[32] Obeid M, Tesniere A, Ghiringhelli F,. Calreticulin exposure dictates the immunogenicity of cancer cell death [J]., 2007, 13(1): 54-61.
[33] Exner R, Sachet M, Arnold T,. Prognostic value of HMGB1 in early breast cancer patients under neoadjuvant chemotherapy [J]., 2016, 5(9): 2350-2358.
[34] Fucikova J, Moserova I, Truxova I,. High hydrostatic pressure induces immunogenic cell death in human tumor cells [J]., 2014, 135(5): 1165-77.
Anti-hepatocellular carcinoma effect of combination of Xuedansu Tablets with doxorubicin on enhancing immunogenic cell death
WANG Sen1, 2, DAI Ting-ting3, ZHONG Rong-ling2, XIA Zhi2, LUO Li-xia1, 2, NING Qing2, SONG Jie1, 2, XIE Lin1, 4
1. The Third Clinical Medical College, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Key Laboratory of Traditional Chinese Medicine Drug Release System, State Administration of Traditional Chinese Medicine, Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China 3. Department of oncology, General Hospital of Easter Theater Command, Nanjing 210002, China 4. Department of Orthopedics, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China
To study the synergistic effect of Xuedansu Tablets (雪胆素片) combined with doxorubicin against liver cancer, and the regulation of cell immunogenic death-related proteins expressions.The main components of Xuedansu Tablets were analyzed by high performance liquid chromatography; Effect of Xuedansu Tablets combined with doxorubicin on survival rate of human hepatocellular carcinoma HepG2 cells was investigated by MTT method; Effect of Xuedansu Tablets combined with doxorubicin on colony formation of HepG2 cells was detected by plate cloning; Flow cytometry was used to analyze the effect of Xuedansu Tablets combined with doxorubicin on apoptosis rate and cell cycle of HepG2 cells; Immunofluorescence was used to detect expressions of calreticulin (CRT) and high mobility protein 1 (HMGB1) which are key indicators of immunogenic cell death; Intracellular and extracellular adenosine triphosphate (ATP) concentrations were detected by ELISA. H22tumor-bearing mice model was established to observeantitumor effect of Xuedansu Tablets combined with doxorubicin; CRT and HMGB1 expressions of tumor tissue in mice were detected by immunohistochemistry; Hematoxylin-eosin (HE) staining method was used to observe the effect of Xuedansu Tablets combined with doxorubicin on myocardial toxicity in mice.Xuedansu Tablets combined with doxorubicin had concentration-dependent cytotoxic and pro-apoptotic effects on HepG2 cells, which could promote the extracellular exposure of CRT, secretion of HMGB1 into extracellular, and increase in extracellular concentration of ATP; Xuedansu Tablets combined with doxorubicin inhibited the growth of subcutaneous transplanted tumors in H22-cell mice, improved immunity, prolonged their survival, increased the number of cells expressing CRT and HMGB1 proteins in subcutaneous tumor tissues of mice.Anti-hepatocellular carcinoma effect of Xuedansu Tablets combined with doxorubicin may be related to the regulation of immunogenic death-related proteins expressions.
Xuedansu Tablets; doxorubicin; immunogenic cell death; calreticulin; high mobility protein 1; adenosine triphosphate
R285.5
A
0253 - 2670(2022)11 - 3367 - 09
10.7501/j.issn.0253-2670.2022.11.012
2022-02-15
国家自然科学基金资助项目(81873055);全国中医药创新骨干人才培训项目(19ZYCXGG-2)
王 森,硕士研究生,研究方向为中药学。E-mail: lookforward163@163.com
谢 林,主任医师,主要从事脊柱退行性疾病研究。E-mail: wtcm66@126.com
宋 捷,副研究员,主要从事中药药理抗肿瘤研究。E-mail: songjie_pharmacy@163.com
[责任编辑 李亚楠]
