基于UPLC-Q-TOF-MS的人参配方颗粒化学成分及指纹图谱研究
2022-05-31姚长良张建青李佳媛果德安
王 静,姚长良,张建青,李佳媛,姚 帅,果德安*
基于UPLC-Q-TOF-MS的人参配方颗粒化学成分及指纹图谱研究
王 静1, 2,姚长良2,张建青2,李佳媛2,姚 帅2,果德安1, 2*
1. 广东药科大学中药学院,广东 广州 510006 2. 中国科学院上海药物研究所 中药标准化技术国家工程研究中心,上海 201203
采用超高效液相色谱串联四极杆飞行时间质谱联用技术(UPLC-Q-TOF-MS)对人参配方颗粒标准汤剂化学成分进行快速表征,阐明人参配方颗粒的化学物质基础,并建立指纹图谱方法对人参配方颗粒进行质量控制。采用ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱,在正、负离子模式下分别采集人参配方颗粒标准汤剂的质谱数据,通过MS DIAL软件辅助解析、数据库检索和对照品比对等方法快速分析人参配方颗粒标准汤剂化学成分。并采用ACQUITY UPLC HSS T3色谱柱(150 mm×2.1 mm,1.8 μm),乙腈-0.01%磷酸水溶液为流动相,建立人参配方颗粒指纹图谱方法。从人参配方颗粒标准汤剂中共鉴定出57个化合物,包括皂苷25个、氨基酸及其衍生物12个、碱基及核苷5个、其他类成分15个。建立的人参配方颗粒指纹图谱有8个共有峰,分别为人参皂苷Rg1、Re、Rf、Rc、Ro、Rb1、Rb2、Rd。指纹图谱方法精密度、稳定性、重复性良好,不同厂家不同批次人参配方颗粒的成分基本相同,仅含量上存在一定差异。该研究基本阐明了人参配方颗粒的化学物质基础,建立的指纹图谱方法为人参配方颗粒的质量控制提供了方法参考。
人参配方颗粒;指纹图谱;UPLC-Q-TOF-MS;高效液相色谱;人参皂苷;人参皂苷Rg1;人参皂苷Re;人参皂苷Rf;人参皂苷Rc
中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,具有便携、易于贮存和使用等特点,是对传统中药饮片的补充[1-3]。虽然中药配方颗粒已经获得广泛的应用,但其化学物质基础及质量控制研究仍然滞后。人参为五加科人参属植物C. A. Mey.的干燥根及根茎[4]。由于其具有大补元气、除邪明目和益智安神等功效,是常用的补益要药[5-6]。目前,对于人参药材化学物质基础已有深入研究,主要含有皂苷、糖、挥发性成分、脂、蛋白质及甾醇类等成分[7-11],其中皂苷类成分研究最多,Zuo等[12]从人参中鉴定了286个人参皂苷。人参配方颗粒应用广泛,其由人参经水提制得,化学物质基础与人参药材存在明显差异。但目前人参配方颗粒的物质基础研究鲜有报道,因此也阻碍了科学可行的人参配方颗粒质量控制方法的构建。本研究采用UPLC-Q-TOF/MS技术,通过数据库检索、对照品比对和MS DIAL软件辅助解析等方法快速分析人参配方颗粒标准汤剂化学成分,并建立人参配方颗粒的指纹图谱方法,从而达到控制人参配方颗粒质量的目的。
1 仪器与材料
Waters ACQUITY UPLC超高效液相色谱仪、Waters Xevo G2-S Q-TOF质谱仪(Waters公司,美国);P180H型超声波水浴锅(德国埃尔玛公司);Quintix 224-1 CN-1型电子天平(赛多利斯北京有限公司);Agilent 1290型超高效液相色谱仪,配置Agilent G7111B四元泵、Agilent G7129A进样器、Agilent G7115A DAD检测器;Milli-Q Integral超纯水系统(Millipore公司,Bedford,美国)。
色谱纯乙腈(批号UCNA1H,Honeywell),分析纯甲醇(批号20210208,国药集团上海化学试剂有限公司),质谱级甲酸(批号UUQBH-JX,梯希爱上海化成工业发展有限公司),色谱级磷酸(批号20200731,色谱级,Tedia公司)。
对照品人参皂苷Rg1(ginsenoside Rg1,批号3852,质量分数98.0%)、人参皂苷Re(ginsenoside Re,批号4147,质量分数98.0%)、人参皂苷Rf(ginsenoside Rf,批号3071,质量分数98.0%)、人参皂苷Rc(ginsenoside Rc,批号7879,质量分数98.0%)、人参皂苷Ro(ginsenoside Ro,批号8689,质量分数98.0%)、人参皂苷Rd(ginsenoside Rd,批号8262,质量分数98.0%)、人参皂苷Rb1(ginsenoside Rb1,批号2326,质量分数98.0%)、人参皂苷Rb2(ginsenoside Rb2,批号9039,质量分数98.0%)均购自上海诗丹德标准技术服务有限公司。
18批人参配方颗粒来源信息见表1。人参药材购自上海雷允上药业有限公司,经上海药物研究所中药现代化中心姚帅高级实验师鉴定为五加科人参属植物人参C. A. Mey.,符合《中国药典》2020版一部人参项的有关规定。
表1 18批人参配方颗粒来源
Table 1 Sources of 18 batches of Ginseng Dispensing Granules
编号批号厂家 S1211201001上海万仕诚药业有限公司 S2211201002上海万仕诚药业有限公司 S3211201003上海万仕诚药业有限公司 S41071251广东一方制药有限公司 S5A1120551广东一方制药有限公司 S6A1120541广东一方制药有限公司 S7A1120561广东一方制药有限公司 S8A1129571广东一方制药有限公司 S9A1105171广东一方制药有限公司 S10A1129582广东一方制药有限公司 S112006001C华润三九医药股份有限公司 S122103002C华润三九医药股份有限公司 S132005003C华润三九医药股份有限公司 S142005001C华润三九医药股份有限公司 S152005002C华润三九医药股份有限公司 S1621056494江阴天江药业有限公司 S1721100641江阴天江药业有限公司 S1821060091江阴天江药业有限公司
2 方法
2.1 对照品溶液的制备
精密称取人参皂苷Rg1、Re、Rf、Rc、Ro、Rb1、Rb2、Rd对照品适量,分别加50%甲醇水制成100 μg/mL的对照品溶液。
2.2 供试品溶液制备
2.2.1 人参配方颗粒供试品的制备 取人参配方颗粒适量,研细,称取1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇水20 mL,超声处理30 min,14 000 r/min离心,取上清液,即得。
2.2.2 人参配方颗粒标准汤剂及其供试品的制备 标准汤剂(实验室自制):取人参药材粉末100 g,加10倍量水浸泡30 min,武火加热沸腾后保持微沸煎煮60 min,经150目滤布滤过,药渣加8倍量水,保持微沸煎煮30 min,合并滤液,浓缩,冻干,得人参配方颗粒标准汤剂粉末[3,13];精密称取1 g粉末,加50%甲醇水20 mL,超声处理30 min,14 000 r/min离心,取上清液,即得。
2.3 色谱、质谱条件
2.3.1 人参配方颗粒标准汤剂的成分分析 色谱条件:ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~1 min,2% A;1~16 min,2%~30% A;16~25 min,30%~44% A;25~28 min,44%~95% A;28~29 min,95%~100% A;29~32 min,100% A),柱温为30 ℃;进样体积为2 μL;体积流量为0.3 mL/min。
质谱条件:电喷雾离子源采用正、负离子模式进行数据采集,以氮气为雾化气和锥孔气,采集方法为fast DDA。正离子模式参数:毛细管电压为2.5 kV,锥孔电压为40 V,离子源温度为120 ℃,去溶剂气温度450 ℃,锥孔气体积流量30 L/h,去溶剂气体积流量600 L/h。负离子模式参数:毛细管电压为2.0 kV,锥孔电压为40 V;离子源温度为120 ℃;去溶剂气温度450 ℃,锥孔气体积流量50 L/h,去溶剂气体积流量800 L/h。扫描范围/100~1500,采集时间0.1 s,当基峰离子强度高于10 000时,触发前三强母离子的二级扫描。碰撞能低质量端设置为10~30 V,高质量端设置为30~50 V。
2.3.2 人参配方颗粒指纹图谱 色谱条件:ACQUITY UPLC HSS T3色谱柱(150 mm×2.1 mm,1.8 μm),流动相为0.01%磷酸水溶液(A)和乙腈(B),梯度洗脱(0~20 min,20%~24% B;20~33 min,24%~28% B;33~60 min,28%~36% B),柱温为35 ℃,进样体积为2 μL,检测波长为203 nm;体积流量为0.3 mL/min。
2.4 数据处理
首先,将采集的高分辨质谱数据通过MSconvert软件进行数据格式转换,后将转换格式后的数据导入MS DIAL软件中进行解卷积、峰提取、代谢物鉴定。并结合高分辨质谱数据提供的准分子离子及二级碎片信息,使用Masslynx软件进行数据分析。
3 结果
3.1 人参配方颗粒标准汤剂的物质基础研究
采用UPLC-QTOF-MS技术获得人参配方颗粒标准汤剂的高分辨质谱数据,其在正、负离子模式下的基峰离子流图见图1。通过数据解析共鉴定57个化合物,包括皂苷25个、氨基酸及其衍生物12个、碱基及核苷5个、其他类成分15个,鉴定结果见表2。
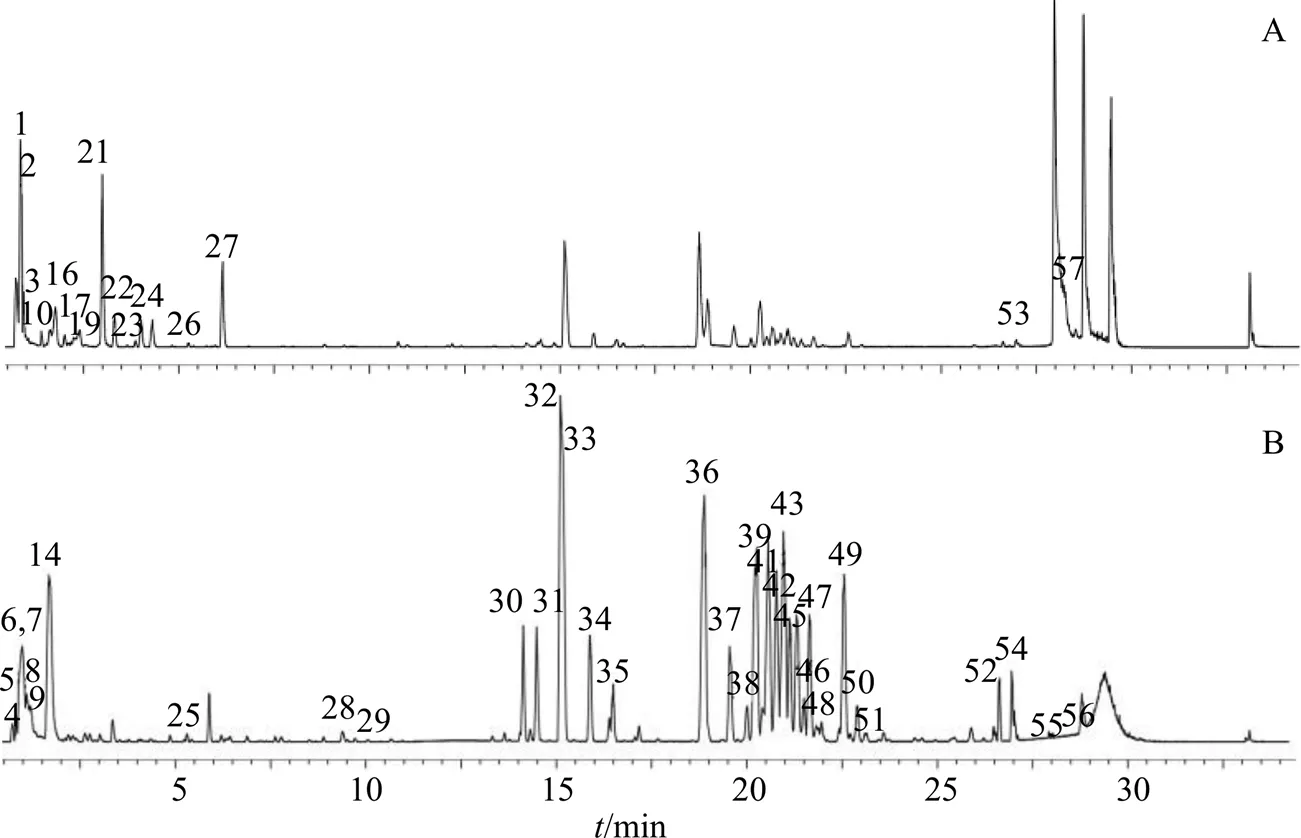
A-正离子模式 B-负离子模式
表2 人参配方颗粒标准汤剂成分鉴定
Table 2 Composition identification of Ginseng Dispensing Granules standard decoction
序号tR/min质量数(m/z)分子式加和离子误差(×10−6)碎片离子化合物名称参考文献 10.79175.120 5C6H14N4O2M+H1.0175.120 5, 158.093 0, 130.097 5, 116.071 7, 70.067 2精氨酸14-15 20.80337.171 8C12H24N4O7M+H−0.5337.171 8, 175.120 9, 158.093 2精氨酸葡萄糖苷16 30.83499.225 0C18H34N4O12M+H−0.1499.225 0, 337.169 2, 175.120 7, 158.093 6精氨酸葡萄二糖苷16 40.86195.047 7C6H12O7M-H−2.8195.049 6, 177.036 7, 147.026 8, 129.013 1, 99.001 5, 74.998 9, 59.003 2葡萄糖酸17 50.86209.028 0C6H10O8M-H−1.7209.027 7, 191.017 4, 133.010 0, 129.015 4, 85.020 8, 71.004 4, 57.023 3葡萄糖二酸18 60.95191.057 7C7H12O6M-H2.1191.057 7, 127.039 1, 85.030 2奎宁酸19-20 70.96341.106 9C12H22O11M-H−1.5341.107 3, 179.053 0, 119.028 9, 89.016 3, 71.000 40, 59.003 4蔗糖19 80.98503.160 3C18H32O16M-H−0.9503.158 7, 341.102 2, 221.063 9, 179.052 3, 119.027 6, 89.016 3棉子糖17,20 91.03133.009 6C4H6O5M-H−4.1133.009 3, 115.004 3, 71.014 6苹果酸14,20 100.92116.069 5C5H9NO2M+H−1.7116.070 8, 70.064 6脯氨酸18,21 111.19266.122 6C10H19NO7M+H−1.4248.113 6, 230.103 6, 194.085 5, 98.058 6γ-氨基丁酸葡萄糖苷17 121.37136.064 0C5H5N5M+H1.7136.062 5, 119.035 1腺嘌呤19-20 131.49123.057 3C6H6N2OM+H1.5123.057 4, 96.044 2, 80.050 2烟酰胺18,22 141.62191.018 1C6H8O7M-H−1.1191.015 7, 173.008 5, 129.016 4, 111.002 0, 87.000 3, 57.022 0柠檬酸18,20 15a1.62274.092 0C11H15NO7M+H−0.7238.070 7, 192.066 7, 130.049 3, 97.029 7脯氨酸戊糖苷 161.71130.050 9C5H7NO3M+H0.5130.049 6, 84.046 7L-焦谷氨酸15,19 172.11182.081 7C9H11NO3M+H0.0165.057 5, 136.078 3, 123.046 7酪氨酸15,21 182.17113.035 7C4H4N2O2M+H0.6113.036 2, 96.007 3, 70.065 6尿嘧啶19-20 192.30132.102 1C6H13NO2M+H−0.486.097 9亮氨酸15,21 20a2.55294.155 9C12H23NO7M+H0.6276.147 2, 230.138 0, 144.102 3, 86.101 7异亮氨酸果糖苷 212.90268.104 8C10H13N5O4M+H0.2268.105 4, 136.063 5腺苷16,22 22a3.15252.109 2C10H13N5O3M+H−0.5252.109 2, 136.063 5虫草素 233.22284.099 1C10H13N5O5M+H−0.4225.127 6, 152.058 9, 135.031 4, 110.035 4鸟苷20-21 243.99166.086 8C9H11NO2M+H0.0120.083 4, 103.057 6苯丙氨酸14,15 255.31382.098 9C14H17N5O8M-H−1.0266.087 8, 206.068 5, 115.006 5琥珀酰腺苷17 265.32127.041 2C6H6O3M+H1.7127.039 9, 109.034 6麦芽酚17 276.14205.098 2C11H12N2O2M+H0.5188.071 2, 159.094 0, 118.065 0色氨酸14-15 289.39337.092 7C16H18O8M-H0.4191.056 3, 173.044 293.352香豆酰奎宁酸22 2910.67163.041 1C9H8O3M-H1.6163.036 7, 119.050 7对香豆酸17,20 30c14.051 007.540 0C48H82O19M+HCOO−3.1961.534 7, 799.479 7, 637.433 1PPT-3Glc 31s14.40977.529 4C47H80O18M+HCOO−2.7931.524 9, 799.484 1, 637.430 6三七皂苷R1 32s15.07845.489 3C42H72O14M+HCOO−0.6845.489 3, 799.486 6, 637.434 5, 475.381 5人参皂苷Rg1 33s15.12991.549 4C48H82O18M+HCOO1.6945.541 5, 783.490 1, 637.430 3, 475.380 8, 119.028 4人参皂苷Re 3415.89885.482 2C45H74O17M-H−2.6841.494 6, 781.471 9, 619.421 0, 475.381 0丙二酰人参皂苷Rg119,23 3516.371 031.542 7C51H84O21M-H1.6987.550 2, 945.539 6, 927.529 4, 637.428 7丙二酰人参皂苷Re19,23 36s18.80845.489 3C42H72O14M+HCOO−0.6799.481 5, 637.431 0, 475.380 2人参皂苷Rf 3719.47815.478 6C41H70O13M+HCOO−0.7769.470 6, 637.431 0, 475.377 2, 161.042 3三七皂苷R219,23 38s20.14829.492 4C42H72O13M+HCOO−2.5783.487 5, 637.429 9, 475.378 0, 161.041 4人参皂苷Rg2 39s20.241 153.603 0C54H92O23M+HCOO2.41 107.588 6, 945.537 9, 783.486 3, 179.051 9人参皂苷Rb1
续表1

序号tR/min质量数(m/z)分子式加和离子误差(×10−6)碎片离子化合物名称参考文献 40a20.40329.232 3C18H34O5M-H−0.5329.231 9, 229.142 0, 211.133 7, 171.099 9, 139.107 8,99.072 29,10,13-TriHOME 4120.531 193.598C50H98O31M-H−3.71 149.602 9, 1 107.588 0, 945.542 2丙二酰人参皂苷 Rb119,23 42s20.801 123.594 0C53H90O22M+HCOO4.01 077.583 5, 783.493 3, 621.433 1人参皂苷Rc 43s20.94955.487 1C48H76O19M-H−3.2955.487 5, 793.431 8, 569.382 1, 455.351 5人参皂苷Ro 4421.161 163.586 5C49H96O30M-H−4.51 119.592 7, 1 077.580 2, 1 059.568 6, 945.542 5,765.487 1丙二酰人参皂苷Rc19,23 45s21.321 123.587 0C53H90O22M+HCOO−3.01 077.580 8, 783.480 7, 621.435 7人参皂苷Rb2 46s21.491 123.587 0C53H90O22M+HCOO−3.01 077.580 1, 783.481 0, 621.434 3人参皂苷Rb3 4721.641 163.586 0C49H96O30M-H−4.51 119.592 7, 1 077.580 2, 1 059.568 6丙二酰人参皂苷Rb219,23 4821.801 163.586 3C49H96O30M-H−4.51 119.592 7, 1 077.580 2, 1 059.568 6丙二酰人参皂苷Rb319,23 49s22.55991.549 4C48H82O18M+HCOO1.6945.544 1, 783.488 3, 621.433 3, 161.041 3人参皂苷 Rd 50c22.64793.435 9C42H66O14M-H−1.5793.437 8, 631.383 2OA-Glc-GlurA 5122.901 031.543 3C51H84O21M-H1.6987.550 2, 945.539 6, 927.529 4, 637.428 7丙二酰人参皂苷Rd19,23 52c26.59793.435 9C42H66O14M-H−1.5793.436 5, 731.439 7, 631.390 4, 569.382 7, 455.351 5OA-Glc-GlurA 5326.74261.184 5C17H24O2M+H−1.0261.184 3, 105.034 4人参环氧炔醇24 54s26.96829.496 3C42H72O13M+HCOO1.4783.489 1, 621.434 3, 459.380 0, 161.041 4人参皂苷Rg3 55c27.50631.382 9C36H56O9M-H−1.7631.382 4, 555.364 1, 455.347 5OA-Glur A 5628.00811.479 6C42H70O12M+HCOO−4.8765.477 7, 603.429 7, 161.042 3人参皂苷Rg512,25 5728.25279.232 0C18H30O2M+H−0.4201.052 1, 95.085 3, 81.068 8亚麻酸19
s-用对照品比对 a-与MS DIAL数据库中二级质谱图进行比较鉴定 c-根据裂解规律进行推断
s-refers to compounds identified by comparing with reference standard a-refers to compounds identified by comparing with MS/MS data obtained from MS DIAL c-refers to compouds characterized according to fragmentation rules
3.1.1 皂苷类 皂苷类成分是人参的主要药效成分之一,是由苷元和1个或几个糖组成,人参中人参皂苷大部分为原人参三醇(PPT)和原人参二醇(PPD)型,含有少量的齐墩果酸(OA)型皂苷[12,25]。通常在负离子模式下具有较好的响应,形成丰富的[M-H]−或[M+HCOO]−离子,母离子中的糖苷键断裂产生一系列脱糖碎片和苷元离子。本研究共鉴定和推测出25个皂苷类化合物,包括PPT型9个(30~38),PPD型11个(39、41、42、44~49、51、54),OA型4个(43、50、52、55),其他型1个(56)。以化合物32为例,在负离子模式下,产生加和离子峰/845.489 3 [M+HCOO]−,根据其元素组成推导其分子式为C42H72O14。母离子碎裂产生[M-H]−准分子离子峰/799.486 6,随后相继丢失六碳糖产生/637.434 5 [M-H-Glc]−与PPT苷元离子/475.381 5 [M-H-2Glc]−。根据以上质谱碎片信息以及与对照品比对,32鉴定为PPT型人参皂苷Rg1。化合物54负离子模式下,产生加和离子峰/829.496 3 [M+HCOO]−,根据其元素组成推导其分子式为C42H72O13。母离子碎裂产生[M-H]−准分子离子峰/783.489 1,随后相继丢失六碳糖产生/621.434 3 [M-H-Glc]−与PPD苷元离子/459.380 0 [M-H-Glc-Glc]−。根据以上质谱碎片信息,54鉴定为PPD型人参皂苷Rg3。化合物43在负离子模式下,产生[M-H]−准分子离子峰/955.487 1;母离子碎裂产生/793.431 8[M-H-Glc]−、569.382 1 [M-H-Glc-Glc-CO2-H2O]−与苷元离子455.351 5 [M-H-Glc-Glc-GlurA]−。根据以上质谱碎片信息以及与对照品比对,43鉴定为OA型人参皂苷Ro。化合物56在负离子模式下,产生[M+HCOO]−加和离子峰/811.479 6,母离子碎裂产生/765.477 7 [M-H]−准分子离子峰、随后丢失六碳糖产生/603.429 7 [M-H-Glc]−。根据以上质谱碎片信息结合文献报道[12],56鉴定为人参皂苷Rg5。
3.1.2 氨基酸及其衍生物 在人参配方颗粒标准汤剂中共鉴定出12个氨基酸及其衍生物(1~3、10、11、15~17、19、20、24、27)。在正离子模式下,化合物27产生/205.098 2 [M+H]+的准分子离子峰,对应分子式C11H12N2O2;其主要的二级碎片有/188.071 2 [M+H-NH3]+、159.094 0 [M+H-HCOOH]+、118.065 0 [M+H-C3H5NO2]+,结合数据库匹配及其碎片信息并参考文献[14,15],27鉴定为色氨酸。化合物3在正离子模式下产生499.225 0 [M+H]+的准分子离子峰,对应的分子式为C18H34N4O12。其主要的二级碎片有/337.172 3 [M+H-Glc]+、175.121 2 [M+H-Glc-Glc]+、158.091 4 [M+H-Glc-Glc-NH3]+,其中/175.120 7的碎片表明结构中含有精氨酸,结合数据库匹配及碎片信息并参考文献数据[16],推测3为精氨酸葡萄二糖苷。
3.1.3 碱基及核苷 在人参配方颗粒标准汤剂中共鉴定出5个碱基及核苷类成分(12、18、21、23、25)。化合物21在正离子模式下产生/268.104 8 [M+H]+的准分子离子峰,对应分子式C10H11N5O4;其主要的二级碎片离子/136.063 5分子组成与腺嘌呤碱基一致。因此,结合数据库匹配和二级碎片并参考文献数据[16,22],21鉴定为腺苷。
3.1.4 其他类 在人参配方颗粒标准汤剂中共鉴定出15个其他类成分(4~9、13、14、22、26、28、29、40、53、57)。其中,化合物7在负离子模式下产生/341.106 9 [M-H]−的准分子离子峰,对应分子式C12H22O11。其主要的二级碎片离子/179.053 0 [M-H-Glc]−、119.028 9 [M-H-Glc-C2H4O2]−、59.003 4 [M-H-Glc-C4H8O4]−。基于上述碎片信息,结合数据库匹配并参考文献[19],7鉴定为蔗糖。化合物14在负离子模式下产生/191.018 1 [M-H]−的准分子离子峰,对应分子式C6H8O7。其主要的二级碎片离子/173.008 5 [M-H-H2O]−、/129.016 4 [M-H-H2O-CO2]−、/111.002 0 [M-H-2H2O-CO2]−、/87.000 3 [M-H-2H2O-2CO2]−。基于上述碎片信息,结合数据库匹配并参考文献数据[18,20],14鉴定为柠檬酸。
3.2 人参配方颗粒指纹图谱的建立
3.2.1 色谱条件优化 分别以乙腈-0.01%磷酸水溶液、乙腈-0.02%磷酸水溶液、乙腈-0.1%磷酸水溶液等流动相系统进行梯度洗脱试验,流动相为乙腈- 0.01%磷酸水溶液时,色谱峰分离较佳,因此选定的流动相为乙腈-0.01%磷酸。同时,考察了25、30、35、40 ℃不同柱温对分离的影响,色谱峰分离受柱温影响较大,温度越高,分离度越佳。由于40 ℃条件较为极端,因此选择条件较温和、分离度较佳的35 ℃。并通过梯度优化,确定最佳的洗脱梯度为0~20 min,20%~24%乙腈;20~33 min,24%~28%乙腈;33~60 min,28%~36%乙腈。
3.2.2 精密度试验 取样品S1作为供试品,精密称取1份样品,按供试品溶液制备方法制备成供试品溶液,进样分析。结果表明,各主要色谱峰相对保留时间和其相对峰面积无明显变化,以2号峰人参皂苷Re为参照峰,其RSD均小于2.0%,表明仪器稳定,精密度良好。
3.2.3 重复性试验 取精密度试验中同一批作为供试品,精密称取6份样品,按供试品溶液制备方法制备成供试品溶液,进样分析。结果表明,各主要色谱峰相对保留时间和其相对峰面积无明显变化,以2号峰人参皂苷Re为参照峰,其RSD均小于2.0%,表明方法重复性良好。
3.2.4 稳定性试验 取精密度试验中同一批样品作为供试品,按“2.2”项方法制备成供试品溶液,分别在0、3、6、9、12、15、18、24 h进样分析。以2号峰人参皂苷Re为参照峰,各主要色谱峰相对保留时间和其相对峰面积RSD均小于2.0%,表明供试品溶液在24 h内稳定。
3.2.5 指纹图谱的建立及相似度评价 将18批人参配方颗粒按“2.2”项方法制成供试品溶液,按“2.3”项指纹图谱的色谱条件对其进行检测,记录色谱图,数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,以S1号样品的色谱图为参照图谱进行全谱峰匹配,以平均值法生成对照图谱(图2)并计算相似度。结果表明,经过与对照品比对,指认了8 个共有峰:1号峰为人参皂苷Rg1,2号峰为人参皂苷Re,3号峰为人参皂苷Rf,4号峰为人参皂苷Rb1,5号峰为人参皂苷Ro,6号峰人参皂苷Rc,7号峰为人参皂苷Rb2,8号峰为人参皂苷Rd。18批人参配方颗粒样品的指纹叠加图谱,见图3,各批样品与对照图谱的相似度分别为0.917、0.917、0.927、0.983、0.994、0.994、0.997、0.997、0.993、0.989、0.989、0.993、0.990、0.972、0.989、0.994、0.992、0.984,样品相似度均大于0.900。

1-人参皂苷Rg1 2-人参皂苷Re 3-人参皂苷Rf 4-人参皂苷Rb1 5-人参皂苷Ro 6-人参皂苷Rc 7-人参皂苷Rb2 8-人参皂苷Rd
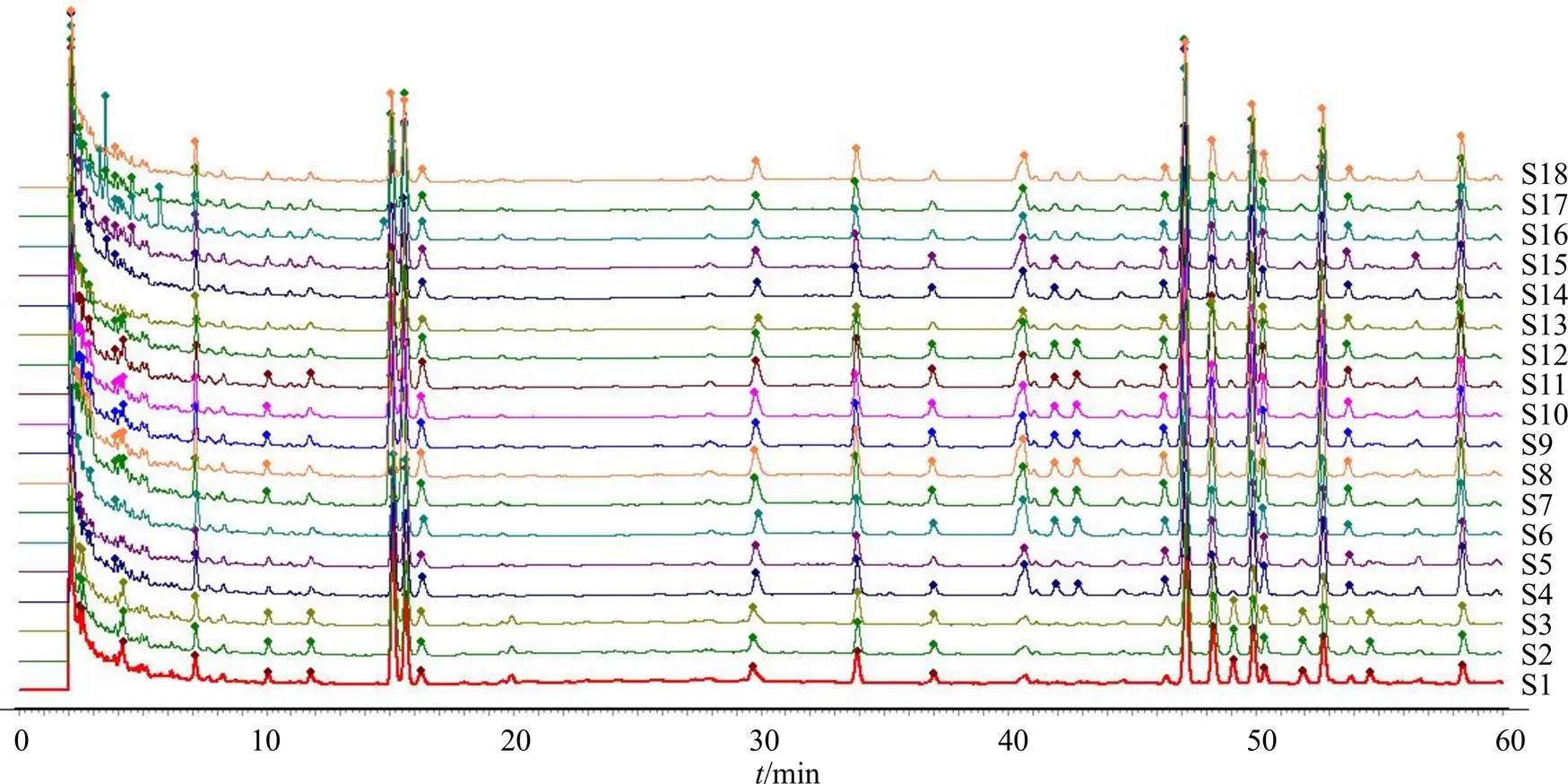
图3 不同厂家18批人参配方颗粒指纹图谱
4 讨论
目前,人参化学研究多集中于药材中皂苷成分,人参配方颗粒的研究多集中于其药效作用,而人参配方颗粒中的化学物质基础尚不明确[26-29]。液质联用技术将液相色谱对复杂样品的高分离能力与质谱的高分辨率、高灵敏度以及能提供化合物的元素组成及离子碎片信息等特点结合起来,可用于化合物的快速鉴定,目前已被广泛应用于中药化学成分鉴定和指纹图谱研究[30-32]。本研究运用UPLC-Q-TOF/MS技术,采用正、负离子2种模式进行质谱扫描,通过数据库检索、对照品比对和MS DIAL软件辅助解析等方法快速分析人参配方颗粒中的化学成分,共鉴定出57个化合物,包括皂苷25个、氨基酸及其衍生物12个、碱基及核苷5个、其他类成分15个,为后续人参配方颗粒的质量控制与药效研究提供了物质基础信息。
中药配方颗粒由于失去了原有饮片所具有的形态学指纹,需要建立完善可行的质量标准,以控制药品的安全性、稳定性、有效性[33]。指纹图谱能够较为全面地反映中药整体的质量信息,因此可被用于对中药配方颗粒的质量控制[34-37]。基于此,本研究建立了人参配方颗粒指纹图谱,在进行指纹图谱条件建立的过程中,本研究对不同流动相体系、柱温、洗脱梯度等色谱参数进行了优化,从而获得峰形较好、色谱峰分离度较佳的指纹图谱条件。并应用于不同厂家的人参配方颗粒质量控制中。不同厂家不同批次的成分基本相同,仅含量上存在一定差异,可能与原药材的来源不同或辅料加入量有关;本研究仍存在配方颗粒样品批次过少,代表性不够等问题。与现有人参配方颗粒标准[38]相比,本方法分析时间较短,色谱峰分离情况更佳,可以应用于提升人参配方颗粒质量控制水平。
利益冲突 所有作者均声明不存在利益冲突
[1] 殷佳, 潘晔, 蔡雪朦, 等. 中药传统汤剂、浸膏剂和配方颗粒剂的比较 [J]. 中草药, 2017, 48(18): 3871-3875.
[2] 何军, 朱旭江, 杨平荣, 等. 中药配方颗粒的现状与发展新思路 [J]. 中草药, 2018, 49(20): 4717-4725.
[3] 中华人民共和国药典委员会. 中药配方颗粒质量控制与标准制定技术要求(征求意见稿) [S]. 2016: 1-2.
[4] 中国药典 [S]. 一部. 2020: 8-9.
[5] Xu W Q, Choi H K, Huang L F. State ofresearch: A global analysis [J]., 2017, 22(9): 1518.
[6] Patel S, Rauf A. Adaptogenic herb ginseng () as medical food: Status quo and future prospects [J]., 2017, 85: 120-127.
[7] Yang W Z, Hu Y, Wu W Y,. Saponins in the genusL. (Araliaceae): A systematic review of their chemical diversity [J]., 2014, 106: 7-24.
[8] Yang W Z, Ye M, Qiao X,. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis: Its application in,andto characterize 437 potential new ginsenosides [J]., 2012, 739: 56-66.
[9] Shi X J, Yang W Z, Qiu S,. Systematic profiling and comparison of the lipidomes from,, andby ultrahigh performance supercritical fluid chromatography/ high-resolution mass spectrometry and ion mobility- derived collision cross section measurement [J]., 2018, 1548: 64-75.
[10] Yang W Z, Shi X J, Yao C L,. A novel neutral loss/product ion scan-incorporated integral approach for the untargeted characterization and comparison of the carboxyl-free ginsenosides from,, and[J]., 2020, 177: 112813.
[11] Shi X J, Yang W Z, Qiu S,. An in-source multiple collision-neutral loss filtering based nontargeted metabolomics approach for the comprehensive analysis of malonyl-ginsenosides from,and[J]., 2017, 952: 59-70.
[12] Zuo T T, Zhang C X, Li W W,. Offline two-dimensional liquid chromatography coupled with ion mobility-quadrupole time-of-flight mass spectrometry enabling four-dimensional separation and characterization of the multicomponents from white ginseng and red ginseng [J]., 2020, 10(6): 597-609.
[13] 陈士林, 刘安, 李琦, 等. 中药饮片标准汤剂研究策略 [J]. 中国中药杂志, 2016, 41(8): 1367-1375.
[14] Jiang M Y, Cao J L, Zhang C B,. A comprehensive strategy for quality evaluation of Wushe Zhiyang Pills by integrating UPLC-DAD fingerprint and multi-ingredients rapid quantitation with UPLC-MS/MS technology [J]., 2022, 210: 114556.
[15] 吴锦忠, 李向高, 杨继祥. 鲜人参与红参氨基酸成分比较研究 [J]. 中药材, 1990, 13(5): 27-28.
[16] 雷冬梅, 姚长良, 陈雪冰, 等. 基于RP-Q-TOF-MS和HILIC-Q-TOF-MS的经典名方当归补血汤成分分析 [J]. 中国中药杂志, 2022, 47(8): 2109-2120.
[17] Horai H, Arita M, Kanaya S,. MassBank: a public repository for sharing mass spectral data for life sciences [J]., 2010, 45(7): 703-714.
[18] Song Q Q, Song Y L, Zhang N,. Potential of hyphenated ultra-high performance liquid chromatography-scheduled multiple reaction monitoring algorithm for large-scale quantitative analysis of traditional Chinese medicines [J]., 2015, 5(71): 57372-57382.
[19] Zhu H L, Lin H Q, Tan J,. UPLC-QTOF/MS-based nontargeted metabolomic analysis of mountain- and garden-cultivated ginseng of different ages in northeast China [J]., 2018, 24(1): 33.
[20] 高健, 吕邵娃. 人参化学成分及药理作用研究进展 [J]. 中医药导报, 2021, 27(1): 127-130.
[21] 熊佩, 李凯琳, 龚开妍, 等. 基于UHPLC-Q-Exactive Orbitrap MS技术的血藤果化学成分分析 [J]. 中国药业, 2021, 30(18): 55-60.
[22] Pan X L, Li Z L, Qian S H,. Chemical constituents of the flower buds of[J]., 2015, 51(3): 559-560.
[23] Christensen L P. Chapter 1 ginsenosides: Chemistry, biosynthesis, analysis, and potential health effects [J]. Adv, 2008, 55: 1-99.
[24] 杨秀伟, 王洪平, 张友波, 等. 人参根和根茎中新的聚乙炔类化学成分 [J]. 中草药, 2021, 52(1): 14-22.
[25] Qiu S, Yang W Z, Yao C L,. Nontargeted metabolomic analysis and “commercial-homophyletic” comparison-induced biomarkers verification for the systematic chemical differentiation of five different parts of[J]., 2016, 1453: 78-87.
[26] 左刚, 张彤, 李非洲, 等. 加味人参养荣配方颗粒与传统饮片治疗气虚证临床对比研究 [J]. 时珍国医国药, 2021, 32(1): 106-109.
[27] 吴昊, 刘同彦, 刘佳, 等. 人参饮片与配方颗粒药效的比较研究 [J]. 人参研究, 2017, 29(1): 8-10.
[28] 张鹏, 邬兰, 李西文, 等. 人参饮片标准汤剂的评价及应用探讨 [J]. 中国实验方剂学杂志, 2017, 23(7): 2-11.
[29] 刚晓超. 中药配方颗粒人参对非小细胞肺癌术后(肺脾两虚)患者T淋巴细胞亚群的影响研究 [D]. 长春: 长春中医药大学, 2015.
[30] 陈明曦, 李艳梅, 孙婷, 等. 液相色谱-质谱联用技术在中药质量研究中的应用 [J]. 中国药剂学杂志, 2021, 19(1): 12-17.
[31] Yu Y, Yao C L, Guo D A. Insight into chemical basis of traditional Chinese medicine based on the state-of-the-art techniques of liquid chromatography-mass spectrometry [J]., 2021, 11(6): 1469-1492.
[32] 严华, 张慧秀, 白宗利, 等. 基于特征图谱的人参属药材西洋参、人参、三七的比较[J]. 世界中医药, 2021, 16(6): 887-895.
[33] 张慧, 陈燕, 汪佳楠, 等. 指纹图谱技术在中药配方颗粒质量评价及过程控制中的应用 [J]. 中国中药杂志, 2018, 43(19): 3822-3827.
[34] 毛明强, 翟艳敏, 封亮, 等. 基于汤剂煎煮特征的中药配方颗粒制备技术发展与应用[J]. 世界中医药, 2020, 15(15): 2228-2233.
[35] 李帅锋, 郑传柱, 张丽, 等. 不同产地何首乌HPLC指纹图谱研究 [J]. 中草药, 2015, 46(14): 2149-2154.
[36] 毕晓黎, 胥爱丽, 李养学. 三七配方颗粒的HPLC指纹图谱研究 [J]. 中国实验方剂学杂志, 2011, 17(9): 54-57.
[37] Yang W Z, Zhang Y B, Wu W Y,. Approaches to establish Q-markers for the quality standards of traditional Chinese medicines [J]., 2017, 7(4): 439-446.
[38] 人参配方颗粒 [S]. 2021: 1-2.
Study on chemical components and chromatographic fingerprints of Ginseng Dispensing Granules based on UPLC-Q-TOF-MS
WANG Jing1, 2, YAO Chang-liang2, ZHANG Jian-qing2, LI Jia-yuan2, YAO Shuai2, GUO De-an1, 2
1. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. National Engineering Research Center of TCM Standardization Technology, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
Ultra performance liquid chromatography tandem quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF-MS) was adopted to rapidly characterize the chemical constituents from standard decoction of Ginseng Dispensing Granules, elucidate the chemical basis of Ginseng Dispensing Granules, and establish an HPLC fingerprint for their quality control.An ACQUITY UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm) column was used for the gradient elution with acetonitrile (A)-0.1% formic acid (B) as the mobile phases, and the data was collected in positive and negative modes. The chemical constituents of Ginseng Dispensing Granules were analyzed and identified by MS DIAL software, comparing with reference standards and searching database. The HPLC fingerprint was established on an ACQUITY UPLC HSS T3 column (2.1 mm×150 mm, 1.8 μm) with acetonitrile −0.01% phosphoric acid as the mobile phases.A total of 57 compounds, including 25 saponins, 12 amino acids and their derivatives, five bases and nucleosides, together with 15 other compounds, were identified in the standard decoction of Ginseng Dispensing Granules. The HPLC fingerprint of Ginseng Dispensing Granules was established with eight common peaks, respectively ginsenoside Rg1, ginsenoside Re, ginsenoside Rf, ginsenoside Rc, ginsenoside Ro, ginsenoside Rb1, ginsenoside Rb2, and ginsenosede Rd. And the precision, stability and reproducibility of the HPLC fingerprint were acceptable. The components in different batches of Ginseng Dispensing Granules from different manufacturers were basically similar, and only slight differences existed in contents.The results of this study clarified the chemical substance basis of Ginseng Dispensing Granules, and the established HPLC fingerprint provided a method reference for the quality control of Ginseng Dispensing Granules.
Ginseng Dispensing Granules; fingerprint; UPLC-Q-TOF-MS; HPLC; ginsenoside; ginsenoside Rg1; ginsenoside Re; ginsenoside Rf; ginsenoside Rc
R284.1
A
0253 - 2670(2022)11 - 3286 - 09
10.7501/j.issn.0253-2670.2022.11.003
2022-02-15
国家自然科学基金重点项目(82130111);国家自然科学基金青年科学基金资助项目(82003938)
王 静,女,硕士研究生。E-mail: jingwang0105@163.com
果德安,男,研究员,博士生导师,主要从事中药化学与现代质量标准研究。Tel: (021)50271516 E-mail: daguo@simm.ac.cn
[责任编辑 王文倩]
