氯气与铁反应的绿色化实验探究
2022-05-30王玉婷王素琴黎泓波王彤彤
王玉婷 王素琴 黎泓波 王彤彤

摘要:针对氯气毒性大、易泄漏,以及与金属反应不易控制、产物检验难等问题,为实现对氯气与铁反应过程与结果进行科学性、系统性地分析,将氯气制备、性质检验与产物验证以及尾气处理集中于一个密闭系统中,符合绿色环保理念。实验装置简单、操作便捷及反应现象明显,不仅可以开展课堂演示实验,也可以用于实验室的创新实验研究;这有利于学生通过实验直观地了解氯气的性质,提高学生的科学探究與创新能力,培养学生的科学精神与社会责任。关键词:氯气;铁;绿色化;集成化;实验探究
文章编号:1008-0546(2022)08-0094-04 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.08.020
一、问题的提出
氯气与金属的反应是学习氯气性质的重要内容,具有很高的教学价值与意义。然而在实际教学中,往往由于氯气的剧毒性、实验的成功率低等,许多教师对该实验望而却步。许多调研报告与教学经验表明,学生的眼、手和脑三位一体协调性地参与化学实验的次数越多,化学知识掌握越牢固,也越能够有效促进学生良好的科学态度和科学精神的形成[1]。因此,教师可以充分发挥主观能动性,将气体的制备、性质检验以及尾气处理设计衔接成相互关联、相互支撑的系统。
该部分内容在人教版[2]、苏教版[3]、鲁科版[4]三版教材中都有性质以及化学方程式的呈现,其中苏教版和鲁科版还有对应的实验操作步骤和结果的描述,不同的是鲁科版还补充了相关实验现象的插图,有利于学生获得直观的体验。从实验操作步骤上来看,虽然教材上所呈现的实验方案设计简单、操作便捷,但存在以下问题:(1)氯气需要提前制备,存在逸散污染以及由于逸散使得氯气浓度降低导致实验现象不明显的可能;(2)没有对产物进行验证;(3)没有进行尾气处理。
针对教材实验中的不足,不少教师和学者对铁与氯气反应的实验进行了改进。比如实验过程中铁丝彻底红热所需时间较长,而停止加热又容易冷却的问题,有不少学者对如何增大铁的受热面积进行改进[5,6]。对于逸散污染以及尾气处理问题,许多学者将实验装置设计为密闭环境并增加尾气处理部分[7,8]。这些实验方案从不同角度进行探究,使得实验在成功率、环保性和安全性等方面得到了提高,但是仍然存在一些问题:(1)有的实验方案仪器较多,搭建不便,操作复杂,技巧性较高;(2)有的实验理论上密闭性良好,实际操作却存在困难;(3)有的实验忽视了装置内残余氯气的处理。
基于此,笔者以氯气与铁反应的过程与结果为导向进行实验探究改进。将氯气的制备、与金属反应、产物验证以及尾气处理集成化于一套密闭反应装置,实验装置简单、步骤便捷和环境安全性高,能够作为课堂实验进行演示,有助于提高学生实验思维的完整性、系统性和高阶性,进而发展学生的科学探究能力与社会责任意识。
二、铁与氯气反应的实验探究
1.实验仪器的改进
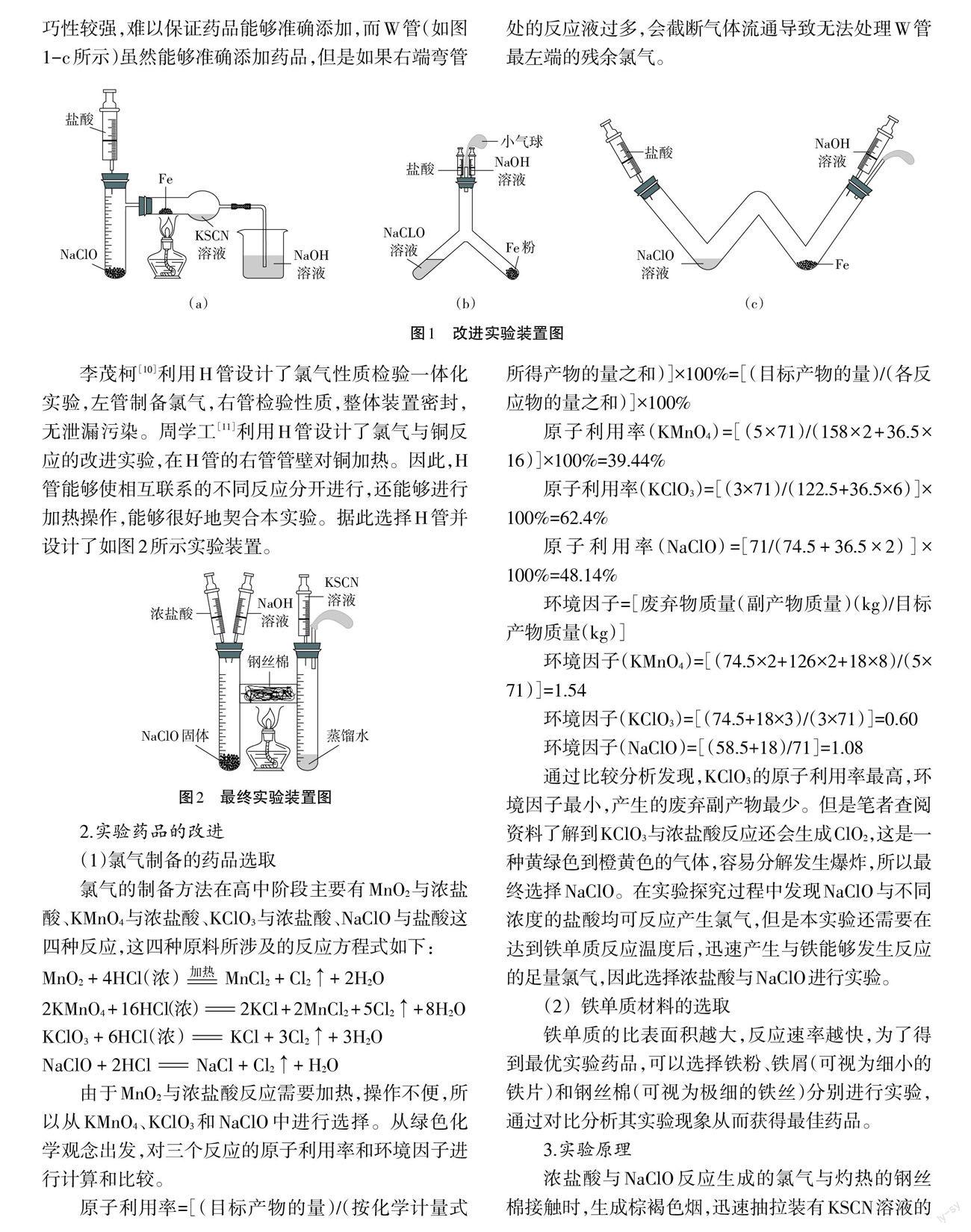
根据实验需要将气体发生器、反应器、尾气处理三部分集成化,初步设计成如图1-a所示装置。实验过程中发现 KSCN 溶液会与 Cl2发生反应生成硫氰((SCN)2),无法验证产物FeCl3,而且装置内残余的氯气也无法处理。于是通过查阅文献找到了Y管[9]和W 管,虽然整个仪器内口径相同,可以较好地处理装置内的氯气,但是Y管实验装置(如图1-b所示)操作技巧性较强,难以保证药品能够准确添加,而W管(如图1-c所示)虽然能够准确添加药品,但是如果右端弯管处的反应液过多,会截断气体流通导致无法处理W管最左端的残余氯气。
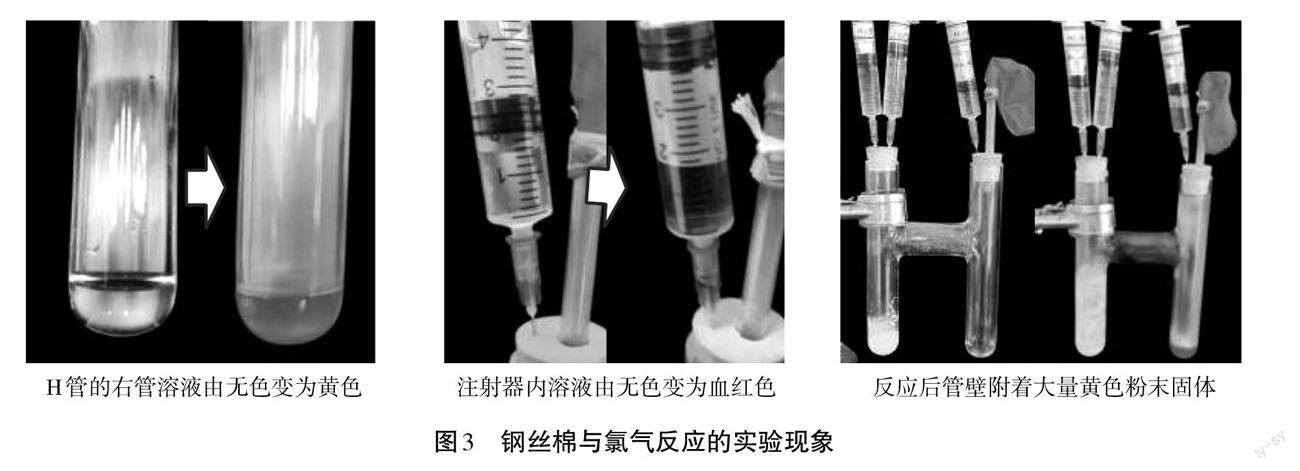
李茂柯[10]利用 H 管设计了氯气性质检验一体化实验,左管制备氯气,右管检验性质,整体装置密封,无泄漏污染。周学工[11]利用 H 管设计了氯气与铜反应的改进实验,在H管的右管管壁对铜加热。因此,H 管能够使相互联系的不同反应分开进行,还能够进行加热操作,能够很好地契合本实验。据此选择H管并设计了如图2所示实验装置。
2.实验药品的改进
(1)氯气制备的药品选取
氯气的制备方法在高中阶段主要有MnO2与浓盐酸、KMnO4与浓盐酸、KClO3与浓盐酸、NaClO与盐酸这四种反应,这四种原料所涉及的反应方程式如下: MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓)= KCl +3Cl2↑+3H2O
NaClO +2HCl = NaCl + Cl2↑+ H2O
由于MnO2与浓盐酸反应需要加热,操作不便,所以从 KMnO4、KClO3和NaClO中进行选择。从绿色化学观念出发,对三个反应的原子利用率和环境因子进行计算和比较。
原子利用率=[(目标产物的量)/(按化学计量式所得产物的量之和)]×100%=[(目标产物的量)/(各反应物的量之和)]×100%
原子利用率(KMnO4)=[(5×71)/(158×2+36.5×16)]×100%=39.44%
原子利用率(KClO3)=[(3×71)/(122.5+36.5×6)]×100%=62.4%
原子利用率(NaClO)=[71/(74.5+36.5×2)]×100%=48.14%
环境因子=[废弃物质量(副产物质量)(kg)/目标产物质量(kg)]
环境因子(KMnO4)=[(74.5×2+126×2+18×8)/(5×71)]=1.54
环境因子(KClO3)=[(74.5+18×3)/(3×71)]=0.60
环境因子(NaClO)=[(58.5+18)/71]=1.08
通过比较分析发现,KClO3的原子利用率最高,环境因子最小,产生的废弃副产物最少。但是笔者查阅资料了解到KClO3与浓盐酸反应还会生成ClO2,这是一种黄绿色到橙黄色的气体,容易分解发生爆炸,所以最终选择NaClO。在实验探究过程中发现NaClO与不同浓度的盐酸均可反应产生氯气,但是本实验还需要在达到铁单质反应温度后,迅速产生与铁能够发生反应的足量氯气,因此选择浓盐酸与NaClO进行实验。
(2)铁单质材料的选取
铁单质的比表面积越大,反应速率越快,为了得到最优实验药品,可以选择铁粉、铁屑(可视为细小的铁片)和钢丝棉(可视为极细的铁丝)分别进行实验,通过对比分析其实验现象从而获得最佳药品。
3.实验原理
浓盐酸与NaClO反应生成的氯气与灼热的钢丝棉接触时,生成棕褐色烟,迅速抽拉装有KSCN溶液的注射器,可以观察到注射器内溶液由无色变血红色。然后在H管的右管注入NaOH溶液中和盐酸使反应终止,并处理反应体系中残余的氯气。其中涉及到几个反应,具体化学方程式为:
NaClO +2HCl = NaCl+Cl2↑+ H2O
2Fe +3Cl2 2FeCl3
FeCl3+3KSCN =3KCl + Fe(SCN)3
NaOH + HCl = NaCl + H2O
2NaOH + Cl2= NaCl+NaClO+H2O
4.实验仪器与试剂
H管(15 cm*9 cm*Φ2 cm)、3号橡胶塞、5 mL注射器3支、酒精灯、小气球、短玻璃导管、铁架台、镊子、胶头滴管、浓盐酸、铁粉、铁屑、钢丝棉、次氯酸钠固体、6 mol/L氢氧化钠溶液、蒸馏水、0.1 mol/L硫氰化钾溶液。
5.实验步骤
(1)根据图2连接实验仪器、组装实验装置,检查装置气密性。检查装置气密性的方法为:用手握捏小气球,若感到阻力,气球存在回弹,则证明气密性良好。
(2)向实验仪器中添加药品。在三支注射器中分别加入浓盐酸、6 mol/L NaOH 溶液以及0.1 mol/L KSCN 溶液备用。在 H 管的左管加入约1 g NaClO固体,然后滴加少量蒸馏水,使用玻璃棒搅拌,使其呈糊状。用胶头滴管在H管的右管滴加3 mL蒸馏水,用镊子将钢丝棉送入 H 管的中部。将带注射器的橡胶塞塞在H管管口。
(3)点燃酒精灯加热钢丝棉3 min左右,使钢丝棉呈黑红状态后再熄灭酒精灯,然后迅速向H管的右管注入浓盐酸。
(4)观察到 H 管中弥漫着棕褐色烟时,向上抽拉装有KSCN溶液的注射器的活塞杆。
(5)反应结束后向 H 管的左管注入 NaOH 溶液, NaOH溶液注射完毕后,可充当气泵,加快装置内气体流通速度,尽可能多地将装置内多余的氯气吸收。
6.实验现象与分析
(1)不同形态的铁单质与氯气反应
不同形态的铁单质与氯气反应的实验现象如表1所示。从实验准备来看,铁粉和铁屑颗粒小,容易掉落在 H 管两侧的管中,会对实验造成干扰,而钢丝棉可以调节蓬松程度使其牢牢地固定在H管的中间,可操作性高。从加热时间上来看,钢丝棉<铁粉<铁屑。从实验现象上来看,虽然铁粉的比表面积大,但因铁粉间比较致密,与氯气的接触面积小,所以反应现象持续时间短、现象最不明显,铁屑次之,而钢丝棉因为蓬松,所以与氯气能够充分接触,现象最为明显。综上所述,选择钢丝棉作为与氯气进行反应的铁单质最合适。
(2)钢丝棉与氯气反应
钢丝棉加热至红热后注入浓盐酸,可以观察到明显的棕褐色烟,大约半分鐘后可以看到H管的右管中原本澄清透明的溶液变成黄色,说明反应产物——棕褐色烟溶于水中。趁 H 管的右管中弥漫着棕褐色烟时,向上抽拉装有KSCN溶液的注射器杆,可以看到注射器内原本无色透明的 KSCN溶液变为血红色,说明棕褐色烟中含有Fe3+,即氯气与铁在加热的情况下生成了FeCl3。反应结束后可以看到 H管壁附着大量黄色粉末固体,从颜色上也可以简单判断产物是FeCl3。
7.实验注意事项与说明
(1)必须等到钢丝棉红热后再制取氯气,进行反应,否则很难出现明显的棕褐色烟现象,不利于学生观察现象、进行学习。
(2)选择高浓度的NaOH溶液进行实验,保证既能够中和剩余盐酸,还能吸收装置中残余的氯气。
(3)盐酸浓度不宜过低,否则无法迅速提供足量浓度的氯气使反应顺利进行,也不宜滴入过多盐酸,否则NaOH溶液在中和剩余盐酸后无法将装置内残余的氯气全部吸收。
(4)在冬天或者气温较低的地区,可以不移开酒精灯直接向H管的左管注入浓盐酸,使铁在持续加热的条件下与氯气发生反应,以避免铁冷却过快导致实验失败。
三、改进优点
1.绿色无污染。选择原子利用率高、环境因子小的药品在全封闭装置中进行实验,能够防止氯气泄漏,减少氯化铁造成的空气粉尘污染。注射器将反应液注射完毕后,可充当气泵,促进装置内气体流通,帮助氯气尽可能被吸收,达到较好的尾气处理效果,实现课堂实验绿色环保,关注师生身体健康,符合化学无污染绿色原则。
2.操作简便,演示性强,现象明显。本实验改进后,整套实验装置简单,操作便捷,实验从开始加热到反应结束只需要大约5 min,现象明显,便于教师进行演示实验,也可用于教师指导下的学生创新实验研究。
3.成功率高。利用 H管将氯气的制备、氯气与铁的反应以及尾气处理融于一套实验装置中进行,通过透明的H管可以观察到钢丝棉的加热情况,便于准确把控氯气制备的时机;选择浓盐酸与NaClO反应,产生氯气的速率够快,能够迅速提供反应所需浓度的氯气; H管中非完全干燥环境,而氯气与铁反应在湿润条件比在干燥条件下更容易进行[12],提高了实验的成功率。
四、结语
化学是一门以实验为基础的学科,在实际教学中应该充分发挥实验的教学功能。尤其是有关有毒物质相关性质的学习,一方面要注意操作安全,另一方面,良好的教学示范能够帮助学生树立辩证的化学观念,改变“闻化色变”的状况。本实验以氯气与铁的反应为例,基于“绿色化学”理念精心选择NaClO与浓盐酸反应制备氯气,无需加热,能快速制取氯气。同时通过实验探究选择钢丝棉进行性质检验实验,现象明显,具有很强的教学示范性,利于教与学质量的提升。循环利用注射器使残余氯气能够被完全吸收,实现有毒气体零排放,符合绿色化学的环保理念。
参考文献
[1]吴晗清,张岩.基于学习进阶的气体制备及性质的教学研究[J].化学教育(中英文),2021,42(3):31-37.
[2]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.化学必修第一册[M].北京:人民教育出版社,2019:42.
[3]王祖浩主编.化学必修第一册[M].南京:江苏凤凰教育出版社,2020:60.
[4]王磊.化学必修第一册[M].济南:山东科学技术出版社,2019:15-16.
[5]李燕.铁与氯气反应实验改进[J].中小学实验与装备,2020,30(6):33.
[6]阙荣辉,吴进,吴凤兮,熊言林.氯气的制取与性质实验绿色化设计[J].化学教育,2017,38(3):68-69.
[7]郎庆利,王培明,齐俊林. 铁与氯气反应实验的环保型设计[J]. 化学教学,2014,36(2):41-42.
[8]宋志贵,陈春丽. 氯气和金属铁、铜反应的实验改进[J].化学教学,2011,33(6):47.
[9]李猛,王世存. 氯气制备及性质实验的一体化设计[J]. 化学教学,2016,38(8):60-63.
[10]李茂柯,盛林娟,伍晓春. 巧用H型試管改进中学化学实验两则[J]. 化学教学,2019,41(12):58-60.
[11]周学工,戚金丽. 巧用石棉和注射器改进铜与氯气反应的实验[J]. 化学教与学,2019(12):95-97.
[12]黄燕燕,宋巧颖,沈甸. 铁与氯气反应途径及产物的探究[J]. 化学教学,2017,39(8):59-62.
