柱前衍生化HPLC法测定藏药熏倒牛种子中15种氨基酸含量
2022-05-30李运张国强高鹏李红玉景明魏锋
李运 张国强 高鹏 李红玉 景明 魏锋

【摘要】目的:建立柱前衍生化HPLC法測定藏药熏倒牛种子中15种氨基酸的含量。方法:供试品在一定量6 moL·L-1盐酸中110 ℃水解6 h,与异硫氰酸苯酯进行衍生化反应。采用CAPCELL PAK-C18(250 mm×4.6 mm,5 μm)色谱柱,以80%乙腈溶液(A)-0.056 moL·L-1乙酸钠缓冲液(B)为流动相,梯度洗脱(0~15 min,5%A;15~20 min,5%A→20%A;20~35 min,20%A→36%A;35~45 min,36%A→70%A;45~50 min,70%→90%A;50~55 min,90%A;55~56 min,90%A→5%A;56~60 min,5%A),流速为1.0 mL·min-1,检测波长254 nm,色谱柱温度40 ℃。结果:15种氨基酸衍生物能够达到基线分离,在0.96~58.56 μg·mL-1范围内线性关系良好,r≥0.9991,精密度、重复性、稳定性试验的RSD值分别小于2.73%、2.85%、2.89%,加样回收率介于95.2%~104.4%之间,RSD值均小于2.46%。经测定,3 批熏倒牛种子中氨基酸总含量分别为1.64%、1.55%和1.08%。结论:此法简便易行,可用于藏药熏倒牛种子中15种氨基酸的含量测定。
【关键词】藏药;熏倒牛;种子;氨基酸含量;高效液相色谱法
【中图分类号】R284【文献标志码】 A【文章编号】1007-8517(2022)04-0048-05
Determination of 15 amino acids in Biebersteinia heterostemon Maxim seeds by precolumn derivation HPLC
LI Yun1,2ZHANG Guoqiang3GAO Peng1LI Hongyu2JING Ming3WEI Feng4
1.Lanzhou Institute for Food and Drug Control /Gansu Engineering Research Center for Monitoring
Exogenous Harmful Residues in Traditional Chinese Medicines, Lanzhou 730030, China;
2.Pharmacy College of Lanzhou University,Lanzhou 730000, China;
3.Pharmacy Collage of Gansu University of Chinese Medicine,Lanzhou 730000, China;
4.National Institutes for Food and Drug Control,Beijing 100050,China
Abstract:Objective To establish a precolumn derivation HPLC method for the determination of 15 amino acids in Biebersteinia heterostemon Maxim seeds. Methods The sample was hydrolyzed in 6 moL·L-1 hydrochloric acid at 110 ℃ for 6 hours,and derivatized with phenyl isothiocyanate (PITC).The analysis was carried out on a CAPCELL PAK-C18 chromatographic column(250 mm×4.6 mm,5 μm)with 80% acetonitrile(A)- 0.056 mol·L-1 sodium acetate buffer (B) as mobile phase by gradient elution(0~15 min,5%A;15~20 min,5%A→20%A;20~35 min,20%A→36%A;35~45min,36%A→70%A;45~50 min,70%→90%A;50~55 min,90%A;55~56 min,90%A→5%A;56~60 min,5%A),at a flow rate of 1.0 mL·min-1, the detection wavelength was 254 nm, the column temperature was set at 40 ℃. Results The 15 amino acids were able to achieve baseline separation in a good linear range of 0.96~58.56 μg·mL-1(r≥0.9991).The RSD values of precision, repeatability and stability tests were respectively less than 2.73%、2.85%、2.89%, and the recoveries of the 15 amino acids (n=6,RSD<2.46%) were between 95.2% and 104.4%. The total contents of the amino acids in three batches of Biebersteinia heterostemon Maxim seeds were 1.64%、1.55%和1.08%.Conclusion This method is simple and easy to operate. It can be used for the determination of 15 amino acids in Tibetan medicine Biebersteinia heterostemon Maxim seeds.
Keywords:Tibetan Medicine; Biebersteinia heterostemon Maxim;Seeds; Amino Acid Contents; HPLC
藏药熏倒牛(Biebersteinia heterostemon Maxim.)为牻牛儿苗科熏倒牛属植物,是藏药“明见赛保”的原植物来源之一 [1]。具有清热解毒、散肿止痛、清血热、祛风毒的功效,用于治疗各种炎症、结核症、丹毒、疟疾、咽喉肿痛、胃痛、全身水肿、中风等疾病[2]。目前,国内外学者主要侧重于熏倒牛中主要化学成分的分离鉴定及初步的药理活性研究,发现其主要含有黄酮、生物碱、苯丙素、香豆素、甾醇、糖类、挥发油和萜类等化合物[3-6],并具有抗氧化[7]、降血糖[8]等活性,民间用于治疗小儿惊厥、抽搐、感冒发热等。在藏区的走访调研中发现,熏倒牛种子可用于治疗各种炎症类、胆囊类疾病及喉蛾、疔疮等。民族药用于疾病的治疗,药效的发挥往往基于多成分多靶点的共同作用,对于熏倒牛种子的研究,仅见于对其籽油中脂肪酸成分的分析[9],从其中鉴定出11种脂肪酸类化合物,主要为棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸等成分,不饱和脂肪酸为74.23%,其中亚油酸含量为73.04%。
氨基酸类成分是重要的生命物质,是组成蛋白质和酶的基本单元,能够增强机体免疫力、调节新陈代谢等[10]。对于熏倒牛种子中氨基酸的相关研究,未见报道。本文采用柱前衍生化法,利用氨基酸在偏碱性环境下,与异硫氰酸苯酯反应生成硫脲,经分子内环化,生成乙内酰苯硫脲类化合物,可用高效液相色谱仪进行定量分析。通过掌握熏倒牛种子中的氨基酸含量,以期为进一步研究藏药熏倒牛药材中的化学成分,深入挖掘其用药潜力和价值提供参考。
1仪器与材料
1.1仪器Waters e2695高效液相色谱仪(包括四元泵、Waters 2998 PDA 检测器、自动进样器及 Empower工作站,美国Waters公司);MS205DU型十万分之一分析天平(瑞士Mettle Toledo公司);Milli-Q IQ 7000超纯水系统(德国默克密理博公司);SBL-10DT超声波恒温清洗机(宁波新芝生物科技股份有限公司);微量移液器(德国eppendorf股份公司)。
1.2材料谷氨酸(批号:140690-201604,含量99.9%)、甘氨酸(批号:140689-201605,含量100%)、精氨酸(批号:140685-201707,含量99.9%)、苏氨酸(批号:140682-201302,含量99.9%)、丙氨酸(批号:140680-201604,含量100%)、酪氨酸(批号:140609-201513,含量99.8%)、缬氨酸(批号:140681-201703,含量99.5%)、异亮氨酸(批号:140683-201302,含量99.9%)、亮氨酸(批号:140687-201804,含量99.9%)、苯丙氨酸(批号:140676-201706,含量100%)、盐酸赖氨酸(批号:140673-201509,含量99.9%),均由中国食品药品检定研究院提供;L-丝氨酸(批号:B21932,含量98.0%)、L-脯氨酸(批号:B21914,含量99.0%)、L-蛋氨酸(批号:B21913,含量98.0%)、L-色氨酸(批号:B21930,含量98.0%),均由上海源叶生物科技有限公司提供;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
实验所用熏倒牛种子,分别采自于甘肃省合作市(样品编号S1、S2)、甘肃省定西市安定区(样品编号S3),并經甘肃中医药大学药学院景明教授鉴定为牻牛儿苗科熏倒牛属植物Biebersteinia heterostemon Maxim.的干燥成熟种子。
2方法与结果
2.1色谱条件采用色谱柱:CAPCELL PAK-C18柱(250 mm×4.6 mm,5 μm);流动相为80%乙腈溶液(A)-0.056 mol·L-1乙酸钠缓冲液(B);流速为1 mL·min-1;检测波长254 nm;色谱柱温度40 ℃;进样体积:10 μL。梯度洗脱程序:0~15 min,5%A;15~20 min,5%A→20%A;20~35 min,20%A→36%A;35~45 min,36%A→70%A;45~50 min,70%→90%A;50~55 min,90%A;55~56 min,90%A→5%A;56~60 min,5%A。
2.2溶液的制备
2.2.1乙酸钠缓冲溶液取三水合乙酸钠7.587 g,加水850 mL,冰醋酸调节PH=6.5(约2滴),加水75 mL,乙腈70 mL,配制成浓度为0.056 moL·L-1的乙酸钠缓冲液。
2.2.20.1moL·L-1的异硫氰酸苯酯(PITC)精密移取 PITC 0.30 mL,加入乙腈定容至25 mL,摇匀即得。
2.2.31.0moL·L-1三乙胺溶液移取三乙胺3.475 mL,加入乙腈定容至 25 mL,摇匀即得。
2.2.4对照品溶液衍生化溶液的配制分别精密称取15种氨基酸对照品适量,用0.1 moL·L-1盐酸定容于10 mL容量瓶,配制成一定浓度的对照品溶液,分别取各浓度氨基酸对照品溶液适量,配制成每1毫升含有谷氨酸、甘氨酸、精氨酸、苏氨酸、丙氨酸、酪氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸、盐酸赖氨酸、L-丝氨酸、L-脯氨酸、L-蛋氨酸、L-色氨酸分别为58.56 μg、11.38 μg、20.56 μg、18.88 μg、10.36 μg、21.04 μg、21.92 μg、10.02 μg、9.62 μg、10.72 μg、10.1 μg、19.48 μg、10.04 μg、10.04 μg、19.68 μg的混合标准溶液,取上述溶液1 mL,加入0.1 moL·L-1的PITC及1moL·L-1三乙胺乙腈溶液各0.5 mL。
2.2.5供试品衍生化溶液的制备取藏药熏倒牛种子粗粉约0.2 g,置于10 mL玻璃顶空瓶中,加6 moL·L-1盐酸溶液5 mL,充氮气后压盖密封,于110 ℃烘箱中水解6 h,取出后放冷,挥干溶剂,残渣加0.1 moL·L-1盐酸溶液定容至10 mL容量瓶中;取其1 mL分别加入0.1 moL·L-1的PITC乙腈溶液、1 mol·L-1三乙胺乙腈溶液各0.5 mL,充分混匀,放置1 h,加入2 mL正己烷,混匀,静置10 min,取2 mL定容于5 mL容量瓶中,即得。
2.2.6空白衍生化溶液的制备用0.1 moL·L-1盐酸溶液代替样品,同“2.2.5”项下方法制备,即得。
2.3方法学考察
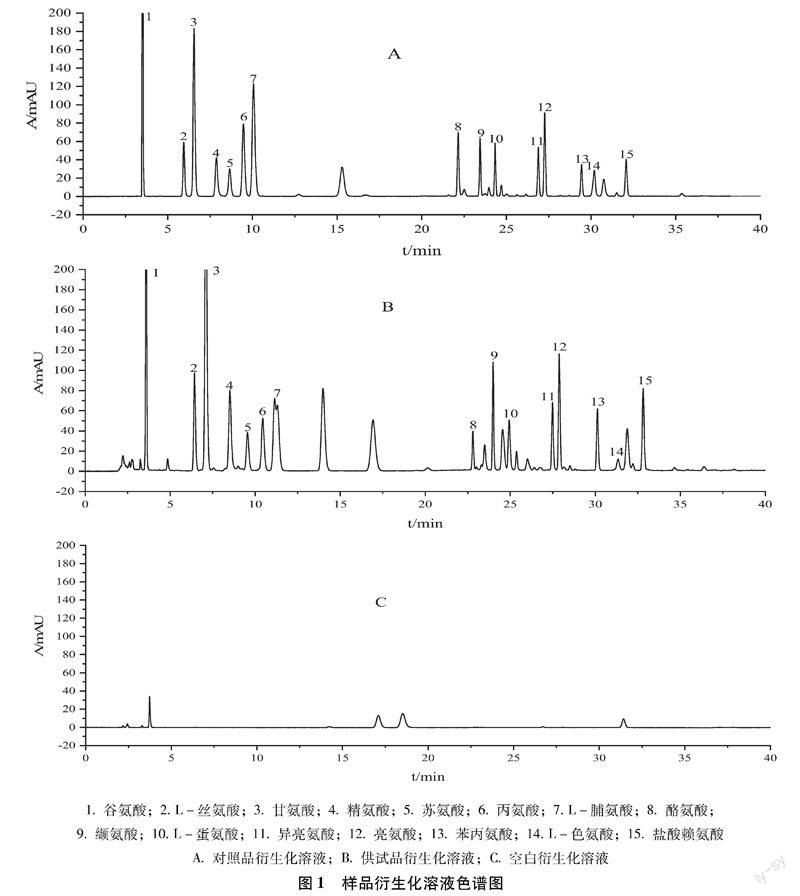
2.3.1系统适用性实验精密吸取“2.2.4”项下制备的对照品溶液和“2.2.5”项下制备的供试品溶液各10 μL,按“2.1”项下色谱条件进样测定,记录色谱图。结果表明,供试品中各氨基酸色谱峰保留时间与对照品溶液各色谱峰保留时间一致,目标峰与相邻色谱峰的分离度均>1.5,理论塔板数以谷氨酸峰计大于9000,色谱图如图1所示。
2.3.2线性关系考察分别精密吸取“2.2.4”项下制备的对照品溶液适量,按照供试品溶液中各氨基酸的实际含量,配制系列浓度的对照品溶液。按“2.1”项下色谱条件进样10 μL,测定色谱峰面积。以对照品溶液中各标准品的质量浓度(X,μg·mL-1)为横坐标,对照品溶液中各标准品的峰面积(Y)为纵坐标,绘制标准曲线。结果表明,谷氨酸等15种氨基酸在各自的线性范围内与色谱峰面积的积分值呈良好线性关系,回归方程、相关系数及线性范围见表1。
2.3.3精密度试验取“2.2.5”项下供试品溶液,按“2.1”项下色谱条件连续进样6次,记录色谱图,计算峰面积。结果显示,各氨基酸质量浓度的RSD值均小于2.73%,表明仪器精密度良好。
2.3.4重复性试验取“2.2.5”项下供试品溶液,按“2.1”项下色谱条件连续进样6次,记录色谱图,计算峰面积。结果显示,各氨基酸的平均含量和RSD值分别为1.947 mg·g-1、0.592 mg·g-1、1.783 mg·g-1、0.975 mg·g-1、0.556 mg·g-1、0.349 mg·g-1、1.264 mg·g-1、0.379 mg·g-1、0.440 mg·g-1、0.814 mg·g-1、0.331 mg·g-1、0.713 mg·g-1、0.407 mg·g-1、0.445 mg·g-1、0.864 mg·g-1和2.85%、1.67%、2.13%、1.97%、2.60%、1.67%、2.55%、0.91%、1.32%、0.62%、2.40%、2.12%、1.60%、0.79%、2.57 %。
2.3.5稳定性试验取“2.2.5”项下供试品溶液,按“2.1”项下色谱条件,分别在0 h、1 h、2 h、4 h、6 h、8 h测定,记录各组分色谱峰,计算峰面积。测得各氨基酸成分的色谱峰面积的RSD值分别为1.43%、2.89%、2.65%、2.19%、1.97%、1.87%、1.11%、0.92%、2.58%、0.98%、2.44%、0.63%、1.92%、2.04%、2.60%,表明样品在8 h内的稳定性良好。
2.3.6加样回收率试验精密称取编号S1的藏药熏倒牛样品0.1 g,共6份,加入各标准品溶液适量,按照“2.2.5”项下制备供试品溶液,按“2.1”项下色谱条件进样,记录色谱图,计算回收率,结果见表1,加樣回收率试验中15种氨基酸的平均回收率及RSD值分别为95.16%、101.99%、104.02%、102.03%、96.99%、100.70%、95.35%、101.82%、95.59%、99.56%、104.37%、101.64%、99.86%、99.57%、102.62%和2.01%、1.96%、2.67%、2.46%、1.46%、2.29%、2.22%、2.33%、1.22%、1.78%、0.98%、2.24%、1.61%、1.17%、1.21%。
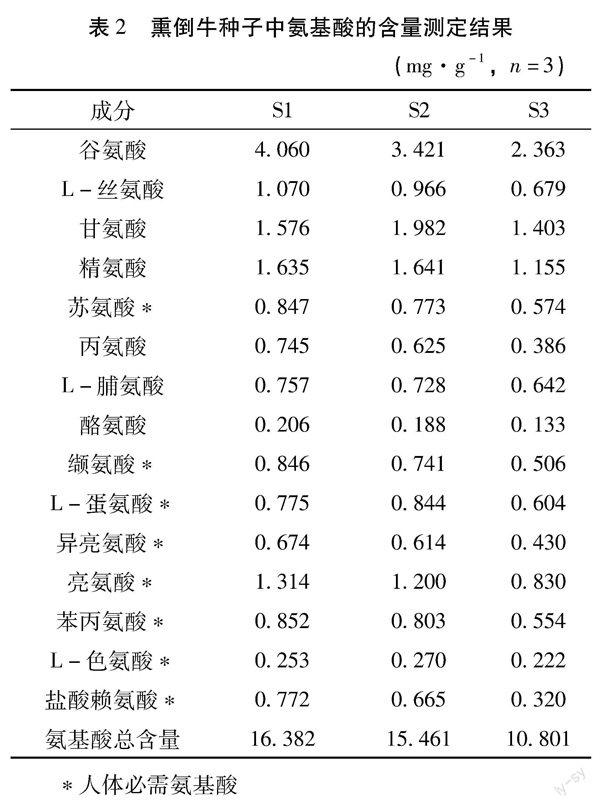
2.3.7样品含量测定结果精密称取编号S1-S3的藏药熏倒牛样品各3份,每份0.2 g,加入各标准品溶液适量,按照“2.2.5”项下制备供试品溶液,按“2.1”项下色谱条件进样,进样体积10 μL,测定样品中各氨基酸的平均含量。结果见表2。
3讨论
对于氨基酸的分析,常采用柱前、柱上及柱后衍生化3种方式。采用柱前衍生化,利用HPLC进行测定,具有方法稳定、普适性强等优点。本研究选用柱前衍生化法,首先对样品的水解方式进行优化,结合文献[11-12],选择以6 moL·L-1盐酸为水解试剂,设置不同时间(1、6、12、24 h)进行水解,以样品中各氨基酸含量为标准,优选最佳的水解方法,最终选择以水解温度110 ℃,水解6 h为样品水解方法,本方法下,样品中各氨基酸能够充分水解,且无焦化现象。其次,通过预实验,遴选了最佳衍生化试剂。常见的衍生化试剂主要有邻苯二甲醛、PITC、二硝基氟苯、9-氯甲酸芴甲酯和丹磺酰氯等[13]。其中用PITC乙腈溶液进行衍生化处理具有产物单一、稳定等特征[14-15],通过优化实验方法,最终选择以0.1 moL·L-1的异硫氰酸苯酯(PITC)乙腈溶液及1 moL·L-1三乙胺乙腈溶液,时间为1 h进行衍生化处理。
本研究结果提示,藏药熏倒牛种子中含有丰富的人体必需氨基酸,约占样品中氨基酸总量的37.4%~38.6%。同时谷氨酸、甘氨酸、精氨酸、亮氨酸、L-丝氨酸等氨基酸含量较高,3批熏倒牛样品中,五种氨基酸的平均含量分别介于2.363~4.060 mg·g-1、1.403~1.982 mg·g-1、1.155~1.641 mg·g-1、0.830~1.314 mg·g-1、0.679~1.070 mg·g-1之间。
本文通过建立柱前衍生化HPLC法同时测定藏药熏倒牛种子中15种氨基酸的含量,具有操作简单,准确度高等特点,能够为藏药熏倒牛种子的药材质量评价、深入开发等提供基础。
参考文献[1]
中国科学院西北高原生物研究所.藏药志[M].西宁:青海人民出版社,1991:263-264.
[2]王维恩,张晓峰,沈建伟,等.藏药熏倒牛化学成分研究[J].天然产物研究与开发, 2009, 21(2): 199-202.
[3]吴海峰,张晓峰,邓烨,等.藏药薰倒牛的化学成分研究[J].中国中药杂志, 2007, 32(20): 2141-2143.
[4]张晓峰,周炳南. 藏药薰倒牛的活性物质研究[J].药学学报,1995,30(3): 211-214.
[5] MENG J C, LU H, LI H, et al. A new antibacterial sesquiterpene glycoside and other bioactive compounds from Biebersteinia Heterostemon [J]. Spectroscopy Lett, 1999, 32(6): 1005-1012.
[6]張亚梅,张普照,陈斌,等.熏倒牛科植物化学成分与药理作用研究进展[J].中药材,2015,38(11):2435-2438.
[7] 王渊龙,侯建平,郭依心,等.薰倒牛提取成分的抗氧化活性研究[J].食品工业,2014(6):169-171.
[8] 王维恩,赵维元.熏倒牛生物碱有效部位对链脲霉素致糖尿病小鼠血糖的影响[J].中成药,2011,33(9):1584-1586.
[9] 王发春,陈志,邱丹,等.藏药熏倒牛籽油中脂肪酸成分分析[J]. 青海师范大学学报(自然科学版),2013(3):38-39.
[10] HANNELORE K, KATJA D, WOLFRAM G, et al. Advances in amino acid analysis[J]. Anal and Bioanal Chem, 2009, 393(2): 445-452.
[11]江东龙,陈芳,熊丹丹,等.柱前衍生化HPLC法同时测定龟甲胶中14种水解氨基酸含量[J].药物分析杂志,2015,35(10):1790-1795.
[12] LI H S,HUANG Z L,LI H L,et al.The hydrolyzed and processed method of the sample for amino acid analysis[J].Tianjin Pharm,1998,11(3):54.
[13]赫欣睿,武中庸,叶永丽,等.高效液相色谱法测定氨基酸的研究进展[J].分析测试学报,2016,35(7):922-928.
[14]HEINRIKSON R L,MEREDITH S C.Amino acid analysis by reverse-phase high-performance liquid chromatography:Precolumn derivatization with phenylisothiocyanate [J]. Anal Biochem,1984,136(1):65-74.
[15]阳利龙,祝文君,何周康.柱前衍生反相高效液相色谱法测定人血清中游离氨基酸[J].儿科药学杂志,2010(16):25-27.
(收稿日期:2021-07-02编辑:陶希睿)
基金项目:甘肃省药品监督管理局2020年度药品科研项目(项目编号:2020GSMPA034);国家药品标准物质协作研究与标定(项目编号:2020-W0204001)。
作者简介:李运(1985-),男,汉族,硕士,高级工程师,研究方向为中药质量控制。E-mail:lyun04@163.com
通信作者:景明(1963-),男,汉族,教授,研究方向为中藏药产品开发研究。E-mail:jm@gszy.edu.cn
