双水解反应的可视化创新实验设计
2022-05-30朱彦博刘业涵任红艳
朱彦博 刘业涵 任红艳

摘要: 针对传统双水解反应教学中存在的缺陷,对双水解反应实验进行改进,设计了传统改进型、直接滴加型和两滴相遇型三种实验方案。将其应用于观察Al2(SO4)3溶液与Na2CO3溶液的双水解反应中,取得了很好的实验效果,并建立了相关的反应模型。有助于培养学生控制变量的研究思想以及证据推理与模型认知、科学探究与创新意识等化学学科核心素养。
关键词: 双水解反应; 可视化; 碳酸钠与硫酸铝; 创新实验
文章编号: 10056629(2022)07005705
中图分类号: G633.8
文献标识码: B
1 引言
在魯科版高中化学教材选择性必修一《化学反应原理》中以泡沫灭火器为情境,介绍了HCO-3与Al3+的双水解反应。双水解作为一种特殊的水解反应,是中学化学教学的重点之一。高中化学课程标准中对水解平衡的要求是让学生认识盐类水解的原理和影响盐类水解的主要因素[1],而双水解反应中所蕴含的水解平衡、平衡移动以及产生的实验现象等知识,对培养学生“宏观辨识与微观探析”“变化观念与平衡思想”两大核心素养均有很大帮助。
查阅近年来对双水解反应的研究,发现主要集中于探究反应产物[2,3]以及能否反应[4]等问题上,缺乏对实验现象可视化方面的思考。笔者认为主要原因在于双水解反应的现象大都比较“明显”。以碳酸钠与硫酸铝溶液反应为例,将两者混合可以观察到快速产生的白色沉淀和细小气泡。但是,细小气泡掺杂于大量白色沉淀中其实是不太容易被察觉的,另外,由于反应物加量不同而引起的实验现象的差异等情况更不易被主动发现。而这些都是可促使学生深度思考、发展科学素养的极好素材。
为创设更具化学学科思维深度的实验情境,更清晰地观察实验现象并获取更多的实验证据,以碳酸钠与硫酸铝溶液反应为例,针对该实验存在的“现象不够清晰”“现象之间有干扰”“无法反映加量不同所引起的变化”等缺陷,设计了三种实验方案: 传统改进型、直接滴加型和两滴相遇型。从试剂用量的改变、微距镜头的使用、多变量的同步一体化设计等多个角度进行实验探究。
2 实验设计
Al3+和CO2-3的反应是典型的双水解反应,本文选用十二水硫酸铝和碳酸钠固体分别配制溶液进行反应,涉及的离子方程式主要有:
Al3++3H2OAl(OH)3+3H+ ①
CO2-3+2H2OH2CO3+2OH-②
CO2-3+H2OHCO-3+OH-③
HCO-3+H2OH2CO3+OH-④
H++OH-H2O⑤
CO2+CO2-3+H2O2HCO-3⑥
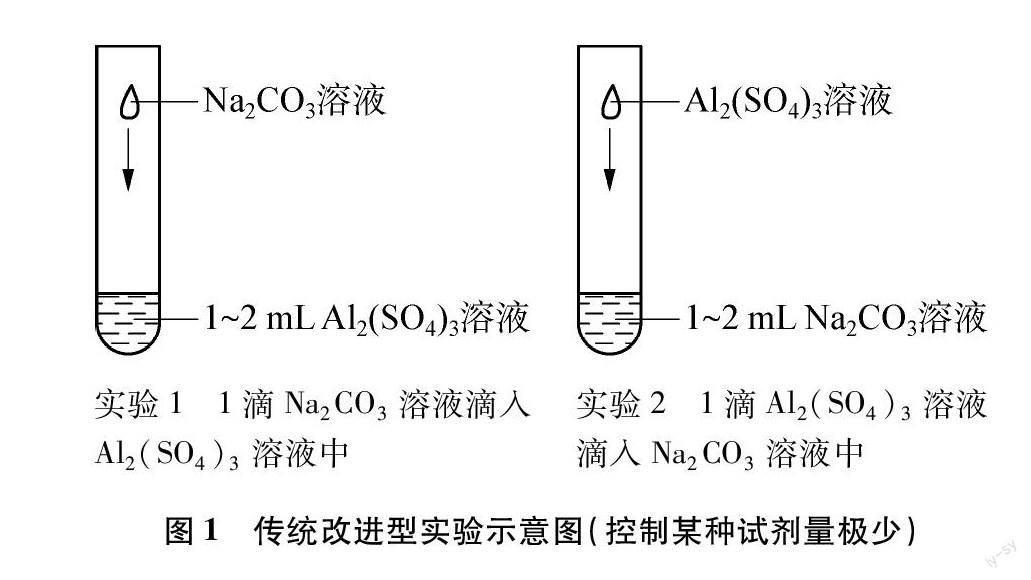
2.1 传统改进型
传统的双水解实验是将碳酸钠溶液与硫酸铝溶液直接混合。比较常见的操作是,在试管中加入1~2mL的某种溶液,用胶头滴管吸取适量的另一种溶液,逐滴加入到试管中,观察现象。但这样的实验存在两个缺陷: 一是气泡掺杂于沉淀中,不易观察;二是难以观察到生成的产物在振荡试管后发生的变化,错失了更多的实验证据。传统改进型主要针对第二个缺陷,只将1滴溶液滴入1~2mL的另一种溶液中,既能看到原有反应现象,也便于观察生成的产物在振荡试管后发生的变化。
2.1.1 实验方案
实验方案如图1所示。
2.1.2 实验材料
试管两支、0.4mol/L Al2(SO4)3溶液和1.2mol/L Na2CO3溶液(浓度可以适当变化,但确保两者浓度之比为化学计量数之比1∶3即可,下文同)、一次性塑料滴管两支
2.1.3 实验步骤
如图1(实验1)所示,在试管中加入1~2mL的Al2(SO4)3溶液,用塑料滴管吸取少量Na2CO3溶液,向试管中滴加1滴,观察现象。振荡试管,再观察现象。实验2将两种溶液对调即可。
2.1.4 实验现象与结果分析
刚滴加溶液时,在两个实验中均可以看到试管中溶液的上方出现白色絮状沉淀,但因为少量微小无色气泡掺杂在白色沉淀中,需要仔细观察才可以看到。由反应①可知,Al3+水解呈酸性,由反应②可知,CO2-3水解呈碱性,两个溶液混合后CO2-3水解生成的OH-和Al3+水解生成的H+结合生成难电离的水,破坏了两种物质的水解平衡,于是促进了两种盐的进一步水解,生成白色絮状沉淀Al(OH)3和H2CO3,H2CO3不稳定分解生成无色气泡CO2。虽然据研究表明在CO2-3过量时生成的白色沉淀应为含少量碳酸根的氧化铝水合物[5],但主要成分仍为Al(OH)3,故本文中将其按Al(OH)3考虑,下文同。
实验1中,轻轻振荡试管,沉淀散开,溶液中出现较多微小气泡。絮状沉淀松散而不紧密,因而在振荡后会散开,散开后未反应完的Na2CO3进入过量Al2(SO4)3溶液中,继续发生反应①和②,故出现较多微小气泡,但沉淀的量却并无肉眼可见的增加。再振荡几次,白色沉淀快速消失,微小气泡数量变多并不断向上移动。沉淀的消失是由于其溶解于Al3+水解产生的酸性环境中。据研究表明,当pH<3.4时,Al(OH)3可溶解生成Al3+[6],用精密pH试纸测得0.4mol/L Al2(SO4)3溶液的pH约为2.5(理论计算pH为2.70),故沉淀可溶解。而CO2在酸性环境中易于生成,故气泡数量变多。
实验2中,轻轻振荡试管,沉淀散开,刚开始产生的微小气泡消失。松散的絮状沉淀在振荡后散开,刚开始产生的CO2进入到过量的Na2CO3溶液中,发生反应⑥,故消失。而之所以刚开始会产生气泡,猜测是刚滴下溶液的交界处暂时形成了一个偏酸性的环境,因而CO2可以生成。继续振荡,溶液中沉淀的数量随着振荡次数的增加渐渐减少,直至最终消失,过程中未观察到有气泡生成。沉淀散开后,未反应完的Al2(SO4)3进入过量Na2CO3溶液中,由于CO2-3过量,此时发生反应①和③,故不再产生气泡。而沉淀的消失是由于其溶解于CO2-3水解产生的碱性环境中,据研究表明,当pH>12时,Al(OH)3可溶解生成AlO-2[7],用精密pH试纸测得1.2mol/L Na2CO3溶液的pH约为12.5(理论计算pH为12.16),故沉淀可溶解。分析比较实验1和实验2中沉淀的溶解速率,发现在OH-浓度比H+浓度更高的情况下,Al(OH)3的溶解速率反而更慢,可以说明Al(OH)3在等浓度的酸中的反应速率要比碱中更快一些。
2.1.5 反思
传统改进型能够观察到白色沉淀和无色气泡在振荡试管后发生的变化,但由于无色气泡会掺杂在白色沉淀中,故刚开始滴加时现象不够清晰,需要仔细观察才能发现细微现象,而且试剂的用量也比较大。
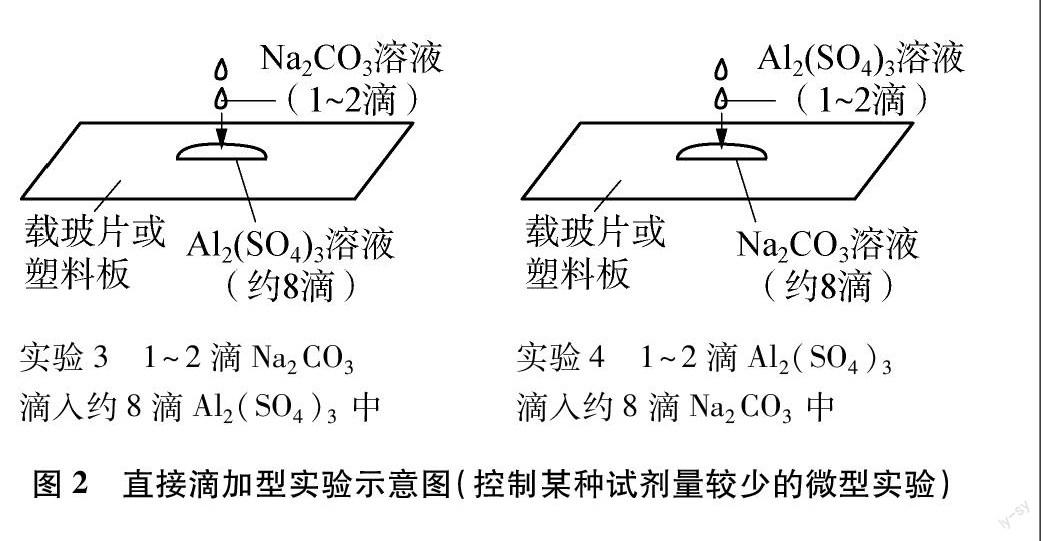
2.2 直接滴加型
为了解决气泡掺杂在沉淀中无法观察清晰的问题,设计了“直接滴加型”实验方案。取约8滴某溶液(如图2所示汇聚成一大滴)和1~2滴另一种溶液(滴数可以适当变化,确保其中一种溶液过量即可),在载玻片或者塑料板上进行实验,并用微距镜头结合手机进行拍摄,将实验现象放大以清晰观察。在教学中可以采取先让学生猜测实验现象,再亲自动手实验,最后解释实验现象的引导方式,激发他们的思考,培养他们科学探究能力和创新意识。
2.2.1 实验方案
2.2.2 实验材料
铁架台、塑料尺、黑色卡纸、十字夹、试管夹、升降台、手机、微距镜头(本文中使用放大倍数为28倍的微距镜头,下文同)、塑料滴管、Al2(SO4)3溶液和Na2CO3溶液
2.2.3 实验步骤
实验3中,先用铁架台和十字夹将试管夹固定起来,把塑料尺夹在试管夹上,并保持其与桌面水平。如图2所示,用滴管在塑料尺上滴约8滴Al2(SO4)3溶液(汇聚成一大滴),将装有微距镜头的手机放置于升降台上,通过调节升降台的高度调整手机镜头的位置,使镜头与液滴刚好对焦,屏幕中能够显示出一个完整的液滴。打开手机录像键,用另一支滴管吸取Na2CO3溶液,直接伸到大液滴的正上方,滴加1~2滴Na2CO3溶液,录下反应视频。实验4换成在约8滴Na2CO3溶液上滴加1~2滴Al2(SO4)3溶液。其余步骤相同。
2.2.4 实验现象与结果分析
实验3中,以在约8滴0.3mol/L Al2(SO4)3溶液上滴加2滴0.9mol/L Na2CO3溶液为例,在拍摄的视频中选取重要的时间节点进行截图,得图3(由于液滴左右基本对称,故只选取图片的左边一半)。
如图3所示,当滴入2滴0.9mol/L Na2CO3液滴后,立即产生白色沉淀和无色气泡。起初气泡在沉淀中间以及边缘都有生成,且中间的气泡较边缘要稍大。这是因为CO2是Na2CO3中的CO2-3水解得到,故刚开始沉淀中间的气泡更大,随着时间推移,中间还未反应完的Na2CO3会向外扩散,使得沉淀与Al2(SO4)3溶液的交界处也产生气泡。从40s到100s,可以明显观察到沉淀中间的气泡开始缩小,而外围的气泡则逐渐增大。这是因为中间的气泡会缓慢溶解于还未反应完的Na2CO3溶液中,向外扩散的Na2CO3溶液则与Al2(SO4)3溶液不断反应生成较多的气泡。CO2易于在酸性环境中生成,因此气泡倾向于生成在沉淀外側的Al2(SO4)3溶液中。而最终沉淀中仍有微小气泡,猜测是滴下的Na2CO3溶液已经被反应完或者是浓度低到不足以再与CO2反应。
实验4中,以在约8滴0.6mol/L Na2CO3溶液上滴加1~2滴0.2mol/L Al2(SO4)3溶液为例,在拍摄的视频中选取重要的时间节点进行截图,得图4(由于现象主要集中在大液滴中部,故只截取图片的中间部分)。
如图4所示,当滴入1~2滴Al2(SO4)3溶液后,立即产生白色沉淀和无色气泡,气泡只在沉淀内部产生,外部几乎不产生。猜测气泡在沉淀内部生成是因为沉淀内部暂时形成了一个偏酸性的环境,能够发生反应②。而沉淀外围是过量的Na2CO3溶液,发生反应③,故不生成气泡。随着时间推移,沉淀内部气泡会合并变大,最终生成一个大气泡。沉淀随着时间的推移逐渐向外增多,将气泡包裹,内部的气泡不溶解于Na2CO3溶液中。由实验2可知沉淀在Na2CO3溶液中的溶解速率较慢,且约8滴Na2CO3溶液中Na2CO3的量也有限,所以当沉淀将气泡包裹起来的时候内部的气泡就不会被Na2CO3溶解,而是保持在其中。正是因为白色沉淀与酸反应的速率要大于碱,所以虽然实验4中两种反应物溶液的浓度较低,但相同时间内形成的沉淀反而要明显多于实验3。
2.2.5 反思
直接滴加型可以非常清晰地观察到白色沉淀和无色气泡以及它们生长变化的细节,从中可以获得更多的实验证据。其变化过程相对复杂,在实验3中出现的“刚开始中间气泡大,后又逐渐缩小”、实验4中出现的“最终气泡没有被溶解”等现象容易引起学生的困惑,但是,如果正确地加以引导,让学生从这些现象中思考背后的原因,可以培养学生的批判性思维和科学严谨的实验态度。
2.3 两滴相遇型
直接滴加型已经非常清晰地观察到实验现象以及变化过程,但还是要分成两个实验去分别探讨过量与少量的情况,故设计了更加巧妙的“两滴相遇型”方案,使得可以在一个实验中一体化地展示Al2(SO4)3与Na2CO3分别过量的情况。将两滴溶液滴在相互靠近的位置上,轻轻一拨使它们相遇反应,这样在一侧就是Al2(SO4)3过量、Na2CO3少量,另一侧就是Al2(SO4)3少量、Na2CO3过量,并对实验现象建立模型,提升学生的模型认知能力。
2.3.1 实验方案
实验方案如图5所示。
2.3.2 实验材料
铁架台、塑料尺、黑色卡纸、十字夹、试管夹、升降台、手机、微距镜头、塑料滴管、Al2(SO4)3溶液和Na2CO3溶液
2.3.3 实验步骤
用铁架台和十字夹将试管夹固定起来,把塑料尺夹在试管夹上,并保持其与桌面水平。用两支分别吸有Na2CO3溶液和Al2(SO4)3溶液的塑料滴管分别在塑料尺上滴上1滴溶液,使这两滴溶液距离很小,如图5(a)所示。将装有微距镜头的手机放置于升降台上,通过调节升降台的高度调整手机镜头的位置,使镜头与液滴刚好对焦,屏幕中能够显示出两个完整的液滴。打开手机录像键,用牙签或者滴管轻轻一拨,使两滴溶液相遇,交界处开始反应,如图5(b)所示,录下反应视频。
2.3.4 实验现象与结果分析
以0.3mol/L Al2(SO4)3溶液与0.9mol/L Na2CO3溶液反应为例,在拍摄的视频中选取重要的时间节点进行截图,得图6[液滴中Na2CO3溶液在上面,Al2(SO4)3溶液在下面]。
当两滴溶液相遇后,交界处立即出现白色沉淀区域,该区域近似为一个椭圆形。仔细观察可以发现靠近Al2(SO4)3一侧的沉淀是蛛网式的丝状沉淀,而靠近Na2CO3一侧的是蓬松的絮状沉淀,二者形态不同。由文献可知,pH对氢氧化铝的晶型有较大影响,随着溶液pH从3升至12,生成的氢氧化铝晶体结构依次为非晶态、勃姆石[γAlOOH]和拜耳石[αAl(OH)3],相应粉体颗粒平均直径依次增大[8~10]。因此,可见随着pH增大,氢氧化铝颗粒更大,团聚得更紧密,沉淀也就更加明显。靠近Na2CO3溶液一侧pH较大,故在宏观上沉淀更加偏向于絮状,而pH较小的Al2(SO4)3一侧则为丝状。
随着反应的进行会发现上端絮状沉淀的量开始增多,这是因为反应区内没反应完的Al2(SO4)3溶液与上方液滴中的Na2CO3溶液相互扩散,在蓬松多孔的絮状沉淀的孔隙处相遇反应,生成氢氧化铝沉淀。生成的沉淀虽然会溶解于Na2CO3溶液形成的碱性环境中,但是由实验2可知,反应速率较慢,所以会有更多的絮状沉淀产生。但是在Na2CO3溶液过量的情况下发生反应③,不生成CO2,所以现象为沉淀量增多而不出现气泡。
沉淀区域下端的边界处内外侧都开始出现无色气泡,但明显外侧要多于内侧。随着时间推移,下端气泡的大小不断增长,相互靠近的气泡会合并成更大的气泡。这是由于反应区内没反应完的Na2CO3溶液与下方液滴中的Al2(SO4)3溶液相互扩散,在蛛网式的丝状沉淀的孔隙处相遇反应,生成氢氧化铝沉淀和CO2气体。但是由实验1可知,沉淀会极快地在Al2(SO4)3溶液形成的酸性环境中溶解,因此不会看到有白色沉淀增多的现象,甚至在反应一段时间后丝状沉淀还会部分溶解。CO2气体在酸性和中性环境中都能够生成,但是更偏向于在酸性环境中生成,因此在沉淀区域下方的内外侧都有气泡不断生长,但外侧的气泡明显多于内侧。
根据反应的实物图[图7(a)]绘制了“两滴相遇型”的模型图,如图7(b)所示,以便学生理解反应中发生的细节变化。
两滴相遇型实验,可以非常清晰地观察到白色沉淀和无色气泡以及它们的生长过程,并且在交界处的两端分别模拟了其中一种溶液过量的情况。考虑到白色沉淀和无色气泡的生成都与溶液的pH有关,因此在之后的教学和学生实验中可以让学生尝试比较不同浓度的硫酸铝溶液和相應浓度的碳酸钠溶液反应的现象差异,以获得更多的实验证据,引发更多的思考。
3 结语
本文针对传统双水解反应教学中存在的缺陷,对双水解反应进行了可视化创新实验设计,分为传统改进型、直接滴加型和两滴相遇型三种实验方案,并将其应用于观察Al2(SO4)3溶液与Na2CO3溶液的双水解反应中,取得了很好的实验效果,获得了更多的实验证据。
该实验方案具有以下创新点:
(1) 微量化。试剂用量少,除传统改进型需要1~2mL溶液以外,其余两种实验方案都只需几滴溶液即可,大大节约了实验资源。
(2) 可视化。改变了反应容器,直接在载玻片或者塑料尺上进行反应,使得现象之间不会相互干扰,并用微距镜头结合手机进行拍摄,可以清晰地观察到微小的气泡以及沉淀与气泡的变化过程。
(3) 一体化。两滴相遇型实验方案可以在一个实验中同时模拟两种溶液分别过量的情况,使得现象形成鲜明的对比,具有更好的视觉效果。
在化学教学中,可以将该实验方案用于多个实验教学设计,例如探究碳酸钠与盐酸的反应、碳酸氢钠与硫酸铝的反应、氯化铁与偏铝酸钠的反应等,创设实验情境让学生观察到更为清晰的实验现象,获得更为有趣而丰富的实验证据以提升课堂教学的思维深度,提高教学质量。另外,以该实验方案为核心开展相关探究活动的设计,鼓励学生设计新的实验方案,亲自动手实验,尝试探索和观察不同条件下的反应现象,有利于建立控制变量的科学思维方式,发展证据推理与模型认知、科学探究与创新意识等核心素养。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 34.
[2]伍强, 罗姣. 碳酸钠及碳酸氢钠与硫酸亚铁反应的探究[J]. 化学教学, 2016, (12): 61~63.
[3][5]陆燕海, 林肃浩. 硫酸铝遇碳酸钠、碳酸氢钠时水解沉淀产物的探索[J]. 化学教育, 2010, 31(7): 74~75.
[4]喻俊, 丁伟. Fe2+、 AlO-2双水解反应的实验初探[J]. 化学教学, 2015, (8): 51~54.
[6]
[7]吕善荣. 利用pH传感器和光传感器探究氢氧化铝的两性[J]. 化学教学, 2021, (3): 79~83.
[8]杨岳洋, 江书安, 李建军, 龙翔, 李海艳, 杨振, 崔爱莉. pH对氢氧化铝晶型影响分析[J]. 无机盐工业, 2017, 348(11): 39~41.
[9]杜雪莲, 孙耀祖. pH值对氢氧化铝晶相及微结构的影响[J]. 郑州大学学报, 2011, 119(5): 38~41, 45.
[10]黄静, 夏举佩, 罗中秋. 碳酸钠沉淀法制备氢氧化铝及其形成机理探讨[J]. 化工进展, 2017, 306(3): 1120~1125.
