问题驱动,促进认知模型建构
2022-05-30胡先锦
胡先锦


摘要:高中化学教学要让学生“知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律”,“能依据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架”。因此,教学苏教版高中化学必修第一册《氧化还原反应》一课时,基于对教学内容和学情的分析,创设真实情境,通过问题驱动,引导学生持续探究,逐步建构科学的氧化还原反应认知模型。
关键词:认知模型;高中化学;氧化还原反应
《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课标》)指出,要让学生“知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律”,“能依据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架”③。
教学苏教版高中化学必修第一册《氧化还原反应》一课时,笔者尝试通过问题驱动,促进学生认知模型的建构。
一、教学内容与学情分析
(一)教学内容分析
氧化还原反应是中学化学的重要内容,是学习元素及其化合物的重要认知载体和认知工具。《课标》对这部分内容的要求是,“认识有化合价变化的反应是氧化还原反应,了解氧化还原反應的本质是电子的转移,知道常见的氧化剂和还原剂。”
本课的主要内容有:从元素化合价变化来判断氧化还原反应,理解其本质是电子的转移,能描述氧化还原反应的有关概念,知道常见的氧化剂和还原剂,初步学会根据氧化还原反应方程式比较物质氧化性、还原性的相对强弱,了解氧化还原反应在生产生活中的应用。其中,重点内容是用化合价升降和电子转移的角度理解氧化还原反应,以及氧化剂、还原剂、氧化产物、还原产物的判断;难点内容是理解氧化还原反应的本质。
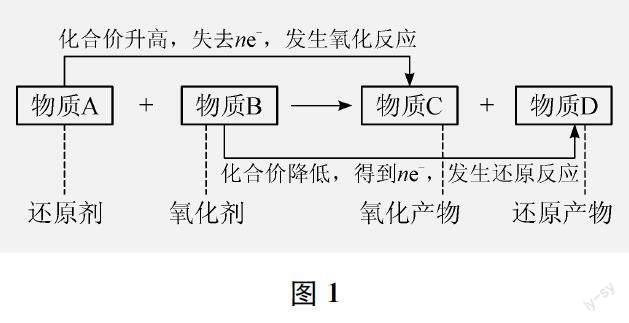
氧化还原反应的理论模型如图1所示。
(二)学情分析
高一学生原有对氧化还原反应的认知模型主要是九年级阶段的“氧气模型”(有氧气参加的反应)和“路径模型”(氢气与氧化铜加热反应中,氢得氧,发生氧化反应;氧化铜失氧,发生还原反应)。对照氧化还原反应的理论模型,学生的认知中还没有“价态模型”(反应中有元素化合价变化的反应为氧化还原反应)和“电子模型”(氧化还原反应的本质是电子的转移)。
二、学习目标
1.通过实验探究,认识氧化还原反应中有元素化合价的变化,反应过程中有电子的转移,从而理解氧化还原反应的本质。
2.基于已有认知模型,通过对氧化还原反应的特征和本质的分析,学习由表及里的科学思维和逻辑推理等科学方法,进行认知模型的修正和完善,逐步建构科学的氧化还原反应认知模型。
3.通过对氧化剂、还原剂、氧化产物、还原产物的判断和对物质氧化性、还原性相对强弱的比较,认识“氧化”和“还原”,体会对立统一的辩证思想。
4.通过氧化还原反应认知模型的实践应用,体验化学概念从生活经验到科学理性的过程,认同化学学科的社会价值和生活意义。
三、教学过程
本课的教学流程如下页图2所示:通过创设情境,激发学生的学习兴趣和问题探究意识;基于认知水平的层进,推动学生对氧化还原反应内容进行持续探究和学习;引导学生不断修正和完善已有的氧化还原反应认知模型,逐步建构科学的氧化还原反应认知模型。
(一)创设情境,从“氧气模型”出发
用破壁机现场榨取果汁,先榨取一杯苹果汁,用玻璃杯盛装后,拿着在教室内走动,供学生观察,发现苹果汁很快变色;再榨取一杯柠檬苹果混合汁,同样操作,发现混合汁不会很快变色。
提出问题:为什么苹果汁会很快变色,而柠檬苹果混合汁不会呢?
预设:苹果汁被氧化了;柠檬汁可以保护苹果汁不被氧化。
百度搜索“苹果汁为什么变色”,得到:酚类化合物易被氧化成醌类化合物,即发生变色反应变成黄色,随着反应的量的增加,颜色逐渐加深,最后变成深褐色。
用生活中的真实现象,让学生感同身受的同时激起好奇心和求知欲,为课堂的推进创设积极氛围,为认知模型的修正创设必要的认知情境。让学生直接了解苹果变色是由于酚类化合物被氧化成醌类化合物,将学生初中阶段最先持有“氧气模型”作为课堂的认知起点。
(二)回顾旧知,向“路径模型”转化
提出问题:回顾初中阶段学习过的H2还原CuO的知识,如何用双线桥法分析标注?
学生回顾氧化还原反应的初始认知——得氧为氧化反应,失氧为还原反应。由此,得到图3所示的氧化还原反应“路径模型”。
H2+CuO△H得氧,发生氧化反应2O+Cu失氧,发生还原反应
通过分析H2还原CuO的反应,带领学生从“氧气模型”上升到“得氧失氧”的“路径模型”,并引出分析氧化还原反应的基本方法之一——双线桥法。
(三)初步延伸,往“价态模型”修正
提出问题:观察H2还原CuO的反应中元素化合价的变化,结合前一阶段学习过的氧化还原反应基本概念,如何判断一个化学反应是不是氧化还原反应?
预设:有元素化合价变化的反应就是氧化还原反应。
引导:钠在氯气中的燃烧反应,也存在着元素化合价的变化,也就属于氧化还原反应。用双线桥法参照H2还原CuO的反应进行分析(如图4所示)。
Cl2+2Na点燃2Na化合价升高,发生氧化反应Cl化合价降低,发生还原反应
学生获得氧化还原反应的进阶认知——元素化合价发生变化,同时改变原有的对燃烧的认识(燃烧不一定需要氧气参加)。
引导学生结合两个化学反应,进一步认知氧化还原反应的外显特征是有元素化合价变化,从而将学生的认知模型转变到“价态模型”。
(四)微观分析,促“电子模型”建构
提出问题:为什么在氧化还原反应中会出现元素化合价的变化?其本质原因是什么?
引导学生从原子结构视角,分析金属钠在氯气中燃烧的微观历程(如图5所示)。
提出问题:是不是所有氧化还原反应都一定发生电子的得失?
引导学生尝试从原子结构视角,分析H2在Cl2中燃烧反应的微观历程,获得“共用电子对”的认知,理解氧化还原反应中电子转移是电子的得失或共用电子对的偏移。
学生形成氧化还原反应的本质认知——电子的转移(电子的得失或偏移)。
提出问题:从电子转移视角,如何用双线桥分析锌和稀硫酸反应生成硫酸锌和氢气?
学生尝试,得到图6。
Zn+H2SO4Zn化合价升高,失去2e-,发生氧化反应SO4+H2化合价降低,得到2e-,发生还原反应↑
引导:当然,电子转移的方向和数目也可以简化表示,(出示图7)即单线桥法。
Zn+H22e-SO4ZnSO4+H2↑
借助原子结构的变化分析,认识元素化合价变化的内在原因,将认知模型进一步提升到“电子模型”,增进对氧化还原反应的本质理解。接着,进一步完善分析氧化还原反应的认知模型,引导学生在巩固双线桥法的同时,领会单线桥法能更加直观地体现电子的转移,并为后续的实验探究做铺垫。
(五)实验探究,让“电子模型”可视
提出问题:我们从理论的视角分析了氧化还原反应的本质是电子的转移,那么,在反应过程中,到底是否有电子的转移呢?能够通过实验证明吗?在初中的学习中,我们已经知道电子的定向移动能够产生电流,怎样验证有电流的产生呢?
预设:借助电流计。
提示:可以参照测量干电池中产生的电流的方法进行实验探究。
提供干电池、导线、电流计、锌片、稀硫酸、石墨棒、烧杯等实验用品,引导学生实验探究:类比测量干电池中产生的电流实验(实验装置图如图8所示),设计氧化还原反应产生电流的验证实验(实验装置图如图9所示),通过观察电流计指针发生偏转来说明电子的转移。
引领学生进行实验探究,培育学生理论分析与实验探究相结合的学科思维,强化氧化还原反应认知的“电子模型”。同时,渗透氧化还原反应为电池制造提供了反应原理的学科思维,为今后学习电化学知识做孕伏。
(六)全面深化,建构科学认知模型
借助双线桥法,以锌和稀硫酸反应为例,分析氧化还原反应中各种物质所承担的反应角色,得到如图10所示的氧化还原反应科学心智模型。
从化合价变化、电子转移的角度,共同分析并初步理解氧化劑、还原剂、氧化产物和还原产物。在此基础上,引出氧化性、还原性的概念,建立“在氧化还原反应中,氧化剂得到电子,表现出氧化性;还原剂失去电子,表现出还原性”的基本认识。
提出问题:从化合价变化或者电子转移的角度来看,氧化剂具有氧化性,氧化产物也具有氧化性,那么,一种具有氧化性的物质(氧化剂)参加反应,生成另一种具有氧化性的物质(氧化产物),是不是存在矛盾呢?
提示:联系初中阶段学习的“强酸制弱酸”的知识思考。
持续推进探究活动,通过较简单的反应实例,帮助学生厘清氧化还原反应中电子转移的数目、方向和氧化剂、还原剂等基本概念,从而确立科学的氧化还原反应认知模型。同时,初步形成氧化性、还原性相对强弱比较的“强制弱”观念。
(七)回归实践,应用科学认知模型
提出问题:(端起留下来的两份果汁)分析鲜榨苹果汁变色的原因(被空气中的氧气氧化),分析柠檬苹果混合汁颜色几乎没有变化的原因。
预设:(1)苹果汁被氧气氧化后,又被柠檬汁还原回来(实际上没有先后);(2)柠檬汁代替苹果汁被氧气氧化,从而保护苹果汁,起到抗氧化作用;(3)苹果汁和柠檬汁都会被氧气氧化,但是柠檬汁会先被氧化。
链接信息:柠檬中富含具有强还原性的维生素C,比苹果中含有的酚类化合物的还原性更强。
布置任务:从氧化还原反应的视角,选择合适的试剂探究维生素C的还原性。
链接信息:图片展示补铁剂、苯酚软膏等药品使用说明书中关于抗氧化的信息,以及食品包装袋内的抗氧化剂等。
课尾,在呼应课堂开头设置的情境的同时,引导学生将化学知识与日常生活实际紧密联系,毕竟“纸上得来终觉浅”,使学生真切感受到“化学就在身边”。通过理论分析和实验探究,强化氧化还原反应的科学认知模型,并在实践中运用模型开展探究。
