半夏叶柄组织培养一步成苗研究
2022-05-30胡文斌刘琼张少飞杨文
胡文斌 刘琼 张少飞 杨文
摘要:為给半夏组织培养和工厂化育苗体系的建立提供参考,以半夏叶柄为外植体,研究了不同消毒措施以及不同浓度激素对诱导外植体一次性成苗的影响。结果显示,以75%乙醇消毒30 s,再用0.1%HgCl溶液消毒6 min的灭菌效果最好;最佳诱导培养基为MS+蔗糖30 g/L+琼脂8 g/L+6-BA 1.0 mg/L+NAA 0.2 mg/L。
关键词:半夏;组织培养;快繁
中图分类号:S567.239 文献标志码:A 文章编号:2097-2172(2022)02-0194-03
doi:10.3969/j.issn.2097-2172.2022.02.019
Study on One-step Plantlet Formation of Pinellia ternate by
Petiole Tissue Culture
HU Wenbin, LIU Qiong, ZHANG Shaofei, YANG Wen
(Longnan Teachers College, Chengxian Gansu 742500, China)
Abstract: In order to provide reference for the establishment of tissue culture system and factory seedling system of Pinellia ternate, the petiole of Pinellia ternate was used as explants to study the effects of different disinfection measures and different concentrations of hormones on inducing one-step plantlet formation. The results showed that the best sterilization measure was to sterilize with 75% ethanol for 30 s, and then sterilize with 0.1% HgCl solution for 6 min; The best induction medium was MS + sucrose 30 g/L + agar 8 g/L + 6-BA 1.0 mg/L + NAA 0.2 mg/L.
Key words: Pinellia ternate; Tissue culture; Rapid propagation
半夏(Pinelliaternata)为天南星科(Araceae)多年生草本药用植物。作为我国珍贵药材之一,半夏不仅具有去痛、降压、抗肿瘤、抗早孕的作用,也具有镇咳祛痰、降逆止呕、消痞散结的功效[1 ]。近年来,随着市场需求的持续增长,野生半夏资源不断减少,种源缺乏、土壤退化以及病虫害等因素,已成为制约半夏产业发展的瓶颈[2 ]。随着科技的发展,植物组织培养技术也得到了迅速发展,已在多种珍稀植物上得以应用,其中关于一步成苗技术的研究也越来越多。一步成苗是将外植体接种到培养基上直接形成完整植株的过程,从而有效减少组织培养过程的步骤,具有再生周期短、易操作、节约人力物力财力等优势,以及广阔的发展前景[3 ]。基于此,我们以MS为基本培养基,附加不同浓度的植物激素6-BA和NAA,对半夏叶柄进行组织培养,一次性诱导无菌芽苗,以期为半夏组织培养和工厂化育苗体系的建立提供参考。
1 材料与方法
1.1 材料
试验材料为野生半夏,取叶柄备用。主要仪器为超净工作台、灭菌锅、光照培养箱及培养架等。试剂为6-卞氨基嘌呤(6-BA),萘乙酸(NAA)。
1.2 方法
1.2.1 培养基配制 基本培养基为MS,含蔗糖30 g/L,琼脂8 g/L,配制好后用0.1 mol/L的HCl或NaOH溶液将pH调节至6.0左右,分装于容量100 mL的三角瓶中,每瓶20~35 mL。用棉塞封口后置于高压锅灭菌,压力1.1 kg/cm2,121 ℃下灭菌20 min[4 - 5 ]。
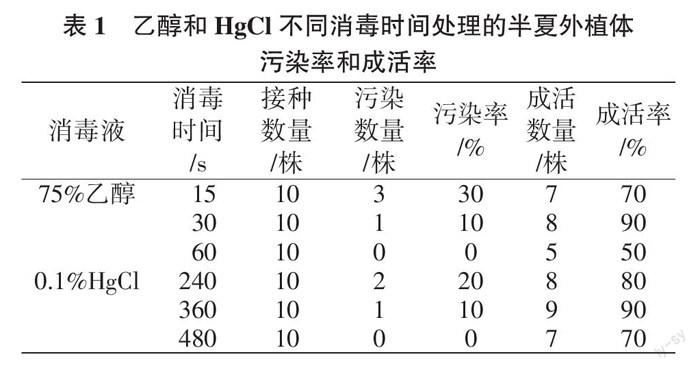
1.2.2 外植体消毒 将半夏植株用棉花蘸自来水清洗干净后流水冲洗过夜。在超净工作台上将叶柄剪成长2 cm左右的片段,用75%乙醇分别消毒15、30、60 s,无菌水冲洗2~3次。再用0.1%HgCl溶液消毒,消毒时间设4、6、8 min(240、360、480 s)(表1),用无菌水冲洗5次。消毒后将外植体接种于MS基本培养基上,接种完成后置于光照培养架上进行培养,光照强度2 000~3 000 Lx,光照周期12 h/d,培养室温度保持(25±2)℃。20 d后统计外植体的污染率及成活率,统计分析乙醇及HgCl溶液的最佳消毒时间[3, 6 ]。
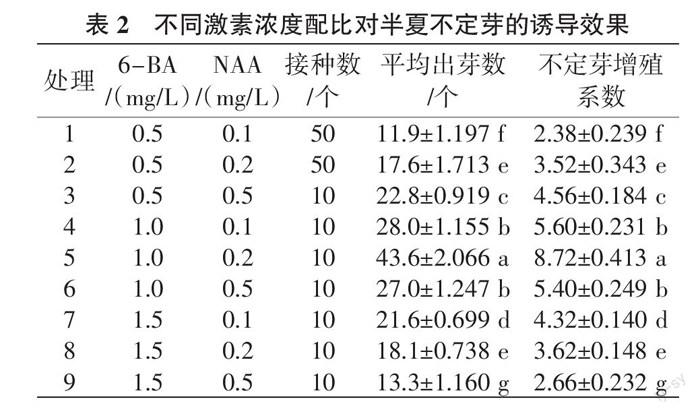
1.2.3 接种及成苗培养 依据上述实验筛选的消毒方法对外植体进行消毒,消毒完成后将外植体接种于附加不同浓度激素的MS培养基(表2),研究激素配比对外植体诱导的影响。接种后于不同时间段观察并统计芽的分化及生长状况,60 d后统计每瓶出芽数,计算不定芽增殖系数,以确定植物激素的最适添加量[3, 7 - 8 ]。
2 结果与分析
2.1 外植体最佳消毒时间的确定
由表1可知,乙醇消毒30 s处理的成活率最高,为90%;消毒60 s处理的污染率最低,但由于消毒时间过长,导致外植体表面发黑,降低了成活率。HgCl溶液消毒360 s处理的成活率最高,达90%;480 s处理的污染率虽然最低,但生长状态并不佳,可能是由于过长的消毒时间导致外植体表面被破坏,进而影响了其生长状态。由此可见,半夏外植体的最佳消毒时间以75%乙醇消毒30 s,0.1%的HgCl溶液消毒6 min为宜。
2.2 不同培养基对半夏叶柄丛生芽的诱导
由表2可知,当6-BA浓度为1.0、1.5 mg/L时,随着NAA 浓度的增高,平均出芽数呈先增加后减少趋势,NAA的最适浓度可设定为0.2 mg/L;当NAA 浓度不变时,随着6-BA 浓度增高,平均出芽数也呈先增加后减少趋势,因此6-BA的最适浓度可设定为1.0 mg/L。处理5平均出芽数最多,且不定芽的增殖系数也最大。
对每瓶平均出芽数进行双因素方差分析,通过主体间效应检验(表3),发现6-BA和NAA 之间存在交互效应,可能是由于NAA在促进生根的同时也在促进细胞分裂。
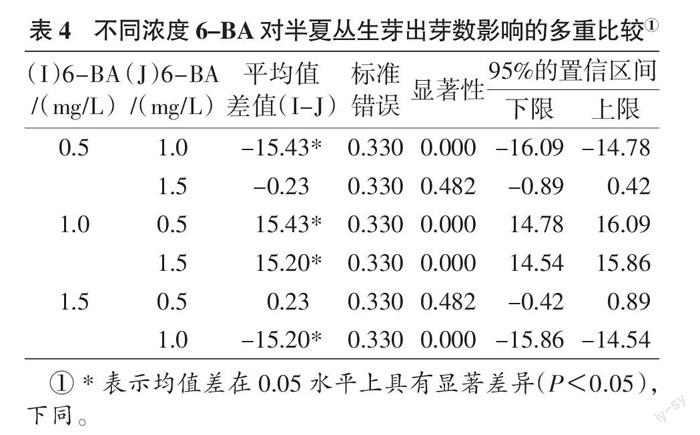
对不同浓度6-BA诱导下半夏丛生芽出芽数进行多重比较可以看出(表4),当6-BA浓度为1.0 mg/L时,与浓度为0.5、1.5 mg/L的出芽数均有显著差异(P < 0.05),而6-BA浓度为0.5 mg/L时的出芽数与浓度为1.5 mg/L时的出芽数没有显著差异(P > 0.05)。
同样,对不同浓度NAA诱导下半夏丛生芽出芽数进行多重比较可以看出(表5),当NAA浓度为0.2 mg/L时,与浓度为0.1 、0.5 mg/L的出芽数均有显著差异(P < 0.05),而当NAA浓度为0.1 mg/L时的出芽数与浓度为0.5 mg/L时的出芽数没有显著差异(P > 0.05)。
综上可知,试验条件下,半夏叶柄诱导不定芽分化最适激素浓度为6-BA 1.0 mg/L+NAA 0.2 mg/L。
2.3 半夏叶柄组织培养不定芽的诱导与植株再生进程
接种7d,半夏叶柄两端慢慢膨大;接种15d,出现淡黄色愈伤组织;接种30d,愈伤组织慢慢分化,长出不定芽;接种60d,不定芽继续增殖,而早前分化的不定芽已在基部生出不定根(图1)。芽苗长至5 cm左右时即可将芽苗分离,然后进行炼苗及移栽。
3 讨论与结论
植物激素是影响愈伤组织诱导和器官分化的主要因子,是植物形态调控及建成的主要影响因素[8 ]。半夏组织培养可以选用块茎、珠芽、茎尖、根、叶片和叶柄等作为外植体[9 - 10 ]。块茎、珠芽、茎尖及根诱导的芽苗数量太少,叶片诱导的芽苗虽然繁殖系数最高,但诱导周期过长;叶柄诱导芽苗数量多,周期也比叶片短[11 ],是半夏组织培养理想的外植体材料。
本研究以半夏叶柄为外植体,研究了不同消毒措施以及不同浓度激素对诱导外植体一次性成苗的影响。结果显示,外植体消毒方法以75%乙醇消毒30 s,用0.1%的HgCl溶液消毒6 min为宜。最佳诱导培养基为MS+蔗糖30 g/L+琼脂8 g/L+6-BA 1.0 mg/L+NAA 0.2 mg/L。对于组培苗炼苗、移栽的条件仍需进一步研究。
参考文献:
[1] 胡文斌,王 瀚,张少飞,等. 半夏的化学成分及其药性、毒性研究进展[J]. 中国资源综合利用,2016,
34(10):57-59.
[2] 崔晓星,李晓洋,孟繁蕴. 半夏快速繁殖技术的研究进展[J]. 中国农学通报,2009,25(1):51-55.
[3] 李先良,李居宁,彭春雷,等. 荆半夏叶柄一步成苗组培快繁体系的优化[J]. 江苏农业科学,2017,60(12):42-44.
[4] 胡文斌,张少飞,孙 娜,等. 陇南红提葡萄茎段组织培养研究[J]. 陕西林业科技,2018(1):6-9.
[5] 程霞英,陶晓晔. 三叶半夏组织培养研究[J]. 安徽农业科学,2010,38(3):1643-1645
[6] 靳 松,陈泽斌,李育川,等. 半夏组培快繁体系的建立[J]. 时珍国医国药,2017,28(7):1759-1761.
[7] 温 琳,惠国强,杨海鹏,等. 半夏叶柄愈伤组织诱导与分化最适培养基筛选[J]. 山西农业科学,2017,
45(6):905-908,977.
[8] 陶米林,刘清波,黄红梅. 半夏组织培养体系的建立[J]. 北方园艺,2013(4):113-117.
[9] 吳能表,曹瑞霞,吴思婧,等. 半夏再生体系的建立[J]. 西南大学学报(自然科学版),2018,40(9):1-6.
[10] 邱 萍,张兴翠. 半夏茎尖组织培养的研究[J]. 西南师范大学学报(自然科学版),2008,33(1):77-81.
[11] 宋艳梅,李 峰,刘 杨. 半夏组织培养快速繁殖研究[J]. 山东中医药大学学报,2010,34(4):368-369.
收稿日期:2022 - 05 - 20
基金项目:陇南市科技计划项目(2020-ZD-10);甘肃省高等学校创新基金项目(2021B-367)。
作者简介:胡文斌(1984 — ),男,甘肃成县人,讲师,硕士,主要从事植物组织培养方面的教学与研究工作。Email: hwbcl195927@163.com。
