电导率传感器在电解质相关问题研究中的系列实验
2022-05-30郑晓慧
郑晓慧


摘要:围绕高中阶段有关电解质的知识点,利用电导率传感器开展系列的定量实验,使学生对电解质、非电解质、强电解质、弱电解质有更清晰的认知,对弱电解质溶液导电能力的浓度依赖性以及同类电解质溶液的电导率进行探究,建立学生定量分析的思维模式,培养学生科学探究精神。
关键词:电解质;电导率传感器;定量分析
文章编号:1008-0546(2022)12x-0084-04
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.12x.021
一、问题的提出
实验是化学教学的重要方法和途径,新课标[1]要求在内容上精心设计学生必做实验,同时适当增加数字化实验、定量实验和创新实践活动等,让学生在实验探究活动中学习科学方法,认识科学探究过程,体会、认识技术手段的创新对化学学科的重要价值。在现行人教版[2-3]教材中,“必修第一册”以及《化学反应原理》课本中均涉及电解质的相关知识,在传统的教学中,经常使用将电解质溶液连入电路,通过观察小灯泡的亮暗以及电流表的指针偏转的方法来说明电解质与非电解质溶液中粒子的存在形式以及强弱电解质的电离区别,这种方法虽然较为直观,但只能进行一些定性的判断,无法做到定量分析。
数字化手持技术由于其便携、直观、实时、定量等特点,被广泛应用于中学化学实验教学与研究性学习,特别是对于电解质相关问题的研究。白涛等研究者采用电导率传感器解决“电离平衡”教学中内容抽象、教师难讲、学生难理解的问题,使微观过程宏观化。[4]邓玉华、杜丽君等研究者利用数字化实验测定无限稀释冰醋酸过程中的电导率和pH的变化,从微观上深入解析弱电解质的电离特征,突破越稀越电离的认识边界。[5]顾仲良等研究者设计并开展基于数字化传感技术多方位探究电离平衡的实验,引导学生测定离子浓度,分析电离程度,推导电离平衡的稀释定律、同离子效应,实现“宏观一微观一符号”三重表征。[6]目前,利用电导率传感器围绕电解质相关问题开展了非常出色的工作,但是均未对弱电解质电离平衡常数在稀释过程中保持恒定这一事实进行推导,也未对相同类型电解质溶液的电导率进行探究,引导学生对《物理化学》中电解质溶液的相关知识产生兴趣并进行深入挖掘。
在电解质相关问题研究中,应用电导率传感器进行的一系列定量实验,使电解质以及弱电解质电离平衡等问题更加直观化,便于学生理解。同时,数字化的教学方式,让学生对现代化的实验仪器有更多的了解,培养学生在探索未知问题的过程中应用与时俱进的研究手段。第三点,也是最重要的一点,电导率传感器能够使学生实现从“定性判断”到“定量分析”的思维转变,结合一系列的创新实验,激发学生的求知欲望与学习兴趣,引发学生的思考与探索,培养学生科学探究的核心素养,使新一轮基础教育改革的思想和理念得以进一步体现。
二、实验部分
1.实验原理
电导率是表示物质传输电流能力强弱的一种测量值,用希腊字母σ来表示。当施加电压于导体或者电解质溶液的两端时,其电流载体(往往称为载流子)会呈现出朝某方向流动的行为,因而产生电流。溶液中载流子一般是离子,利用电导率传感器测定一定条件下溶液的导电性,可以在一定程度上反应溶液中的离子浓度、种类等情况。
2.仪器及药品
仪器:朗威DISLab LW-C802电导率传感器,朗威DISLab LW-D801数据采集器,朗威DISLab LW-A801有线接口,DJS-IE铂黑电导电极,烧杯,100 mL容量瓶,玻璃棒,胶头滴管,药匙,分析天平。
药品:冰醋酸,浓盐酸,氯化钠,氯化钾,无水乙醇。
3.实验操作与步骤
分别配制0.1 mol/L NaCl溶液,0.1 mol/L KCl溶液,0.1 mol/L盐酸溶液,0.1 mol/L、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L醋酸溶液,根据图1组装实验装置,在小烧杯中盛装待测液,插入电导率传感器,待其读数稳定后读取测量值,每个样品测量三次,并取其平均值作为实验结果。本实验于2022年07月07日上午进行,本地室内气温30。C,大气湿度60%,气压99.4 kPa。
三、实验结果与讨论
1.分别测定蒸馏水、无水乙醇、0.1 mol/L盐酸溶液以及0.1 mol/L醋酸溶液的电导率。
本实验适用于电解质相关概念模块,有助于学生更好地理解电解质、非电解质、强电解质与弱电解质等相关概念。通过对比表1中相同温度下无水乙醇、蒸馏水以及0.1 mol/L盐酸溶液的电导率差别,说明三者体系中物质存在形式的差异。由于电导率传感器非常灵敏,因此做了空白组实验进行零点校准,由实验结果可知,常温下,无水乙醇的电导率几乎为零,说明无水乙醇中几乎不存在自由移动的离子,主要以乙醇分子的形式存在。而0.1 mol/L盐酸溶液的电导率远远大于无水乙醇,说明盐酸溶液中HCl不是以分子的形式存在,而是电离出了H+与cr,自由移动的H+和Cl-(实际上是水合H+与水合cr)使溶液的导电性大大增强。通过对比无水乙醇与盐酸溶液电导率的区别,使学生明确电解质与非电解质的概念。通过对比相同温度下同等浓度盐酸溶液与醋酸溶液的電导率数值,可反映出不同电解质在水溶液中的电离能力存在差异,即完全电离与部分电离,对比相同温度下0.1 mol/L醋酸溶液、蒸馏水的电导率,说明不同弱电解质的电离程度也存在差别,进而引出电离平衡常数的概念。
实验结果中比较值得注意的是蒸馏水的电导率测试结果。水的电离极其微弱,具有微弱的导电性,而这种微弱的导电性无法利用传统实验体现出来,电导率传感器的使用很好地揭示了水是弱电解质这一事实。25℃时,水的离子积常数Kw=lxl0-'4,水中c(H+)=c(OH一)=1X10-7 mol/L,查表得纯水的电导率为5.5X10-6S/m[7],事实上,水的电导率小于1X10 -4 S/m就认为是很纯的了,有时称为“电导水”,若大于这个数值,肯定含有某种杂质。[7]本实验中蒸馏水的电导率为0.014 mS/cm,可能是由于实验温度高于室温以及水中溶解极少量二氧化碳或残存少量杂质离子所导致。
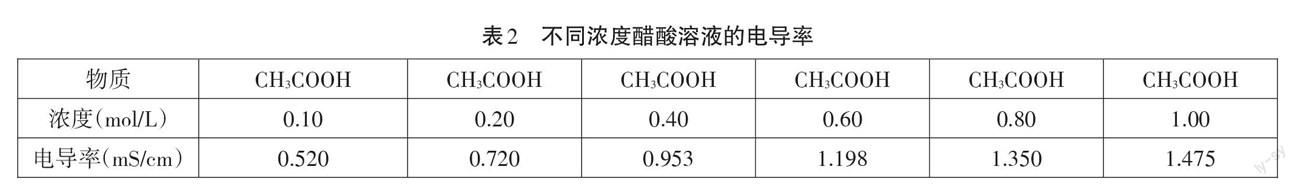
2.分别测定0.1 mol/L、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L醋酸溶液的电导率。
本实验适用于弱电解质的电离平衡模块。由表2实验结果可知,1.0 mol/L醋酸溶液的电导率远小于0.1 mol/L醋酸溶液电导率的十倍(大约三倍左右),说明水的加入促使醋酸分子的电离平衡右移,经过定量计算,还可以证明电离平衡常数在稀释过程中保持恒定。
在醋酸溶液中,存在醋酸分子的电离平衡,由于水的电离极其微弱,可忽略水的电离,而将溶液的导电性归因于醋酸分子电离出的H+以及CH3COO(实际上是水合H+与水合CH3COO),在高中阶段,可认为溶液某离子所产生的电导率正比于其溶液中的离子浓度。对于实验条件下的醋酸溶液,忽略水的电离,则有
c( H+)≈c(CH3COO-)oc σ
即σ= kc(离子)
而醋酸分子电离微弱,资料表明,常温下0.1 mol/L醋酸溶液的电离度仅约为1.3%,因此醋酸分子的浓度可近似为溶液的表观浓度。因此对于不同浓度的醋酸溶液,其电离平衡常数的比值就近似为电导率的平方除以溶液的表观浓度的比值,其表达式如下:
如果依据以上推导,电导率的平方除以溶液表观浓度的值应该是一个常数。但是在对实验中的电导率的平方除以溶液表观浓度的值对溶液的表观浓度作图后却发现,如图2所示,电导率的平方除以溶液表观浓度的值对溶液的表观浓度变化呈现出良好的线性关系,但却不是常数,而是随着溶液浓度升高而比值降低。同时我们也应该注意到,在上述电离平衡常数比值计算中,0.96距离1也还是存在一些偏差。一方面,溶液浓度的变化影响醋酸分子的电离程度,进而导致醋酸分子的浓度与溶液的表观浓度发生偏差,同时,醋酸溶液稀释到一定程度时,水的电离就不能忽略;另一方面,H+以及CH3COO-对电导率的贡献实际并不相同,进而导致曲线随着溶液浓度升高而呈现下降的趋势。
3.分别测定0.1 mol/L盐酸溶液、0.1 mol/L NaCl溶液以及0.1 mol/L KCl溶液的电导率。
本实验可作为一个探究实验,引发学生的进一步思考。在高中生的认知里,在温度等外界条件相同时,溶液的导电性只与溶液中离子浓度以及离子所带电荷数相关,对于相同浓度的盐酸溶液、NaCl溶液以及KCl溶液而言,由于是强电解质,三者在水溶液中完全电离,所带电荷数也相同,其导电能力应该相同,但是从实验获得的电导率数据来看,如表3所示,同等条件下,三者的电导率相差较大且σ(HCl)>σ(KCl)>σ( NaCl),这说明不同离子在水溶液中的导电能力是不同的,进而涉及到溶液中离子的电迁移率及其相关影响因素等若干问题。
对于同等浓度的NaCl溶液和KCl溶液而言,电导率的差异可归因于Na+和K+不同的电迁移率。在水溶液中,二者均以水合离子的形式存在,在同主族离子中,随着原子序数增加,離子半径逐渐增大,通常会使其吸附水分子的能力逐渐减弱,导致其水合离子的半径逐渐减小,因此,K+的水合离子半径小于Na+的水合离子半径,在外加电场的水溶液中迁移时,K+所受阻碍更小,电迁移率更大。同时我们应注意到,同等条件下,0.1 mol/L盐酸溶液的电导率远远大于同等浓度NaCl溶液以及KCl溶液的电导率,这是由于H+特殊的传导电流方式造成的。在溶液中,离子通过在电场下的定向移动以及在阴阳电极的得失电子完成电流的传导,而H+在溶液中主要依靠一种质子传递机理(Grotthuss机理)传导电流,离子本身并未长程移动,而是依靠氢键在相邻水分子之间链式传递,如图3所示,其效果如同H+以很高的速率迁移一样,因此具有很高的电迁移率[7]。此处向学生引出电迁移率的概念,引发学生更多的思考与探究。实际上,对于实验2中的醋酸溶液,由于H+与CH3COO-的电迁移率相差较大,溶液的电导率主要由H+贡献,但是由于溶液中c(H+)≈c(CH3COO-),因此不会对电离平衡常数的计算造成影响。
四、总结与展望
本文利用电导率传感器围绕电解质的相关知识开展了系列定量实验:实验1夯实基础,以更加直观的视角加深学生对电解质相关概念的理解;实验2突破难点,通过具体的数值计算,验证弱电解质电离平衡常数在稀释过程中保持恒定,培养学生的定量思维;实验3拓展探究,通过学生意料之外的实验现象激发学生的求知欲望,培养学生的科学探究精神。在实验设计上,秉承由浅人深、由易到难的原则,层层推进,逐步深入,既适应学生的学习规律,又使学生的学科素养得以提升。
笔者认为,利用电导率传感器还可以做出更多的探索:例如利用电导率传感器探究离子反应的条件,探究弱电解质电离平衡的影响因素,探究难溶电解质的沉淀溶解平衡等。这些实验不仅仅适合教师科研,更适合走进课堂,走进学生,让学生手脑并用,体验探索的乐趣,体会与时俱进的实验手段下愈发迷人的化学。
参考文献
[1] 中华人民共和国教育部普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018.
[2]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书(化学必修第一册)[M].北京:人民教育出版社,2020.
[3]人民教育出版社,课程教材研究所,化学课程教材研究开发中心,普通高中教科书(化学选择性必修1)[M].北京:人民教育出版社,2020.
[4] 白涛.基于手持技术和多媒体技术的“电离平衡”教学研究[J].化学教育,2010(3):78-80.
[5]邓玉华,杜丽君.数字化实验在化学核心素养“宏观辨识与微观探析”维度的教学应用——以弱电解质的教学为例[J]化学教育,2019(21):77-81.
[6] 顾仲良.技术支持下多方位探究离子浓度的教学设计——以“弱电解质的电离平衡”为例[J].中小学数字化教学,2022(2):11-14.
[7] 印永嘉.物理化学简明教程[M].北京:高等教育出版社,2007.
