基于数字化实验发展证据推理与模型认知的教学设计
2022-05-30宋蕊
宋蕊

摘要:学生“证据推理与模型认知”学科核心素养的培养,需要创设真实的探究情境,让学生从各种途径收集大量的信息、数据、图表等,进行证据的推理与模型的构建。数字化实验可弥补传统定性实验的某些不足,提供丰富的信息与数据。本文以“氢氧化铝的两性”教学为例,进行了基于数字化实验发展证据推理与模型认知的教学设计。
关键词:证据推理与模型认知;数字化实验;氢氧化铝的两性
文章编号:1008-0546( 2022)12x-0029-05
中图分类号:C632.41
文獻标识码:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.007
一、设计思想
《普通高中化学课程标准(2017年版)》提出发展学生化学学科核心素养的要求,化学学科核心素养之一“证据推理与模型认知”是一种高级思维活动,证据推理要求学生具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。模型认知是证据推理基础上的进阶模式,学生通过建立认知模型,运用模型解释化学现象,揭示现象的本质和规律。[1]
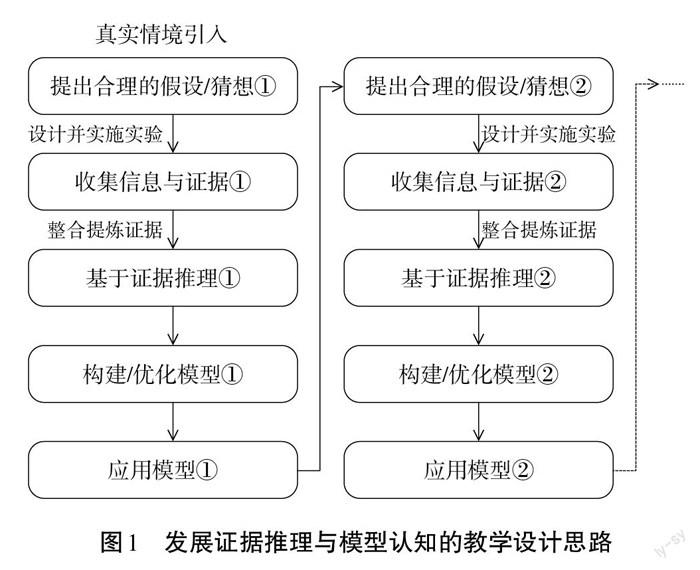
发展证据推理与模型认知需要为学生创设真实的探究情境,通过让学生从各种途径收集大量的信息、数据、图表等,将信息和学科知识有效整合在一起,并运用已有的知识进行基于证据的推理。在证据推理的基础上,学生构建认知模型,或优化已有的认知模型,最后运用模型解决实际问题、或利用模型解释化学现象。故发展证据推理与模型认知的教学模式有五个重要模块:提出合理的假设/猜想、收集信息与证据、基于证据推理、构建/优化模型、应用模型。五个模块并非孤立存在,而是互相联系、不断循环、螺旋上升式的关系。[2]
如图1所示,教学通过循环上升的五个模块,不断提出更高阶的问题与假设,在过程中不断发展学生证据推理能力,并在螺旋上升的过程中不断优化学生认知模型。在“氢氧化铝的两性”教学中,学生的氢氧化铝溶解模型从“氢氧化铝与强酸、强碱反应的定性认识”到“氢氧化铝是否完全溶解取决于pH的范围”,再到“重新从定量角度认识为何氢氧化铝与强酸、强碱反应”,学生关于氢氧化铝溶解的模型构建经历了若干阶段。
数字化实验是由数据采集器和传感器组成的定量采集数据的实验系统,数字化实验可以将不易观察到的实验现象用数据、图表等方式呈现,通过数字化实验进行定量实验探究,可进一步发展学生阅读图表信息,分析定量数据,理解实验现象的能力;还可以帮助学生基于数据进行证据推理,构建新的认知模型,促进对化学反应定性到定量的认识。[3]
二、“氢氧化铝的两性”教学设计
1.教学内容与学情分析
该教学内容为沪科版《化学高二》8.2“铝和铝合金的崛起”的重要组分。此前,学生已学习了氢氧化铝溶于强酸与强碱,对氢氧化铝的溶解性有定性的认识,还学习了强弱电解质、影响电离平衡移动的因素、水的电离与pH等相关知识。学生对氢氧化铝与酸和碱的定性反应已经掌握,但是仅停留在简单记忆,对于“氢氧化铝在酸和碱中的溶解受什么影响?”“为何氢氧化铝不溶于弱酸、弱碱?”等问题不能从本质上理解。故本节课从定量实验的角度帮助学生建立对氢氧化铝两性更加准确的认识,构建氢氧化铝在酸和碱中溶解的模型、氢氧化铝在不同酸碱条件下的存在形式模型;并通过本节课深化对电离平衡移动影响因素的认识,感受化学反应从量变到质变的过程,也重新认识强酸弱酸、强碱弱碱的本质差异。[4-6]
2.教学目标
(1)通过实验探究,基于实验事实进行分析推理,结合电离平衡移动原理解释Al(OH)3在不同酸中溶解性差异的本质原因;
(2)通过实验探究,了解Al(OH)3在酸中的溶解存在量变到质变的变化过程,并初步建立Al(OH)3在酸中的溶解模型;
(3)通过对定量实验的数据分析,完善Al(OH)3溶解与pH的关系模型;
(4)应用Al(OH),溶解与pH的关系模型解决问题。
3.教学环节
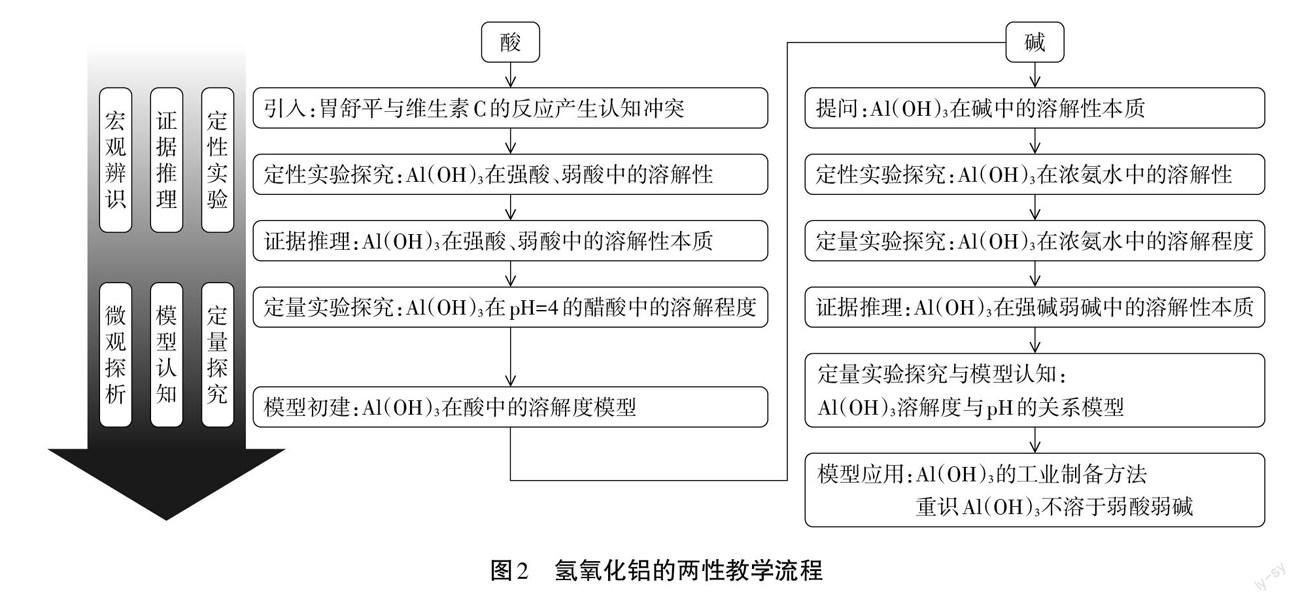
本节课的教学内容共三大部分:从定性与定量的角度再认识氢氧化铝和酸、碱的反应;通过数字化实验从宏微结合的角度了解氢氧化铝和酸、碱反应的实质;深化对氢氧化铝化学性质反应原理的模型构建与认知。如图2所示,本节课以Al(OH)3在酸和碱中溶解性为骨架,设计真实情境,产生认知冲突。学生在体验定性实验探究和肉眼观察的局限性后,基于证据分析推理进行数字化定量实验设计,通过实验数据认识Al(OH)3在酸和碱中溶解的本质,实现从对物质间化学反应的宏观认知到微观原理的探析。
在理解Al(OH)3的溶解本质基础上探究Al( OH)3在哪些pH范围内才能完全溶解,学生通过数字化定量实验设计、分析实验数据,认识氢氧化铝在不同pH环境中的存在形式,并发掘实验数据,运用氢氧化铝的溶解本质解释该实验数据图与高中阶段常见沉淀质量与NaOH体积关系图的偏差。最后结合实验结果与不同酸碱的pH数据,重新认识教材中Al(OH),溶于强酸、强碱,从对化学反应的定性认识与机械记忆,转变为对化学反应变化的本质与平衡对化学反应量变到质变的影响;体会对强酸弱酸、强碱弱碱对体系pH的影响程度,重新认识强弱电解质。
三、“氢氧化铝的两性”数字化实验设计
1.数字化实验一:Al(OH),在弱酸、弱碱中的溶解程度
(1)数字化实验设计思路
由于AI(OH)3在弱酸弱碱中不能完全溶解,肉眼无法判断反应是否有发生,本实验引入数字化实验,利用溶液中离子浓度增大电导率增大的原理,使用电导率传感器进行数字化实验,用数字与曲线表征实验事实,促进学生对Al(OH)3溶解本质的理解。设计Al(OH)3固体和醋酸、氨水反应的数字化实验,探究影响Al( OH)3溶解程度的本质原因。用等初始电导率的氯化钠溶液和Al(OH)3固体作为对照组,排除Al(OH)3自身溶解对电导率的影响。
(2)数字化实验仪器与药品
实验仪器:50mL烧杯、磁力搅拌器、Vernier电导率传感器、Vernier数据采集器、铁架台。
药品:pH=4醋酸溶液、Al(OH)3固体、与pH=4的醋酸电导率相同的NaCl溶液。
仪器设计如图3所示。
2.数字化实验二:Al(OH),溶解度与pH的关系模型探究
(1)数字化实验设计思路
利用数字化实验,通过pH探头测定向硫酸酸化的硫酸铝溶液中逐步滴加NaOH溶液的pH变化,观测Al(OH)3开始沉淀、沉淀最大与完全溶解的pH。
学生通过观察发现,利用肉眼无法准确观察沉淀开始、沉淀最大与沉淀消失的准确节点。故对实验装置进行优化,利用感光度大小特征沉淀的量,从而得到Al(OH)3开始产生沉淀、沉淀完全、沉淀开始溶解和沉淀完全溶解对应的pH,根据数据得到Al(OH)3在不同pH下的存在状态,建立Al(OH),溶解模型。培养学生利用数字化实验进行实验探究、优化实验设计的能力。
通过挖掘本实验的数据,引导学生利用本节课所学知识,从Al(OH)3在不同酸碱性环境中的反应实质,解释该实验数据图与高中阶段常见沉淀质量与氢氧化钠体积关系图的偏差:①恰好完全沉淀到完全溶解需要继续滴加NaOH溶液提高溶液环境pH;②产生沉淀与沉淀溶解所需的NaOH溶液体积比并非3:1,有部分NaOH溶液用于提高体系的环境pH。学生利用直观的数据,解释为何通常認为“Al(OH)3不溶于弱酸、弱碱”,重新从定量角度认识Al(OH)3不溶于弱酸、弱碱,感受强酸强碱对体系pH的影响。
(2)数字化实验仪器与药品
实验仪器:50 mL烧杯、磁力搅拌器、Vernier pH传感器、Vernier滴数传感器、Vernier光传感器、台灯、Vernier数据采集器、铁架台。
药品:0.1 mol/L Al2(SO4)3溶液、1.0 mol/L NaOH溶液、稀H2S04溶液。
仪器设计如图4所示。
四、“氢氧化铝的两性”教学片段
1.创设情境产生疑问
[引入]老王最近胃疼和牙龈疼,吃了药没好,就医后知道胃舒平和维生素C不能同时服用,药效会抵消的。请同学们根据信息猜测在这个过程中可能发生什么,理由是什么?
[学生]维生素有酸性,有可能发生了酸碱中和反应。
[教师]但是维生素C是弱酸,Al(OH)3能溶于哪种酸呢?
[学生]强酸。
[教师lAl(OH)3能溶于弱酸吗?我们可以进行实验探究。请同学们探究Al(OH),在pH=4的稀盐酸、pH=4的醋酸、pH=2.4的醋酸中的溶解程度。
[学生]Al(OH),在pH=2.4的醋酸中完全溶解了,在pH=4的盐酸和醋酸中有一点溶解。
2.定量实验探究-Al(OH)3能否溶于弱酸和弱碱
[教师]肉眼观察沉淀的变化有局限性,但通过实验,同学们认为影响Al(OH)3在不同酸中的溶解程度的因素是什么?
[学生]pH越小,溶液中氢离子浓度越大,促进Al(OH)3的碱式电离平衡向正向移动。
[教师]在pH=4的酸中是否有溶解用肉眼无法准确判断,可以利用数字化实验,常见的数字化实验传感器有电导率、浊度计、感光度计等等,同学们认为哪种传感器用来测量Al(OH)3是否有溶解更好呢?
[学生]电导率也可以,因为溶解后离子浓度会变大;浊度计也可以;感光度计也可以。
[教师]老师这里使用了电导率传感器进行实验,将Al(OH)3固体加入pH=4的醋酸溶液中,请同学们观察数据变化。
[学生仔细观察]起始是26.3 μS/cm,加入Al(OH),固体后逐渐增大,然后逐渐平稳,最终电导率达到286.5 μS/cm,电导率增大了,说明溶液中离子浓度增大了。
[教师]哪些行为会使得离子浓度增大呢?是Al( OH)3溶解的电离,还是电离平衡移动呢?
[学生]都有可能,需要设计对照试验,把Al(OH),固体溶解在水中,测量电导率。
[教师]电导率虽然会随着离子浓度的增大而增大,但随着浓度的增加,电导率增加的幅度变小。如果初始电导率不同,电导率增大的幅度也是不同的,怎么办?
[学生]使用电导率相同的溶液,但是这个溶液不可以和Al(OH)3反应,比如氯化钠溶液。
[教师]非常好,那我们来观察Al(OH),固体加入相同电导率的氯化钠溶液中的电导率变化。
[学生仔细观察]起始是26.3μS/cm,加入Al(OH),固体后逐渐增大,然后逐渐平稳,最终电导率达到244.4 μS/cm,电导率也增大了,但是没有在醋酸中多。所以Al(OH)。在pH=4的醋酸中是可以部分溶解的。
[教师]Al(OH)3在酸中的溶解程度由pH的大小决定,Al(OH)3还存在酸式电离,可以溶于碱,Al(OH),真的只能溶于强碱吗?
[学生]也许弱碱的pH够大,Al(OH)3就可以溶解,因为氢氧根离子浓度越大,越能够促进Al(OH)3的酸式电离正向移动。可以用浓氨水进行刚才的数字化实验。
[教师]进行Al(OH)3与氨水的导电率实验演示,证明Al(OH)3也可部分溶解在氨水中。
3.构建Al(OH)3的溶解模型
[教师]Al(OH)3究竟在多大pH的酸碱中才能够溶解呢?在探究前,请同学们思考下列问题,向含有少量硫酸的Al2(SO4)3溶液中逐滴滴加NaOH溶液,随着NaOH溶液体积的增加,溶液中的沉淀如何变化?请绘制在如下坐标系中。
[学生思考并绘制]如图5所示。
[教师]如果想测定Al(OH)3恰好在酸中和碱中完全溶解的pH,应该测量哪个节点的pH。
[学生]沉淀刚好产生的pH是在酸中完全溶解的pH,刚好完全溶解pH是在碱中完全溶解的pH。
[教师]老师利用数字化实验,向含有少量硫酸的Al2(SO4)3溶液中逐滴滴加NaOH溶液,同时测定pH,请同学们仔细观察,并记录你需要的数据。同时老师也想知道沉淀最大时的pH,请同学们观察。
[学生]在pH大概为3时开始产生沉淀,到pH大概为13时沉淀消失,但是沉淀最大点很难看清楚。
[教师]无法用肉眼观察清楚,怎么办呢?
[学生]借助数字化实验仪器。
[教师]在刚刚给同学们介绍的传感器中有一个感光度的传感器,可以测量光的强度,透光率越高,则溶液越澄清,反之越浑浊,请同学们仔细观察实验现象,并根据感光度曲线判断各节点的pH。
[学生]开始沉淀大约为3,沉淀完全溶解大约为13,pH大约为5沉淀完全,pH大约为9沉淀开始溶解。
[教师]感光度的图像实際反应了沉淀的量,请同学们观察图像与我们之前绘制的m 沉淀/V NaOH图有何不同?
[学生]实际的图最高点并不是折线,有一段时间沉淀不变化。因为恰好完全沉淀到完全溶解需要继续滴加NaOH溶液提高溶液环境pH。产生沉淀与沉淀溶解所需的氢氧化钠体积比并非3:1,有一部分NaOH溶液用于提高溶液环境pH。
4.Al(OH)3的溶解模型应用
[教师]制取Al(OH)3不一定用铝离子与氨水反应来制取,我们可以通过调节其pH来制取,工业上制取Al(OH)3也会采取用在硫酸铝中滴加氢氧化钠,我们应将pH控制在哪个范围内呢?
[学生]5< pH<9
[教师]通过今天的学习,我们发现Al(OH)3的溶解程度实际取决于pH的大小,但是为何教材的结论为Al( OH),溶于强酸强碱呢?以下为弱酸、强酸的浓度及其对应的pH(略),请同学们判断Al(OH)3在这些酸碱中能否溶解,分析为何Al(OH)3溶于强酸强碱?
[学生]弱酸和弱碱很难达到完全溶解的pH范围,但是很稀的强酸和强碱却能做到。
[教师]化学反应是绝对的,但也是相对的,希望同学们对Al(OH)3的两性有新的认知。
五、教学反思
本节课通过层层探究Al(OH)3在酸和碱中的溶解程度,让学生体验收集证据,对Al(OH)3的性质提出可能的假设,基于证据进行分析推理,形成科学结论,分析定性实验现象、定量实验数据和物质性质来建立解决复杂化学问题的思维模型;引导学生从定性角度认识“Al(OH)3能溶解与不能溶解”,转变到定量角度认识“Al(OH)3溶解的量变到质变”,体会化学变化的绝对性与相对性,探析影响Al(OH)3溶解的本质因素。从定性角度认识“强酸与弱酸”,转变到定量角度体会强酸、弱酸对体系pH的影响能力。从定性角度认识Al(OH)3和酸、碱反应,转变到从酸碱性环境角度考虑物质的存在形态。通过实验数据优化Al(OH),溶解的模型,根据所学知识解释与传统模型的偏差。
参考文献
[1] 中华人民共和国教育部,普通高中化学课程标准(2017 版)[s].北京:人民教育出版社,2018.
[2] 陈稹天,侯丹,占小红.基于3DTG发展学生“证据推理与模型认知”核心素养——以“科学使用含氯消毒剂”为例[J].化学教学,2021(03):51-56.
[3]黄毓展,蔡立媚,钱扬义,基于数字化实验,落实“证据推理与模型认知”学科核心素养——以拓展探究复分解型离子反应发生条件的教学应用为例[J].化学教育(中英文),2021,42(15):51-57.
[4]林琳,江家发.基于化学学科核心素养的教学设计课例——对“氢氧化铝与氨水反应”的教学研究[J].化学教与学,2020(01):51-55+60.
[5] 吕善荣.利用pH传感器和光传感器探究氢氧化铝的两性[J].化学教学,2021(03):79-83.
[6] 李友银,石璞.铝盐与氢氧化钠反应生成氢氧化铝沉淀的实验探究[Jl.化学教育,2016,37(05):53-55.
