2种石房蛤毒素完全抗原交联方法的比较及多克隆抗体的制备
2022-05-30高烨宏赵学楠杨敏仪吴惠娟王荣智汪世华
陈 睿, 高烨宏, 赵学楠, 杨敏仪, 吴惠娟, 王荣智, 汪世华
生物农药与化学生物学教育部重点实验室,福建省病原真菌与真菌毒素重点实验室, 福建农林大学生命科学学院,福建 福州 350002
石房蛤毒素(saxitoxin, STX)是一种毒素极强的胍胺类神经毒素,为麻痹性贝类毒素(paratic shellfish position)的主要成分之一,该毒素主要来源于海水或淡水中的膝沟藻、海洋甲藻、淡水蓝藻等有害浮游生物,通过食物链积累于蛤类、贝类以及蟹类等水产中,哺乳动物食用了这些被污染后的水产后,会引发呼吸麻痹、死亡等一系列中毒反应(李淑冰等,2000)。STX对小鼠的半致死剂量LD50为10 μg·kg-1(陈常英等,1994)。STX在世界分布广泛,在我国的山东、福建、广东等地均发生过人类误食STX污染的水产品后引发的中毒事件(孔凡洲等,2007)。因此,渔业生产中亟需一种简便、快速、灵敏的STX检测方法。
目前,国际上用于检测贝类毒素的方法主要为理化分析法和生物测定法。理化分析法包括高效液相色谱法(high performance liquid chromatography, HPLC)、液相色谱(liquid chromatograph-mass spectrometer, LC-MS)、分光光度法、免疫化学法。其中,较常用的HPLC能精确测定毒素的种类和含量,但样品前处理较繁琐且需要昂贵的仪器(马燕玲,2013)。生物测定法包括小鼠生物测定法(mouse bioassay, MBA)、酶联免疫吸附测定法(enzyme-linked immunosorbnent assay, ELISA)、家蝇生物分析法(house-fly biassay)、蝗虫生物分析法(locust bioassay, LBA)、神经细胞生物分析法(neurional bioassay)等。其中,MBA是国际上较通用的方法,该方法方便、快捷且成本低廉,但测定结果受小鼠个体的影响较大,误差大、重现性差,不能分析样品中的具体组分;ELISA简便、快速、灵敏、成本低,同MBA及HPLC相比,更快速经济,以满足大批量样品快速筛查的需要(Zhietal.,2018)。目前,我国对STX的研究较少。本试验通过2种不同的方法,使用微量的STX制备了多种STX多克隆抗体,并采用酶联免疫分析对其效价进行比较,以期为商业化生产多克隆抗体提供数据支撑。
1 材料与方法
1.1 材料
1.1.1 试验动物 Balb/c小鼠(雌性6周龄)购买于吴氏实验动物贸易有限公司。
1.1.2 试剂 STX毒素标准品由台湾Algalchem公司提取,鸡卵清白蛋白(ovalbumin, OVA)购于源叶生物公司,牛血清白蛋白(bovine serum albumin, BSA)购于翊圣生物公司,钥孔血蓝蛋白(keyhole limpet hemocyanin, KLH)、高碘酸钠和硼氢化钠购于Macklin公司。弗氏完全佐剂(complete freunds adjuvant, CFA)和弗氏不完全佐剂(incomplete freunds adjuvant, IFA)购于SIGMA公司。N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)购于Aladdin公司。1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride, EDC)购于梯希爱(上海)化成工业发展有限公司,辣根过氧化物标记的山羊抗鼠IgG购于Bioss公司。
1.2 方法
1.2.1 完全抗原的制备及分析 EDC法:将0.09 mmol·L-1NHS和0.09 mmol·L-1EDC分别加入装有450 μL二甲基亚砜(dimethyl sulfoxide, DMSO)的1.5 mL EP管中,分别制备3管,用移液枪吹打溶解,并用锡纸包裹管身,分别加入50 μL STX标准品,固定于25 ℃恒温摇床中,转速120 r·min-1混合12 h。取出置于常温离心机中12000 r·min-1离心10 min,取上清备用。将20 mg的OVA、BSA、KLH蛋白分别溶于10 mL ddH2O中(pH6.5),并用NaHCO3缓冲液(0.5 mol·L-1,pH9.6)将pH调至7,最后每种蛋白取5 mL分装3个10 mL EP管中备用。将上清分别缓慢加入制备好的3种蛋白溶液中,固定于25 ℃恒温摇床中,转速120 r·min-1振荡12 h,取上清,按顺序用0.05 mol·L-1的(NH4)2CO3透析4 h,0.01 mol·L-1的(NH4)2CO3透析过夜,再换成新的0.01 mol·L-1的(NH4)2CO3透析4 h,最后ddH2O透析4 h,用PEG20000置于冰上浓缩至1~2 mL,置于-20 ℃保存(Meietal.,2019)。用琼脂糖凝胶电泳和紫外分光光度计分析。
高碘酸盐法:将5 mg的OVA、BSA、KLH蛋白分别溶于1 mL ddH2O中,用0.1 mol·L-1的乙酸将pH调至4.4。将含有6.9 mg高碘酸钠的0.3 mL ddH2O分别逐滴加入到配置好的蛋白溶液中,避光条件下反应1 h,接着用乙酸钠缓冲液(0.1 mol·L-1,pH4.4)透析,放置备用。将28 μL的STX加入到200 μL乙酸溶液(0.1 mol·L-1)中,混匀,分别制备3管,再分别加入到活化后的蛋白溶液中。用NaHCO3缓冲液(0.5 mol·L-1,pH9.6)将pH调至7.5。并在20 ℃条件下水浴1 h,分别加入0.1 mL NaBH4(4 mg·mL-1)。最后在4 ℃下孵育20 min,并分别用PBS透析3次,每次4 h,再用ddH2O透析4 h,用PEG20000置于冰上浓缩至1~2 mL,置于-20 ℃保存(Christineetal.,1995)。用琼脂糖凝胶电泳和紫外分光光度计分析。
1.2.2 试验小鼠的免疫 分别以EDC法和高碘酸盐法制备的STX-BSA、STX-KLH为免疫原,分别免疫6周龄健康的Balb/c雌性小鼠,共免疫3组。首次免疫,将200 μg的免疫原用PBS稀释至500 μL,与等体积500 μL的弗式完全佐剂混合,并用乳化仪乳化成乳浊液,在小鼠皮下多点注射(刘帅帅等,2011)。之后每隔14 d,将100 μg免疫原用400 μL的PBS稀释,再与等体积500 μL的弗式不完全佐剂混合,并用乳化仪乳化成乳浊液,在小鼠皮下多点注射。
1.2.3 多克隆血清的获取 间隔1~2个免疫周期,用扎取小鼠尾部静脉血管的方法,取小鼠尾部静脉血进行血清效价测定。待小鼠免疫7次后,摘小鼠眼球取血,取血完毕后脱臼处死(王月英等,2007)。取得的血液置于37 ℃恒温水浴锅中30 min,再于4 ℃冷冻离心机中,12000 r·min-1离心30 min。取上层血清,加入体积甘油混匀,置于-20 ℃保存。
1.2.4 ELISA检测多克隆抗体的效价 分别将EDC法和高碘酸盐法制备的STX-OVA为检测原,用包被缓冲液(pH9.6)稀释到10 mg·mL-1,在高效价的96孔酶标板上每孔加入100 μL,37 ℃孵育2 h。取出弃掉残液,拍干,每孔加入200 μL PBSM封闭液,4 ℃封闭过夜。取出弃掉封闭液,用PBS洗涤3次,拍干,再用PBST洗涤3次,拍干,放置于4 ℃冰箱备用。将多抗血清与PBSM按照1∶500、1∶1000、1∶2000、1∶4000、1∶8000、1∶16000、1∶32000、1∶64000的比例稀释混匀,每孔100 μL按顺序加入包有相应检测原的酶标孔中,将PBSM加入2孔包有检测原的酶标孔中为阴性对照。37 ℃孵育1 h,取出弃掉残液,洗板操作同上,再加入稀释比为1∶8000的HRP标记的山羊抗鼠IgG为二抗,每孔100 μL,37 ℃孵育1 h,取出弃掉残液,洗板操作同上,加入TMB显色液,37 ℃ 孵育15 min,加入2 mol·L-1的H2SO4终止液,每孔50 μL (Caietal.,2021)。用酶标仪测D450 nm的值,收集数据并分析。
1.2.5 2种抗原制备方法所制备出的抗原的差异比较 分别将EDC法和高碘酸盐法制备的STX-OVA用包被缓冲液(pH9.6)稀释到10 μg·mL-1作为包被原,在高效价的96孔酶标板上每孔加入100 μL,其后的操作同1.2.4。
2 结果与分析
2.1 完全抗原的制备及分析
2.1.1 EDC法制备完全抗原与分析 利用EDC法制备STX-BSA、STX-OVA和STX-KLH。将BSA与STX-BSA完全抗原和OVA与STX-OVA分别进行0.8%琼脂糖凝胶电泳和紫外光谱扫描分析。在琼脂糖凝胶电泳中,STX-BSA完全抗原与BSA蛋白相比,由于其分子质量更大,迁移率较低,说明成功制备了STX-BSA完全抗原。通过紫外分光光度计检测STX、BSA和STX-BSA完全抗原的光谱,STX-BSA完全抗原的波峰同BSA和STX的波峰相比,出现红移,佐证了STX-BSA完全抗原的成功制备(图1A、B)。图1C、D中,STX-OVA完全抗原的迁移率比OVA蛋白低,且STX-OVA完全抗原的波峰同OVA和STX的波峰相比,出现红移,说明STX-OVA成功制备。用同样的方法也成功制备了STX-KLH的交联物。
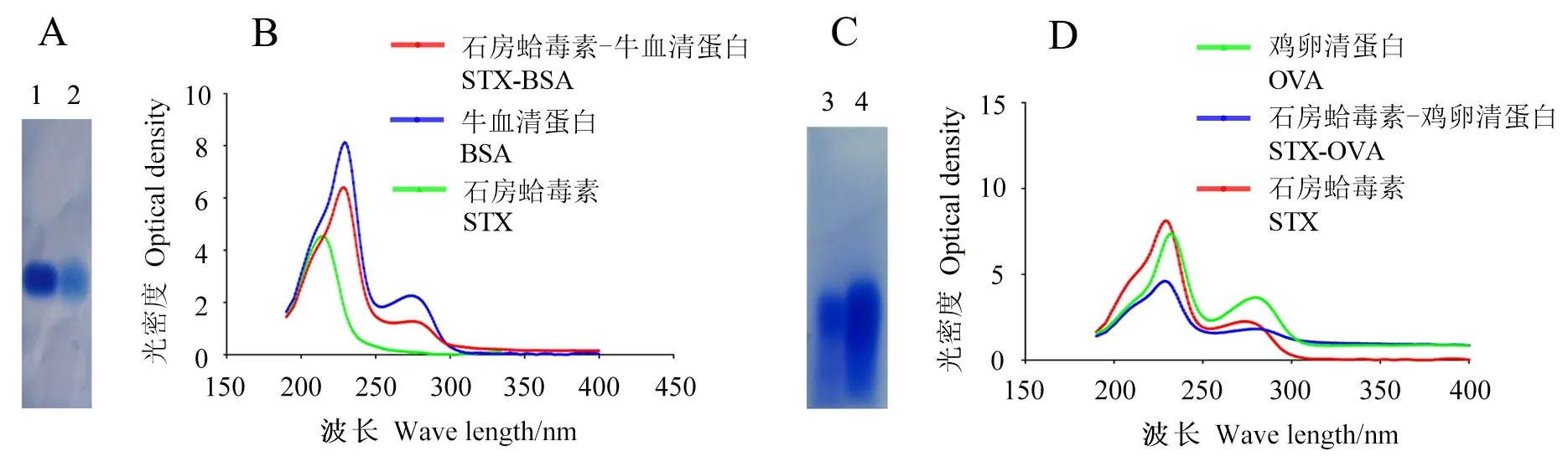
图1 EDC法交联STX的琼脂糖凝胶电泳和紫外光谱扫描Fig.1 Agrosegel electrophoresis and UV-vis analysis of STX conjugates by EDC A:泳道1为BSA,泳道2为STX-BSA交联产物;B:STX、BSA和STX-BSA交联产物紫外光谱扫描图; C:泳道3为OVA,泳道4为STX-OVA交联产物;D:STX、OVA和STX-OVA交联产物紫外光谱扫描图。 A: Lane 1 is BSA protein, lane 2 is STX-BSA conjugates; B: UV-vis analysis of STX, BSA and STX-BSA conjugate; C: Lane 3 is OVA protein, lane 4 is STX-OVA conjugates; D: UV-vis analysis of STX, OVA and STX-OVA conjugate.
2.1.2 高碘酸盐法制备完全抗原与分析 利用高碘酸盐法制备STX-BSA、STX-OVA和STX-KLH。将BSA与STX-BSA完全抗原分别和OVA与STX-OVA进行0.8%琼脂糖凝胶电泳和紫外光谱扫描分析。在琼脂糖凝胶电泳中,STX-BSA完全抗原与BSA蛋白相比,迁移率较低,说明成功制备STX-BSA完全抗原。通过紫外光谱扫描检测STX、BSA和STX-BSA完全抗原的光谱,STX-BSA完全抗原的波峰同BSA和STX的波峰相比,出现红移,说明STX-BSA完全抗原的成功制备(图2A、B)。图2C、D中,STX-OVA完全抗原的迁移率均比相应的蛋白载体低,且波峰均出现红移,说明STX-OVA完全抗原的成功制备。用同样方法也成功制备了STX-KLH的交联物。
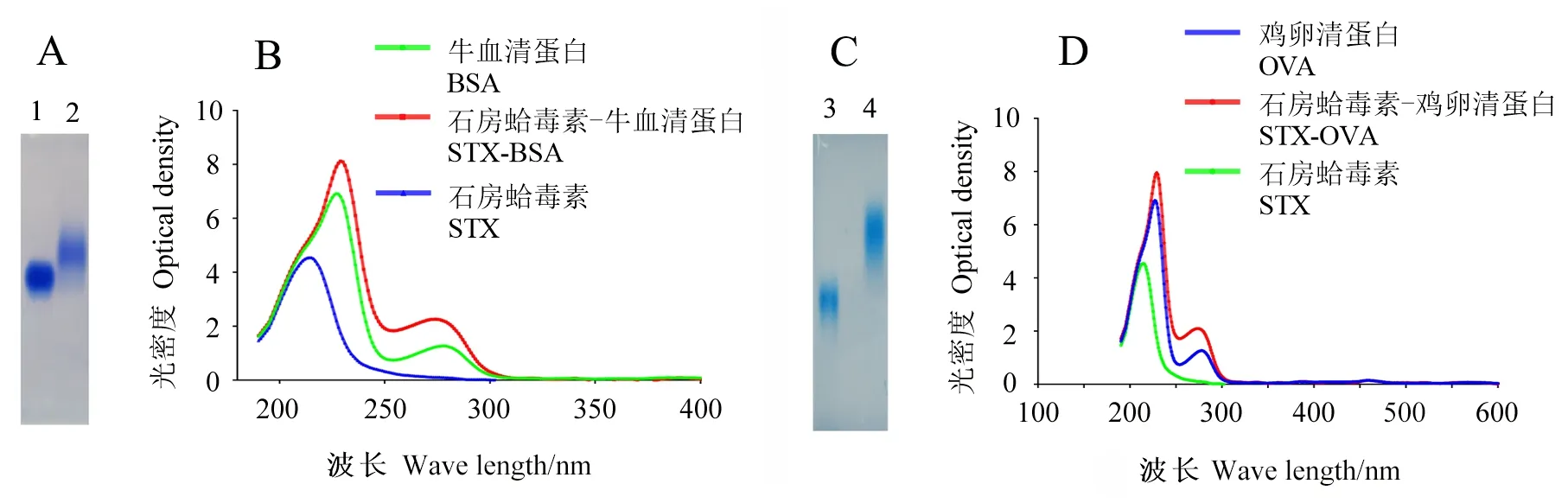
图2 高碘酸盐法交联STX的琼脂糖凝胶电泳和紫外光谱扫描Fig.2 Agrosegel electrophoresis and UV-vis analysis of STX conjugates by periodate reaction A:泳道1为BSA,泳道2为STX-BSA交联产物;B:STX、BSA和STX-BSA交联产物紫外光谱扫描图; C:泳道3为OVA,泳道4为STX-OVA交联产物;D:STX、OVA和STX-OVA交联产物紫外光谱扫描图。 A: Lane 1 is BSA protein, lane 2 is STX-BSA conjugates; B: UV-vis analysis of STX, BSA and STX-BSA conjugate; C: Lane 3 is OVA protein.Lane 4 is STX-OVA conjugates; D: UV-vis analysis of STX, OVA and STX-OVA conjugate.
2.2 多克隆抗体的效价测定
2.2.1 EDC法制备的完全抗原的效价测定 以STX-BSA和STX-KLH为免疫原,分别皮下免疫2只小鼠,得到多抗血清,进行ELISA试验,用酶标仪测效价。以STX-BSA为免疫原免疫小鼠,得血清效价图3A,1号小鼠的效价最为明显,血清滴度为1∶1000时,D450 nm为3.316;血清滴度为1∶8000时,D450 nm为0.06,获得较高效价。而2号小鼠在各血清滴度下,D450 nm均为0.050左右,故以EDC法制备的STX-BSA为免疫原进行皮下免疫的2只小鼠中,仅有1号小鼠能发生特异性免疫应答。以STX-KLH为免疫原免疫小鼠得血清效价图3B,1号小鼠与2号小鼠相比,能显示出效价梯度,但血清滴度为1∶500时,D450 nm仅为0.596,说明用EDC法制备的STX-KLH的完全抗原的效果并不理想。

图3 EDC法制备的抗原免疫小鼠血清效价测定Fig.3 The titer assay of anti-serum with EDC method A:以STX-BSA为免疫原;B:以STX-KLH为免疫原。 A: Immunogen is STX-BSA; B: Immunogen is STX-KLH.
2.2.2 高碘酸盐法制备的完全抗原的效价测定 分别以STX-BSA和STX-KLH为免疫原,皮下免疫3只小鼠,用STX-OVA作为检测原免疫小鼠得到多抗血清进行ELISA试验,用酶标仪测效价。以STX -BSA为免疫原免疫小鼠可得得血清效价图4A, 1 号和2号小鼠均随着血清滴度增加表现出明显的效价梯度:1号小鼠在血清滴度为1∶500 时,D450 nm为 0.882,获得 较高效价;2号小鼠在血清滴度为1∶500 时,D450 nm为0.452,血清滴度为1∶8000时,D450 nm为0.284,获得效价。3号小鼠在各血清滴度下,D450 nm均为0.050左右,说明3号小鼠没有发生特异性免疫反应。故以高碘酸盐法交联STX-BSA为免疫原进行皮下免疫的3只小鼠中,1号和2号小鼠均能发生特异性免疫应答,且1号小鼠多抗血清的效价较高。以STX-KLH为免疫原免疫小鼠得得血清效价图4B,3只小鼠均随着血清滴度增加表现出明显的效价梯度:1号小鼠在血清滴度为 1∶ 500 倍 时,D450 nm为 1.856,获得较高效价;2 号小鼠在血清 滴度为 1 ∶ 500时,D450 nm为 0.990,获得效价;3 号小鼠在血清滴度为 1∶ 500 时,D450 nm为 0.488,在血清滴度为1:8000时,D450 nm为0.076,具有效价。故以高碘酸盐法交联STX-KLH为免疫原进行皮下免疫的3只小鼠中,3只小鼠都发生特异性免疫应答,其中1号小鼠多抗血清的效价较高。
图4 高碘酸盐法制备的抗原免疫小鼠血清效价测定Fig.4 The titer assay of anti-serum with periodate reaction A:以STX-BSA为免疫原;B:以STX-KLH为免疫原。 A: Immunogen is STX-BSA; B: Immunogen is STX-KLH.
2.2.3 2种制备方法所制备出的免疫原的差异 由上述试验结果可知,EDC法和高碘酸盐法交联的STX-BSA和STX-KLH完全抗原均可作为免疫原引起小鼠的特异性免疫应答。比较这2种方法制备的完全抗原免疫小鼠后得到的多克隆抗体血清的效价差异,结果见表1。表中为免疫不同完全抗原后的4组小鼠与不同方法制备出的检测原进行ELISA试验,选取效价最高的1只进行分析,比对D450 nm为1时的多克隆抗体血清的稀释度。用EDC法交联的STX-BSA免疫小鼠获得多克隆抗体血清,与用EDC法交联的STX-OVA为检测原进行间接ELISA试验,测得D450 nm为1时的抗体稀释度最高,为4×103。此外,多克隆抗体血清对于不同交联方法制备出的检测原STX-OVA对多克隆抗体血清的检测效果相似,证明EDC法和高碘酸盐法制备出的STX-OVA交联产物可作为通用的检测原混用,同时证明这2种方法均能保留STX的主要结构。

表1 不同的多克隆抗体对于检测原的效价比较Table 1 Comparison of different polyclonal antibodies to titer of detective antigen
3 讨论
STX为小分子半抗原,分子质量为299 ku,在免疫反应中没有免疫原性,需要与分子质量大的载体蛋白交联制备成完全抗原才能进行免疫。常用的载体蛋白有OVA、BSA和KLH等。本试验仅用了少量的STX通过2种交联方法成功制备了6种STX的完全抗原,并通过免疫小鼠获得抗STX的多克隆抗体,对其进行了间接ELISA试验,比较了不同免疫原制备的多克隆抗体的差异。对比2种交联方法,EDC法先是通过EDC活化STX上的酰胺基团,接着NHS替换了活化后的酰胺基团,最让其与蛋白载体产生缩合反应,从而交联。高碘酸盐法中高碘酸钠为氧化剂,先将STX上的惰性羟基氧化为醛基形成中间产物,再通过硼氢化钠还原剂,除去多余高碘酸钠的同时,让中间产物与蛋白交联。2种方法的交联产物虽然在结构上略有差别,但制备的完全抗原均具有免疫原性,证明这2种交联方法并未影响STX的结构。通过对比交联出的免疫原所制备出的多克隆抗血清的效价发现,EDC法更具优势。
对比不同的蛋白载体,BSA来源于牛血清,为一种可溶性良好且稳定的一种蛋白载体。KLH来源于软体动物,与哺乳动物的亲缘性较远,试验发现,2种交联方法均能让STX与BSA载体蛋白交联,从而使免疫小鼠产生免疫应答,但是从免疫效果来看,与BSA交联的完全抗原能产生更高的效价,因此,BSA更适合作为STX的蛋白载体。
本试验的结果表明,在石房蛤毒素完全抗原的制备中,在交联方法的选择上,EDC法较高碘酸盐法更具优势;而在免疫原的选择上,STX-BSA完全抗原效果最好。该结果可为商业化批量生产STX多克隆抗体提供一定的数据支撑。
