红树林耐糖β-葡萄糖苷酶产生菌的分离鉴定及发酵条件优化
2022-05-30刘晓烜张海文石惠宇李连彬王学梅
■刘晓烜 孙 楠 张海文 石惠宇 李连彬 王学梅
(海南大学动物科技学院,海南 海口 570100)
β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21)能够水解β-1,4-糖苷键,从非还原端释放葡萄糖。它属于纤维素酶的一大类,是纤维素水解过程中的限速酶。近年来,许多研究报道了β-葡萄糖苷酶水解纤维素资源[1]、大豆苷[2-3]、染料木苷[4]、甜菊糖苷[5]等生物质的能力。
在纤维素水解过程中生成的葡萄糖会抑制β-葡萄糖苷酶活性,从而会负反馈抑制内切葡聚糖酶和外切葡聚糖酶的活性,阻碍纤维素的水解[6-7]。具有高耐受性的β-葡萄糖苷酶可以减弱葡萄糖对自身的抑制,然而自然界中存在的葡萄糖耐受型β-葡萄糖苷酶产量很低,很大程度上限制了该酶在工业上的应用[8]。因此,开发新的高产葡萄糖耐受型β-葡萄糖苷酶的菌株具有重要意义。红树林拥有丰富生物资源,林璐等[9]从海南演丰红树林国家自然保护区土壤中分离出325株真菌,包括木霉、曲霉和青霉等;Gao等[10]从红树林中分离到一种耐盐碱纤维素酶Cel5A;麦志茂等[11]通过宏基因组技术在海南红树林土壤中鉴定得到了两种β-葡萄糖苷酶。
本研究从海南东寨港红树林自然保护区土壤中分离到一株不需要特定碳源诱导产高葡萄糖耐受性β-葡萄糖苷酶的菌株,并通过响应面Plackett-Burman设计、最陡爬坡设计、Box-Behnken设计优化培养条件提高了其产酶水平,为β-葡萄糖苷酶的研究与应用提供理论基础和新的菌种来源。
1 材料与方法
1.1 材料
1.1.1 样品
在海口东寨港红树林选取腐殖质丰富的土壤作为样品点采集不同深度(5~20 cm)土壤, 从中筛选高产β-葡萄糖苷酶的菌株。
1.1.2 培养基及溶液配制
①富集培养基:CMC 10 g、CaCl20.3 g、(NH4)2SO41.4 g、MgSO4·7H2O 0.3 g、K2HPO4·3H2O 2.62 g、微量元素母液1 mL、水1 000 mL,121 ℃灭菌20 min。
②初筛培养基:CMC 10 g、NH4NO31 g、(NH4)2SO41 g、NaCl 0.5 g、琼脂20 g,121 ℃灭菌20 min,待冷却至60 ℃时加入1 mL氯霉素溶液。
③柠檬酸高铁铵-七叶苷琼脂培养基:CMC 10 g、蛋白胨1 g、FeSO4·5H2O 0.01 g、NaCl 0.5 g、七叶苷1 g、柠檬酸高铁铵2.5 g、水1 000 mL,121 ℃灭菌20 min。
④发酵培养基:微晶纤维素10 g、酵母提取物0.3 g、CaCl20.3 g、MgSO4·7H2O 0.3 g、K2HPO4·3H2O 2.62 g,加入500 mL McIlvaine 缓冲液,快速搅拌彻底溶解可溶成分,加入1 mL微量元素母液,用纯化水定容至1 000 mL,121 ℃灭菌20 min,备用。
⑤微量元素母液:FeSO4·7H2O 0.5 g、ZnSO4·7H2O 0.14 g、MnSO4·H2O 0.17 g、CoCl2·6H2O 0.287 g、水100 mL。
⑥McIlvaine 缓冲液:配制0.2 mol/L Na2HPO4和0.1 mol/L 柠檬酸溶液,用柠檬酸溶解加入Na2HPO4溶液中,直至pH为5.0。
1.2 ?产β-?葡萄糖苷酶菌株的筛选与鉴定
1.2.1 菌株的筛选
取10 g红树林源土样,置于90 mL灭菌ddH2O中振摇。静置后取10 mL上清液于三角瓶并加90 mL富集培养液,于28 ℃、180 r/min富集培养48 h。取10 mL富集培养液作梯度稀释后涂布于初筛平板上,28 ℃培养7 d。挑取生长单菌落进行划线分离,直至得到单一菌种。将分离得到的纯化菌株接种于七叶苷平板,每个菌株重复3次,28 ℃培养过夜,测量黑色沉淀圈直径。
选择上述沉淀圈较大的菌株接种于马铃薯葡萄糖琼脂(PDA)平板上,28 ℃培养7 d,挑取孢子制作孢子悬液,按1×105个/mL 接种量接种于发酵培养基,28 ℃、180 r/min 的发酵条件下培养7 d。取发酵液12 000 r/min离心15 min,收集上清液即粗酶液。取经过适当稀释后的上清液100 μL,加入100 μL 5 mmol/L对硝基苯-α-D-葡萄糖苷(pNPG)后于40 ℃反应10 min,加入600 μL 1 mol/L Na2CO3显色,采用煮沸10 min失活的粗酶液作为对照,于400 nm波长下测定吸光度值。
酶活单位U定义:每分钟产生1 μmol对硝基苯酚(pNP)所需要的酶量。
1.2.2 菌株的鉴定
形态学鉴定:观察菌落形态,并进行棉兰染色镜检。
分子学鉴定:提取菌株基因组,利用引物ITS1(TCCGTAGGTGAACCTGCGG)、ITS4(TCCTCCGCTTA TTGATATGC)扩增菌株ITS 序列,琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序。测序结果在NCBI进行BLAST比对。
1.3 聚多曲酶J1粗酶液β-葡萄糖苷酶的酶学性质研究
1.3.1 粗酶液制备
在单因素试验的基础上,将原发酵培养基中唯一碳源微晶纤维素改进为葡萄糖,并将培养基最终pH调整为7.0,孢子按1×107个/mL 接种量接种于发酵培养基,30 ℃、180 r/min 的发酵条件下培养7 d。取发酵液于4 ℃、12 000 r/min 离心15 min,收集上清液即粗酶液待测。
1.3.2 不同pH对β-葡萄糖苷酶酶活的影响
将粗酶液在pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0和9.0 条件下分别进行酶促反应,将90 μL 缓冲液和10 μL粗酶液混匀后孵育2 min,加入100 μL 5 mmol/L pNPG 在40 ℃反应10 min,反应完毕后加入600 μL 1 mol/L Na2CO3终止反应,测定OD400nm的吸光度,每个反应3个重复,将最高酶活定义为100%。
1.3.3 不同温度对β-葡萄糖苷酶酶活的影响
在相同pH条件下,取90 μL缓冲液和10 μL粗酶液混匀后加入100 μL 5 mmol/L pNPG,将混合液于30~90 ℃(间隔为10 ℃)条件下进行反应10 min,反应完毕后加入600 μL 1 mol/L Na2CO3终止反应,测定OD400nm的吸光度。每个反应3个重复,将最高酶活定义为100%。
1.3.4 不同浓度葡萄糖对β-葡萄糖苷酶酶活的影响
在最适酶反应条件下,测定粗酶液在葡萄糖终浓度分别为0、20、40、60、80、100、200、300、400 mmol/L和500 mmol/L 条件下的酶活,每个反应3 个重复,以葡萄糖浓度为0时酶活定义为100%。
1.4 响应面法优化发酵条件
1.4.1 Plackett-Burman设计法
Plackett-Burman设计可以通过较少的试验次数来快速筛选出具有显著效应的因子[12]。因此在单因素试验的基础上,以葡萄糖为唯一碳源,选取对发酵结果影响较大的7个因子进行筛选,包括:碳源浓度(A)、氮源浓度(B)、pH(D)、温度(G)、接种量(E)、转速(I)、装液量(K),以C、F、H、J为空项估计试验误差,每个因素取高低两个水平。设计12组测试,每组3个重复,响应值为β-葡萄糖苷酶酶活,以此筛选具有显著效应的因子。
1.4.2 最陡爬坡路径法
最陡爬坡路径法即在Plackett-Burman 基础上,进一步逼近最优区域进而确定Box-Behnken 设计的中心点[13]。根据Plackett-Burman设计的各因素水平及效应评价确定关键因子的爬坡方向及步长,测定发酵培养液中酶活变化趋势,确定关键因子的最优范围。
1.4.3 Box-Behnken试验设计
根据Plackett-Burman和最陡爬坡法试验结果,采用Box-Behnken中心组合设计了3因素3水平15个测试组,其中3个为中心复合点,进一步研究影响酶活关键因素的最佳水平,使用方差分析来确定显著的试验因素。采用Design-Expert 8.0 拟合试验数据,得到二次方程,分析主效应和交互效应,预测得到最优值。
1.4.4 验证试验
以最优条件进行验证,重复3 次平行试验,测定β-葡萄糖苷酶酶活的最佳值,以评估模型的可靠性,并确定优化条件。
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株的筛选(见表1)
由表1可知,在分离纯化后的13株菌株中观察到共有5株菌株产生明显黑色沉淀圈,编号J1~J5,进一步检测了这5 株菌株发酵7 d 后发酵液酶活,菌株J1的粗酶液酶活达到1.01 U/mL,最高。综合试验结果,选择J1作为后续发酵产酶菌株。

表1 七叶苷平板及摇瓶发酵筛选结果
2.1.2 目的菌株的鉴定(见图1)
对菌株J1 鉴定如图1,形态学见图1A,在PDA 平板上28 ℃培养7 d后直径约22 mm,质地为丝绒状至絮状、致密;颜色呈暗蓝灰绿色,间有淡褐色区域;有辐射形沟纹;具渗出液,褐色至暗褐色;分生孢子见图1B,其头球形为辐射形。
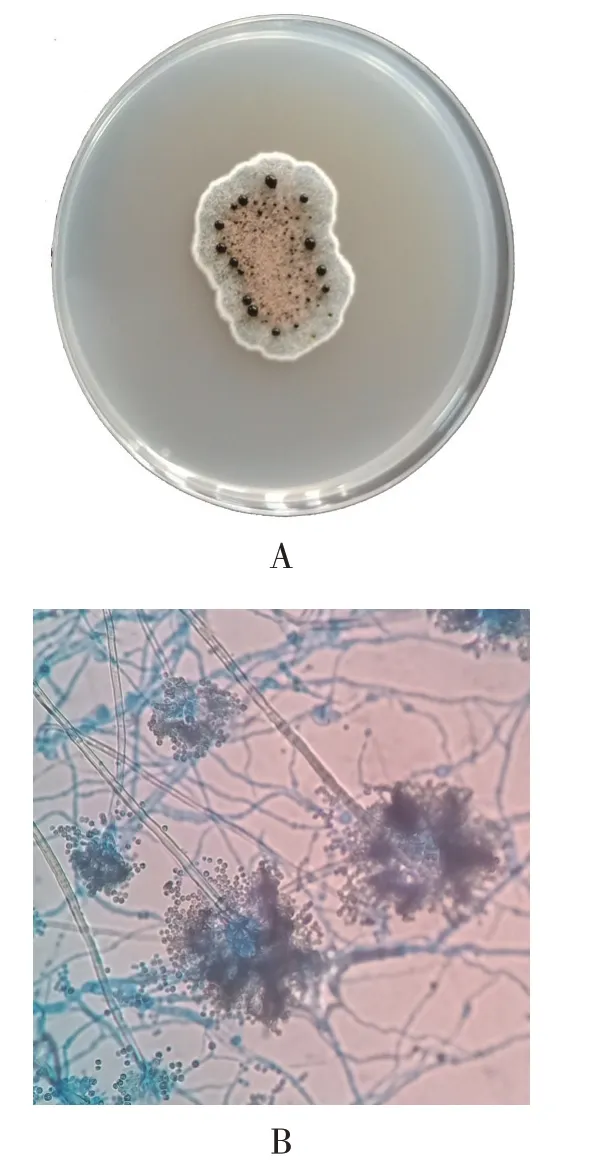
图1 菌株J1在PDA平板上的菌落形态及孢子形态
在NCBI 上进行BLAST 比对,结果表明J1与聚多曲霉的同源性为99.82%。结合菌株的形态学和分子生物学鉴定菌株J1为聚多曲霉。
2.2 聚多曲酶J1粗酶液中β-葡萄糖苷酶的酶学性质研究
2.2.1 不同pH 和温度对β-葡萄糖苷酶酶活的影响(见图2)
由图2可知,聚多曲酶J1粗酶液β-葡萄糖苷酶最适酶促反应pH为5,与大多数研究结果一致。推测粗酶液中存在多个β-葡萄糖苷酶组分,使得其在酸性和碱性条件下仍保留20%左右的相对酶活。聚多曲酶J1粗酶液β-葡萄糖苷酶最适酶促反应温度为60 ℃,由此可见聚多曲酶J1所产β-葡萄糖苷酶多为嗜温酶。其他文献中报道的红树林土壤来源的β-葡萄糖苷酶,如红树林土壤宏基因组文库中鉴定表达的Bgl1269最适pH为6.0,最适温度为40 ℃[14],同样从红树林土壤宏基因组文库中鉴定表达的r-mLBgl 最适pH 为7.0,最适温度为40 ℃[15]。一般来说,生物质酶促水解反应温度为30~50 ℃,其最适酶促反应温度为60 ℃意味着其可以在较高温度下进行酶水解反应,可以有效避免杂菌的污染。
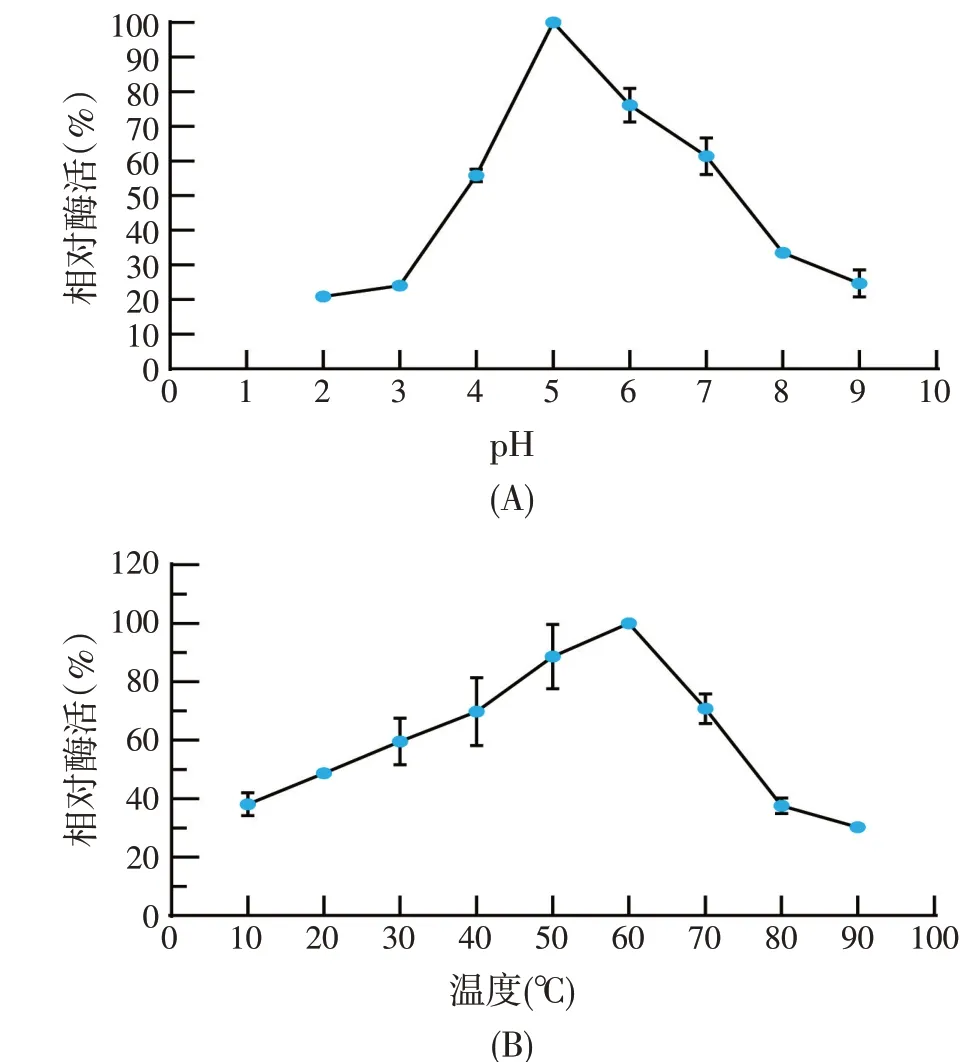
图2 pH和温度对酶活的影响
2.2.2 葡萄糖对β-葡萄糖苷酶酶活的影响(见图3)
纤维素资源转化为生物能源过程中产生的葡萄糖可以抑制纤维素水解并起到反馈抑制的作用。因为β-葡萄糖苷酶水解纤维二糖的β-1,4键,在糖化过程中积累的葡萄糖会导致β-葡萄糖苷酶的产物抑制,进而导致纤维二糖的积累和其他纤维素分解酶的抑制[16]。研究一般用葡萄糖抑制常数IC50来衡量β-葡萄糖苷酶的葡萄糖耐受性。聚多曲酶J1粗酶液β-葡萄糖苷酶葡萄糖耐受性试验结果如图3所示,在葡萄糖浓度为200 mmol/L时可保持49.3%活性,其IC50为178.5 mmol/L。有大量学者研究表明[17-20],曲霉属A.niger、A.foetidus、A.oryzae、A.japonicus等IC50在10~50 mmol/L不等。所以聚多曲酶J1具有产葡萄糖耐受性β-葡萄糖苷酶的潜力,值得进一步挖掘。
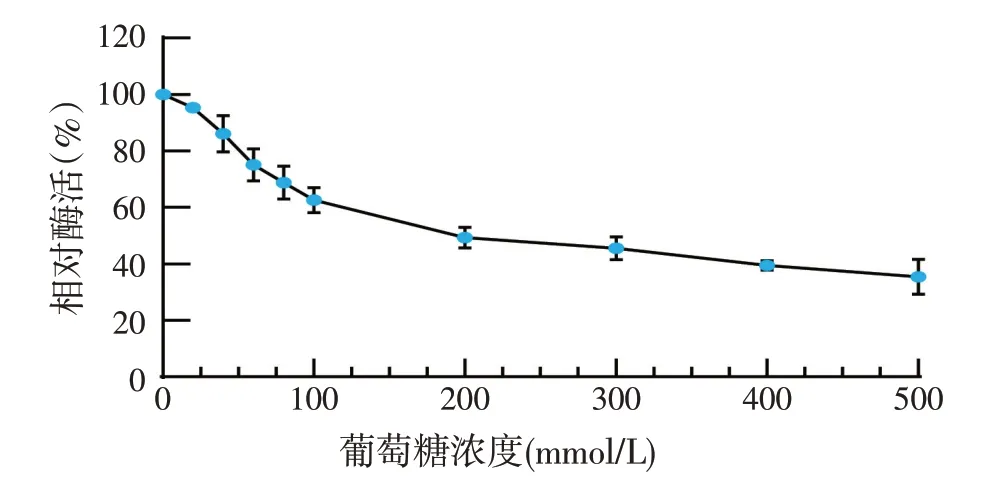
图3 葡萄糖耐受性
2.3 Plackett-Burman试验(见表2、表3)
通过Plackett-Burman 试验设计测定不同组合β-葡萄糖苷酶酶活结果见表2,各组酶活在0.426~1.367 U/mL 范围内,其中第2组酶活最高。对7个影响因素的效应评价如表3所示,氮源浓度、pH、接种量、转速这4因素为正效应,碳源浓度、温度和装液量这3个因素为负效应。其中pH(P=0.000 5)、温度(P=0.023 9)、接种量(P=0.039 8)3个因素的P值都小于0.05,表明这3个因素具有显著性,因此选取这3个因素进行爬坡试验。
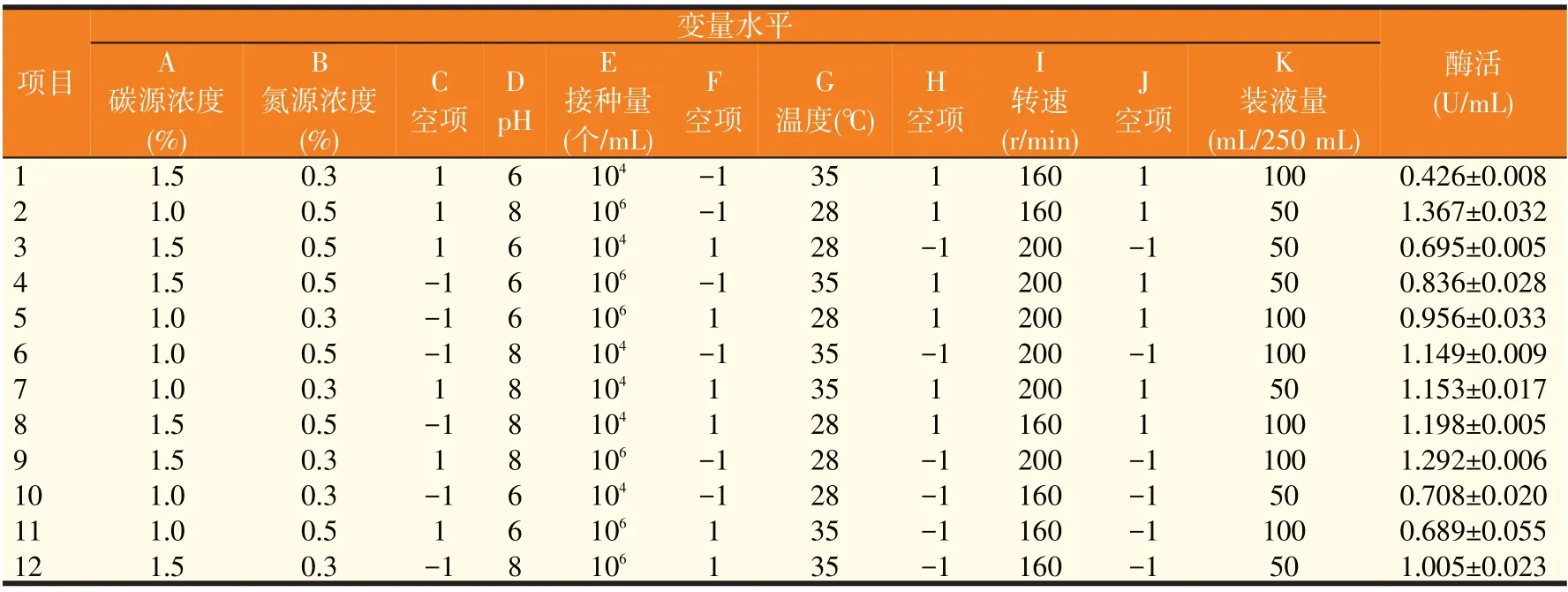
表2 Plackett-Burman试验设计及结果
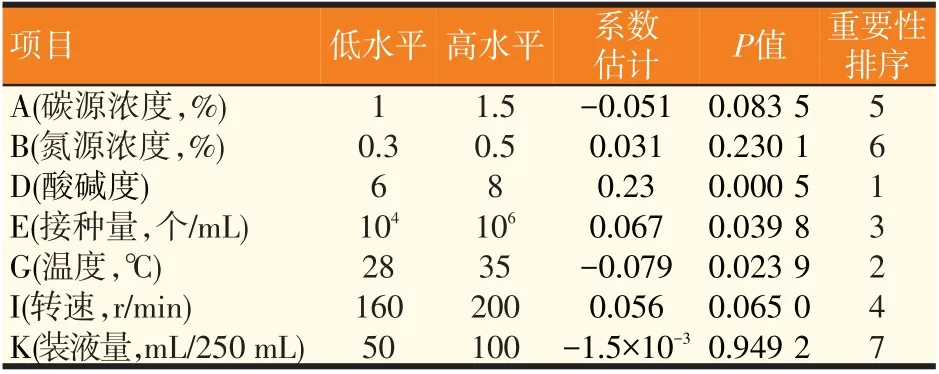
表3 Plackett-Burman设计的各因素水平及效应评价
2.4 最陡爬坡试验(见表4)

表4 最陡爬坡路径试验设计及结果
最陡上升路径分析表明,随着pH 和接种量的增加,温度的减少,酶活呈现先上升后下降的趋势。当pH为8.0、接种量1×106个/mL、温度28 ℃时,酶活达到最大,为这3 个因素的最大响应值区域,故Box-Behnken以第3组条件为中心点进行响应面分析。
2.5 Box-Behnken试验设计(见表5、表6)
根据Box-Behnken 试验设计确定显著因子的最优水平,试验设计及结果如表5所示,设计3因子3水平的响应面分析试验,中心点设置3 次重复,试验设计及结果分析如表6。由Design-Expert 8.05 软件进行回归分析得到多元回归模型:
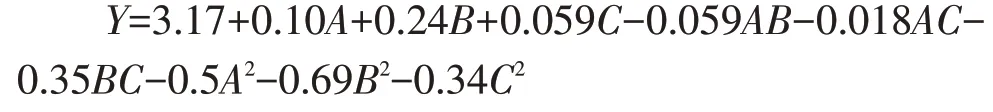
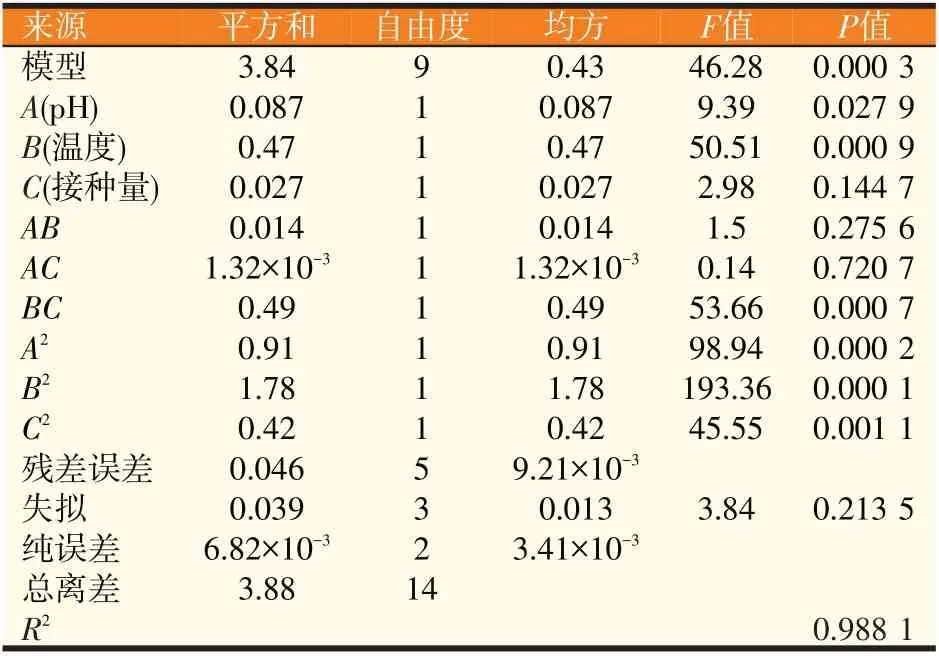
表5 回归模型的方差分析

表6 Box-Behnken设计因素水平和聚多曲霉J1 β-葡萄糖苷酶酶活
决定系数R2为0.988 1,说明回归方程的拟合较好,模型自变量和因变量之间存在显著线性关系。模型P值=0.000 3<0.05,表明此模型显著;失拟项P=0.213 5>0.05,表明模型与试验数据之间拟合度好,可用此模型在摇瓶水平预测聚多曲霉J1产β-葡萄糖苷酶的情况。
2.6 响应面结果分析(见图4)
由图4可知,当接种量不变时,随着pH增加和温度升高,β-葡萄糖苷酶酶活先增大后减小,表明在一定范围内,适当增加pH并提高发酵温度有利于菌株产酶,pH和温度交互作用响应面图坡度较陡且二维等高线图呈椭圆形,表明对β-葡萄糖苷酶酶活有显著的影响(图4A、B);当温度不变时,根据响应面图的坡度可以看出pH对β-葡萄糖苷酶酶活影响较大,pH和接种量交互作用等高线图呈圆形,表明其无显著交互作用(图4C、D);当pH不变时,根据响应面可以看到随接种量的增加酶活呈不断上升趋势,而随温度变化酶活先增大后减小,从等高线图容易看出,温度对酶活的影响显著(图4E、F)。
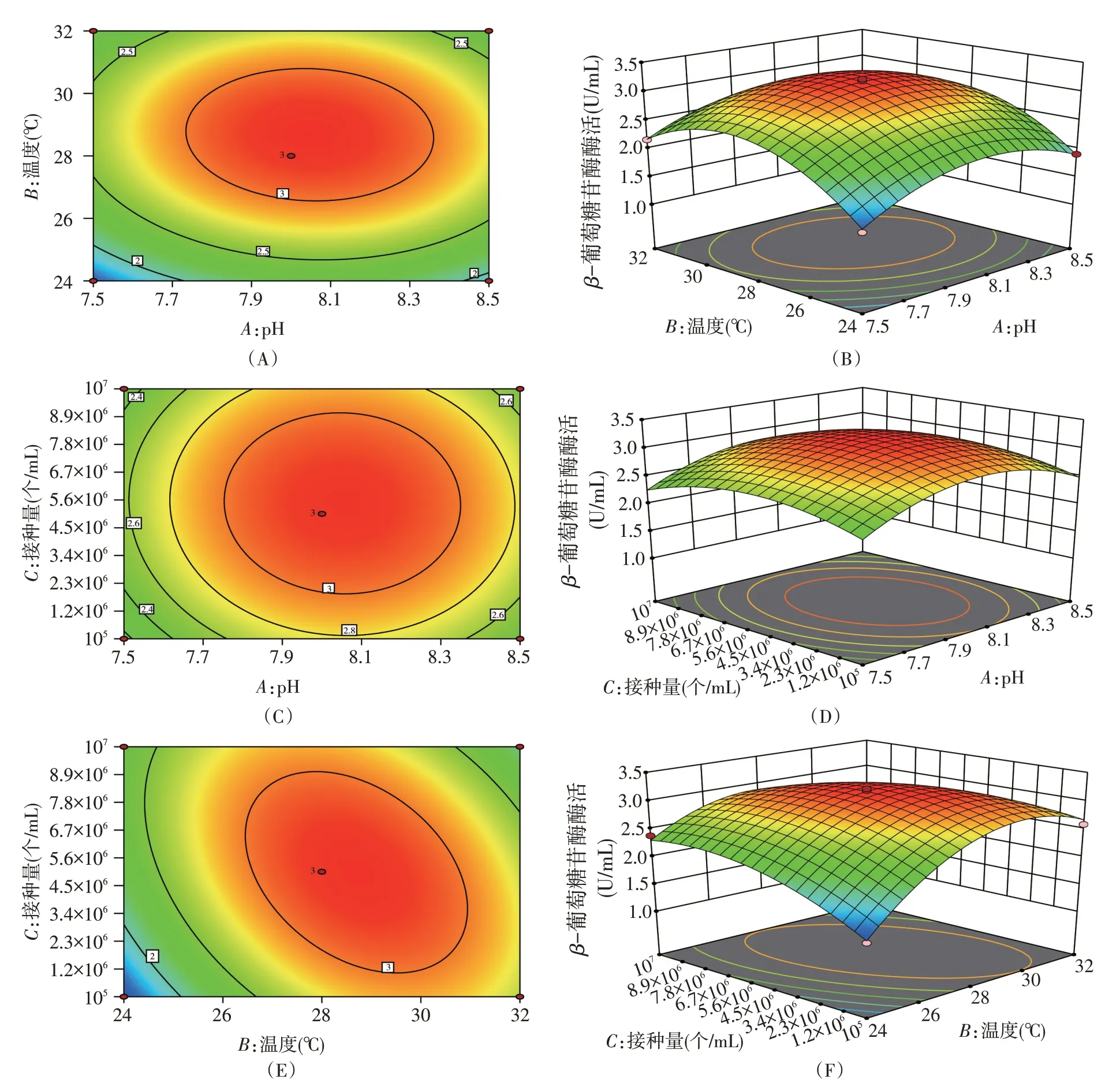
图4 两因素对β-葡萄糖苷酶酶活交互作用影响的等高线和响应面
2.7 模型验证
根据该模型,当培养温度28.7 ℃,初始pH 8.05,接种量5.02×106个/mL,预测的最大响应值为3.2 U/mL。预测相应比优化前提高了3倍。为了验证预测结果,我们在该优化条件下进行了3次平行试验,测得发酵液中β-葡萄糖苷酶酶活分别为3.37、3.28、3.26 U/mL,与预测值接近。优化后的聚多曲霉J1菌株发酵条件为:碳源1%、氮源0.5%、pH 8.05、接种量5.02×106个/mL、培养温度28.7 ℃、摇床转速160 r/min、装液量100 mL/250 mL。
3 讨论
红树林生态系统中蕴含着丰富的微生物资源,包括细菌、真菌等[21]。本研究利用七叶苷平板显色法[22]从红树林腐殖质土壤中筛选分离出一株具有高产β-葡萄糖苷酶的真菌,综合形态学与分子生物学鉴定[23]结果鉴定其为聚多曲霉。
传统上,商业化纤维素和经过处理的生物质被用作诱导纤维素酶的碳源,这是生产该类酶最好的方法[24],但底物通常很昂贵。所以,挖掘可以不受碳源诱导限制而能分泌高效的纤维素酶的生物可以很大程度上降低酶的成本。有研究报道,艾米斯托克篮状菌可以在不同碳源的培养基中生长并分泌较高水平的纤维素酶[25]。本研究发现聚多曲酶J1 可以在以葡萄糖为唯一碳源的培养基中分泌较高水平的β-葡萄糖苷酶,这种现象是特殊的,因为纤维素分解酶通常需要纤维素或其衍生物的诱导,而它们在水解过程中会受到水解最终产物葡萄糖的抑制[26],如Hanif等[27]研究表明葡萄糖的添加对纤维素酶的产生有抑制作用。
据报道,β-葡萄糖苷酶的差异性与培养基中提供的碳源有关[28],这可能是真菌对环境的一个适应,可以利用这一特性通过控制碳源从该菌株中选择性地表达所需的酶[24]。有研究表明大多数微生物β-葡萄糖苷酶对葡萄糖都很敏感[29],为了获得具有葡萄糖耐受性特性的酶,本研究以葡萄糖为唯一碳源对聚多曲酶J1进行发酵,结果表明粗酶液具有一定的葡萄糖耐受性。
工业生产中β-葡萄糖苷酶存在酶活低等问题,优化其产酶条件是解决该问题的重要途径之一[30]。已有研究表明固态发酵中涉及到的诱导机制较为复杂[31],碳源、氮源、接种量、温度和酸碱度等因素都会影响固态发酵条件下的产酶水平。Idris 等[32]利用响应面法对里氏木霉的发酵条件进行了优化,优化后酶活提高3.2倍。为进一步提高聚多曲酶J1产酶水平,通过响应面法优化其发酵条件,其中接种量、温度、pH显著影响了β-葡萄糖苷酶酶活。根据发酵中菌体形态及密度变化我们判断随着接种量超过5.05×106个/mL后产酶水平开始下降,可能是由于生长和生物量积累的增加,其中大部分资源用于菌体的生长而非用于产酶;温度过低或过高均会导致产酶量降低,可能是因为低温状态下菌体生长较为缓慢不利于产酶,而高温会影响酶的稳定性;初始pH 对产酶的影响可能是因为该菌株筛选自红树林深层土壤,其生长环境偏碱性,其最佳发酵初始pH为8.05,符合海水酸碱度。
4 结论
①研究从红树林土壤中筛选出一株不需要特定碳源诱导产β-葡萄糖苷酶的菌株J1,综合形态学和分子生物学鉴定为聚多曲酶。
②聚多曲酶J1可以产葡萄糖耐受性β-葡萄糖苷酶,该酶较好的葡萄糖耐受性使其具有潜在的应用价值与开发潜力。
③经响应面优化确定其产β-葡萄糖苷酶最佳发酵条件为碳源1%、氮源0.5%、pH 8.05、接种量5.02×106个/mL、培养温度28.7 ℃、摇床转速160 r/min、装液量100 mL/250 mL,优化后酶活提高了约3倍。
