改性粘土对虾夷扇贝(Mizuhopecten yessoensis)体内麻痹性贝毒的影响*
2022-05-30孟晓君宋秀贤宋维佳张培培申慧慧俞志明
孟晓君 宋秀贤① 张 悦 宋维佳张培培 申慧慧 俞志明
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 山东青岛 266071; 2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东青岛 266237; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心山东青岛 266071)
赤潮是一种全球性的海洋生态灾害, 近年来, 在世界各沿海国家频繁暴发, 严重制约海洋经济发展、威胁人类食品安全, 特别是有毒甲藻赤潮在世界范围内呈逐年增加的态势(Andersonet al, 2012; 唐赢中等,2016)。其中, 亚历山大藻(Alexandrium)是一种能够产生麻痹性贝毒(paralytic shellfish poisoning, PSP)的典型甲藻, 广泛分布于我国沿海。2002~2017 年间, 该藻在我国近海形成了24 次赤潮(梁玉波等, 2019)。2016上半年智利近海暴发的链状亚历山大藻(Alexandrium cantenella)和Pseudochattonella verruculosa赤潮, 造成智利的三文鱼年产量损失了12% (Mascareñoet al,2018)。频繁暴发的亚历山大藻赤潮不仅给养殖业带来巨大损失, 还会对人的生命造成威胁。当亚历山大藻赤潮暴发时, 贝类滤食藻细胞后可通过食物链将PSP 转移到人体, 严重时可导致人类中毒死亡(Briceljet al, 1998)。据统计, 全球范围内每年约发生2 000起PSP 中毒事件, 人员死亡率高达15% (Andersonet al, 2012)。因此, 寻求一种高效、安全的有毒赤潮防控方法尤为重要。
改性粘土治理赤潮主要是依靠粘土颗粒和赤潮生物间的有效碰撞与结合, 形成粘土-细胞絮凝体沉降至水体底部, 从而实现对水体中赤潮生物的有效去除。该方法具有操作简便、成本低、环境友好等优点, 是一种安全、高效的赤潮应急处置技术(俞志明等,2019)。改性粘土对多种赤潮生物具有理想的去除效果, 0.2 g/L MC I 对密度为1×104cells/mL 的太平洋亚历山大藻(Alexandriumpacificum) 3 h 去除率可达75%(Zhanget al, 2018)。Liu 等(2017)和Zhu 等(2018)研究发现, 改性粘土还会对残留赤潮藻细胞产生胁迫作用, 抑制赤潮再次暴发。另外, 以往研究表明, 适宜浓度的改性粘土在高效去除赤潮生物的同时, 对太平洋牡蛎(Crassostrea gigas)、仿刺参(Apostichopus japonicas Selenka)、虾夷扇贝(Mizuhopecten yessoensis)、硬壳蛤(Mercenaria mercenaria)、大西洋鲑(Salmo salar)等多种生物无不良影响(高咏卉等, 2007; 王志富等, 2014; 王梓瞳等, 2019; 张培培等, 2019)。
不同贝类对PSP 的累积和排出速率不同, 存在明显的种间差异, 通常相较于牡蛎和蛤类, 扇贝对PSP的累积毒性高, 排出慢(邱江兵, 2014)。因此, 扇贝更易受到亚历山大藻的影响, 造成PSP 在其体内的累积。其中虾夷扇贝隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、珍珠贝目(Pteriodia)、扇贝科(Pectinidae), 是我国北方重要的养殖贝类。虾夷扇贝在辽宁沿海的养殖面积达70 余万公顷, 年产量超20万吨, 产值达 50 亿元(全国水产技术推广总站,2018)。近年来虾夷扇贝体内PSP 的检出率较高, 时文博等(2020)在抽查天津市市场销售的9 种经济贝类中 PSP 含量时发现, 虾夷扇贝的检出率最高, 达66.7%。改性粘土可高效防控亚历山大藻赤潮, 但对虾夷扇贝体内PSP 的影响尚不清楚。本研究以虾夷扇贝为受试生物, 考察了改性粘土絮凝亚历山大藻后贝类体内PSP 含量、组分的变化, 初步分析了带来这些影响的原因, 以期为现场应用提供科学依据。
1 材料与方法
1.1 实验材料
改性粘土材料由广西北海的高岭土经聚合氯化铝(poly aluminum chloride, PAC)改性处理配制而成,本文称之为 MC I, 制备方法详见文献(俞志明等,1994)。配制MC I 母液浓度为40 g/L。
虾夷扇贝取自山东威海荣成寻山集团, 扇贝规格为壳长(48.0±7.10) mm、壳高(47.55±5.55) mm, 实验前驯化7 d。海水取自青岛汇泉湾近海, 驯化条件为pH值7.8~8.2, 温度14~18 °C, 均匀充气, 使溶解氧保持>5 mg/L, 自然光照培养。每日投喂适量小新月菱形藻(Nitzschia closterim f.minutissima)。
太平洋亚历山大藻(A.pacificum)取自中科院海洋研究所海洋生态与环境科学重点实验室。培养海水经0.45 μm 滤膜过滤后, 121 °C 高温灭菌30 min, 在光照65 μmol photon/(m2·s), 光暗比为L∶D=12 h∶12 h, 温度19~21 °C 下, 采用L1 培养液培养。选择指数生长期的藻进行实验, 藻密度约为7×103cells/mL。
1.2 实验方法
1.2.1 PSP在虾夷扇贝体内的累积 实验使用体积为65 L (660×440×343 mm)的水箱, 各水箱放入45只虾夷扇贝, 共设A、B、C三组, 每组设置3个平行。A组为空白组, 添加50 L海水; B组为对照组, 添加50 L稀释后密度为2×103cells/mL的A.pacificum藻液;C组为实验组, 添加50 L稀释后密度为2×103cells/mL的A.pacificum藻液后, 喷洒MC I母液使其终浓度为0.2 g/L。累积阶段为4 d, 期间不换水, 不投饵。A组在0、2、4 d时取样, B、C组在3 h、12 h、1 d、2 d、4 d时取样, 进行虾夷扇贝体内PSP含量、组分, 以及水体中藻密度的测定。其他培养条件同驯化条件。
1.2.2 PSP 在虾夷扇贝体内的排出 4 d 后, 将B、C 两组中扇贝取出, 依次放入6 个盛有5 L 海水的烧杯中, 排出阶段为6 d, 每日换水、投喂适量小新月菱形藻。B、C 组分别在6 d 时取样, 进行虾夷扇贝体PSP 含量、组分的检测。其他培养条件同驯化条件。
1.2.3 MCI 对虾夷扇贝滤水率的影响 在20 L(440×298×243 mm)的水箱中各放入虾夷扇贝35 只,一次性喷洒适量MC I 母液, 使各组MC I 浓度分别为0、0.05、0.26、0.52 g/L, 每组设置三个平行。喷洒后的第2 d 开始隔天换水一次, 不吸底, 换水量2/3,第2 d 换水后每日投喂适量小新月菱形藻。在9 d 时从各水箱随机取 3 只虾夷扇贝, 放置在密度为1×105cells/mL 的小新月菱形藻藻液中, 同时设置无生物的自然沉降组1 个, 扣除由藻细胞自然沉降和生长带来的误差, 2 h 后测定各组藻密度。滤水率的计算公式参见(Coughlan, 1969)。
1.3 实验参数的测定
1.3.1 藻细胞密度的测定 将藻液混匀后取至离心管中, 加入鲁哥氏液将其固定后, 用100 μL 浮游植物计数框在显微镜(NIKON ECLIPSE50i)下计数。
1.3.2 PSP 的提取 样品前处理参考吴海燕等(2017), 从各组水箱中分别取出4 只虾夷扇贝分离其消化腺组织和食用组织(除消化腺外的全部组织), 在底部平铺吸水纸的50 目筛子上平铺沥水约10 min,分别置于组织匀浆机中匀浆。称取5 g 食用组织匀浆于50 mL 离心管中, 加入5 mL 1%乙酸水溶液, 涡旋混合90 s, 将离心管密封置于沸水中煮沸5 min, 取出置于流水下冷却至室温, 4 500 r/min 离心10 min,量取提取液体积。称取全部消化腺组织匀浆置于15 mL 离心管中, 加入与其重量相同体积的1%乙酸水溶液后重复上述提取步骤。
分别移取上述食用和消化腺组织提取液1 mL 于2 mL 离心管中, 加入5 μL 氨水, 涡旋混匀。依次用2 mL 乙腈、2 mL 20%乙腈水溶液(含1%乙酸)、2 mL 0.1%氨水溶液活化Supelco ENVI-Carb (250 mg/3 mL)固相萃取柱, 加入500 μL 提取液, 再用700 μL 超纯水淋洗, 负压挤干, 最后用 1 mL 75%乙腈水(含0.25%甲酸)洗脱混匀, 过0.22 μm 滤膜于进样小瓶中,-20 °C 下保存, 供液相色谱-串联质谱分析。
1.3.3 PSP 的检测 PSP 通过高效液相色谱串联质谱法测定, 所用仪器为1290 Infinity II 型高效液相色谱仪和G6546 Q-TOF/MS(美国Agilent 公司)。
色谱条件: 采用 ZIC-HILIC 色谱柱(2.1 mm×150 mm, 3.5 μm)对PSP 毒素进行分离。使用二元流动相, 梯度洗脱。流动相A: 水(含2 mmol/L 乙酸铵,0.03%甲酸), 流动相B: 90%乙腈水溶液(含2 mmol/L乙酸铵, 0.03%甲酸); 梯度洗脱程序: 0~5 min,100%~30% B; 5~20 min, 30% B。停止时间: 20 min;平衡时间: 8 min; 流速: 0.2 mL/min; 进样体积为10 μL; 柱温: (30±1) °C。
质谱条件: 在全扫描负离子模式下对PSP 毒素进行高分辨质谱检测。采用AJS-ESI 离子源; 干燥气温度: 300 °C; 干燥气流速: 8 L/min; 雾化器压力:20 psi; 鞘气温度: 320 °C; 鞘气流速: 11 L/min; 毛细管电压: 3 500 V; 扫描范围 100~600m/z。
1.4 数据处理
利用SPSS 22.0 软件, 对数据进行单因素方差分析(ANOVA), 比较实验组与对照组间是否存在显著差异(差异显著性水平α=0.05), 运用Origin 2019 和Excel 2016 对数据进行处理和绘图。PSP 不同组分毒性的归一化处理: 将组分STX 的毒性设为1, 其他组分按照毒性因子(表1), 统一转换为STX 来表示, 计算方式参见(Turneret al, 2015)。

表1 麻痹性贝毒(PSP)毒性因子(Oshima, 1995)Tab.1 The toxicity factor of PSP (Oshima, 1995)
2 结果与分析
2.1 改性粘土对A. pacificum 的去除效果
为了明确改性粘土自身是否会对虾夷扇贝的滤食行为产生影响, 首先考察了不同浓度MC I 处理下扇贝滤水率的变化情况。实验结果显示, 添加MC I的实验组中扇贝滤水率与对照组无显著差异(P>0.05),说明该实验中所选用的MC I 用量下不会影响扇贝的滤食情况, 选择0.2 g/L MC I 进行后续实验。
对于未添加MC I 的B 组, 在虾夷扇贝的滤食作用下, 藻密度呈平缓下降的趋势, 3 h 时藻密度由2 000 cells/mL 降低至1 593 cells/mL, 在4 d 时藻密度降低至23 cells/mL。添加了0.2 g/L MC I 的C 组, 由于MC I 对藻细胞的快速絮凝沉降, 藻密度在3 h 内由2 000 cells/mL 迅速降低至67 cells/mL, 在此后的各时间点均低于 100 cells/mL, 在 4 d 时降低至17 cells/mL(图1)。在实验过程中, B 组藻密度均高于C 组。
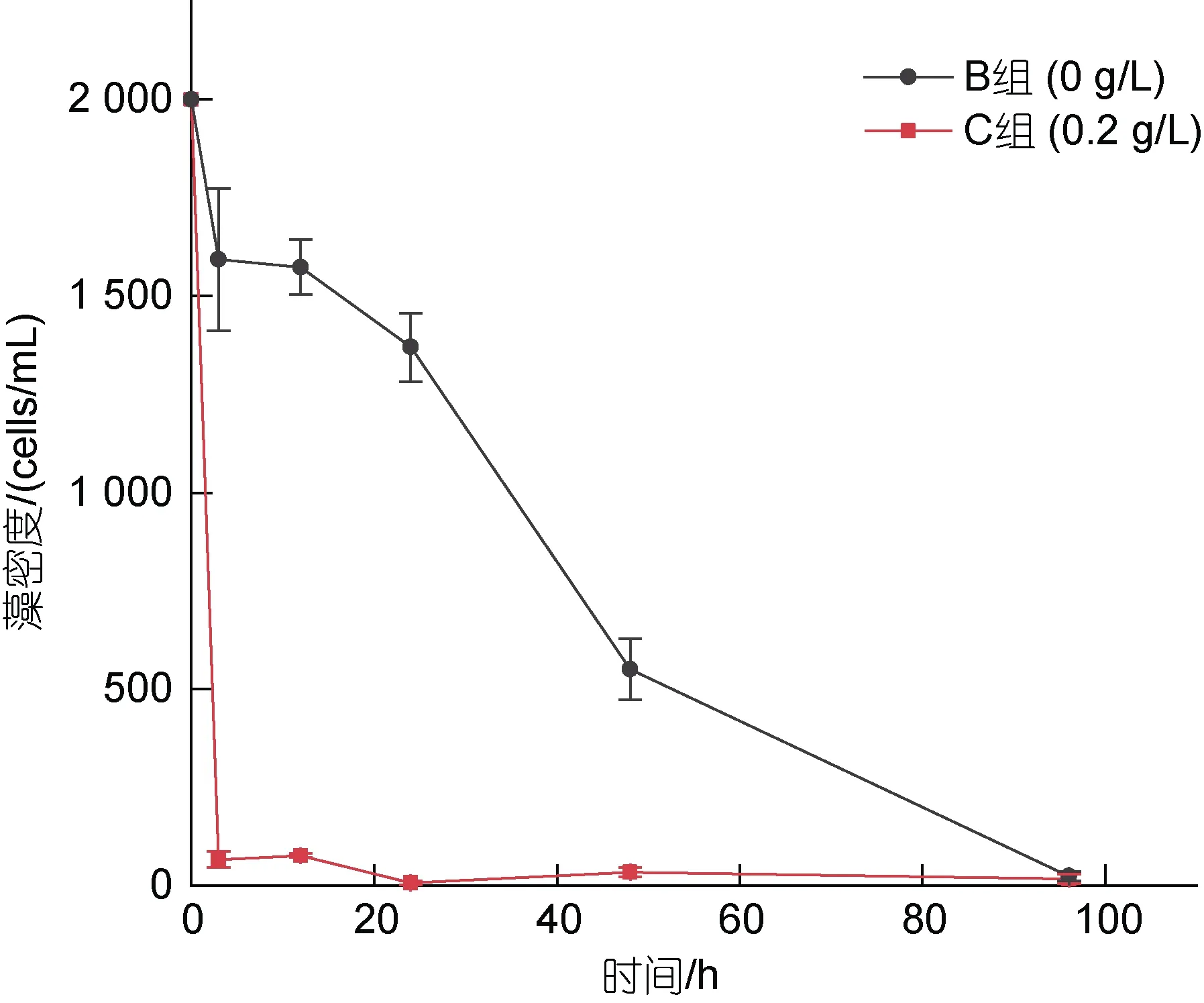
图1 不同实验组中A. pacificum 密度的变化Fig.1 Changes in algal density of A. pacificum in each experimental group
2.2 贝类组织中的毒素变化情况
2.2.1 PSP 毒素含量 首先需要确定实验所用虾夷扇贝是否被PSP 毒素污染。分析结果显示, 空白组虾夷扇贝(A 组)的食用组织在0、2、4 d 三个取样点均未检测到 PSP, 但在其消化腺组织中检测到少量PSP, 均为0.025 μmol/kg, 说明实验所用扇贝在原来的生长环境中被产毒藻轻微污染, 但含量较低, 对后续的实验结果不会产生干扰。
B 组和C 组扇贝食用和消化腺组织中PSP 含量的变化如图2 所示。在前4 d 累积阶段, B 组扇贝食用组织中PSP 含量不断上升, 由实验前的未检出到2 d 时升高至0.92 μmol/kg, 在4 d 时达到最高1.61 μmol/kg;C 组呈现先升高后降低的趋势, 在2 d 时就达到最高0.59 μmol/kg, 随后呈下降趋势。在累积阶段B 组扇贝食用组织中PSP 含量始终高于C 组(图2a)。同样,B 组扇贝消化腺组织中 PSP 含量, 由实验前的0.025 μmol/kg逐渐升高, 在4 d时达到最高20.2 μmol/kg;C 组虽然也有所增加, 2 d 后达3.91 μmol/kg, 到4 d时又降至2.69 μmol/kg。总体而言, 添加了改性粘土的C 组扇贝消化腺组织中PSP 含量在不同的采样时间点均低于B 组(图2b)。
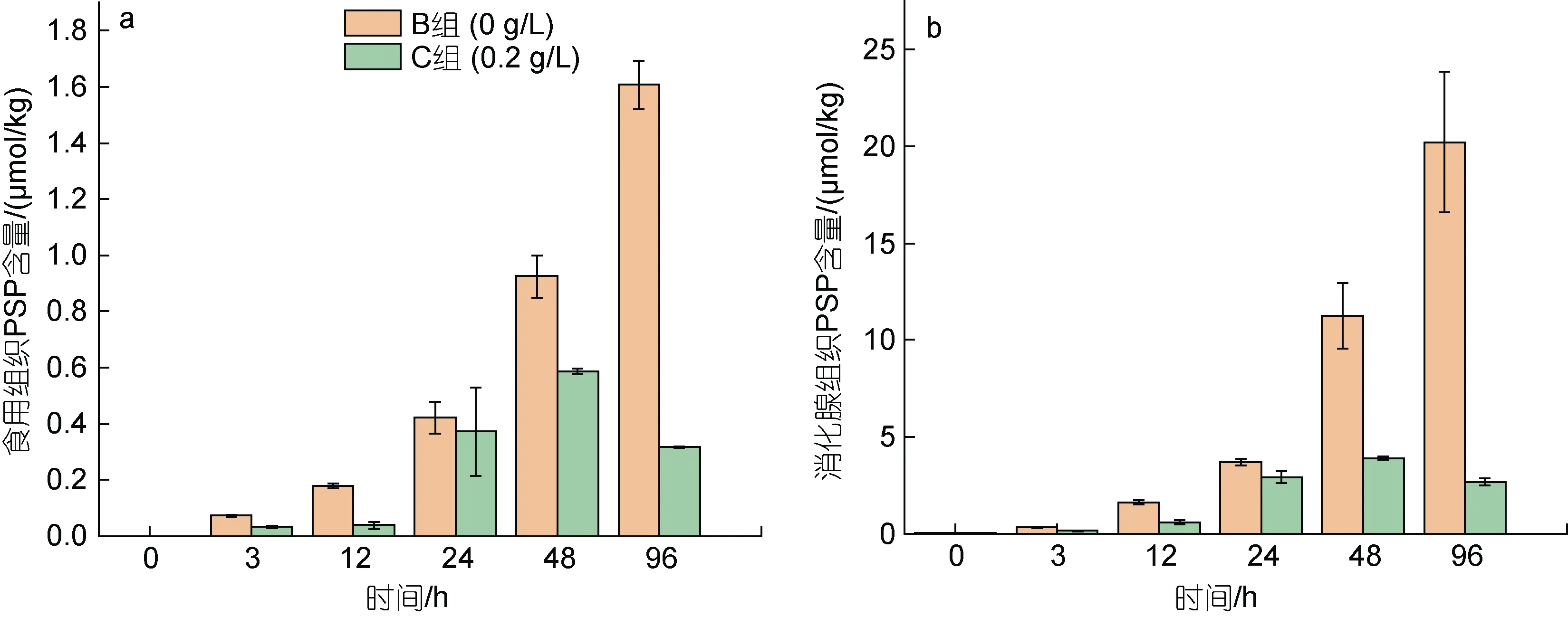
图2 累积阶段虾夷扇贝不同组织中PSP 含量变化Fig.2 Changes in PSP concentration in different tissues of Mizuhopecten yessoensis in accumulation stage
经过在海水和小新月菱形藻共培养体系中6 d 的排出阶段后, 扇贝各组织中PSP 含量均明显降低。其中, 在食用组织中, B 组和C 组PSP 含量分别由1.61和0.32 μmol/kg 降低至0.6 和0.09 μmol/kg。在消化腺组织中, B 组和C 组PSP 含量分别由20.2 和2.69 μmol/kg 降低至9.15 和1.61 μmol/kg (表2)。不论是食用组织还是消化腺组织, B 组PSP 含量均显著高于C 组(P<0.05)。
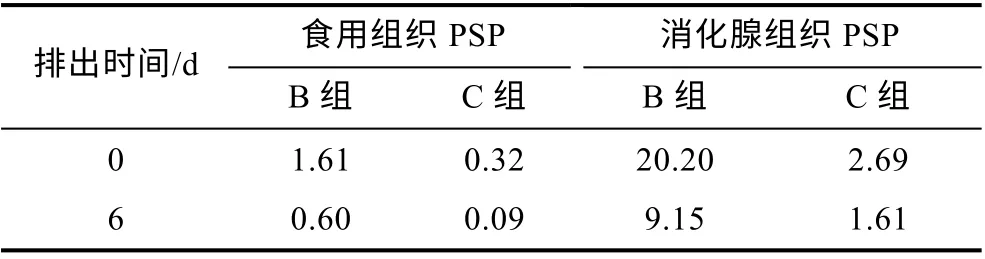
表2 排出阶段虾夷扇贝不同组织中PSP 含量(单位: μmol/kg)Tab.2 PSP concentration in different tissues of Mizuhopecten yessoensis in depuration stage (unit: μmol/kg)
2.2.2 PSP 毒素组分 如图3 所示,A.pacificum藻细胞中PSP 组分主要包括C1、C2、GTX1、GTX2、GTX3、GTX4、GTX5、dcGTX2、dcGTX3。当虾夷扇贝滤食了A.pacificum藻细胞后, 其体内PSP 组分与藻细胞相比存在明显差异。滤食3 h 后, 原本在藻细胞中存在的GTX2、GTX3、GTX4、dcGTX2、dcGTX3在扇贝食用和消化腺组织中均未检出。此外, 两种扇贝组织中C1∶C2 比率与藻细胞相比有明显降低, 在食用组织中, B、C 组C1∶C2 比率由藻细胞中的2.8分别降低至0.7 和0.5; 在消化腺组织中, 两组比率均降低至0.6。另外, 在3 h 时, 扇贝各组织中未检出GTX4, 而对于GTX4 的差向异构体GTX1, 在食用组织中, B、C 组扇贝GTX1 占比分别由藻细胞中的22%升高至41%和42%, 在消化腺组织中, GTX1 占比分别为26%和24%。在前4 d 的累积阶段, B、C 组扇贝食用和消化腺组织中PSP 主要组分均为C1、C2、GTX1、GTX5, 组分占比在不同取样时间点均较稳定,且两组间差异不大。
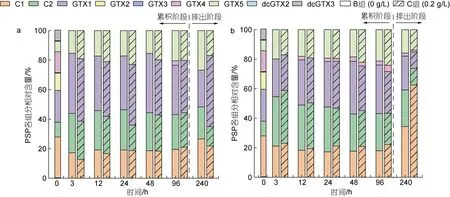
图3 藻细胞内及虾夷扇贝不同组织中PSP 组成Fig.3 PSP composition in algae and different tissues of Mizuhopecten yessoensis
经过6 d 的排出实验后, 扇贝食用和消化腺组织中PSP 主要组成仍为C1、C2、GTX1、GTX5, 但有些组分占比发生了明显的变化。其中, 在食用组织中,C 组GTX1 占比明显升高, 由35%升高至48%; 在消化腺组织中, B、C 组C1 占比均有不同程度的提升, B组中C1 占比由18%提高到34%, C 组中C1 占比由22%提升到62%。
2.2.3 PSP 毒素水平 PSP 由多种组分组成, 不同组分的毒性有很大差异(表1)。在贝类体内可能存在含量高的组分毒性低, 含量低的组分毒性高的情况。为更清楚地了解改性粘土絮凝藻细胞过程中对扇贝不同组织中PSP 总毒性的影响, 本研究将PSP 不同组分的毒性进行归一化处理, 统一用STXeq 来表示。虾夷扇贝食用和消化腺组织中PSP 毒素水平的变化如图4、表3 所示。
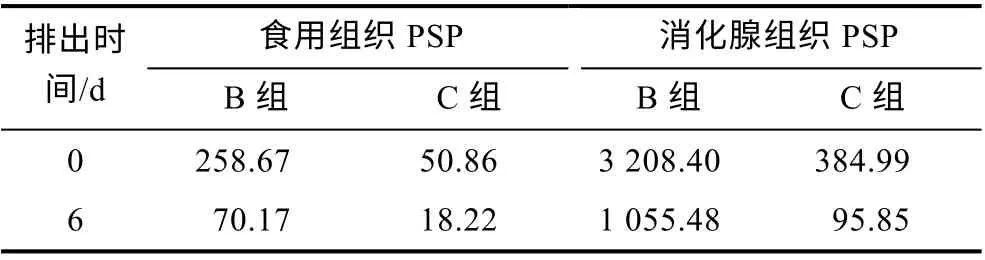
表3 排出阶段虾夷扇贝不同组织中PSP 毒素水平(单位:μg STXeq/kg)Tab.3 PSP toxicity level in different tissues of Mizuhopecten yessoensis in depuration stage(unit: μg STXeq/kg)
在前4 d 累积阶段, B 组食用组织的PSP 毒素水平不断上升, 由实验前的未检出提升至 4 d 时的258.67 μg STXeq/kg; 利用改性粘土絮凝去除A.pacificum的C 组中, 食用组织的PSP 毒素水平先上升, 在2 d 时达到最高值98.92 μg STXeq/kg, 随后呈下降趋势。在累积阶段B 组扇贝食用组织中PSP 毒素水平始终高于C 组(图4a)。同样, B 组扇贝消化腺组织中的 PSP 毒素水平, 由实验前的 0.68 μg STXeq/kg逐渐升高至4 d 时的3 208.4 μg STXeq/kg; C组则呈现先升高后降低的趋势, 2 d 后升高至574.54 μg STXeq/kg, 到4 d 时又降至384.99 μg STXeq/kg。总体而言, C 组扇贝消化腺组织中PSP 毒素水平在不同时间点均低于B 组(图4b)。
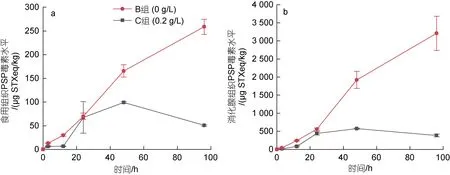
图4 累积阶段虾夷扇贝不同组织中PSP 毒素水平变化Fig.4 Changes in PSP toxicity level in different tissues of Mizuhopecten yessoensis in accumulation stage
经过在海水和小新月菱形藻共培养体系中6 d 的排出阶段后, 扇贝各组织中PSP 毒素水平均明显降低。在食用组织中, B、C 组扇贝PSP 毒素水平分别由258.67、50.86 μg STXeq/kg 降低至70.17、18.22 μg STXeq/kg; 在消化腺组织中, B、C 组扇贝PSP 毒素水平分别由 3 208.4 和 384.99 μg STXeq/kg 降低至1 055.58 和95.85 μg STXeq/kg (表3)。B 组食用和消化腺组织PSP 毒素水平均显著高于C 组(P<0.05)。
3 讨论
改性粘土技术通过对天然粘土矿物进行改性处理, 使粘土表面电性由负电转变为正电, 实现了对多种赤潮生物去除效率的极大提升(曹西华等, 2006; 张雅琪等, 2013; 邱丽霞等, 2017; 俞志明等, 2019), 目前, 已成为我国近海赤潮治理的首选方法。现场及室内研究均表明, 改性粘土在有效防控赤潮的用量下,对多种鱼(Zhanget al, 2019; 张培培等, 2019)、虾(孙晓霞等, 2000; 宋秀贤等, 2003)、贝(高咏卉等, 2007;王志富等, 2014; 王梓瞳等, 2019)等养殖生物无不良影响。本研究中0.2 g/L MC I 对A.pacificum藻细胞的去除率在3 h 时即达到了97%, 在随后的几天中藻密度始终维持在低水平, 没有出现再次增殖。此外,低于0.52 g/L 的MC I 对虾夷扇贝的滤水率也没有造成显著负面影响(P>0.05), 这与以往改性粘土对滤食性贝类影响的研究结果一致。再一次体现了改性粘土在高效去除赤潮生物的同时, 对典型养殖生物无不良影响。
本研究中所使用的MC I 对虾夷扇贝的滤食行为没有影响, PSP 在扇贝体内的累积主要受到水体中藻细胞密度及藻细胞毒力的影响。宋维佳等(2021)研究发现, MC I 主要是通过去除水体中的有毒藻细胞来降低水体中的总PSP 含量, 改性粘土是一种绿色环保的除藻材料, 适当用量可以有效降低水体中藻细胞密度, 但不会导致藻细胞大量破裂释放或分泌毒素。因此, 本研究中前4 d 虾夷扇贝体内PSP 含量的变化主要受到水体中A.pacificum藻密度的影响, B、C 两组扇贝组织中PSP 的变化与藻密度的变化具有较好的对应关系。例如, B 组扇贝食用和消化腺组织中PSP毒素水平与藻细胞密度呈现出较强的负相关关系(图5), 反映出扇贝各组织中PSP 毒素水平的变化主要源自藻细胞密度的变化。在实验的前4 d, 生长在A.pacificum中的B 组扇贝不断滤食藻细胞, 水中藻密度不断降低, 导致扇贝食用和消化腺组织中PSP 毒素水平在累积阶段不断上升, 在第4 d 毒素水平达到最高。而在添加0.2 g/L MC I 的C 组中, 在3 h 时MC I即絮凝沉降了体系中97%的藻细胞, 此后藻密度始终维持在一个较低的水平, 这大大降低了扇贝摄入有毒藻的几率, C 组扇贝食用和消化腺组织毒素水平在第2 d 达到高峰, 随后呈下降趋势。累积及排出阶段中, B 组扇贝PSP 毒素水平均高于C 组。Li 等(2019)的研究表明, 在16 d 的A.pacificum与海湾扇贝共培养实验中, 未添加MC I 的对照组中, 在3 h 内扇贝即积累了初始藻液中 73.2%的 PSP, 而添加 0.1 和0.5 g/L MC I 后, 扇贝的毒素水平始终保持在一个较低的水平。前人和本研究结果均表明, MC I 能有效絮凝沉降水体中的A.pacificum, 从而能够减少贝类对有毒藻的滤食, 大大地降低了PSP 在贝类体内的积累,该研究结果为改性粘土技术在近海贝类养殖水体中的实际应用提供了重要的科学依据。
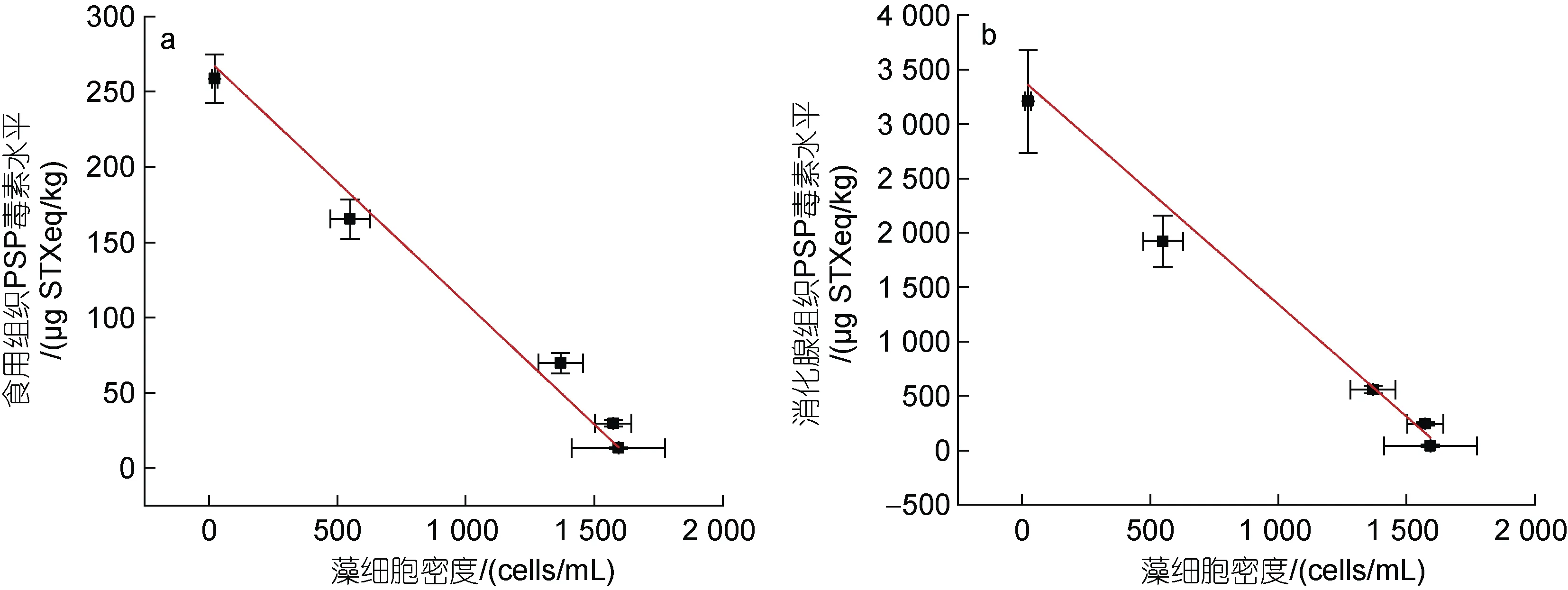
图5 对照组(B 组)虾夷扇贝不同组织中PSP 毒素水平与藻密度的关系Fig.5 Relationship between toxicity level of PSP in different tissues of Mizuhopecten yessoensis and algal density of A. pacificum in the control group
我国规定上市贝类中 PSP 的安全限量标准为800 μg STXeq/kg, 从安全限量标准来看, 在各个取样时间点, B 组扇贝的食用组织以及C 组扇贝的两种组织毒素水平均低于安全限量标准, 而生长在较高密度A. pacificum的虾夷扇贝(B 组), 其消化腺组织的毒素水平在2 d 后高于安全限量标准。另外, B、C组扇贝消化腺组织中毒素水平为食用组织的数倍甚至十多倍。消化腺是扇贝主要的毒素累积器官, 建议在食用时剔除消化腺以保证安全。已有学者研究过PSP 在贻贝、扇贝等体内的累积和排出情况(Kwonget al, 2006; Liet al, 2017), 发现消化腺是PSP 主要的累积器官, 这与本文的研究结果一致。
多项研究表明, 亚历山大藻和以其为食的贝类体内PSP 的组分有所差异。如Kwong 等(2006)的研究发现, 芬迪亚历山大藻(Alexandriumfundyense)中PSP 组成中氨基甲酸酯类毒素(GTX1-4、STX、neoSTX)占比仅为 33.4%, 但滤食它的翡翠贻贝(Perna viridis)体内此类毒素占比为53.0%。双壳贝类中PSP 的转化极为复杂多变, 可发生不同毒素种类间的转化和差向异构体间的转化, 如PSP11 位C 原子上的R2、R3 基团的空间异构化, β 异构体可转化为稳定的α异构体, 如 GTX3→GTX2, C2→C1, GTX4→GTX1 等(包振民等, 2021)。Asakawa 等(2005)的研究发现, 滤食塔玛亚历山大藻(Alexandrium tamarense) 2 d后, 相比藻细胞PSP 组成, 菲律宾蛤仔体内GTX1∶GTX4 比率提高。在本文的研究中, 当虾夷扇贝滤食了A. pacificum藻细胞3 h 后, 与初始藻细胞中的PSP组成相比, 扇贝食用和消化腺组织中均未检出藻细胞中所含有的GTX2、GTX3、GTX4、dcGTX2、dcGTX3(图3)。其中, GTX2、GTX3、GTX4 可能在扇贝体内转化为其他组分, 也有可能在短时间内被扇贝本身排出。dcGTX2、dcGTX3 本身在藻类中占比较低, 文献中还未记载过这两类毒素向其他PSP 组分的转化路径, 因此在3 h 内有可能被扇贝本身排出体外。扇贝各组织中C1∶C2 比率降低, 这与贝类中常见的C2→C1 的转化有所不同, 可能发生了和其他组分间复杂的转化。3 h 后未在扇贝各组织中检出GTX4, 但GTX1 占比相比藻细胞均有所提高, 有理由推断GTX4 可能向GTX1 发生了快速转化。在4 d 的PSP累积阶段中, 不论是食用组织还是消化腺组织, B 组和C 组的PSP 组成差异不大, 说明改性粘土的添加不会影响扇贝对PSP 的生物转化过程。经过6 d 的排出阶段后, C 组扇贝食用组织中GTX1、B 组和C 组扇贝消化腺组织中的C1 占比均有不同程度的提升, 说明GTX1、C1 的排出速率可能比其他毒素低或其他组分向其发生了转化。
4 结论
(1) 0.2 g/L MC I 能有效絮凝去除水体中大部分的A.pacificum藻细胞, 并对虾夷扇贝的滤食行为没有影响。
(2) 整个实验过程中, 无论是累积阶段还是排出阶段, MC I 处理后虾夷扇贝食用组织和消化腺组织中PSP 毒素水平均低于未添加改性粘土的对照组。一定用量MC I 的添加可通过降低水体中A.pacificum藻细胞密度, 减少虾夷扇贝对水体中有毒藻的摄入量, 从而降低扇贝食用组织和消化腺组织内PSP 毒素的积累。
(3) 累积阶段中, MC I 处理组虾夷扇贝食用组织和消化腺组织中PSP 各组分相对含量与未添加改性粘土的对照组无明显差异, 即本实验用量MC I 的添加未对虾夷扇贝体内的PSP 转化造成明显影响。
