黑质LAMP2A 过表达改善帕金森病恒河猴模型的运动功能
2022-05-30朱旭超窦长松
朱旭超,窦长松,张 钰,秦 川,张 玲
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类动物模型三级实验室,北京 100021)
帕金森病(Parkinson’s disease,PD)是以静止性震颤、运动迟缓、肌强直等运动功能障碍为主要临床表现的神经退行性疾病,主要病理机制是中脑黑质致密部多巴胺能神经元变性丢失、纹状体多巴胺水平显著降低,以残存神经元胞体中出现的LBs 为特征性标志物,目前无有效治疗手段。如何清除形成LBs 的错误折叠α-syn 是PD 的重要研究方向[1]。分子伴侣介导的细胞自噬(chaperone-mediated autophagy,CMA) 是降解α-syn 的重要途径[2]。LAMP2A 是CMA 的限速步骤,在PD 病人黑质致密部和杏仁核中的表达水平降低导致CMA 水平下降[3-4]。α-syn 因清除能力不足而出现异常聚积和错误折叠,形成具有神经毒性作用的α-syn 寡聚体[5],导致多巴胺能神经元变性坏死。PD 大鼠模型中已经证实过表达LAMP2A 可以改善α-syn 病理和运动能力[6]。为进一步探究LAMP2A 上调对PD是否有潜在的治疗价值,本研究利用恒河猴构建PD模型[7],给予腺相关病毒载体过表达LAMP2A[8-9]。通过行为学方法对接受LAMP2A 过表达干预的PD恒河猴模型进行精细运动能力检测,为进一步研究PD 的发病机制和治疗提供了参考。
1 材料和方法
1.1 实验动物
普通级4~5 岁雄性恒河猴7 只,体重(5.28±0.6)kg,均购自于中国医学科学院医学实验动物研究所北方中心[SCXK(京)2021-0004],并饲养于中国医学科学院医学实验动物研究所北方中心[SYXK(京)2017-0027]。普通环境条件为12 h/12 h 昼夜周期,温度(23±2)℃,湿度45%~60%。每天饲喂特制猴饲料3 次,中间1 次给予适量水果。在本研究中所涉及的动物实验均经过中国医学科学院医学实验动物研究所动物实验伦理委员会审核批准(IACUC-QC19025),并遵循3R 原则。
1.2 主要试剂与仪器
人α 突触核蛋白ELISA 试剂盒(生工,D71156-0096);Human p-α-SYN ELISA Kit (茁 彩,ZC-54871)。主要的手术装置有大动物脑立体定位注射仪(瑞沃德,中国);高周波X 射线机(Mikasa,日本);山和谷阶梯实验装置、平板取食实验装置自制。
1.3 实验方法
1.3.1 帕金森病恒河猴模型的制备与分组
利用大动物立体定位注射仪并参考Yu 等[10]的方法。以前连合为三维坐标系原点,纹状体坐标为:前后值(antero-posterior,AP)=-4 mm,距中缝值(media-lateral,ML)=± 14 mm,平面值(dorsoventral,DV)=-3 mm;黑质区坐标为AP=-7 mm,ML=±3 mm,DV=-4 mm[7,11]。向所有7 只恒河猴的右脑纹状体区注射帕金森病患者死后脑组织的LBs 提取物(100 μL,3 μL/min),而在左脑纹状体注射非帕金森病人死后的脑组织提取物(100 μL,3 μL/min),以此作为自身对照来构建帕金森病模型(图1A)。LAMP2A 过表达组在其黑质区双侧注射了过表达LAMP2A 的腺相关病毒载体(10 μL 每侧,1 μL/min);对照组在其双侧黑质区注射对照病毒载体(10 μL 每侧,3 μL/min)(图1B)。人脑组织样本来自荷兰脑库,脑组织提取物和病毒载体均来自法国波尔多大学Erwan Bezard 教授实验室[7]。
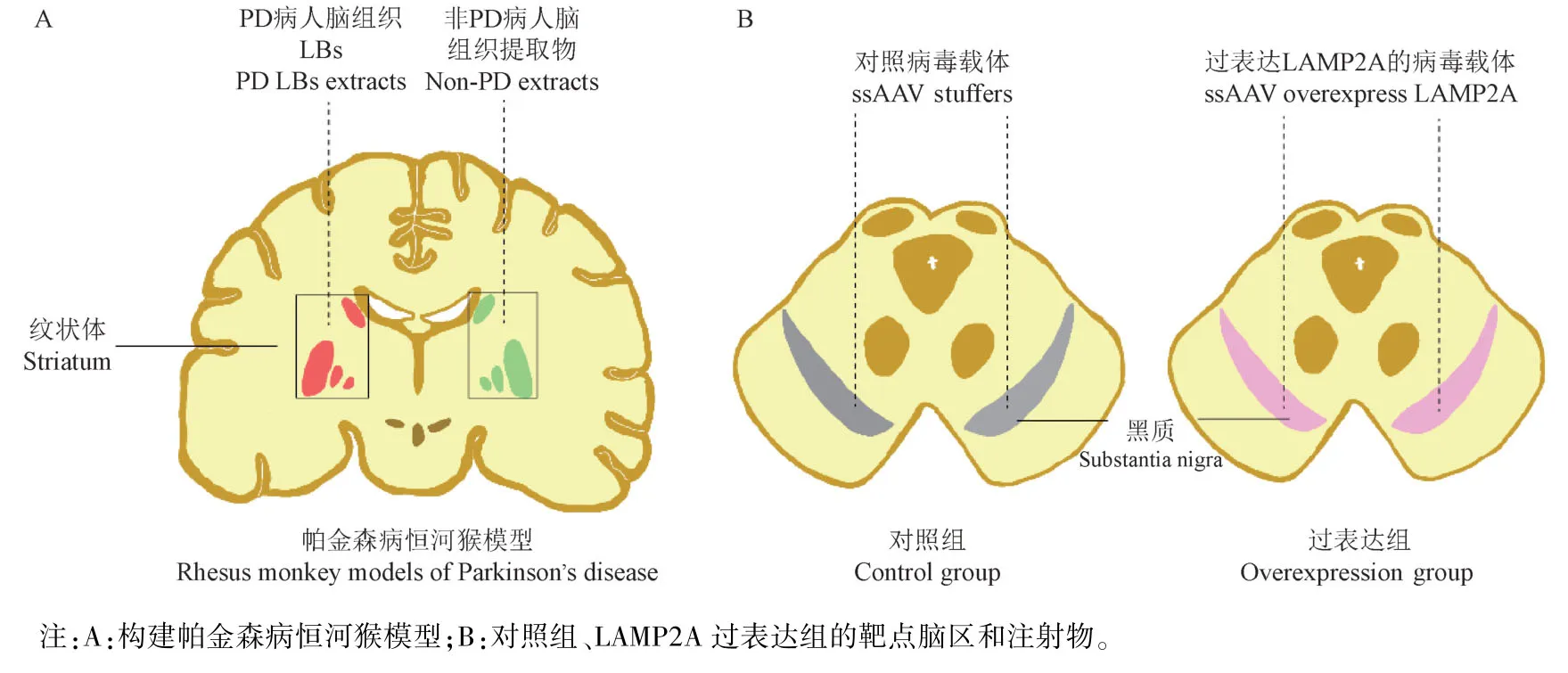
图1 本研究中实验猴造模及分组示意图Note.A,Construction of rhesus monkey models of Parkinson’s disease.B,Target brain area and injection in control group and LAMP2A overexpression group.Figure 1 Experimental monkey modeling and grouping schematic diagram in this study
1.3.2 阶梯实验
术后第14 月,在实验人员能够通过食物引诱与实验猴进行互动时,对动物进行行为学测试,将1 cm3苹果块作为食物奖励,每次正式实验开始前对实验猴禁食1 餐。
分为山阶梯实验和谷阶梯实验,根据先前的研究[12-13]设计制作而来(图2A、2D)。在动物适应阶段(正式实验前1 周,每天1 次)训练动物穿过挡板从阶梯模具上获得食物奖励,随后开始正式实验。实验前在每层的阶梯模具上放置食物,摄像机记录动物伸手穿越孔洞、取到食物后缩回孔洞的时间,连续测试10 d。对动物每侧肢体每次抓取食物的时间进行统计分析,用错误上肢取食的时间将不被记录。装置中透明挡板的孔道直径为8 cm;阶梯模具每个阶梯长8 cm,宽3 cm,高4 cm;山阶梯中两模具距离2 cm,谷阶梯中两模具距离12.5 cm,模具距挡板前方10 cm。
1.3.3 平板取食实验
分为两端平板取食和中央平板取食实验,依据文献[14]由亚克力板制作改进而来(图3A、3D)。学习适应阶段和正式实验阶段类似于阶梯实验。使用两个2×4 排列的圆形孔槽亚克力板供实验猴取食,实验时长和统计指标同阶梯实验。每个平板模具长20 cm,宽10 cm,厚2 cm,上有8 个直径3 cm,深0.5 cm 的孔槽,相邻两孔槽之间的距离为2 cm;中央平板取食实验中两模具并齐,两端平板取食实验中两模具距离15 cm,模具距挡板前方10 cm。
1.3.4 酶联免疫吸附测定
在手术前和手术后的第4、8、12 月,分别采集动物血清和脑脊液。以10 mg/kg 剂量的盐酸氯胺酮肌肉注射麻醉动物后[15],局部去毛暴露下肢皮下静脉,酒精棉球消毒,使用5 mL 含肝素钠采血管取血。血液在采血管内室温静置30 min 后随即以3000 r/min 的转速4℃离心15 min,取上清。恒河猴麻醉后取立位坐姿,利用腰穿穿刺针在L5 与L6 椎间隙穿刺。有落空感时停止,旋转针头,引出脑脊液,从第2 滴开始收集,每只动物每次取1~1.5 mL[16]。按照试剂盒内提供的操作手册分别对猴血清和猴脑脊液进行总α-syn 水平和磷酸化α-syn 水平的测定并进行数据分析。
1.4 统计学方法
实验数据采用Graphpad Prism 8.0 软件进行统计分析和绘图,以平均数±标准差()表示,多组间比较采用双因素方差分析,两两比较应用t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 LAMP2A 过表达改善PD 恒河猴模型垂直方向精细运动能力
本实验中帕金森病恒河猴模型采取右侧纹状体区LBs 注射的方式,因此研究中重点检测术后第12 月实验猴注射脑区对侧[17],即左侧上肢抓取食物的精细运动能力。将对照组和LAMP2A 过表达组的左右上肢取食时间分别统计分析,为了消除个体差异,研究中采用该动物左手取食时间和其右手取食时间的比值作为衡量指标。由于山阶梯实验(图2A)中一侧上肢抓取同侧目标的运动路径较短,因此山阶梯测试中没有显示出两组比值上的差异(图2B)。为进一步探究LAMP2A 对过表达组动物抓取运动的影响,研究发现在山阶梯中LAMP2A过表达组动物的两侧肢体运动没有明显的变化(图2C);但谷阶梯(图2D)中对照组恒河猴的差异表明对照组动物自身左手取食时间高于右手,P<0.01(图2E),同时说明对照组左手精细运动的差异是由注射物LBs 引起而非注射本身的机械损伤。在相对困难的谷阶梯实验中也明显提高了LAMP2A过表达组实验猴左手抓取的成绩,抓取时间缩短P<0.05(图2F),左手的取食效率提升。阶梯实验提示术后第12 月的PD 恒河猴模型,肉眼没有观察到明显的肢体运动障碍,但精细运动能力下降;同时黑质区LAMP2A 的过表达可以改善其精细运动表现。

图2 阶梯实验装置及结果()Note.A,Hill staircase task equipment.B,Ratio of time spent on the left hand to the right hand in hill staircase task.C,Time to get food from left and right hands in hill staircase task.D,Valley staircase task equipment.E,Ratio of time spent on the left hand to the right hand in valley staircase task.F,Time to get food from left and right hands in valley staircase task.Compared to the control group,*P<0.05,**P<0.01.Figure 2 Staircase task equipment and results
2.2 LAMP2A 过表达改善PD 恒河猴模型水平方向精细运动能力
和阶梯实验类似,平板取食实验旨在测试实验猴水平方向上的精细运动能力。中央平板取食实验(图3A)因其运动路径短,相对简单,两组动物上肢抓取时间的比值没有出现明显变化(图3B),LAMP2A 过表达组上肢抓取时间的缩短也并不明显(图3C);在相对困难的两端平板取食实验(图3D)中,对照组动物上肢抓取时间的比值出现差异,P<0.05(图3E),LAMP2A 过表达组动物左手抓取的效率明显提高,抓取时间下降,P<0.05(图3F)。
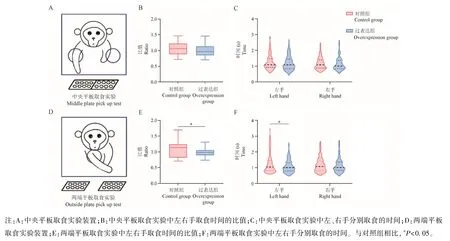
图3 平板取食实验装置及结果()Note.A,Middle plate pick up test equipment.B,Ratio of time spent on the left hand to the right hand in middle plate pick up test.C,Time to get food from left and right hands in middle plate pick up test.D,Outside plate pick up test equipment.E,Ratio of time spent on the left hand to the right hand in outside plate pick up test.F,Time to get food from left and right hands in outside plate pick up test.Compared to the control group,*P<0.05.Figure 3 Pick-up test equipment and results
2.3 LAMP2A 过表达组PD 恒河猴模型磷酸化αsyn 水平降低
为了探究LAMP2A 改善实验猴精细运动能力的机制,我们对对照组和过表达组的猴血清、脑脊液的总α-syn 以及磷酸化α-syn 水平进行检测。结果表明,对照组恒河猴脑脊液的总α-syn 水平在术后第12 月显著增高(P<0.001)(图4A);LAMP2A过表达组恒河猴脑脊液总α-syn 水平在各时间点相对平稳,但术后第4 月的血清总α-syn 浓度与术前相比出现上升(P<0.05),而后随时间趋于平稳,在术后第12 月低于同期对照组(图4B);LAMP2A 过表达组脑脊液磷酸化α-syn 浓度在术后第4 月显著增加(P<0.001),而在术后第8 月出现下降并于第12 月恢复至术前水平,表明LAMP2A 在第8 月作用凸显(图4C);对照组恒河猴血清磷酸化α-syn 水平在术后第4 月开始,也均高于同期的过表达组(图4D)。ELISA 结果说明LAMP2A 降低了过表达组恒河猴血清、脑脊液的总α-syn 和磷酸化α-syn 水平,同时生物学证据也支撑了LAMP2A 过表达组恒河猴的较好的行为学表现,提示LAMP2A 在帕金森病病理进程中潜在的治疗作用。

图4 实验猴脑脊液和血清总α-syn 水平和磷酸化α-syn 水平比较()Note.A,Total α-syn level of experimental monkey cerebrospinal fluid.B,Total α-syn level of experimental monkey serum.C,Phosphorylated α-syn level of experimental monkey cerebrospinal fluid.D,Phosphorylated α-syn level of experimental monkey serum.Compared with the control group in the same period,*P<0.05,***P<0.01.Compared to the control group at 0 months,##P<0.01,###P<0.001.Compared to the LAMP2A overexpression group at 0 months,%P<0.05,%%%P<0.001.Figure 4 Comparison of total α-syn levels and phosphorylated α-syn levels in the cerebrospinal fluid and serum of experimental monkeys
3 讨论
本研究行为学实验表明,过表达LAMP2A 可以改善PD 恒河猴模型的精细运动能力,避免潜在的肢体运动障碍。我们在研究中并没有加入野生型恒河猴和1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD 恒河猴模型进行比较分析。但Recasens等[7]在研究中证实单侧纹状体注射LBs 构建的PD恒河猴模型具备α-syn 病理和黑质纹状体变性表现,术后第9 月开始出现纹状体多巴胺能神经元减少,并发现同侧颞叶皮层的中央前回、额叶上回和内嗅皮层的α-syn 免疫组化信号增加。这可能是由于纹状体在解剖上的高度联接性导致LBs 在同侧脑区的扩散,在PD 恒河猴模型和PD 小鼠模型中尚未有LBs 单侧注射向对侧扩散的报告。因此,本研究中对照组实验猴左手抓取效率的下降是由于其右侧纹状体LBs 的注射引起。
Shimozawa 等[18]将人工合成的α-syn 原纤维注射入野生型狨猴纹状体3 月后便能够检测到磷酸化α-syn 免疫反应阳性,但没有观察到明显的行为障碍。本研究也未发现恒河猴明显的肢体运动障碍,这与先前的研究一致。人类黑质多巴胺神经元数量减少50%以上、纹状体多巴胺含量降低80%以上才会出现明显的PD 运动障碍症状[19]。本研究中术后第14 月出现精细运动能力下降的实验猴在病理阶段可能已经达到多巴胺能神经元损伤并出现行为异常的阈值[20]。不同于MPTP 注射诱导的急性PD 恒河猴模型,早期即出现明显肢体运动障碍[21],本文中PD 恒河猴模型模拟慢性病理进程[22],早期肢体运动障碍不明显,故对照组实验猴肢体精细运动能力的下降是α-syn 病理进程的反映。
LAMP2A 是CMA 的限速步骤,前期的PD 大鼠模型中已经证实,LAMP2A 可以显著提高CMA 活性,减少了黑质区酪氨酸酶阳性神经元的丢失,总α-syn 也接近于对照组水平[6]。我们分析恒河猴精细运动能力下降是因为α-syn 寡聚体可以抑制核心蛋白复合体(soluble N-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)的组成,抑制囊泡内神经递质的释放[23],造成纹状体多巴胺含量的降低,引起运动症状。此外,α-syn 寡聚体可以损伤线粒体复合体Ⅰ,造成线粒体脂质过氧化,导致多巴胺能神经元死亡[24]。因此,当α-syn 的产生和清除之间的平衡被打破时,α-syn 单体便会错误折叠成α-syn 寡聚体,引发神经毒性[25]。而α-syn 被热休克蛋白70(heat shock protein 70,HSP70)识别后,LAMP2A 能够将α-syn—HSP70 复合物募集到溶酶体表面,随后进入溶酶体降解[23-24],因此LAMP2A过表达通过直接增加溶酶体膜表面的LAMP2A 受体,提高了CMA 清除α-syn 的效率。更为重要的是,磷酸化α-syn 可以阻止高尔基体或者内质网形成自噬体膜,以减少自噬溶酶体途径对自身的降解[26]。但磷酸化α-syn 是否也抑制了溶酶体膜的形成,尚未有更多的报道。而且,LAMP2A 过表达可以激活蛋白激酶C(protein kinase C,PKC)[27],同时PKC 可以诱导转录因子EB(transcription factor EB,TFEB)入核激活,促进溶酶体的产生[28]。因此,LAMP2A 不仅可以直接提高CMA 活性增加α-syn的清除,可能同时也促进了溶酶体的产生。
最近的一项研究显示,研究人员靶向小鼠神经元线粒体,小鼠初期表现出精细运动能力障碍[29],这与我们的研究结论不谋而合。但小鼠的研究中没有进行α-syn 病理分析,因此本研究也尚需进一步的病理探究。另外,一项前瞻性研究表明确诊帕金森病10 年后28%的患者出现痴呆,确诊17 年后有78%进展为帕金森病痴呆[30]。而本研究中动物接受手术时间较短,实验猴在由透明挡板和模具构成的立体空间中没有表现出视觉空间认知[31]的差异,因此有必要对其进行长期的观察研究以确定LAMP2A 对认知功能的影响。
综上所述,本研究在帕金森病恒河猴模型上初次验证了过表达LAMP2A 可能通过增加α-syn 的CMA 途径清除、促进溶酶体的产生和减少磷酸化αsyn 对溶酶体膜形成的抑制改善了PD 恒河猴模型的精细运动能力,为进一步研究其中的机制以及为PD 的治疗提供了实验依据。
