基于GEO数据库筛选心脏肥大差异表达mRNA及其网络构建
2022-05-30邓勇志
晏 阳,邓勇志
(山西医科大学附属心血管病医院心脏大血管外科,太原 030024)
心脏肥大是指在心脏前负荷或者后负荷增加的情况下,为了维持心脏对于外周器官的灌注量,以满足其正常或应激条件下需求而导致的心肌细胞数量不变但心脏体积增加。
有证据[1-4]表明,长链非编码RNA(long noncoding RNA,lncRNA)与微小RNA(microRNA,miRNA)均与心脏肥大高度相关。ZHU等[3]指出lncRNA-MIAT可增强miR-150的表达,影响心肌细胞的病理发育,从而促进心肌肥大的发生与发展;也有研究[4]证明,miR-20b通过抑制磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)的表达并间接增强蛋白激酶AKT的活性来诱导心脏肥大,而CHAR的过度表达可导致miR-20b的下调,提示lncRNA CHAR通过海绵样作用吸收miR-20b,调节miR-20b-PTEN-AKT信号传导途径减轻心肌肥大。这些研究表明lncRNA可能通过调节miRNA进而在心脏肥大的发病过程中发挥重要作用。另有证据[5-6]表明lncRNA-miRNA-mRNA竞争性内源性RNA(competing endogenous RNA,ceRNA)调控网络与乳腺癌、肝癌、骨肉瘤的发生呈高度相关性,但关于心脏肥大的类似研究相对较少。本研究采用生物信息学方法分析心脏肥大的相关差异表达基因,并构建lncRNA、miRNA、mRNA之间的ceRNA调控网络,旨在为心脏肥大的发病机制及潜在治疗靶点的研究提供理论依据。
1 资料与方法
1.1 芯片数据
GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)代表了目前最大的微阵列数据公共存储库。本研究从GEO数据库中检索与心脏肥大相关的基因芯片数据,并下载符合要求(包含心脏肥大患者及健康对照的芯片数据)的基因表达谱GSE60291(平台GPL570,Affymetrix人类基因组U133 Plus 2.0阵列),共包含6份心肌样本,其中3份心脏肥大患者心肌样本及3份正常心肌样本。所有数据均以原始状态获得,并使用Perl(版本5.32.3)和R软件(版本:4.0.2)进行标准化。
1.2 数据处理
1.2.1 差异表达基因的筛选
在GEO数据库中下载原始数据,将探针ID转移到基因符号或mRNA名称。将下载好的数据按照R语言包分为实验组与对照组,将其用于筛选肥大心脏心肌细胞与正常组织之间差异表达的mRNA。同时计算对数倍数变化(logFC),P值与校正P值,然后将P<0.05和|logFC|>0.5设置为差异表达mRNA的纳入标准,筛选获得差异表达基因并绘制其热图。
1.2.2 lncRNA结合的miRNA
在lncRNADisease数据库2.0(http://www.rnanut.net/lncrnadisease/)中搜索[7],检索词为“cardiomegaly”,得到与心脏肥大相关的lncRNA,并进一步筛选已知其全部长度及序列的lncRNA,包括SLC26A4 antisense RNA(ENSG00000233705)、Pvt1 oncogene(ENSG00000249859)、MAGL1 intronic transcript 1(ENSG00000272610)、CCDC144NL antisense RNA(ENSG00000233098)、BACE1 antisense RNA(ENSG00000278768)、ATXN8 opposite strand(ENSG00000230223)。通过Starbase数据库(http://starbase.sysu.edu.cn/)筛选出6个lncRNA对应的miRNA,以构建心脏肥大相关的lncRNA ceRNA网络,研究心脏肥大可能的发病机制。
1.2.3 预测与心脏肥大有关的miRNA的下游靶基因
将预测到的与lncRNA结合的miRNA,通过miRNet(https://www.mirnet.ca/)预测miRNA对应的靶点基因与从芯片GSE60291中筛选的差异基因取交集,以得到的交集mRNA构建相关ceRNA网络并对取得的mRNA进行基因本体论(Gene ontology,GO)功能分析与京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析。分子功能、生物过程、细胞成分的mRNA通过使用org.Hs.eg.db、ggplot2、cIusterProfiIer等软件包,以P<0.05为标准进行GO与KEGG信号通路分析。
1.2.4 ceRNA调控网络的构建
利用Cytoscape软件(版本3.7.1)分别构建lncRNA-miRNA以及miRNA-mRNA调控关系网络,在此基础上用merge功能得到lncRNA-miRNA-mRNA的ceRNA网络,连线代表节点之间存在着调控关系。
2 结果
2.1 差异表达的mRNA
从GEO数据库获得3份心肌肥大组织样本与3份正常心肌组织样本,以|logFC|>0.5且校正后P<0.05为筛选标准,共获得差异mRNA 104个,使用R语言制作差异表达mRNA的热图。见图1。
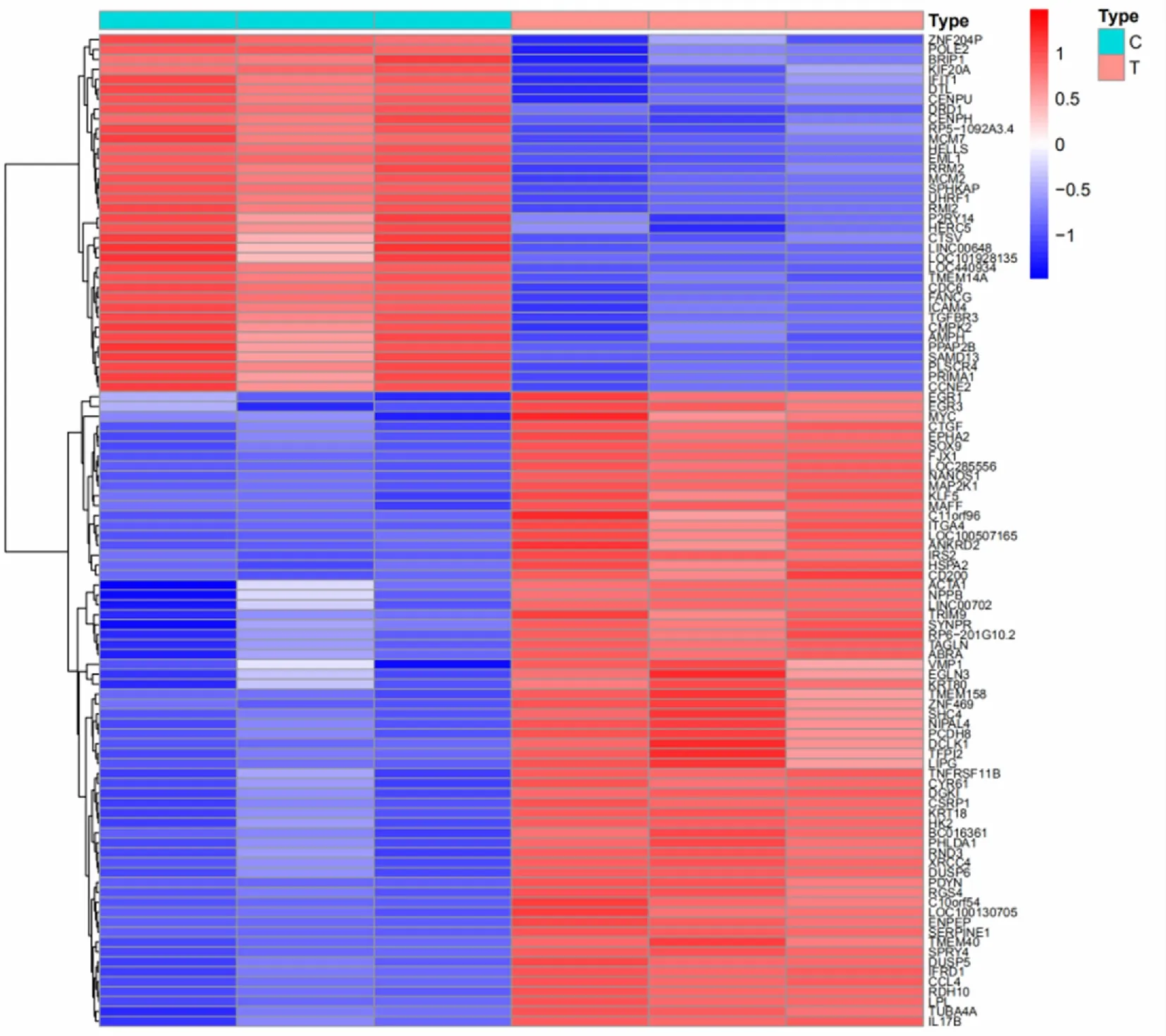
C:对照组T:实验组。1个小格为1个基因,颜色表示基因的表达水平,红色表示高表达,蓝色表示低表达,颜色越深则表示表达水平越高。
2.2 与lncRNA结合的miRNA
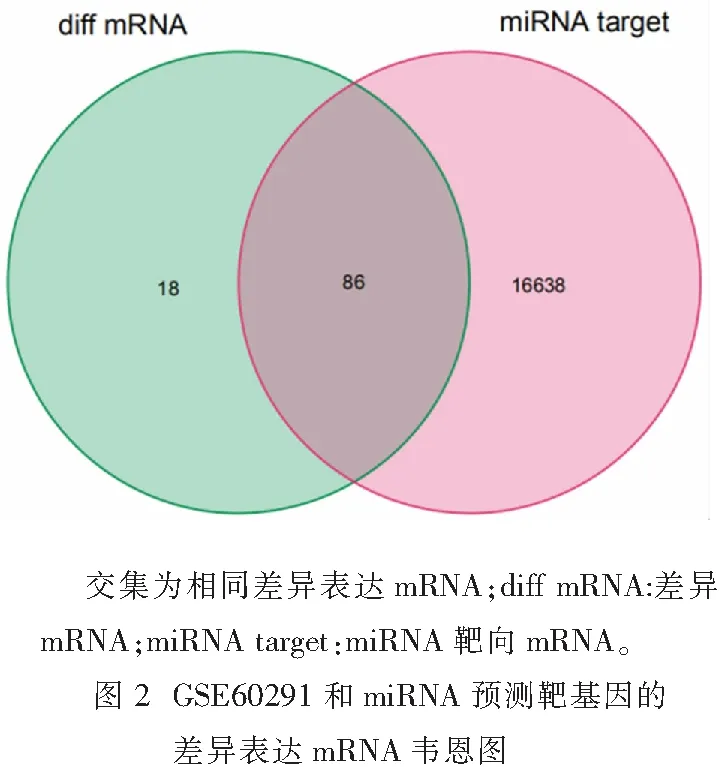
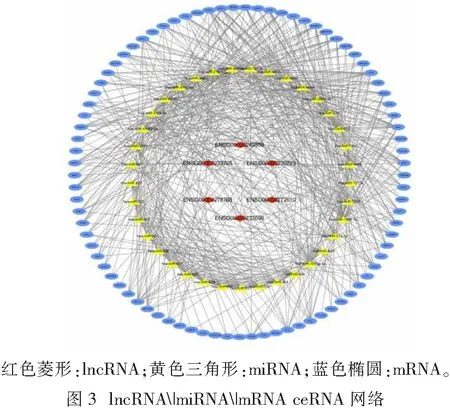
在lncRNA数据库中检索得到6个与心脏肥大相关的lncRNA,通过Starbase数据库(http://starbase.sysu.edu.cn/)筛选出6个lncRNA对应的37个miRNA。将37个miRNA通过miRNet(https://www.mirnet.ca/)预测miRNA对应的mRNA,最终得到16 724个靶基因,将所有靶基因与分析芯片得到的差异表达基因进行取交集得到共同差异基因86个,使用生物信息学与进化基因组学网站(http://bioinformatics.psb.ugent.be/cgi-bin/liste/Venn/calculate_venn.htpl)绘制韦恩图(图2)。使用Cytoscape v3.7.1进行lncRNA-miRNA-mRNA网络构建,其中包括差异表达RNA 86个,miRNA 37个,有调控关系的lncRNA 6个。见图3。
2.3 GO功能和信号通路富集分析
将所筛选出的差异表达基因分别在分子功能、生物过程、细胞成分3个方面进行分析。根据GO功能注释,在细胞成分方面显示目标基因富集于黏着斑、前突触、突触小泡等。见图4A。生物过程分析结果表明目标基因在肌肉组织发育、肌肉器官发育、横纹肌组织发育、DNA复制等过程中富集显著。见图4B。而分子功能分析表明目标基因在ATP酶活性、DNA结合转录激活因子活性、RNA聚合酶Ⅱ特异性、DNA结合转录因子结合等方面显著富集。见图4C。KEGG分析结果显示目标基因主要在MAPK信号通路、细胞周期、细胞凋亡、乳腺癌等方面富集显著。见图5。
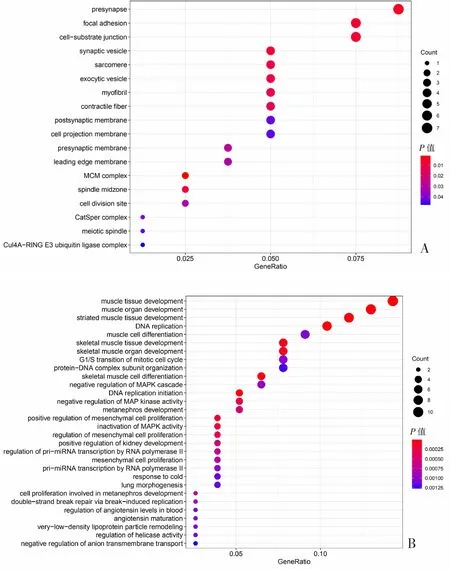
A:细胞成分;B:生物过程;Count:空集于该功能的miRNA数目。图4 靶基因GO富集分析可视化气泡图

C:分子功能;Count:空集于该功能的miRNA数目。图4(续)
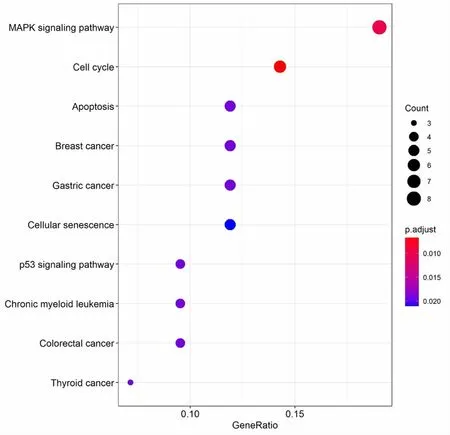
图5 靶基因KEGG通路富集分析可视化气泡图
3 讨论
lncRNA构成了人类转录基因组的大部分,在许多细胞过程如细胞分化、组织器官发育、癌症中均发挥重要作用[8]。有研究[9]发现,竞争性内源性RNA即ceRNA与具有共享miRNA反应元件(miRNAs responses elements,MRE)的miRNA的mRNA竞争,并通过影响miRNA的可用水平以此充当miRNA的调节剂,而lncRNA与环状RNA则以共同共享的MRE以此充当miRNA的“海绵”,抑制正常的miRNA和靶向mRNA的活性。这些MRE共享元件形成转录后ceRNA以调节mRNA表达。lncRNA可作为ceRNA与miRNA竞争性地结合,调节miRNA的沉默与表达并在许多生物过程中发挥作用,如有研究[10]发现lncRNA-ROR与胚胎干细胞(embryonic stem cell,ESC)中的核心转录因子(transcription factors,TF),即Oct4,Sox2和Nanog共有共同的MRE,螯合miR-145降低了miRNA介导的这些转录因子的阻遏效应,提示在典型的ceRNA机制中,当Linc-ROR和核心ESC TF相互交叉调节以提高它们的水平时,ceRNA的活性导致了Linc-ROR和核心ESC TF之间的反馈调节环,且这种反馈调节回路在ESC中运行,以维持多能性。在lncRNA-miRNA-mRNA轴的基础上,lncRNA可能参与多种病理生理过程,影响心脏疾病的发生与发展。CHENG等[11]在探索lncRNA ZEB2-AS1与PTEN对细胞表面积的调控作用时,发现lncRNA ZEB2-AS1可以通过下调PTEN来刺激心脏肥大。另有研究[12]发现lncRNA Gm15834通过自身高表达来增强心肌细胞的自噬活性促进心肌肥大的发生,Gm15834还可以作为microRNA(miR)-30b-3p的内源性“海绵”RNA,在心肌肥大中被下调。抑制miR-30b-3p增强了心肌的自噬活性加剧了心肌肥大。这些研究均表明肥厚心肌中的lncRNA及其下游靶基因的表达谱在心脏肥大的病因与分子机制中有着重要的作用。
本研究利用lncRNADisease数据库筛选出6个与心脏肥大高度相关的lncRNA,对其进行miRNA及下游靶基因预测,再与通过GEO数据集GSE60291中筛选出的104个差异表达的基因取交集,共得到86个相同的差异基因。将lncRNA对应的miRNA所对应的靶基因分别与这86个差异基因取交集,以此成功构建出lncRNA-miRNA-mRNA ceRNA调控网络。随后对这86个差异表达基因进行GO功能分析与KEGG富集分析:靶基因在分子功能、生物过程、细胞成分3个方面最显著富集的为ATP酶活性、肌肉组织发育、前突触等方面,提示这些富集的基因或蛋白质分子在心脏肥大的生物学过程中扮演着重要的角色。KEGG通路富集分析发现,靶基因富集到丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路、细胞周期、细胞凋亡、p53信号通路等信号通路富集,提示在研究心脏肥大的发病机制与发展过程中应重点关注这些信号通路。MAPK是协调各种生理和病理事件(如癌症、炎症、心脏重塑等)的中央信号传导体,MAPK激活通常是通过膜受体或其它不确定的应激感应效应子来实现的,然后导致高度组织化的顺序发挥作用的蛋白激酶序列激活,这些蛋白激酶既放大信号又介导多种细胞质和核调节蛋白的磷酸化,由此MAPK可广泛地参与心肌肥厚、心脏重塑、心力衰竭等心血管疾病的发生发展[13]。最新研究[14]表明miR-326可通过阻断MAPK信号通路来调节心脏肥大的进程。BA等[15]发现大蒜素可以通过激活MAPK/ERK/mTOR信号通路抑制自噬的发生,从而减轻病理性心肌肥大。另有研究[16]证明大蒜及其代谢产物可通过诱导Na+/K+-ATPase在大鼠心脏中的活性来减轻心肌肥大及心脏重塑,其机制可能是在低Na+/K+-ATPase水平或活性通过NCX促进Ca2+流入,导致Ca2+积累,从而加速心肌坏死、收缩衰竭并引发心律失常。而钙超载是Iso诱导的心脏肥大和心力衰竭的机制之一。
本研究还发现lncRNA-miRNA-mRNA在调节心脏肥大的过程中,靶基因显著富集于黏着斑。黏着斑激酶(focal adhesion kinase,FAK)是一种广泛表达的非受体酪氨酸激酶,可转导整合素,生长和激素因子的信号,是许多基本生物学过程和功能(包括细胞黏附,迁移,增殖和存活)的关键参与者。FAK在这一功能范围内的参与支持了它在机体发育和疾病的重要方面的作用,例如中枢神经系统和心血管发育,癌症,心脏肥大和组织纤维化[17]。FAK在其非活化、活化和高活性状态之间是通过磷酸化来控制切换的。有研究[18]表明S910磷酸化的FAK可暴露埋藏的生长因子受体(growth factor receptor 2,Grb2)相互作用位点而引起病理性心脏肥大。在进一步的研究中通过计算机筛选PM2307被确定为最佳抑制剂,PM2307的结合亲和力优于FAT-Grb2复合物以及先前报道的小分子抑制剂,可以抑制生长因子受体2-局部黏着激酶相互作用,用于治疗病理性心肌肥大[19]。这些都提示FAK在心脏肥大的病理机制中有着重要作用。此外,肥厚心肌差异表达基因也显著富集于乳腺癌、胃癌、结直肠癌、自噬等多个信号通路,提示心脏肥大可能与这些癌症的发病机制有着共同之处,但具体需进一步探讨。
综上,本研究通过分析心脏肥大中的mRNA表达差异,成功构建lncRNA-miRNA-mRNA ceRNA调控网络,可望为研究心脏肥大的发病机制提供新的思路和潜在的治疗靶点。但本研究纳入的样本数量较少,这可能导致筛选的lncRNA、miRNA及mRNA出现偏差,在后续的研究中可提高样本数及深入的实验研究来验证这些差异表达基因的作用及调控网络的效应。
