植物多糖抗炎活性机制及其构效关系研究进展
2022-05-29吴现华张仁堂
刘 闯,吴现华,刘 静,张仁堂,
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.山东土地乡村振兴集团有限公司,山东济南 250000)
多糖,又名多聚糖,是由10 个以上的单糖组成的一类天然高分子聚合物,分为淀粉多糖和非淀粉多糖,在自然界中分布极广,通过糖苷键将醛糖或酮糖连接而成[1]。如今已经有超过300 种多糖被人们从各种天然产物中提取出来,其中,植物类多糖占比较高[2]。植物非淀粉多糖优势较明显,能够通过参与机体生理代谢发挥较广泛的药理作用,如抗氧化、降血糖、免疫调节、抗肿瘤和抗炎等生物活性[3]。因此,近年来对植物多糖的深入研究日趋增多,多糖的抗炎作用也已得到人们的认可,主要的研究集中在药食同源植物多糖,如枸杞多糖[4]、马齿苋多糖[5]和黄芪多糖[6]等,多糖在医学领域对炎症疾病的预防与治疗作用已成为国内外学者的研究热点。
炎症是一种常见的生理反应,在大多数情况下是有益的,受到刺激时可激活免疫系统帮助人体机能恢复正常,是人体的自动防御反应,红、肿、热、痛和功能障碍是其在临床症状上的五个主要表现[7]。但是,当炎症攻击人体自身组织时,对人体是有害的,严重时可致人死亡[8]。对于某些炎症的发病机制仍未明确,更没有彻底的治疗解决方法,只能依靠相关药物来缓解症状,例如溃疡性结肠炎(ulcerative colitis,UC)等[9]。目前,对于炎症的治疗药物主要分为甾体类和非甾体类两种,大部分抗炎药存在治疗周期长、费用高、副作用大、治疗效果不佳等缺点[10]。研究发现,植物多糖在预防和治疗炎症方面具有多途径、多靶点、低毒性、副作用小等独特的优势[11]。本文对植物多糖的抗炎作用、机制以及构效关系进行综述。
1 植物多糖抗炎机制研究
1.1 抗氧化应激
氧化应激与多种炎症性疾病的发生发展密切相关,其在病理过程中发挥着重要作用。氧化应激主要是指机体产生活性氧(reactive oxygen species,ROS)与消除活性氧之间的动态平衡失调,机体氧化与抗氧化的平衡被打破是导致多种疾病发生的主要原因,如类风湿性关节炎等[12]。炎症会导致中性粒细胞的炎性浸润,然后对机体造成氧化损伤并产生大量自由基,进而加剧炎症反应[13]。展锐等[14]研究发现大枣多糖对DPPH、ABTS 和羟基自由基均具有清除能力,同时,体外抗炎活性评价结果显示其仍具有较强的抗炎能力,进一步推断大枣多糖可以通过清除体内过量自由基,调节细胞内抗氧化酶活性,从而干扰炎症反应中的相关靶点,进一步增强其抗炎作用。另外,其他学者通过建立相关的炎症模型,体内评价了不同植物多糖的抗氧化作用以及抗炎活性,并进一步分析了两者的关联。例如,钟敏等[15]观察到高浓度正北芪多糖可显著提高UC 小鼠结肠组织的抗氧化能力,升高模型小鼠体内超氧化物歧化酶(superoxide dismutase,SOD)活力,降低一氧化氮合酶(nitric oxide synthase,NOS)活性、丙二醛(malondialdehyde,MDA)含量和一氧化氮(nitric oxide,NO)水平,进而缓解UC 的炎症症状。此外,猫爪草多糖也可降低MDA 含量以及提高SOD 活性,进而修复氧化应激损伤[16]。张晓晓等[17]测定了牛蒡多糖(ASALP)对脂多糖(lipopolysaccharide,LPS)诱导小鼠血清中SOD 活性、总抗氧化能力水平和MDA 含量的影响,发现LPS+ASALP 组的三者水平几乎恢复到对照组水平,结果表明ASALP 可能通过降低氧化损伤来减轻炎症。ROS 还可以触发NF-κB 和MAPK 途径,促进炎症介质的表达,从而加重炎症反应[18]。郑岚等[19]通过建立斑马鱼模型,研究发现黑蒜多糖具有显著的体内、体外清除自由基能力以及较明显的体内抗炎作用,结果显示,黑蒜多糖通过降低斑马鱼体内ROS 的产生来缓解过氧化损伤和炎症,所以其抗炎机制可能与其干扰ROS 介导的信号途径相关。
由上可知,氧化应激与炎症反应之间相互影响、相互作用,但关于炎症机制的氧化应激学说尚未明了,目前只是研究发现部分植物多糖可通过发挥一定的清除自由基和抗氧化作用进而缓解炎症反应,并推测其可能是通过抑制NF-κB 和MAPK 信号通路来发挥抗炎作用。
1.2 调节细胞因子的分泌
细胞因子是细胞之间相互影响的介质,在炎症的发生和维持中具有重要地位。目前为止,研究植物多糖发挥抗炎作用的细胞因子大多集中于肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-10(interleukin-10,IL-10)等[20]。巨噬细胞作为炎症发生发展过程的重要角色,当其受到外源体等入侵后会分泌一定的促炎因子和抗炎因子[21],从而发挥抗炎效果,如图1。

图1 多糖类物质影响炎症性肠病可能的作用机制[43]Fig.1 Possible mechanisms of the effect of polysaccharides on inflammatory bowel disease[43]注:↑:上调;↓:下调。
通过建立LPS 诱导的小鼠腹腔巨噬细胞RAW264.7 细胞炎症模型,罗志锋等[22]证实枸杞多糖可显著降低细胞上清液中TNF-α、IL-1β和IL-6的含量,同时,袁雷等[23]发现一种血满草酸性多糖可抑制炎症细胞中促炎因子(IL-1β,IL-6 和TNF-α)分泌并促进抗炎因子(IL-10)的产生,两种植物多糖均具有一定的抗炎能力且呈剂量依赖性。王倩等[24]建立了二甲苯致小鼠耳廓肿胀模型,发现只有高剂量的芡茎多糖处理能显著降低模型小鼠耳廓中IL-1β、TNF-α、IL-6 的含量并缓解小鼠耳廓肿胀度。研究发现红芪多糖[25]、牛蒡多糖[[17]、鱼腥草多糖[26]等均可通过调控炎症相关细胞因子而表现出较强的体内、体外抗炎活性。
此外,有些学者还研究发现,植物多糖的部分寡糖片段可降低免疫细胞中的炎症因子的表达。Popov 等[27]采用酸水解法降解甜椒果胶多糖得到了一种部分被甲基和乙酰基取代的主链为α-D-1,4 半乳糖醛酸多糖片段(CA-H),通过小鼠实验,发现CAH 可减少LPS 刺激的TNF-α的释放,并增加IL-10的产生。同时,Kuang 等[28]也是使用相同降解方法发现一种抗炎效果较好的含半乳糖醛酸含量很高的麻黄多糖片段,但进一步的水解后这一片段便失去了相关免疫活性,故可见多糖的分枝结构或空间构象与其发挥抗炎活性之间具有密切关系。而且半乳糖醛酸寡糖片段的聚合度与其生物活性之间呈一定的正相关[29]。
综上,通过测定细胞因子的水平变化来观察多糖对炎症反应的调控作用是较为常见的方法,深入研究细胞因子在炎症中的变化规律以及从分子水平探讨抗炎机制具有十分重要的意义。植物多糖的部分寡糖片段可干扰炎症因子的表达,但是其构效关系以及特定的信号通路仍需进一步揭示和总结。
1.3 调控免疫细胞
植物多糖能调节多种免疫细胞,其中包括非特异性免疫中的自然杀伤细胞(NK 细胞)、巨噬细胞、中性粒细胞等和特异性免疫细胞(如T/B 淋巴细胞等)的生长、分化或迁移进而增强机体的细胞免疫活性达到缓解炎症的作用[30]。
研究者发现韩国柑橘皮多糖[31]和马齿苋多糖[32]能有效激发NK 细胞活性以及降低促炎因子水平。黄芪多糖可通过改善巨噬细胞形态,恢复巨噬细胞增殖能力,从而改善肠黏膜的损伤及抑制肠道炎症反应[33]。郭艳等[34]实验证实黄芪多糖还可以抑制UC 模型大鼠体内辅助型T 细胞17 的细胞分化,进而控制溃疡性结肠炎的发生发展。中性粒细胞,作为血液非特异性细胞免疫系统中的重要组成部分,是病原体入侵后第一线[35]。在炎症性肠病中,当中性粒细胞移动到肠黏膜位置就会释放ROS、NO 等物质产生毒性[36]。孙晓红等[37]对人中性粒细胞进行离体培养并采用LPS 诱导成功建立了炎症细胞模型,加入北五味子多糖(NSCP)进行观察,结果显示,NSCP 组凋亡百分率显著高于模型组、TNF-α水平较LPS 组明显下降,且均与处理时间和浓度呈正相关,因此推断NSCP 可缓解炎症细胞因子对中性粒细胞凋亡的抑制作用而表现出一定的抗炎活性。Popov 等[38]将蔓越莓多糖应用到结肠炎模型小鼠,观察到多糖参与后降低了小鼠腹腔中性粒细胞的粘附性,抑制了嗜中性粒细胞向肠黏膜的迁移,表明蔓越莓多糖通过减少嗜中性粒细胞的浸润而发挥预防乙酸性结肠炎作用。
综上,植物多糖是通过增强巨噬细胞的吞噬和分泌能力、激活NK 细胞活性、促进T/B 淋巴细胞的增殖分化以及阻碍中性粒细胞的迁移从而发挥抗炎活性。但是机体免疫细胞类型众多,而且往往是通过多个信号通路间相互作用调节机体免疫,在炎症性肠病的发生、发展及转归中发挥重要作用,因此关于植物多糖对动物免疫调节作用和抗炎活性的关系机制方面仍需进一步研究探索。其中,中性粒细胞与结肠炎的联系较为紧密,然而其具体作用机制尚不明确,有研究表明它不仅可以介导炎症反应[39],还可以参与组织修复[40],因此,对中性粒细胞在炎症性疾病中具体作用和机制的深入研究是必要的。
1.4 改善肠道菌群、肠黏膜屏障
健康者的肠道细菌总数可达百万亿个,肠道菌群的功能强大,与许多疾病的发生和发展息息相关。已有研究证实,植物多糖具有调节肠道菌群比例、改善肠道完整性和修复肠黏膜等功能,如图1。目前,对于多糖-肠道菌群-疾病关系的相关研究越来越多,因人体缺乏水解多糖的相关酶,多种多糖难以被机体直接吸收,进入肠道后可与微生物相互作用,通过改变肠道菌群比例以及被降解产生短链脂肪酸(shortchain fatty acids,SCFAs)进而表现抗炎、抑菌等多种药理活性[13]。由表1 可知,与炎症相关的肠道微生物多为普雷沃氏菌、瘤胃球菌、拟杆菌属以及丁酸菌、螺旋菌、乳酸菌、双歧杆菌等,研究证实前者与促炎细胞因子(TNF-α、IL-1β、IL-6 等)的表达呈正相关,后者与抗炎细胞因子(IL-10 等)的分泌呈正相关[11]。另外,毛螺菌科和考拉杆菌属等能促进SCFAs的生成,有助于调节肠内稳态[41]。而且植物多糖可以缓解结肠炎小鼠肠道黏膜损伤,维护肠道屏障的完整性,据研究报道,肠道菌群与肠黏膜屏障之间具有协同作用[42]。综上,植物多糖可发挥益生元功能促进部分有益菌的繁殖,而肠道菌群又与免疫密不可分,因此,多糖可通过此途径发挥抗炎作用。但是,植物多糖抗炎机制较为复杂,是多靶点多途径综合作用的结果,探究其分子机制十分必要。
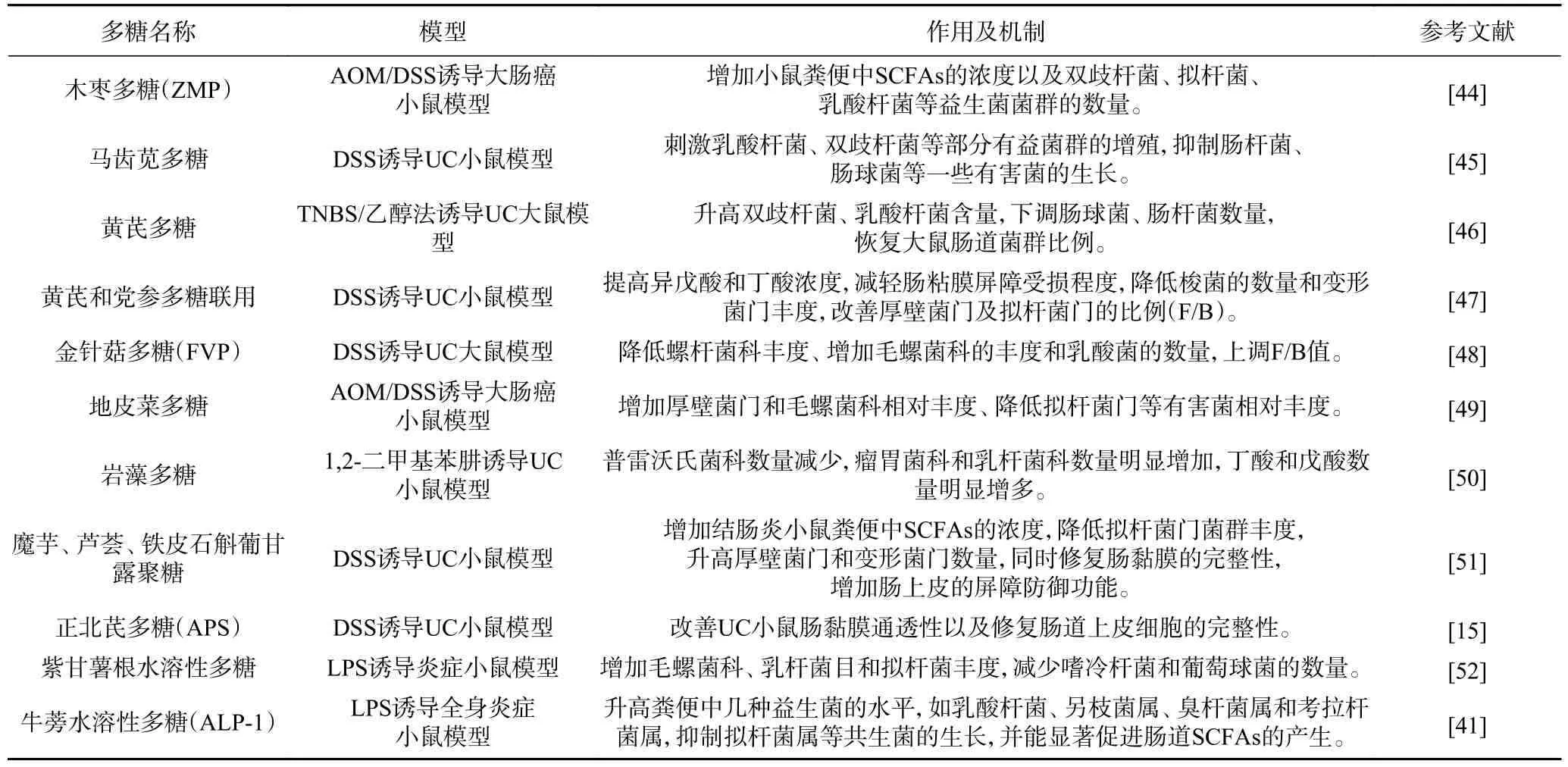
表1 植物多糖对炎症动物模型肠道菌群的影响Table 1 Effects of plant polysaccharides on intestinal microflora in inflammatory animal models
2 植物多糖抗炎构效关系研究
2.1 平均分子量
研究表明植物多糖的分子量大小与其活性功能之间有较大关系[53]。
李苹等[54]使用3.5、50、100、300、1000 kDa 的透析袋对醋柴胡粗多糖进行透析,得到6 种不同分子量区间的多糖片段,进而研究了6 种多糖对RAW264.7细胞的影响,结果表明,醋柴胡多糖可增加细胞吞噬活性,但1000 kDa 以上分子量的多糖较其它分子量多糖增加更明显,表明大分子量多糖可在机体炎症反生早期发挥作用,对病原体进行吞噬杀灭。张鑫等[55]分离出9 个分子量片段的枸杞多糖,进一步采用谱效灰色关联度分析方法探讨了其中在2~106kDa分子量之间的7 种多糖与抗炎作用之间的关系,结果表明分子量约为34.6 kDa 的枸杞多糖片段与抗炎活性相干性最强,推断可能该分子量片段的枸杞多糖在药理活性中表现主要作用。戴玮等[56]采用半仿生提取工艺和水提法得到分子量为521.37、262.50 kDa的霍山石斛多糖,发现二者均可抑制LPS 刺激RAW264.7 细胞的炎症因子NO 和IL-1β的异常分泌,但前者的抑制效果优于后者。刘艳芳[57]研究了不同分子量范围的赤芝多糖组分,并比较了各组分多糖的体内外抗炎活性,结果显示,低分子量组分(3.5×104g/mol)的抗炎功效强于大分子量多糖组分(1.80×106g/mol 及以上)。
大部分学者认同低分子量多糖药理活性更强的说法,但是如果分子量过低就无法构成与生物活性相关的聚合结构[58]。然而,有些植物多糖反而是大分子量的抗炎活性强于低分子量,这可能也与多糖的链构象等因素有关,因此,多糖种类、分子量与生物活性三者之间的关系较复杂,不同种类多糖能够发挥最佳具体生物活性的分子量分段不同。
2.2 单糖组成、糖苷键类型和位置
由不同种类的单糖和糖苷键类型所构成的多糖,其生物活性存在显著差异。因此,单糖组成和糖苷键的类型和位置,既是研究多糖的基础和前提,也是进一步探究其构效关系的重要组成部分。
单糖组成对多糖的生物活性有显著影响[59],如表2 所示,大部分植物多糖主要由阿拉伯糖(LArabinose,Ara)、半乳糖(Galactose,Gal)、葡萄糖(Glucose,Glc)、鼠李糖(L-rhamnose monohydrate,Rha)、甘露糖(Mannose,Man)、木糖(Xylose,Xyl)和岩藻糖(Fucose,Fuc)组成。其中,葡聚糖(DGlc 均聚物)已被证明对炎症性疾病具有较强的改善作用[60]。有研究人员通过给感染杀鲑气单胞菌的鲤鱼喂食β-D-1,3 连接的葡聚糖,发现这类β-葡聚糖可以显著地下调肠道内皮细胞的TNF-α、IL-1β和IL-6 的表达而缓解炎症[61]。此外,那些岩藻糖含量较高的多糖往往表现出显著的抗炎活性。例如,Kang等[62]通过对一种昆布多糖分步纯化,分别得到含有48%、65%、69%和82%的岩藻糖的四种多糖,进一步比较这四种多糖的抗炎活性,发现它们对LPS诱导的RAW264.7 巨噬细胞生成NO 的水平具有抑制作用,而且抑制效果依次升高。
糖苷键的类型和位置可能影响多糖的抗炎活性。多糖发挥抗炎活性与机体的免疫调节密切相关,已有研究证实,β-(1→3),(1→6)糖苷键被认为在增强免疫调节作用中起重要作用[63]。例如,Wei 等[64]以狭叶香蒲为原料,提取并分离纯化得到两种多糖(PTA-1、PTA-2),其中,PTA-2 由葡萄糖(66.7%)和鼠李糖(33.3%)组成,PTA-1 由β-(1,3)糖苷键组成。然后通过建立LPS 刺激的RAW264.7 巨噬细胞模型,发现PTA-2 干预后细胞TNF-α水平下降,IL-6 水平显著降低,ROS 表达下调,表明PTA-2 具有抗炎作用。同时,Jen 等[65]比较了五种不同由β-糖苷键连接的水溶性蘑菇和植物多糖的体外抗炎活性得出结论,含β-(1→3,1→6)糖苷键的多糖具有更强的抗炎活性。另外,一种主要由Ara、Rha 和葡萄糖醛酸(Glucose Acid,GlcA)以(1→4)糖苷键连接的豆渣水溶性多糖也表现出较强的体外抗炎作用[66]。目前,一般认为β构型的多糖活性较高[58]。由表2可以看出,一般具有(1→3)、(1→4)和(1→6)糖苷键的多糖都表现出一定的生物活性;同时发现Gal 和Glc 的含量占比相对较高,因此,可以猜测二者与植物多糖抗炎作用可能相关。
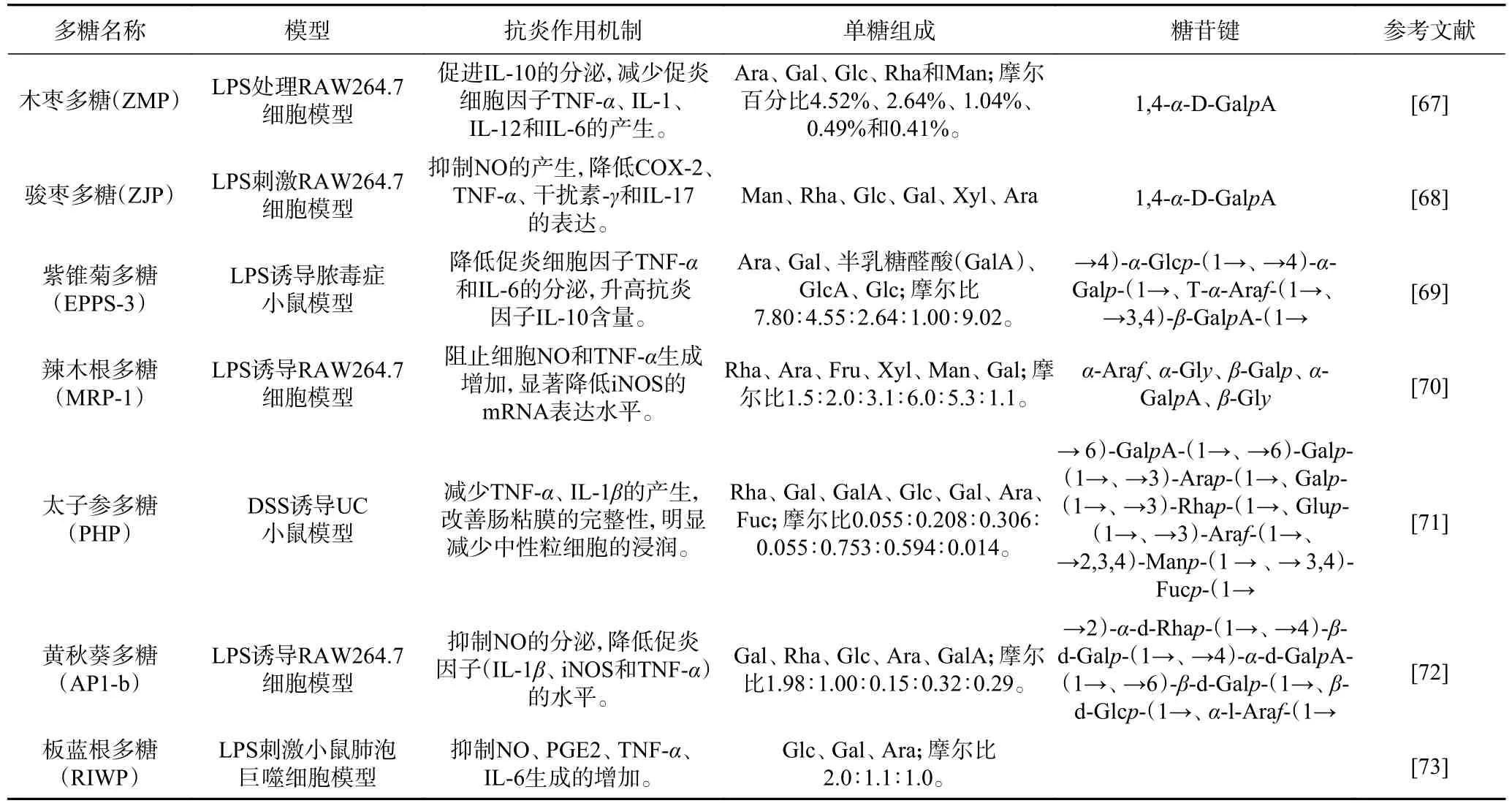
表2 植物多糖的抗炎作用机制以及单糖组成和糖苷键结构Table 2 Anti-inflammatory mechanism, monosaccharide composition and glycosidic bond structure of plant polysaccharides
2.3 主链与支链
一般来说,支链较主链的分子作用小,而且它可以调节多糖的空间构型,因此,其分支度、长度和取代位置对多糖的药理活性有较大影响。分支复杂程度较高的多糖其抗炎活性普遍强于单个分支链的多糖[74],但并非分支度越高抗炎活性越好,张超[75]对三棱多糖的几个多糖组分进行部分酸水解处理,发现多糖支链和分子量的减小反而促进了多糖的抗炎效果。已有研究表明,以β-(1→3)-D-葡聚糖为主链的多糖具有更强的生物活性,但支链上必须有β-(1→6)键[76]。Neyrinck 等[77]发现分子量在4500~5500 kDa之间的带有1,6 分支的β-D-1,3 连接的葡聚糖对LPS 诱导的小鼠肝损伤具有显著的抗炎作用。根据表3 可知,不同植物多糖的主链与支链差异较大,但均具有较高的复杂度。有研究表明,分支度较高的多糖在抗炎活性方面高于单一支链多糖,既可调节相关细胞因子的释放又可抑制NO 的产生[78]。侧链的存在与发挥抗炎活性密切相关,但是关于植物多糖主链和侧链与其具有抗炎作用的构效关系尚不完全清楚。
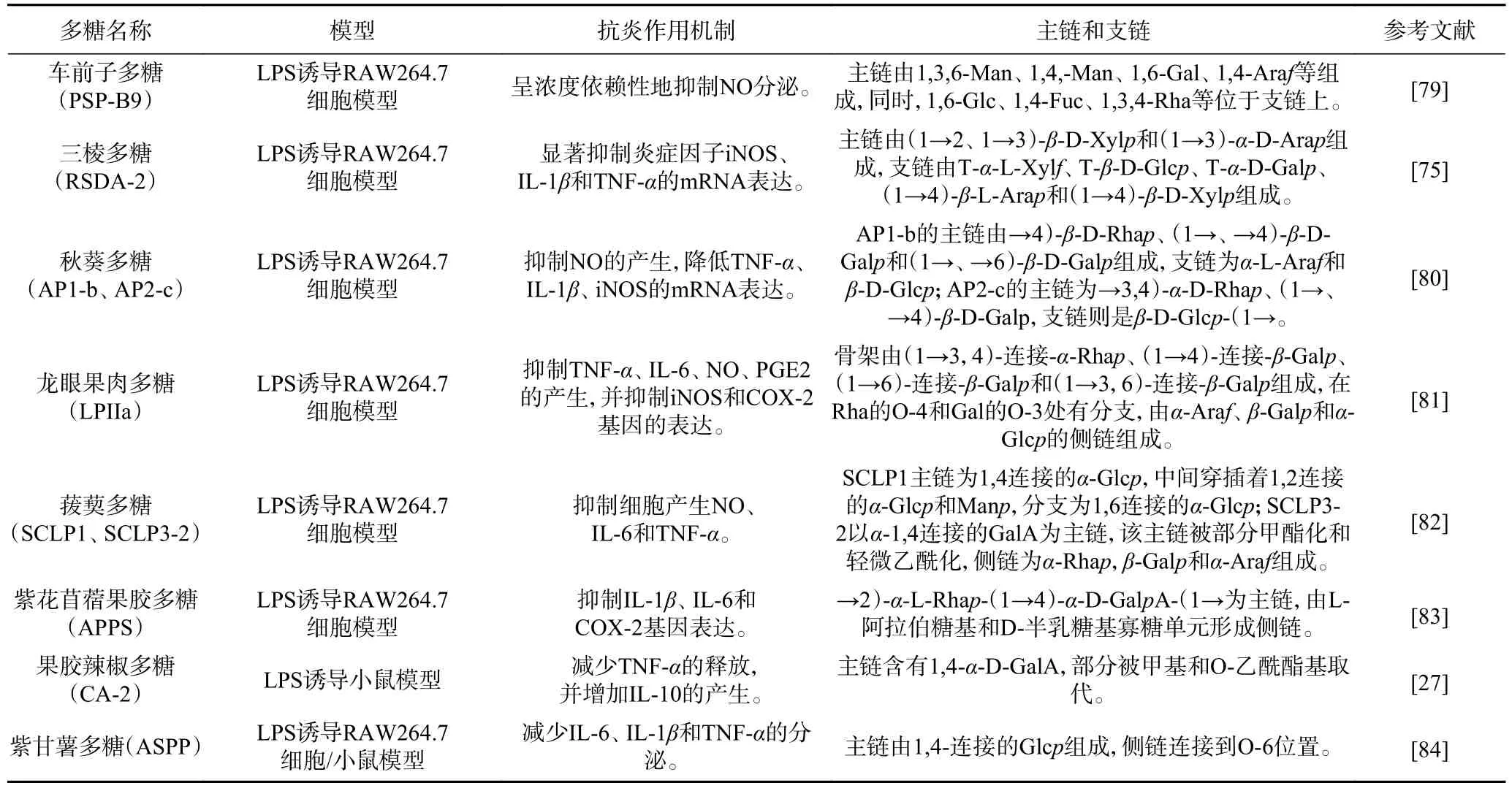
表3 植物多糖的抗炎作用机制及其主链、支链组成Table 3 Anti-inflammatory mechanism, main chain and branch chain composition of plant polysaccharides
2.4 化学修饰
多糖取代基的存在与否和种类差异对其药理活性也有影响,可通过对多糖进行羧甲基化、硫酸化、乙酰化、硒化等分子修饰方法,增强其抗炎活性。
袁雷等[23]对血满草多糖进行硫酸化修饰,探究了二者对LPS 诱导的RAW264.7 细胞炎性反应的影响,发现两种多糖均可显著抑制促炎因子IL-1β,IL-6 和TNF-α的分泌,并提高抗炎因子IL-10 的含量,但在高浓度(1600 μg/mL)情况下,多糖改性后的抗炎作用明显增强,甚至接近阴性对照组的治疗效果。王筱霏[85]发现黄芪多糖经硫酸化修饰后体外抗炎效果得到增强,即相同剂量条件下,硫酸化多糖在减少炎症因子(TNF-α、IL-1β、IL-8)的分泌和增强紧密连接蛋白(ZO-1、occludin)的表达方面显著强于未修饰多糖。此外,同一多糖浓度下,硒化乌拉尔甘草多糖作用于LPS 刺激下细胞体外炎症模型的抗炎效果优于未硒化多糖[86]。
通过化学方法可对多糖取代基团进行添加或消除,但是并不是所有的改性方法都可以增强多糖原本较弱的药理活性或者激发其原本不具有的活性。近年来,对活性多糖改性的研究成为热点,关于多糖改性后的具体结构变化与活性之间的构效关系仍需深入的阐释。
2.5 高级结构
植物多糖的高级结构对生物活性的影响远远大于初级结构。
赵宏等[79]采用原子力显微镜法对具有体外抗炎活性的车前子多糖(PSP-B9)进行研究,发现其分子链较短,且3D 结构显示其表面有若干不规则密集的凸起。X-射线衍射法分析表明枸杞多糖(LEP)形成具有非晶态结构的半晶态聚合物,可抑制卡拉胶诱导的小鼠炎症反应[87]。目前,对于三螺旋结构多糖的抗炎活性研究主要集中于真菌类多糖。例如,刘晓菲等[88]通过刚果红试验和圆二色谱法检测发现羧甲基茯苓多糖具有三螺旋结构,且能够发挥显著的体外抗炎活性。同时,赤芝多糖也表现出较好的体内外抗炎活性,在水溶液体系中也具有三螺旋结构[54]。然而,刘玮等[89]发现姬松茸多糖没有三螺旋构象,但仍表现出一定的体外抗炎作用。研究表明,三螺旋结构是多糖具有药理活性的重要空间构型,如果多糖的三螺旋结构遭到破坏,那么其药理作用效果将会显著下降[90]。而且适当的分子量和三螺旋链构象均有利于三螺旋多糖生物活性的提高[91]。目前关于具有抗炎活性植物多糖结构的研究大部分仍停留在一级结构,而空间结构与生物活性关系的研究主要集中在抗氧化和抗肿瘤方面,因此,探究并阐释植物多糖抗炎活性与高级结构之间的构效关系有重要意义。
3 总结与展望
植物多糖来源广泛,且不同种类、不同产地、不同部位、不同提取纯化方法都会得到初级结构甚至高级结构存在差异的多糖,进而影响其生物活性。目前的研究认为人体缺少多糖水解酶,机体不能直接吸收和消化多糖,而是通过进入肠道后一方面被微生物降解为单糖以及生成某些代谢物进一步发挥重要作用;另一方面,认为多糖具有益生元作用,通过改善肠道菌群的比例而达到治疗部分疾病的作用。
多糖的抗炎作用作为其多种药理活性之一,众多学者已经通过体外和体内实验对多糖的抗炎效果进行了评价。体外炎症主要采用LPS 诱导的RAW264.7细胞建立模型,动物实验大部分集中于急性DSS/TNBS 诱导小鼠或大鼠结肠炎模型的研究。通过测定促炎和抗炎炎症因子的分泌以及观察炎症症状和相关部位的组织切片情况,对不同多糖的抗炎效果进行评价。众多研究表明,植物多糖主要通过下调炎症相关NF-κB 和MAPK 信号通路中相关蛋白的磷酸化水平,调控炎症因子TNF-α和IL-1β基因转录,降低促炎因子IL-6 分泌并升高抗炎因子IL-10 含量以及降低蛋白iNOS 和COX-2 的表达量,从而起到治疗炎症的作用[92]。但是,大部分对于抗炎机制的研究仍停留在表面,对于分子水平和基因层次的研究较少。而且多糖的抗炎机制往往是通过多途径、多靶点等方式来实现,与机体免疫调节和肠道菌群密不可分。因此,进一步研究揭示多糖在治疗结肠炎及调节肠道菌群方面的潜在作用机制具有十分重要的意义。
目前,对于植物多糖一级结构的研究较多,但是仍需进一步剖析多糖初级结构甚至高级结构和抗炎之间的联系。例如,确定不同种类多糖发挥抗炎活性的具体分子量区间,并探究此区间多糖片段的抗炎作用方式,可能直接作用于免疫系统或间接作用于肠道微生物;研究抗炎活性多糖的单糖、糖链构型及构象,揭示其发挥抗炎活性的必要结构;讨论多糖主链和支链的抗炎作用机制差异,如侧链可能与细胞表面起作用,而主链可能通过其它途径起作用,以及通过改变侧链分支度对抗炎活性的影响;多糖高级结构的解析与药理活性的关系研究是未来的重点和趋势,仍存在许多问题亟待解决,例如,是多糖三螺旋构象还是其中的单链发挥抗炎作用;植物多糖三螺旋结构与抗炎活性之间具体的作用机制,如巨噬细胞NO 的生成和部分免疫因子的表达与多糖三螺旋构象密切相关,而干扰素的合成则与三螺旋结构不相关[93]。因此,采用多种技术联用、新兴技术的应用以及计算机模拟空间构象等方法深层次测定多糖的高级结构是必要的。此外,利用不同技术对多糖进行结构修饰,改善其结构特性,增强其抗炎活性,使植物多糖开发成治疗炎症性疾病的药物分子成为可能。
