三种益生菌与低聚果糖复合粉对小鼠免疫功能的影响
2022-05-29苏硕楠侯林中
苏硕楠,侯林中
(唐山市工人医院,河北唐山 063003)
肠道内特定的微生物群可有效维持免疫平衡,并对人体健康起着至关重要的作用,当正常微生物群遭到破坏则打破了肠道免疫系统平衡,可能会引发疾病[1−2]。益生菌可通过改善肠道微生物构成、产生抗炎因子、抑制病原菌群生长,从而预防和治疗一些消化道疾病[3−5]。乳杆菌属(Lactobacillus)细菌是肠道正常菌群中益生菌的重要成员,近年来越来越引起食品科学、微生物学、微生态学等领域的关注[6−8]。
乳双歧杆菌V9(Bifidobacterium lactisV9,B.lactisV9)、干酪乳杆菌Zhang(Lactobacillus caseiZhang,L.caseiZhang)、植物乳杆菌P-8 (Lactobacillus plantarumP-8,P-8)均为国内外目前用于开发的重要的Lactobacillus属细菌[9−11]。这三种菌株均具有良好的耐酸性,能够较好的耐受人工胃液、肠液以及胆盐,是目前国内外重点研究开发的益生菌[12−13]。越来越多研究证明,Lactobacillus属细菌对维持肠道微生态平衡,增强肠道免疫功能尤为重要[5,14]。
不同乳酸菌株的免疫调节功能因菌株类型而异。一方面是由于不同菌株细胞壁构成不同,其对免疫细胞的影响也不同[5]。另外一方面,不同的乳酸菌产生的胞外多糖等代谢产物亦不同,其对免疫力的影响也不同[15−17]。低聚果糖(fructo-oligosaccharide,FOS)是一种不易被小肠吸收的膳食纤维,可促进肠道中双歧杆菌的生长,抑制病原菌生长,从调节肠道菌群[18−19]。研究表明,益生菌与低聚果糖等益生因子合用可更好地调节机体免疫力[20]。但益生菌V9、P-8、Zhang 与FOS 联合使用对免疫系统的影响尚未见研究报道。本文重点通过检测三种益生菌(乳双歧杆菌V9、干酪乳杆菌Zhang、植物乳杆菌P-8)与低果聚糖复配的益生复合粉(BLLF)对小鼠免疫脏器指数、细胞免疫、单核-巨噬细胞功能、体液免疫及NK 细胞活性的影响,以探讨其对小鼠免疫功能的调节作用,为其开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
乳双歧杆菌V9(活菌数2000 亿/g)、干酪乳杆菌Zhang(活菌数2000 亿/g)、植物乳杆菌P-8 菌粉(活菌数2000 亿/g)、低聚果糖 金华银河生物科技有限公司;刀豆蛋白A(ConA)、二硝基氟苯(DNFB)
Sigma 公司;Hank's 液、RPMI1640 培养基、胎牛血清 美国Gibco 公司;MTT 试剂盒、LDH 检测试剂盒 英国Abcam 公司;淋巴细胞分离液、0.4%台盼兰溶液 北京索莱宝科技有限公司;印度墨汁、YAC-1 细胞、20%鸡红细胞 上海源叶生物科技有限公司;1% NP40、0.2 mol/L 的Tris-HCl 缓冲液(pH=8.2) 碧云天生物科技有限公司;C57BL/6J 小鼠(雄性,18~22 g) 购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2019-0010,饲养环境:室温(23±2)℃,相对湿度:40%~70%。
MS3 基本型旋涡混合器 德国IKA 公司;去离子水发生器 美国Millipore 公司;Multiskan MK3型酶标仪 美国Thermo Scientific 公司;721 型分光光度计 上海精密科学仪器有限公司;CX33 显微镜日本奥林巴斯。
1.2 实验方法
1.2.1 实验动物及给药 参考文献配比比例[15−16],称取冷冻干燥保存的乳双歧杆菌V9、干酪乳杆菌Zhang、植物乳杆菌P-8,按照质量比50:25:25 的比例用双蒸水溶解至所需浓度后,备用。低聚果糖用双蒸水溶解至所需浓度后,备用。将小鼠随机分为8 个免疫组,每个免疫组分为4 个实验组,即蒸馏水组(空白组)、BLLF 低、中、高剂量组(三联菌0.01 mg/kg+低聚果糖0.1 g/kg、三联菌0.02 mg/kg+低聚果糖0.1 g/kg、三联菌0.06 mg/kg+低聚果糖0.1 g/kg)0.1 mL/10 g 体重,每日灌胃1 次,连续30 d。按照文献中增强免疫力的研究方法对BLLF 进行评价[21−24]。
1.2.2 小鼠体重及免疫脏器指数的测定 每周称量一次各组小鼠的重量,实验当天称重结束后颈椎脱臼处死,无菌取出小鼠的脾脏、胸腺,将周围组织剥离干净,用滤纸吸净组织表面血液后,称重,分别计算胸腺或脾脏重量(mg)与体重(g)的比值[25]。
1.2.3 ConA 诱导小鼠脾淋巴细胞转化实验 无菌取脾,磨碎后过滤,制成浓度为3×106个/mL 的单细胞悬液。每孔1.0 mL,加至24 孔培养板中,实验组加75 μL ConA/孔(终浓度为7.5 μg/mL),对照组加75 μL 无菌水,继续培养72 h。测定实验孔和对照孔在570 nm 处的OD 值[26−27]。
1.2.4 DNFB 诱导小鼠迟发型变态反应(DTH)实验(耳肿胀法) 小鼠腹部脱毛后,取50 μL 1% DNFB溶液,均匀涂抹在小鼠腹部皮肤进行致敏反应。5 d后,取20 μL 1% DNFB 溶液均匀涂抹右耳上,左耳作为对照。24 h 后处死小鼠,采用打孔器取相同大小的左右耳片进行称重。以两耳片的重量之差表示DTH 的程度[28−29]。
1.2.5 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法) 取20%鸡红细胞悬液1 mL,腹腔注射进入小鼠体内。30 min 后脱臼处死,经腹腔注入生理盐水2 mL,转动鼠板1 min 后,吸出腹腔洗液1 mL,平均分滴于2 片载玻片上,37 ℃保湿孵育30 min。生理盐水漂洗后,1:1 丙酮-甲醇溶液固定,4%(v/v)Giemsa-磷酸缓冲液染色3 min,蒸馏水漂洗晾干,油镜下观察计数,计算吞噬指数和吞噬百分率[30]。
1.2.6 小鼠碳廓清实验 将用生理盐水4 倍稀释的印度墨汁尾静脉注入小鼠0.1 mL/10 g。于注入墨汁第2、10 min 分别从内眦静脉丛取血20 μL,加到2 mL 0.1% Na2CO3溶液中。以Na2CO3溶液为空白对照,用分光光度计在600 nm 波长处测定OD 值并计算吞噬指数α[24,31]。
1.2.7 抗体生成细胞测定 收集绵羊红细胞(SRBC),用生理盐水配成2%(v/v)的细胞悬液,每只鼠腹腔注射0.2 mL 进行免疫。4d后处死小鼠,无菌条件下取脾脏,制备脾细胞悬液,用生理盐水稀释成5×106个/mL 的脾细胞悬液。用Jerne 改良玻片法检测抗体生成细胞[23]。
1.2.8 血清溶血素测定 同1.2.7 方法免疫小鼠,4 d后,摘除眼球血于离心管中,收集血清。取300 倍稀释后的血清1.0 mL,依次加入10% SRBC 0.5 mL、补体1.0 mL,反应20 min 后,离心取上清1.0 mL,加都氏试剂3.0 mL。以10% SRBC 0.25 mL 加都氏试剂4.0 mL 混匀后作空白对照。540 nm 处测定各管光密度值,计算半数溶血值(HC50)[22−23]。
1.2.9 小鼠NK 细胞活性测定 收集YAC-1 细胞,调整细胞浓度至4×105个/mL。无菌取脾,制成单细胞悬液,调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(效靶比50:1),加入U 型96 孔培养板中,以加靶细胞+培养液各100 μL 的孔作为靶细胞自然释放孔,以加靶细胞+1% NP40 各100 μL的孔作为靶细胞最大释放孔。培养箱中继续培养4 h,1500 r/min 离心,每孔吸取上清100 μL 到平底96 孔培养板中,加入LDH 基质液100 μL,反应3 min,每孔加入1 mol/L 的HCl 30 μL,490 nm 处测定OD 值,计算NK 细胞活性[24]。
1.3 数据处理
数据以均数±标准差表示,每组n=10,采用SPSS 10.0 软件分析,多组间比较采用单因素方差分析(ANOVA)检验,成对组间比较采用t检验,P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 小鼠体重、胸腺、脾脏指数测定结果
实验期间,各组小鼠一般状况良好,未发现纳差、腹泻、中毒或自然死亡等现象。各组小鼠的初始体重和终末体重均无显著性差异(P>0.05),提示低、中、高剂量组BLLF 对健康小鼠均无明显毒性(见表1)。衡量机体免疫功能的指标为免疫器官的脏器系数,其中,胸腺和脾脏指数主要以反映免疫器官的发育和免疫细胞的功能状况为主,同时,间接反映了机体的整体免疫水平[25]。低、中、高剂量组的BLLF 对小鼠免疫脏器指数的影响结果详见表1。结果显示,给予小鼠BLLF 连续灌胃30 d,低、中、高剂量组小鼠的脾脏/体重比值、胸腺/体重比值与空白对照组相比差异均无统计学意义(P>0.05)。结果表明BLLF 对小鼠的免疫器官的重量无显著影响,进一步证明了其安全性。
表1 BLLF 对小鼠脏器/体重比值的影响(±s,n=10)Table 1 Effects of BLLF on mice organs ratios to body weight (±s, n=10)
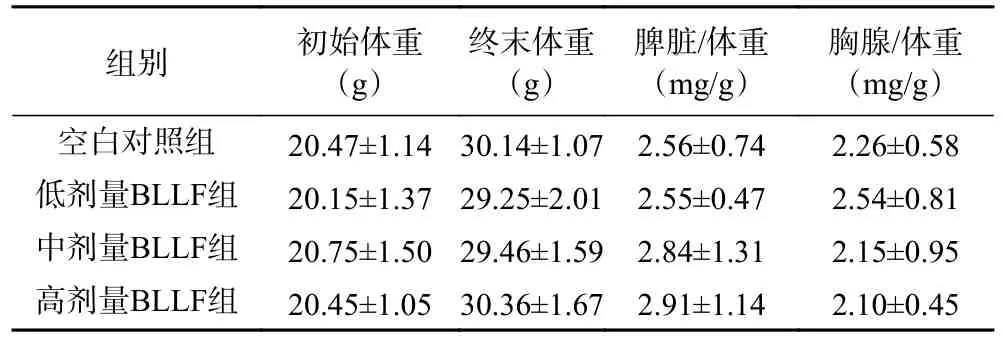
表1 BLLF 对小鼠脏器/体重比值的影响(±s,n=10)Table 1 Effects of BLLF on mice organs ratios to body weight (±s, n=10)
组别 初始体重(g)终末体重(g)脾脏/体重(mg/g)胸腺/体重(mg/g)空白对照组 20.47±1.14 30.14±1.07 2.56±0.74 2.26±0.58低剂量BLLF组 20.15±1.37 29.25±2.01 2.55±0.47 2.54±0.81中剂量BLLF组 20.75±1.50 29.46±1.59 2.84±1.31 2.15±0.95高剂量BLLF组 20.45±1.05 30.36±1.67 2.91±1.14 2.10±0.45
2.2 不同剂量BLLF 对小鼠细胞免疫功能的影响
T 淋巴细胞受到ConA 刺激后会转化为母细胞持续增殖。通过MTT 法检测其细胞增殖能力可以反映细胞免疫功能的强弱[25]。不同剂量BLLF 对ConA 促进脾淋巴细胞增殖作用结果见表2。统计发现,低、中、高剂量BLLF 组的OD 差值与对照组的OD 差值间均无显著性差异(P>0.05)。本实验结果表明BLLF 对小鼠的脾淋巴细胞的增殖能力无显著影响。
表2 BLLF 对ConA 诱导的小鼠淋巴细胞增殖能力及耳廓肿胀度的影响(±s,n=10)Table 2 Effects of BLLF on ConA-induced mouse splenic lymphocyte transformation ability and auricle swelling degree (±s, n=10)
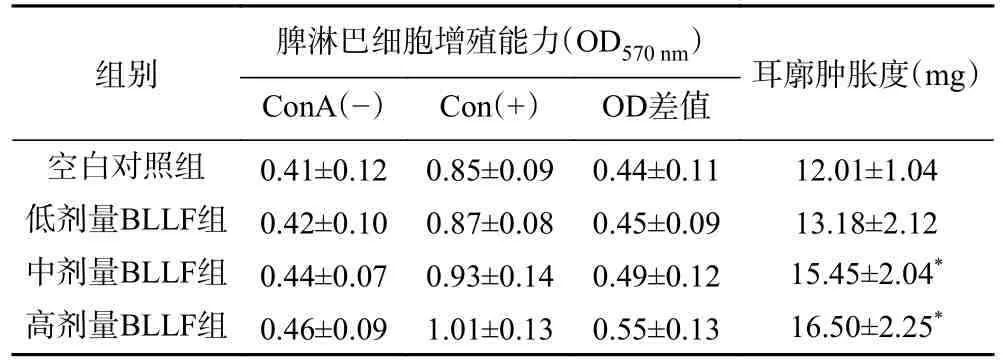
表2 BLLF 对ConA 诱导的小鼠淋巴细胞增殖能力及耳廓肿胀度的影响(±s,n=10)Table 2 Effects of BLLF on ConA-induced mouse splenic lymphocyte transformation ability and auricle swelling degree (±s, n=10)
注:与空白对照组比较,*P<0.05;表3~表5同。
组别脾淋巴细胞增殖能力(OD570 nm)耳廓肿胀度(mg)ConA(−) Con(+) OD差值空白对照组 0.41±0.12 0.85±0.09 0.44±0.11 12.01±1.04低剂量BLLF组 0.42±0.10 0.87±0.08 0.45±0.09 13.18±2.12中剂量BLLF组 0.44±0.07 0.93±0.14 0.49±0.12 15.45±2.04*高剂量BLLF组 0.46±0.09 1.01±0.13 0.55±0.13 16.50±2.25*
DNFB 涂抹于小鼠耳廓后,可引起迟发性变态反应,导致鼠耳局部组织增厚。小鼠耳廓肿胀度可反映小鼠细胞免疫功能的强弱[25]。表2 中的数据显示,中、高剂量BLLF 组的耳廓肿胀度显著(P<0.05)高于空白对照组。本实验结果表明BLLF 可增强DNFB 诱发的迟发性变态反应,正向调控小鼠的细胞免疫功能。研究表明,益生菌可影响肠道黏膜免疫细胞群的数量和分布,增强肠道免疫功能。低果聚糖在肠道不可被消化吸收,也可以促进肠道有益菌的增殖,进而增强益生菌免疫调控作用[19]。
2.3 不同剂量BLLF 对小鼠单核-巨噬细胞功能的影响
单核-巨噬细胞是具有抗感染、抗肿瘤和免疫调节作用的免疫细胞,反映了机体非特异性免疫反应的强弱。当机体受到病原体或异物侵入时,这些巨噬细胞能向这些部位募集,并通过胞吞作用吞噬并消化分解异物[26]。由表3 可知,给予小鼠低、中、高剂量的BLLF 30 d 后,与对照组相比,高剂量组小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数均显著(P<0.05)升高。
表3 BLLF 对小鼠巨噬细胞吞噬功能的影响(±s,n = 10)Table 3 Effects of BLLF on the function of monocyte macrophage of the mice (±s, n=10)
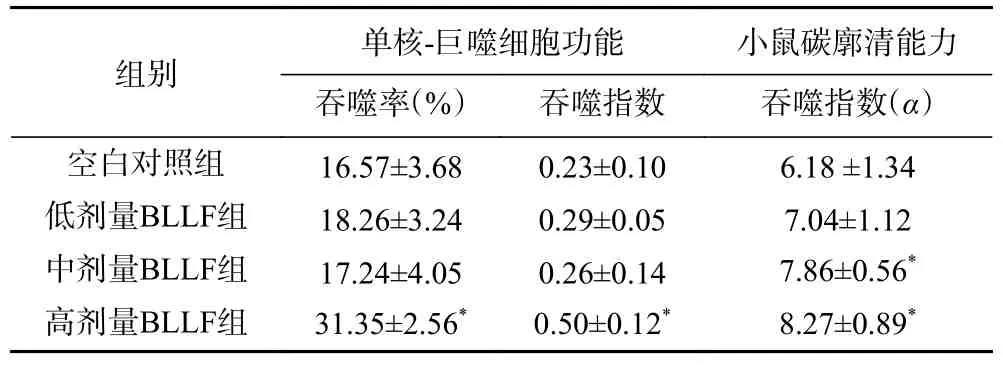
表3 BLLF 对小鼠巨噬细胞吞噬功能的影响(±s,n = 10)Table 3 Effects of BLLF on the function of monocyte macrophage of the mice (±s, n=10)
组别单核-巨噬细胞功能 小鼠碳廓清能力吞噬率(%) 吞噬指数 吞噬指数(α)空白对照组 16.57±3.68 0.23±0.10 6.18 ±1.34低剂量BLLF组 18.26±3.24 0.29±0.05 7.04±1.12中剂量BLLF组 17.24±4.05 0.26±0.14 7.86±0.56*高剂量BLLF组 31.35±2.56* 0.50±0.12* 8.27±0.89*
BLLF 对小鼠碳廓清功能的影响结果见表3。其中中、高剂量组小鼠的吞噬指数α与空白对照组相比具有统计学差异(P<0.05)。与对照组相比,中、高剂量组碳廓清功能显著升高(P<0.05)。这一结果表明BLLF 能有效增强小鼠巨噬细胞的吞噬能力,提示小鼠非特异性免疫能力明显增强。这可能是益生菌与低果聚糖共同作用的结果。益生菌可增强巨噬细胞的吞噬活性,当肠道受到到病原体或异物侵入时,这些巨噬细胞能向这些部位募集,并通过胞吞作用吞噬并消化分解异物,增加肠道防御能力。低果聚糖在肠道不可被消化吸收,且在肠道可促进肠道双歧杆菌的增殖[19]。
2.4 不同剂量BLLF 对小鼠体液免疫功能的影响
溶血空斑试验可用于体外检测和计数抗体生成细胞数目[31]。空斑的数量是反映机体的体液免疫功能的重要指标。低、中、高三个剂量BLLF 组与空白对照组的空斑数(每106脾细胞)见表4。统计分析结果表明,中、高剂量组的空斑数与空白对照组相比具有显著性差异(P<0.05),说明给予BLLF 能明显提高小鼠体液免疫功能。
表4 BLLF 对小鼠抗体生成细胞与血清溶血素检测结果(±s,n=10)
Table 4 Effects of BLLF on number of antibody producing cells and hemolytic activity (±s, n=10)

表4 BLLF 对小鼠抗体生成细胞与血清溶血素检测结果(±s,n=10)
组别 空斑数(每106脾细胞) HC50空白对照组 16±4 64.25±14.58低剂量BLLF组 18±2 73.43±18.37中剂量BLLF组 29±6* 95.68±10.54*高剂量BLLF组 30±4* 106.83±16.58*
小鼠体内产生的抗体溶血素在补体的参与下,与SRBC 共同孵育发生溶血反应,释放血红蛋白,而通过测定血红蛋白含量能反映动物产生溶血素的能力[24,26]。HC50的测定可评价SRBC 细胞发生溶血反应产生溶血素的能力。低、中、高三个剂量BLLF 组与空白对照组的HC50值见表4。统计分析结果表明,中、高剂量组的HC50值与空白对照组相比具有显著性差异(P<0.05)。这进一步证明,BLLF 可显著提高小鼠的体液免疫功能。益生菌可通过调节抗炎因子、转录因子等的分泌影响局部和整体的免疫应答反应,产生相应的抗体。低果聚糖也可以机体血清IgG 抗体的浓度,进而增强益生菌的体液免疫功能[20]。
2.5 不同剂量BLLF 对小鼠NK 细胞活性的影响
NK 细胞是机体重要的免疫细胞,其活化后可合成和分泌多种细胞因子,发挥免疫调节及靶细胞杀伤作用[28−29]。低、中、高三个剂量BLLF 组与空白对照组的NK 细胞活性见表5。统计分析结果表明,中、高剂量BLLF 组NK 细胞活性显著高于对照组(P<0.05)。这表明,中、高剂量BLLF 可显著增强NK 细胞的活性,进而提高机体靶细胞对NK 细胞杀伤的敏感性。益生菌及其代谢产物可通过增强机体的免疫反应,提高NK 细胞的杀伤活性。低果聚糖也可以调控如INFγ/IL-4、IL-10、TGF-β等的分泌,进而增强益生菌的体液免疫功能[20]。
表5 BLLF 对NK 细胞活性的影响(±s,n=10)Table 5 Effects of BLLF on NK cell activities (±s, n=10)

表5 BLLF 对NK 细胞活性的影响(±s,n=10)Table 5 Effects of BLLF on NK cell activities (±s, n=10)
组别 NK细胞活性(%)空白对照组 24.17±10.42低剂量BLLF组 27.24±14.15中剂量BLLF组 36.51±10.28*高剂量BLLF组 38.67±9.38*
3 讨论与结论
乳酸菌能够调节肠道微生物区系的平衡,在增强机体抵抗力方面具有不可低估的作用[6−7,32]。研究证实,不同益生菌株对免疫功能的影响也不同[3−5]。研究表明,不同的乳酸菌进入机体后,能通过不同的机制激活肠黏膜免疫系统,起到保护机体免受感染源的侵袭、抗突变和防癌、预防糖尿病和心血管疾病的作用[5,32−33]。赵雯等[32]研究表明,热灭活的乳双歧杆菌BL-99 能够通过增强免疫球蛋白A 的分泌,促使肠黏膜淋巴细胞的增殖,增强自然杀伤细胞和巨噬细胞功能等机制增强机体免疫力。乳双歧杆菌M8 可以通过增加淋巴细胞比例、T 淋巴细胞转化增殖能力和促进细胞因子分泌等机制改善细胞免疫、体液免疫及固有免疫,从而增强免疫功能低下的大鼠的免疫功能[33]。
随着益生菌产业的快速发展,多元化的复合益生菌产品不断涌现。研究表明,低聚糖类益生元可作为益生菌的营养和能量来源,协同促进益生菌在肠道的定植和功效发挥,增强益生菌的免疫保护功能。Finamore 等[34]研究发现,乳杆菌与长双歧杆菌的复合制剂能增强T 细胞、B 细胞的功能和NK 细胞活性进而提高机体免疫力。朱自平等[20]研究表明,嗜酸乳杆菌LA85 和低聚果糖复配组成合生元菌剂可显著增加小鼠迟发型变态反应、淋巴细胞转化能力、抗体生成细胞数、HC50值,并可提高小鼠单核-巨噬细胞吞噬能力和NK 活性。本研究评估了三种益生菌与低聚果糖复配的益生复合粉对机体免疫能力的影响,为其开发和利用提供实验依据。胸腺、脾脏是动物体内主要的免疫器官,胸腺和脾脏指数能反映免疫器官的发育和免疫细胞的功能状况[23−25]。本研究结果表明,各剂量BLLF 组小鼠脾脏指数和胸腺指数无差异。这初步明确了给予高、中、低剂量BLLF对小鼠的安全性。其急性毒性、遗传毒性、亚慢性毒性等尚需进一步的体内外实验验证。
ConA 诱导的T 细胞增殖转化率和DNFB 诱导小鼠DTH 常用来反映细胞免疫能力的强弱。近年来关于乳酸菌对迟发型超敏反应(DTH)的影响已有一些报道。如乳酸菌Lactobacillus casei(L. casei)活菌体细胞呈时间和浓度依赖性地增强鼠体内抗原特异性的DTH 效应[35]。本研究结果表明,BLLF 对ConA 诱导的脾淋巴细胞转化无显著影响(P>0.05),而中、高剂量BLLF 组的耳廓肿胀度显著高于空白对照组(P<0.05)。这与文献报道相符[34−35]。
乳酸菌细胞壁肽聚糖、脂磷壁酸或胞外多糖等成分激活免疫系统的巨噬细胞。常见的双歧杆菌、乳酸杆菌和鼠李糖乳杆菌都可以有效提高巨噬细胞的吞噬能力[32,34]。本研究结果表明,高剂量BLLF 可显著提高小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬能力(P<0.05),中、高剂量BLLF 可显著增加小鼠碳廓清功能(P<0.05)。益生菌细胞壁肽聚糖的主要成分是胞壁酰二肽,可激活巨噬细胞释放IL-1 和IL-6,诱导淋巴细胞产生IFN-γ,增强NK 细胞的杀伤作用[32−35]。本研究结果表明,中、高剂量BLLF 可显著增强NK 细胞的活性(P<0.05)。
综上所述,BLLF 可通过增强细胞免疫、单核-巨噬细胞功能、体液免疫及NK 细胞活性来增强小鼠的免疫系统水平。该制剂与其他益生菌复方制剂的相比,其对免疫功能的调控机制相似,但确切的分子水平的调控机制尚需进一步研究。本研究为乳双歧杆菌V9、干酪乳杆菌Zhang、植物乳杆菌P-8、FOS组成的复合制剂的增强免疫力的功能提供了基础数据支持,也为其进一步的开发和利用奠定了基础。
