西藏梨果仙人掌茎粗多糖组分分析及抗炎效果评价
2022-05-29程秀峰张金超刘振东
程秀峰,张金超,赵 倩,罗 章,刘振东
(西藏农牧学院食品科学学院,西藏特色农牧资源研发省部共建协同创新中心,西藏林芝 860000)
梨果仙人掌(Opuntia ficus-indica(Linn.) Mill.)又被称作米邦塔,营养和药用价值较高,食用历史悠久,且种类繁多,分布广泛[1]。西藏林芝市察隅县察瓦龙乡,位于林芝察隅县东南部,地理位置相对偏远,交通不便,但气候独特,盛产野生的梨果仙人掌。其富含多种营养物质和活性功能成分,多糖作为其功能性成分之一,含量较高[2]。仙人掌粗多糖是机体免疫调节剂,是细胞生长代谢过程中不可或缺的一类高分子化合物[3]。有研究表明,仙人掌多糖具有抗氧化、抗癌、抗病毒、降血糖、降血脂及增强免疫等多种生理活性[4]。郭利平[5]的研究表明:仙人掌多糖具有清除自由基、延缓衰老、降低血糖含量、防治癌症等功效。王海涛等[6]发现米邦塔仙人掌多糖能够有效抑制SDS 对细胞膜和DNA 的损伤。郭庆启等[7]表示仙人掌多糖提取液能够有效抑制大肠杆菌和枯草杆菌的生长繁殖。
炎症是生物体对损伤或感染的应答反应[8]。通常情况下,炎症过程能够被机体较好地调控,发挥其有利作用。但当其不受控制时,持续性的过度炎症反应就会破坏正常细胞的结构和组织功能。在炎症反应过程中,免疫细胞最先被激活,第一时间赶到机体的损伤部位,导致活性氧(Reactive oxygen species,ROS)的生成[9]。高浓度的ROS 对机体是有害的,会氧化蛋白及脂质细胞成分,破坏DNA 的完整性[10]。炎症反应过程,能导致神经系统细胞的损伤,增加早老性痴呆的发生概率[11]。慢性炎症的轻微增加会导致肥胖和抑郁症风险增大[12−14],炎症长时间得不到控制,会扰乱正常生理功能,诱发各类疾病[15−16]。近年来许多研究者证明,大部分多糖具有很好的抗炎活性[17−20]。Liu 等[21]发现,蟹味菇多糖具有抗炎及抗氧化活性,可抑制LPS 诱导的肺衰竭。Zhang 等[22]发现,沙棘浆果多糖可以通过抗氧化和消炎作用来预防四氯化碳导致的小鼠肝中毒。
目前,虽然已经有了仙人掌干、仙人掌酒等初级加工产品,但是产量有限、创收有限、附加值较低[23]。对西藏梨果仙人掌进行深入研究,可以为其食用价值和药用价值的深度开发提供理论依据,进而带动当地相关产业的发展。本研究在对梨果仙人掌粗多糖组分分析的基础上,对粗多糖的抗炎效果进行了评价,为仙人掌的开发利用和深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
仙人掌 在2019 年9 月29 日采自林芝市察隅县察瓦龙乡的梨果仙人掌品种。将新鲜的仙人掌茎去刺、切片后置于−80 ℃超低温冰箱预冻,预冻后使用真空冷冻干燥机进行冷冻干燥至样品完全干燥,备用;SPF 级雄性昆明小鼠 5~6 周龄,体重18~22 g,由仪征安立卯生物科技有限公司生产,许可证:SCXK(苏)2016-0005。小鼠饲养及相关动物实验严格按照《试验动物管理条例》要求进行[24];TFA 三氟乙酸 AR,阿拉丁试剂有限公司;PMP 甲醇、单糖AR,国药集团化学试剂有限公司;乙酸铵 AR,天津市光复精细化工研究所;ELISA 试剂盒 上海博湖生物科技有限公司。
FTIR Nicolet iS 5 FT-IR 傅里叶变换红外光谱仪 赛默飞世尔科技;waters 1525 凝胶色谱仪GPC
美国waters 公司;三重四级杆质谱 UPLC-MS/MS
沃特世科技(上海)有限公司;101-A4(640L)电热鼓风干燥箱 无锡玛瑞特科技有限公司;xmtd-204数显恒温水浴锅 河北德科机械科技有限公司;WMS-1033 光学显微镜 上海豫光仪器有限公司。
1.2 实验方法
1.2.1 仙人掌茎粗多糖提取 西藏梨果仙人掌茎的粗多糖含量参照出口植物源食品中粗多糖的测定之苯酚-硫酸法[25]进行测定。称取5.00 g 仙人掌冻干粉于1000 mL 烧杯中,用95%乙醇浸泡,每8 h 更换一次乙醇,浸泡至样品呈白色,室温干燥。按照1 g样品50 mL 水的比例加入蒸馏水,90 ℃热水浸提3 h,4000 r/min、20 min 离心后,弃去沉淀取上层清液。用4 倍体积95%乙醇醇沉,4000 r/min、20 min离心,取沉淀弃去乙醇,置于−80 ℃超低温冰箱预冻,于低温冷冻干燥机冻干即得仙人掌茎粗多糖。
1.2.2 总糖含量及分子量测定 参照GB/T 15672-2009 食用菌中总糖含量的测定方法[26]测定茎粗多糖的总糖含量。凝胶渗透色谱(Gel Permeation Chromatography,GPC)测定粗多糖总糖分子量的实验条件[27]为检测器:2414,色谱柱:PL aquqgel-OH MIXED 8 μm,流动相:0.2 mol/L NaNO30.01 mol/L NaH2PO4pH7,流速:1 mL/min,温度:30 ℃,进样量100 μL。配制1.0 mg/mL 多糖溶液,过0.45 μm 水相滤膜后,进样检测。
1.2.3 单糖组成及含量测定 采用PMP 衍生法测定茎粗多糖中的单糖组分[28],具体操作如下:
多糖水解:称取10 mg 粗多糖样品于20 mL 钳口瓶中,加入2 mol/L 的TFA 水溶液5 mL,按照流速10 L/min,时间1 min 充氮气封管,100 ℃水解2 h;冷却后取样品1 mL,加入1 mL 甲醇,70 ℃水浴下氮气吹干,如此重复2 次,去除TFA;加入0.3 mol/L的NaOH 溶液1 mL,充分溶解残渣,得到多糖水解液,按一定梯度稀释后衍生测定。
水解后单糖的提取:称取干样约0.4 g、湿样1.5 g(精确到小数点后4 位)于具塞刻度管中,加入10 mL 80%乙醇,在70 ℃水浴超声提取30 min;10000 r/min 离心,取滤液用80%乙醇定容至10 mL,然后取2 mL 加入试管用氮气吹干,之后加入1 mL 0.3 mol/L NaOH 溶液充分溶解,确保无残留。
单糖衍生化[29]:取400 μL 的混合单糖标准液于5 mL 具塞试管中,加PMP 溶液400 μL,漩涡振荡混匀,70 ℃水浴2 h,放凉至室温,加0.3 mol/L 的HCl 400 μL 进行中和,先后加水和氯仿1200 μL,漩涡振荡混匀后,静置,弃去氯仿相,重复以上步骤,萃取2 次。用水系0.45 μm 微孔膜将剩余水相过滤后供HPLC 进样检测分析。
高效液相色谱法(High Performance Liquid Chromatography,HPLC)检测条件[30]:HPLC 检测过程的色谱条件:色谱柱AGILENTEC-C182.7 μm,2.1 mm×50 mm,流动相A:50 mmol/L 乙酸铵缓冲液(氨水调节至pH=8.0),流动相B:乙腈,流速:0.4 mL/min,柱温:35 ℃,进样量:2 μL,质谱扫描条件:特征离子扫描模式(SIR),ESI+喷雾电压:2.0 kV,锥孔电压:30 V,离子源温度:150 ℃,脱溶剂温度:500 ℃,脱溶剂气(N2):1000 L/h,SIR 模式检测离子:481.09、495.1、510.1、511.08、525.06。
为使样品的所有组分在最短时间内实现最佳分离,提高柱效,改善检测器的灵敏度,梯度洗脱,洗脱程序为:0~1 min,86%A;1~7 min,86%~81.5%A;7~11 min,81.5%~80%A;11~13 min,80%~40%A;13~14.5 min, 40%A; 14.5~14.6 min, 40%~86%;14.6~17 min,86%A。
1.2.4 粗多糖红外光谱特征基团分析 通过KBr 压片法制得粗多糖样品薄片,用傅里叶变换红外光谱仪测定[31],扫描范围4000~400 cm−1,分辨率0.5 cm−1,以空气做参比。在吸收光谱上,以基线法测定吸收带的峰高和峰面积,用于定性分析。
1.2.5 小鼠足肿胀抗炎试验
1.2.5.1 小鼠实验分组 健康雄性昆明小鼠60 只,每个小鼠体重18~22 g,适应性喂养7 d,随机分为空白组、模型组、阳性对照组、茎粗多糖低剂量组、茎粗多糖中剂量组、茎粗多糖高剂量组,共计6 组,每组10 只小鼠。其中空白组药物为生理盐水,模型组不做药物处理,阳性对照组是3 mg/kg 的醋酸地塞米松,茎粗多糖低剂量组为100 mg/kg 的茎粗多糖,茎粗多糖中剂量组为200 mg/kg 的茎粗多糖,茎粗多糖高剂量组为400 mg/kg 的茎粗多糖。各组实验动物每天10 时灌胃给药1 次,每只0.2 mL,连续给药10 d。空白组除外,其他小组末次灌胃后30 min,右后足皮下注射质量分数为1%的角叉菜胶0.03 mL 致炎,所有小鼠均建模成功。4 h 后处死小鼠,踝关节处剪下两后足称重。
1.2.5.2 小鼠足肿胀度和肿胀抑制率 肿胀度计算公式如下:

式中,S 是肿胀度(mg),m肿胀组是除空白组外其余组足重(mg),m空白组是空白组足重(mg)。
肿胀抑制率计算公式如下:
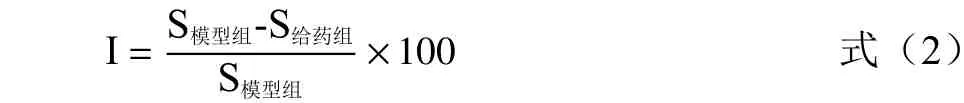
式中,I 是肿胀抑制率(%),S模型组是模型组的肿胀度,S给药组是给药组肿胀度。
1.2.5.3 观察小鼠足肿胀情况 取小鼠足垫组织块1 cm×1 cm,用10%中性甲醛溶液固定48 h 以上。取固定好的小鼠足垫组织块流水冲洗8 h,将清洗好的组织块依次经过50%(2 h)、60%(2 h)、75%(2 h)、85%(2 h)、95%(2 h)、无水乙醇(0.5 h)各浓度乙醇逐级脱水。将脱水好的组织用无水乙醇二甲苯(1:1)透明,透明后的小鼠足垫组织使用软蜡透蜡、硬蜡包埋,随后进行修块、切片,厚度为5 μm,贴片、烤片,待用。
将贴好的小鼠足垫切片进行脱蜡、过渡、梯度乙醇水化、苏木素染色、蓝化、洗涤、伊红染色、梯度乙醇水化、透明、封片等一系列常规苏木精-伊红染色法(Hematoxylin-eosin Staining,HE)染色处理后,利用光学显微镜对小鼠足垫组织切片进行观察和显微照相。
1.2.5.4 检测小鼠血浆中IL-1β、IFN-γ、TNF-α炎症因子的含量 末次给药4 h 后,眼眶取血,血浆使用EDTA 作为抗凝剂,收集后30 min 内,在1000×g,2~8 ℃下离心15 min。按照ELISA 试剂盒使用说明进行小鼠血浆中IL-1β、IFN-γ、TNF-α三种炎症因子含量的检测。
1.3 数据处理
利用Excel 整理数据,并用GraphPad Prism 8软件作图。
2 结果与分析
2.1 总糖含量及分子量的测定结果
参照GB/T 15672-2009 方法测定西藏梨果仙人掌茎粗多糖总糖含量,总糖校正曲线方程为y=0.0081x−0.0022(R2=0.9992)。测得其总糖含量为405.724 mg/g,与靳丹虹等[32]的总糖含量基本一致,与安徽仙人掌[33]茎总糖含量相当。
表1 为西藏梨果仙人掌茎粗多糖凝胶渗透色谱相对峰表,由表可知,粗多糖的总糖Mp 峰位分子量为24915 Da。

表1 粗多糖凝胶渗透色谱相对峰表Table 1 Relative peak table of crude polysaccharide gel permeation chromatography
2.2 单糖组成及含量的测定结果
结合表2 可知在西藏梨果仙人掌茎粗多糖的单糖组成中:D-葡萄糖(Glc)含量最高,达44.066 mg/g,其次为L-阿拉伯糖(Ara)26.679 mg/g、D-半乳糖(Gal)17.815 mg/g、D-木糖(Xyl)6.650 mg/g、D-半乳糖醛酸(GalUA)6.361 mg/g、L-鼠李糖(Rham)含量为2.410 mg/g,其他按照含量从高到低依次为D-甘露糖(Man)、D-葡糖醛酸(GlcUA)、D-核糖(Rib)、L-岩藻糖(Fuc)、D-甘露糖醛酸、D-氨基葡萄糖(GlcN)、D-半乳糖胺(GalN),其中D-半乳糖胺(GalN)含量最低为0.004 mg/g。

表2 粗多糖各单糖组成Table 2 The monosaccharide composition of crude polysaccharide
2.3 粗多糖红外光谱的分析
红外光谱图可以反映出高分子特有的基团,在结构分析中发挥着重要的作用[34]。图1 为粗多糖红外光谱图,由图可知,粗多糖在610.06、1047.88、1082.31、1416.78、1602.79、3393.49 cm−1附近有吸收峰。分析如下:经过对粗多糖特征基团的分析,发现其特征主要集中在两个方面,一方面有较强的伸缩振动,表现为伯胺和仲胺的-NH 伸缩振动(3393.49 cm−1)、-C=C-伸缩振动(1602.79 cm−1)、CO 伸缩振动(1082.31 cm−1);另一方面有较强的-OH弯曲振动(1416.78 cm−1)、C-O 不对称收缩振动(1047.88 cm−1)和C-CO-C 面内弯曲振动(610.06 cm−1),由红外吸收图谱可知,所提取的梨果仙人掌组分符合多糖结构特征和官能团特性[35]。

图1 西藏梨果仙人掌茎粗多糖红外扫描谱图Fig.1 Infrared scanning spectra of crude polysaccharides fromAnthuriumof pear fruit in Tibet
2.4 不同剂量茎粗多糖对足肿胀度和肿胀抑制率的影响
如图2 所示,空白组小鼠由于足部未注射角叉菜胶致炎,故空白组小鼠的足肿胀度为0。模型组小鼠的肿胀度为(0.054±0.023)mg(P<0.01),与空白组相比,模型组小鼠出现了炎症反应,致炎模型成功。阳性对照醋酸地塞米松组的平均肿胀度为0.011±0.008 mg(P<0.01),说明醋酸地塞米松组在此模型中显示了很好的抗炎作用。与模型组相比,粗多糖低、中、高剂量组足肿胀度均减小,肿胀抑制率增大。随着药物剂量从100~400 mg/kg 的不断增加,足肿胀度不断降低,足肿胀抑制率不断增加,茎粗多糖高剂量组400 mg/kg 的足肿胀度和足肿胀抑制率与阳性对照醋酸地塞米松组最为接近。由此可见,西藏梨果仙人掌茎粗多糖在小鼠足肿胀炎症模型中具有良好的抗炎作用。原因可能是仙人掌多糖通过抑制某些炎症因子的表达,促进炎症和免疫反应中多种功能细胞因子的表达,达到抑制炎症的发生和发展的目的[36]。结果表明,西藏梨果仙人掌茎粗多糖在浓度100~400 mg/kg 范围内,抗炎效果随着茎粗多糖浓度的增加而不断增强。
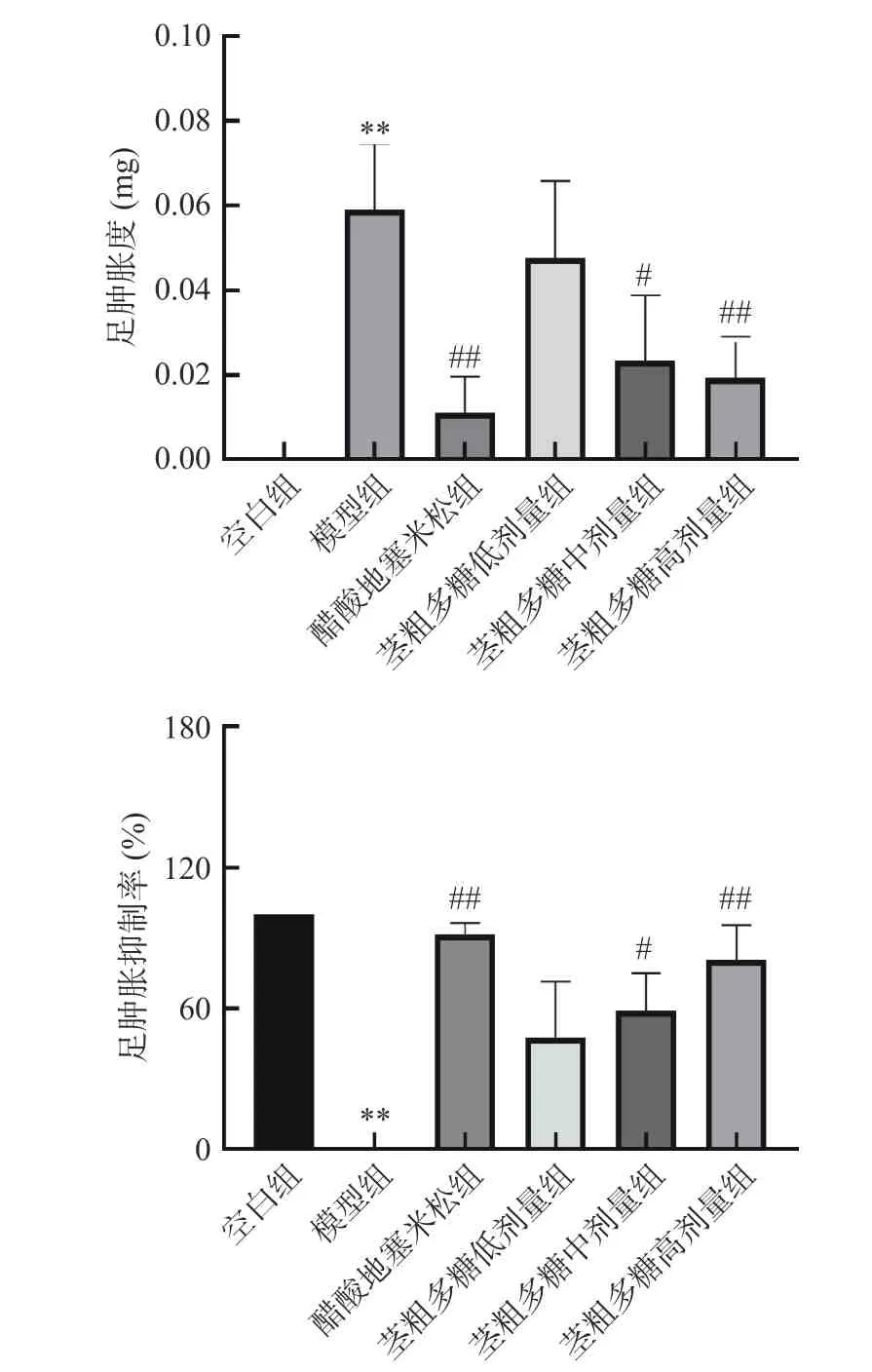
图2 小鼠足肿胀度和足肿胀抑制率Fig.2 Foot swelling degree and inhibition rate of foot swelling in mice注:**表示与空白组相比,P<0.01,#、##分别表示与模型组相比,P<0.05,P<0.01,图4~图6 同。
2.5 HE 染色观察仙人掌茎粗多糖浓度对足肿胀情况的影响
利用显微镜观察小鼠足肿胀HE 染色切片,见图3。

图3 小鼠足肿胀HE 染色切片Fig.3 HE staining sections of mouse foot swelling
由图3 可知:空白组小鼠的HE 染色细胞组织正常。由于注射角叉菜胶,小鼠自身产生炎症反应,模型组切片细胞核稀疏、凌乱,细胞质水肿变形,与空白组相比足部有明显水肿和阳性中性粒细胞明显减少,说明造模成功[37]。醋酸地塞米松组小鼠切片细胞水肿得到明显改善,紫色中性粒细胞显著增多。从茎粗多糖低、中、高三种剂量组小鼠的切片来看,足部炎性细胞浸润程度随着茎粗多糖浓度的升高而减少,中性粒细胞数量也随着剂量的增加逐渐增多,且中性粒细胞明显高于空白组,茎粗多糖高剂量组切片与阳性醋酸地塞米松组最为相似,局部细胞炎症较模型组得到较大程度缓解。
2.6 仙人掌茎粗多糖浓度对IL-1β、IFN-γ、TNF-α炎症因子的影响
由图4 可知,模型组的IL-1β表达水平最高达到了395.759 pg/mL,空白组的IL-1β表达水平最低,为63.137 pg/mL。阳性对照醋酸地塞米松组、茎粗多糖高、中、低剂量组的IL-1β表达水平依次递增,西藏仙人掌茎粗多糖剂量与IL-1β表达水平呈剂量依赖性,IL-1β的表达水平随着茎粗多糖剂量的增加而降低。其中,茎粗多糖高剂量组的IL-1β表达水平与阳性对照醋酸地塞米松组的IL-1β表达水平最为接近。
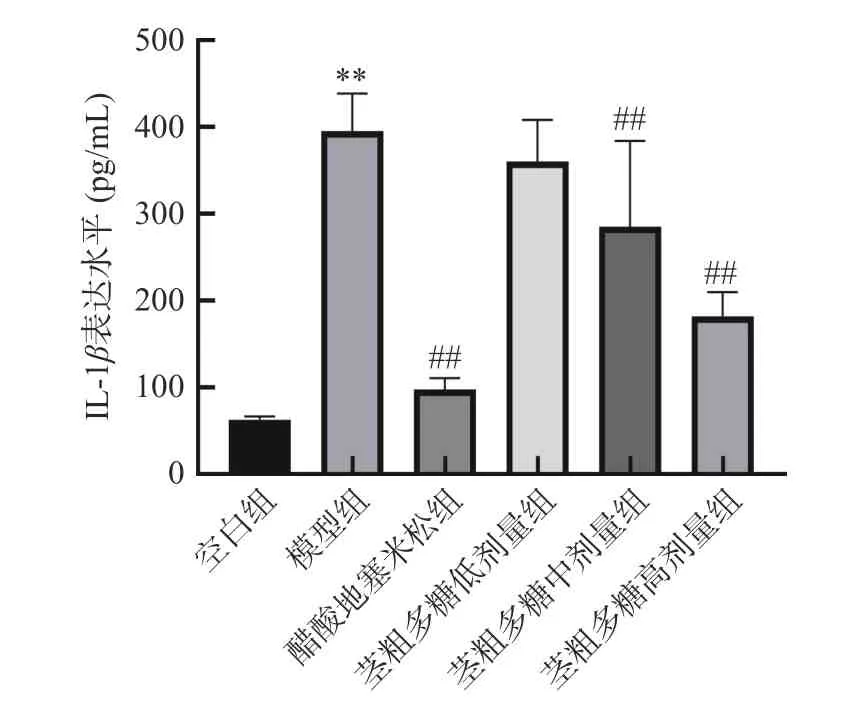
图4 IL-1β炎症因子表达水平图Fig.4 Expression level map of IL-1βinflammatory factors
由图5 可知,空白组IFN-γ表达水平最低,其次是阳性对照醋酸地塞米松组、茎粗多糖高、中、低剂量组,模型组IFN-γ表达水平最高,为121.815 pg/mL。西藏梨果仙人掌茎粗多糖剂量与IFN-γ表达水平呈剂量依赖性,IFN-γ的表达水平随着茎粗多糖剂量的增加而降低,茎粗多糖400 mg/kg 组的IFN-γ表达水平与阳性对照醋酸地塞米松组的IFN-γ表达水平最为接近。
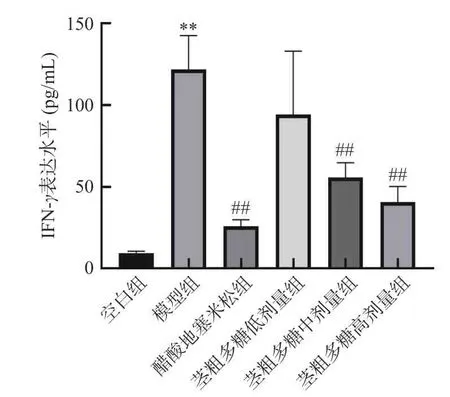
图5 IFN-γ炎症因子表达水平图Fig.5 Expression level map of IFN-γinflammatory factors
由图6 可知,TNF-α表达水平随着茎粗多糖剂量的增加而降低。空白组、阳性对照醋酸地塞米松组、茎粗多糖高、中、低剂量组的TNF-α表达水平依次递增。西藏梨果仙人掌茎粗多糖剂量与TNF-α表达水平呈剂量依赖性。西藏梨果仙人掌茎粗多糖高剂量组的TNF-α表达水平与阳性对照醋酸地塞米松组的TNF-α表达水平最为接近。
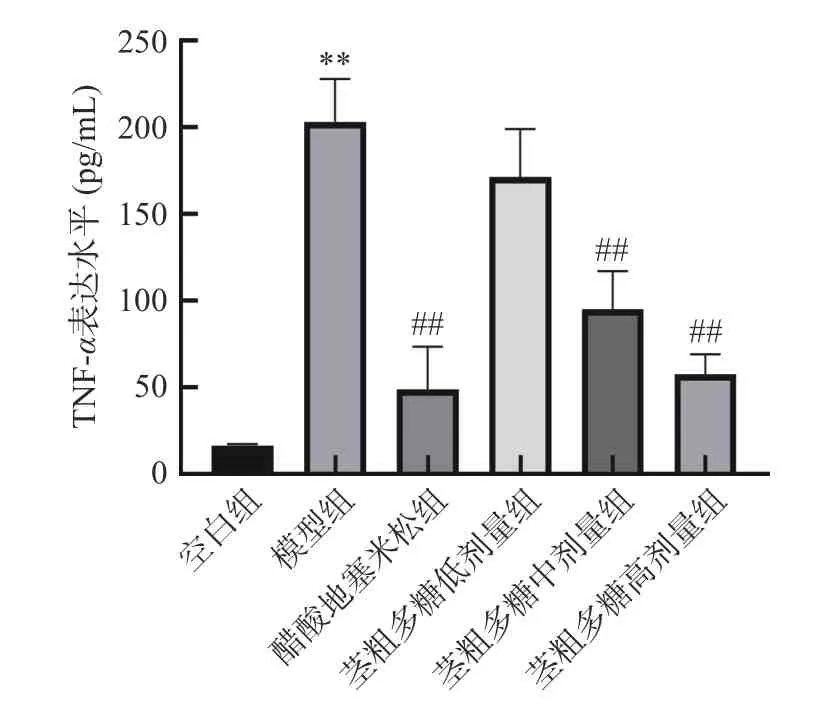
图6 TNF-α炎症因子表达水平图Fig.6 Expression level map of TNF-αinflammatory factors
综上所述,西藏梨果仙人掌茎粗多糖具有良好的抗炎作用,这主要是仙人掌茎粗多糖通过抑制IL-1β、IFN-γ、TNF-α等多种炎症因子的表达,也有可能是粗多糖促进在炎症和免疫反应中具有多种功能细胞因子的表达来抑制炎症的发生和发展。
3 结论
西藏梨果仙人掌茎粗多糖的总糖含量为405.72 mg/g,总糖Mn 数均分子量为14887 Da,Mw重均分子量为31278 Da。在其单糖组成方面,D-葡萄糖含量最高。对西藏梨果仙人掌茎粗多糖进行特征基团分析,发现其特征主要集中在伸缩振动和弯曲振动两个方面,伸缩振动表现为伯胺和仲胺的-NH伸缩振动、-C=C-伸缩振动、C-O 伸缩振动;弯曲振动表现为-OH 弯曲振动、C-O 不对称收缩振动和CCO-C 面内弯曲振动。
通过分析炎症细胞因子与机体炎症之间的关系,并结合实验结果可以看出:模型组小鼠血浆中的IL-1β、IFN-γ、TNF-α炎症因子表达水平明显高于其他组,空白组的炎症因子表达水平明显低于其他组。茎粗多糖高剂量组的IL-1β、IFN-γ、TNF-α炎症因子表达水平与阳性对照醋酸地塞米松组表达水平最为接近,三种炎症因子表达水平与西藏梨果仙人掌茎粗多糖呈剂量依赖性,表达水平随着茎粗多糖浓度的升高而降低,说明西藏梨果仙人掌茎粗多糖具有良好的抗炎作用。综上所述,西藏梨果仙人掌茎粗多糖含量较高,且具有较好的抗炎作用。因此,在之后的研究中可以对在西藏梨果仙人掌茎粗多糖作用下促进的多功能细胞因子进行深入研究,同时对比抑制炎症因子和促进功能细胞因子的表达水平情况,本实验有助于为仙人掌的后续开发利用和深加工提供理论依据。
