益生菌发酵刺麒麟菜制备硫酸多糖工艺优化及性质分析
2022-05-29谷福蝶刘庆梅刘光明
张 军,谷福蝶,刘 艳,周 钰,刘庆梅,2,刘光明,
(1.集美大学海洋食品与生物工程学院,福建省海洋功能食品工程技术研究中心,福建厦门 361021;2.中国医学科学院北京协和医院,疑难重症及罕见病国家重点实验室,北京 100005)
近年来,海洋藻类作为丰富且重要的海洋生物资源,因含有糖类、多酚、蛋白质等丰富的天然活性物质,被广泛报道[1−2]。据《2021 中国渔业统计年鉴》统计,2020 年我国麒麟菜养殖产量高达3856 吨,同比2019 年增长818%。刺麒麟菜(Eucheuma spinosum)属于红藻纲,红翎菜科,是生产卡拉胶的主要原材料,其富含的硫酸多糖在卡拉胶加工过程中一直被当作废弃物处理[3]。但硫酸基团被认为是酸性多糖主要的活性基团,硫酸多糖也被证实具有更高的生物活性[4],因此富含硫酸基团的刺麒麟菜硫酸多糖在食品工业与医药领域具有极大的发展潜力。
刺麒麟菜硫酸多糖的物理制备方式以热水浸提和低温冻融为主,常辅以超声破碎处理以提高得率,低温冻融刺麒麟菜硫酸多糖(Low temperature freeze-thawEucheuma spinosumsulfate polysaccharide,L-ESP)对比热提多糖粘度降低,溶解性提高,硫酸基团保护较好,但依旧存在着分子量大、生物利用度低等问题,往往给进一步加工利用带来困难。因此,刺麒麟菜硫酸多糖制备方式的开发备受关注。
益生菌不仅可以生产健康的发酵食品[5],益生菌与膳食互作更是被定为2020 年益生菌科学研究十大热点之一[6]。有研究报道,采用益生菌发酵得到的多糖,生物活性物质溶出率显著提升,分子量降低,更易被肠道吸收[7−8],其生物活性也优于未发酵多糖[9−11]。鼠李糖乳杆菌(Lactobacillus rhamnosus)是一种益生菌菌株,常作为乳品[12]、饮料[13]、保健食品或饲料的原料或发酵剂被广泛使用。Wu 等[14]利用鼠李糖乳杆菌发酵四种海藻,发现得到的海藻低聚糖(SwOSLAFP)显示出更大的还原能力和亚铁离子螯合能力以及对过氧化氢的清除能力,抗氧化活性显著提高。综上所述,益生菌发酵已经应用于天然多糖的制备,但刺麒麟菜多糖的发酵制备工艺、性质特征、抗过敏活性以及相关的构效关系尚不明确。
因此本文利用鼠李糖乳杆菌发酵刺麒麟菜制备发酵刺麒麟菜硫酸多糖(FermentedEucheuma spinosum、 sulfate polysaccharide,F-ESP),借助Box-Behnken 响应面法进一步优化制备条件,并对其化学成分、物理性质和官能团结构进行进一步解析,通过大鼠嗜碱性粒细胞(Rat Basophilic Leukemia-2H3,RBL-2H3)经典脱颗粒模型初步评价其抗过敏活性,旨在为刺麒麟菜多糖工业化生产和功能食品的开发提供理论基础,为刺麒麟菜的高值化利用提供新思路。
1 材料与方法
1.1 材料与仪器
刺麒麟菜 绿新(福建)食品有限公司;鼠李糖乳杆菌(BNCC185356) 北京北纳创联生物技术研究院;RBL-2H3 细胞 上海复祥生物技术有限公司;MEM 液体培养基 美国HyClone 公司;胎牛血清 美国Gemini 生物科技公司;台氏缓冲液(PB180338) 武汉普诺赛生命科技有限公司;MRS培养基、DEAE-52 纤维素 北京索莱宝科技有限公司;BCA 蛋白检测试剂盒 上海碧云天生物技术有限公司;内毒素检测鲎试剂盒 厦门鲎试剂生物科技股份有限公司;MTT、β-氨基己糖苷酶底物、抗二硝基苯单克隆抗体小鼠抗 美国sigma 公司;DNPBSA 基因生物技术国际贸易(上海)有限公司;其他试剂为国产分析纯。
InfiniteM200PRO 酶标仪 德国Tecan 公司;NP80 紫外分光光度计 德国IMPLEN 公司;内径0.7~0.8 mm 乌氏粘度计 上海宝山启航玻璃仪器厂;Waters 2695 型高效液相色谱 美国Waters 公司;Forma3111 水套式CO2细胞培养箱 美国Thermo公司;SG-403 生物安全柜 美国Baker 公司;Nunc细胞培养板 美国Thermo 公司;PhenomPro 台式扫描电镜 美国Phenomworld 公司;ALPHA 傅里叶红外光谱仪 德国Bruker 公司。
1.2 实验方法
1.2.1 发酵刺麒麟菜粗多糖的制备 刺麒麟菜淘洗去除泥沙后于50 ℃烘箱烘干,将干燥后的刺麒麟菜剪碎放入破壁机粉碎过100 目筛,置于保鲜盒存放于阴凉干燥处待用。参考Zhang 等[15]的方法稍作修改,将刺麒麟菜菜粉按照一定料液比与超纯水混合后,加入2.5%(w/w)的果葡糖浆,然后121 ℃高温灭菌20 min,冷却至室温后加入适量已活化的鼠李糖乳杆菌,于37 ℃厌氧发酵,然后100 ℃灭活10 min,于室温下8000 r/min 离心10 min,收集上清。加入4 倍体积的无水乙醇,4 ℃静置过夜,8000 r/min 离心10 min 得到沉淀,将沉淀复溶于超纯水,冷冻干燥后,即得到发酵刺麒麟菜粗多糖。参考陈玉芳等[16]的方法,将刺麒麟菜粉和超纯水按照料液比1:90 混合,−18 ℃冷冻2 h,解冻温度55 ℃,反复冻融三次,制备冷冻刺麒麟菜多糖作为后续样品对照。
1.2.2 单因素实验设计 取刺麒麟菜10 g,固定接菌量为4%(v/v),发酵时间为24 h,探究料液比(w/v)为1:40、1:50、1:60、1:70,1∶80 时对粗多糖得率的影响;固定料液比1:70、发酵时间为24 h,探究接菌量为0.5%、1%、2%、4%、8%时对粗多糖得率的影响;固定料液比1:70、接菌量4%,探究发酵6、12、18、24、30 h 时对粗多糖得率的影响。粗多糖得率以冻干粗多糖质量与菜粉质量之比计算。
1.2.3 响应面法优化发酵刺麒麟菜粗多糖制备工艺
根据单因素实验结果,选取料液比、接菌量、发酵时间为自变量,以发酵刺麒麟菜粗多糖得率为响应值,以Box-Benhnken 设计原理进行响应面试验设计(见表1),用Design Expert 12 软件拟合因素与响应值之间的函数关系,分析回归方程从而预测最优工艺参数。
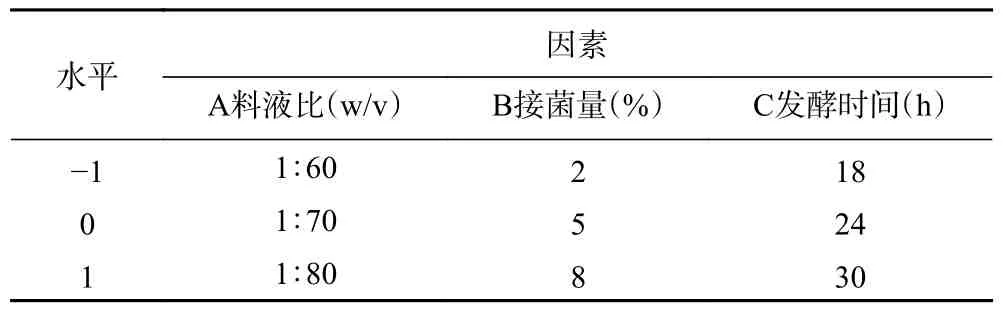
表1 响应面试验设计的因素及水平Table 1 Factors and level of response surface test design
1.2.4 发酵刺麒麟菜硫酸多糖的分离纯化 按照最佳工艺发酵得到发酵刺麒麟菜粗多糖后,取1 g 按10 mg/mL 复溶于超纯水,上样于预装20 g 的DEAE Cellulose-52 的直径2.5 cm 的层析柱,恒流泵流速设置为2 mL/min,依次用0、0.5、1、2 mol/L 的氯化钠溶液阶段洗脱,每管收集5 mL。蒽酮硫酸比色法测定每管洗脱液在630 nm 处的吸光度,并做出洗脱曲线,收集糖含量较高的部分,3 kDa 透析膜透析72 h,冷冻干燥机冻干,即得到发酵刺麒麟菜硫酸多糖F-ESP;低温冻融刺麒麟菜硫酸多糖L-ESP 纯化方式同上。
1.2.5 发酵刺麒麟菜硫酸多糖的化学组成分析 按照Zhang 等[17]的方法进行单糖组成分析;以半乳糖为标准品,利用蒽酮硫酸显色法[18]对纯化后的发酵刺麒麟菜硫酸多糖和低温冻融刺麒麟菜多糖的总糖含量进行测定;参考赵凯等[19]的方法,利用3,5-二硝基水杨酸比色法测定还原糖含量;硫酸根含量参考Yu 等[20]以K2SO4为标准品,利用Dodgson-Price 法[21]进行测定;蛋白质含量参考Tang 等[22]采用碧云天BCA 蛋白检测试剂盒进行测定;利用鲎试剂内毒素检测试剂盒检测内毒素含量。
1.2.6 发酵刺麒麟菜硫酸多糖的物理性质分析
1.2.6.1 平均分子量的测定 参照Gong 等[23]的方法利用高效凝胶渗透法(HPGPC),采用示差检测器,配制pH 为6 的20 mmol/L 磷酸盐缓冲液为流动相,将标准品和样品按照2%(w/v)的浓度溶于磷酸盐缓冲液,分别进样于TSK-GELG4000 SWXL 色谱柱,流速为0.4 mL/min,进样体积20 μL,对两种多糖样品的纯化产物的平均分子量进行测定。
1.2.6.2 溶解度的测定 称取纯化后的冻干样品200 mg 置于烘干至恒重的15 mL 离心管中,加入10 mL 超纯水混合,室温下振荡30 min,使多糖样品充分溶解,将样液全部转移至50 mL 容量瓶中,定容至刻度线后混匀。吸取10 mL 于8000 r/min 离心10 min,将上清液完全转入称量瓶中烘干,恢复至室温后称重。按照式(1)计算:
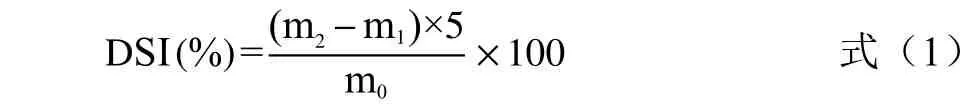
式中:DSI 溶解度(%);m0样品质量(g);m1称量瓶质量(g);m2烘干样品+瓶质量(g)。
1.2.6.3 比浓粘度的测定 在25 ℃恒温条件下,使用内径为0.7~0.8 mm 的乌氏粘度计测定浓度为0.5 g/dL 的L-ESP 和F-ESP 的比浓粘度(ηre),参照Liu 等[24]的方法进行,每个样品独立测定5 次,分别记录样液通过毛细管的时间,按照式(2)计算:

式中:t0纯水流经毛细管的时间(s);t 样品流经毛细管的时间(s);η0纯水的粘度;ηr相对粘度;ηsp特性粘度;ηre比浓粘度(dL/g);C 样品浓度(g/dL)。
1.2.6.4 扫描电镜分析 将多糖样品固定在载物台导电胶表面,将载物台转移至蒸金室,打开真空泵,达到真空度后,溅射仪喷金90 s,然后在放大倍数为500×、1000×、3000×条件下进行拍照,观察多糖样品的微观形貌。
1.2.7 发酵刺麒麟菜硫酸多糖的红外光谱分析 将样品与干燥的溴化钾以1:100 比例混合后研磨,经手动压片后利用傅里叶红外光谱仪在400~4000 cm−1进行扫描[25]。
1.2.8 发酵刺麒麟菜硫酸多糖抗过敏活性评价RBL-2H3 细胞使用10% FBS-MEM 在5% CO2,37 ℃下培养,并采用MTT 试剂按照说明书检测不同浓度样品对细胞活力的影响;RBL-2H3 细胞脱颗粒参考Zhang 等[26]的方法,将RBL-2H3 细胞计数后用10%的FBS-MEM 稀释,按照5×104个/孔铺至96 孔培养板,用终浓度0.1 μg/mL 的anti-DNP-IgE 敏化过夜,然后PBS 洗涤一次,样品组加入不同浓度样品(10、25、50、100 μg/mL)的台氏缓冲液100 μL 孵育1 h,然后向阳性组和样品组加入终浓度为0.5 μg/mL的DNP-BSA 激发,阴性孔加入同体积的PBS 缓冲液,1 h 后收集上清,向板底加入含有0.1% TritionX-100 的台氏缓冲液100 μL,裂解5 min,吹打均匀后吸取上清和裂解液各25 μL,置于黑色荧光板,加入100 μL 1.2 mmol/mL 的β-氨基己糖苷酶底物,混匀后37 ℃孵育30 min,检测激发波长360 nm,发射波长450 nm 条件下的吸光度值。β-氨基己糖苷酶抑制率按照式(3)、(4)计算:

1.3 数据处理
实验结果均重复三次以上,数据以平均值±标准差(Mean±SD)表示。采用SPSS 20.0 软件中的图基检验(Tukeytest)进行差异显著性分析,P<0.05 为差异显著,P<0.01 为差异极其显著。
2 结果与分析
2.1 单因素实验结果
图1A 所示,料液比不断增大,粗多糖得率呈现先快速增长后平缓的趋势,分析是因为料液比增大导致内外渗透压以及溶液饱和度的变化,当料液比为1:40 时溶液极易达到饱和,且粘稠度高,不易于多糖的进一步析出,当液体体积不断增大至1:80,刺麒麟菜粉末与发酵液接触面积增大,多糖溶出率也随之上升,到达工艺上限。但料液比为1:70 和1:80 时,多糖得率差异不显著(P>0.05),因此选择1:70 作为后续试验条件。
图1B 所示,得率随着接菌量的增大逐渐升高,接菌量为4%时达到峰值,当扩大至8%时,得率明显下降,分析是因为鼠李糖乳杆菌能够以刺麒麟菜中某些糖类为碳源,利用了一部分可代谢的糖,从而导致最终得率的下降,这也印证了刺麒麟菜可能具有益生元特性,也有大量文献对此进行了报道[27−29]。
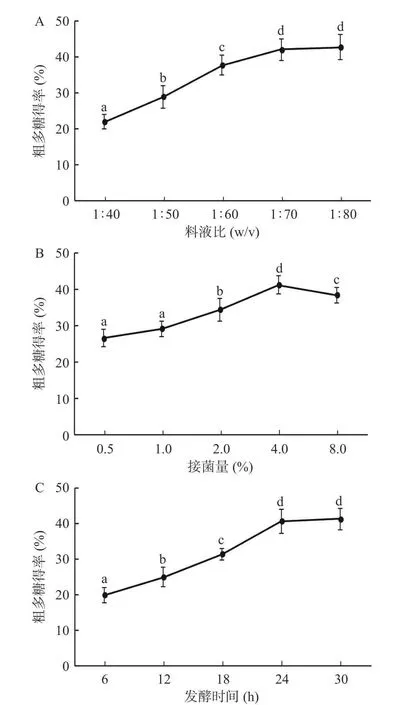
图1 料液比(A)、接菌量(B)、发酵时间(C)对发酵刺麒麟菜粗多糖得率的影响Fig.1 Effects of material-liquid ratio(A), inoculation amount(B) and fermentation time(C) on the yield of F-ESP
刺麒麟菜皮层最外2~3 层多为小型薄壁细胞,内容物较少,向内逐渐增大[30],而发酵前期主要分解了外侧小型薄壁细胞的初生壁,随着发酵时间增长,内层较大的薄壁细胞被分解,大量内容物析出,得率显著提高,如图1C 所示,当发酵时间不断增长至30 h时得率达到峰值,但与24 h 差异不显著(P>0.05)。
2.2 响应面法优化发酵刺麒麟菜粗多糖制备工艺
响应面试验根据 Box-Benhnken 原理利用DesignExpert 12 软件进行试验设计,称量冻干后的所有固形物并计算多糖得率,结果如表2 所示。
采用Design-Expert 12 软件对表2 结果进行多元回归拟合,得到多糖得率对料液比(A)、接菌量(B)、发酵时间(C)的二次多项式回归模型:

表2 发酵制备刺麒麟菜硫酸多糖响应面试验设计及结果Table 2 Experimental design and results of response surface for preparation of F-ESP
Y= 40.00+2A+2.03B+0.6038C−1.75AB−1.87AC−0.0475BC−3.49A2−4.71B2−2.04C2
如表3 所示,相关系数R2为模型与总和的比值=272.80/281.95=0.9675,表示模型拟合性能良好,且失拟检验P值大于0.05,表明模型未失拟,模型P值远远小于0.05,说明各因素与响应值的线性关系十分显著,模型F值为23.20,说明该模型有意义,上述结果表明回归二次模型建立成功,可用于评价发酵刺麒麟菜硫酸多糖的工艺条件。根据ANOVA 分析数据差异项,接菌量和液料比的变化对多糖得率的影响显著差异(P<0.01),根据各因素的F值判断主次因素并进行排序:接菌量>液料比>发酵时间。综合上述数据和分析,拟合出发酵刺麒麟菜硫酸多糖最佳工艺条件为料液比1:72.3、接菌量5.5%、发酵时间24.2 h,预测值为40.41%。为便于操作,条件参数设置为料液比1:70,接菌量5%,发酵时间24 h,按照该条件独立重复制备三次的粗多糖得率均值为41.70%±2.0%,与预测值相符合,且显著大于冻融法的得率(33.52%±2.71%)。
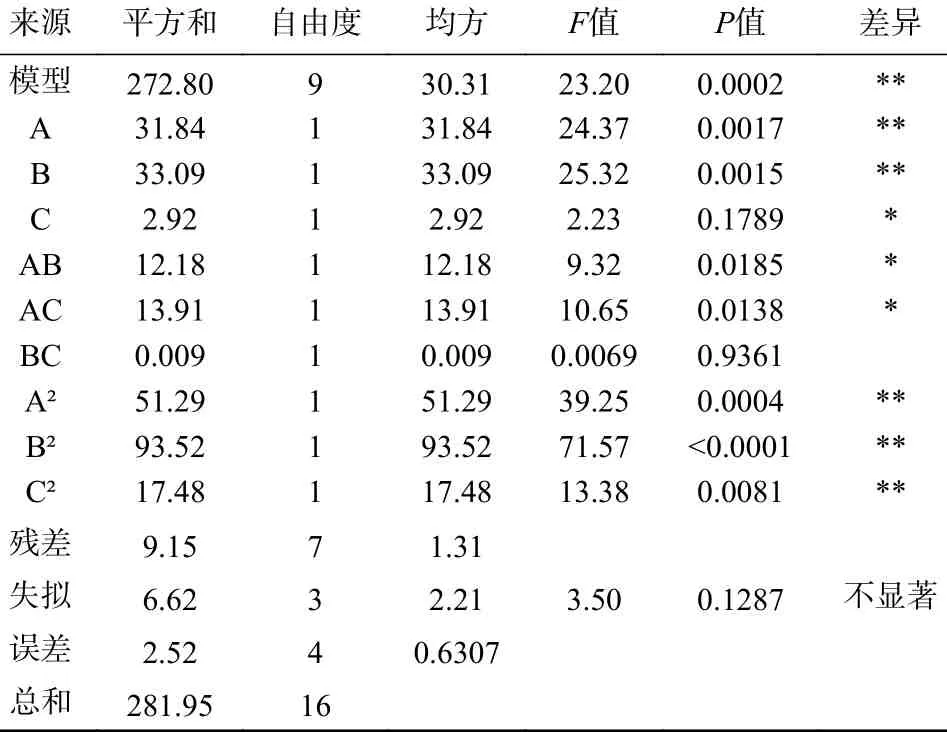
表3 回归模型的方差分析Table 3 Analysis of variance of regression model
如图2 所示,响应曲面映射在等高线上的图形越接近椭圆表明差异越显著,越接近圆越不显著。

图2 各因素对发酵刺麒麟菜粗多糖得率交互影响的响应面图和等高线图Fig.2 Response surface diagram and contour map of the interaction of various factors on the yield of F-ESP注:A 为料液比-发酵时间,B 为接菌量-料液比,C 为发酵时间-接菌量。
根据表3 和图2A 结合判断,料液比和发酵时间相互作用显著(P<0.05),分析可能是因为料液比一定时,发酵时间的增加导致多糖的逐渐溶出,使得多糖得率先增加再平缓,当发酵时间一定时,料液比同样决定了多糖的溶出量以及刺麒麟菜纤维内部和溶液的浓度差;图2B 可以看出料液比与接菌量的响应曲面较陡峭,结合表3 中可知AB 交互项对多糖得率的影响显著(P<0.05),说明料液比与接菌量的交互作用对多糖得率影响较大;接菌量和发酵时间的等高线图曲面比较平缓(图2C),交互作用不显著(P>0.05)。
2.3 发酵刺麒麟菜硫酸多糖的分离纯化
如图3 所示,图3A 为冻融法制备的L-ESP 洗脱曲线,图3B 为鼠李糖乳杆菌发酵制备的F-ESP 洗脱曲线,将两种粗多糖上样于DEAE-52 层析柱,经过0、0.5、1、2 mol/L 的NaCl 溶液阶段洗脱,测定总糖含量绘制洗脱曲线,各得到3 个组分,命名为LESP-1、L-ESP-2、L-ESP-3,F-ESP-1、F-ESP-2、FESP-3。据报道硫酸根的存在能够显著提高植物多糖的生物活性[31],因此对三个组分的硫酸根含量进行测定,并结合得率选取L-ESP-3 和F-ESP-3 作为后续实验的样品。
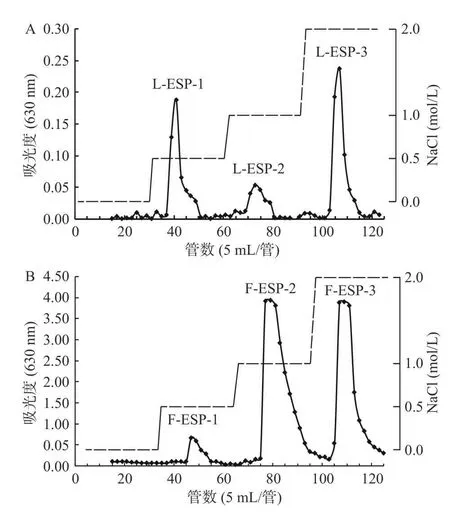
图3 L-ESP(A)和F-ESP(B)的DEAE-52 洗脱曲线Fig.3 DEAE-52 elution curves of L-ESP (A) and F-ESP(B)
2.4 发酵刺麒麟菜硫酸多糖的化学成分分析
将L-ESP-3 与F-ESP-3 经三氟乙酸水解后还原乙酰化得到用于检测的糖醇乙酰酯衍生物,利用气相色谱法进行单糖组成的检测。取九个单糖标准品混合处理后测得标品的气相色谱图,如图4 所示,与标准品的保留时间对比发现:L-ESP-3 主要成分为半乳糖(91.14%)、含少量木糖(1.53%)与葡萄糖(7.33%),F-ESP-3 在仪器精度范围内只检出半乳糖,未检出其他单糖。说明鼠李糖乳杆菌发酵消耗了葡萄糖并进一步转化为半乳糖,改变了F-ESP-3 的单糖组成。Gao 等[32]同样发现,植物乳杆菌发酵使苦瓜中葡萄糖含量降低,半乳糖含量升高。
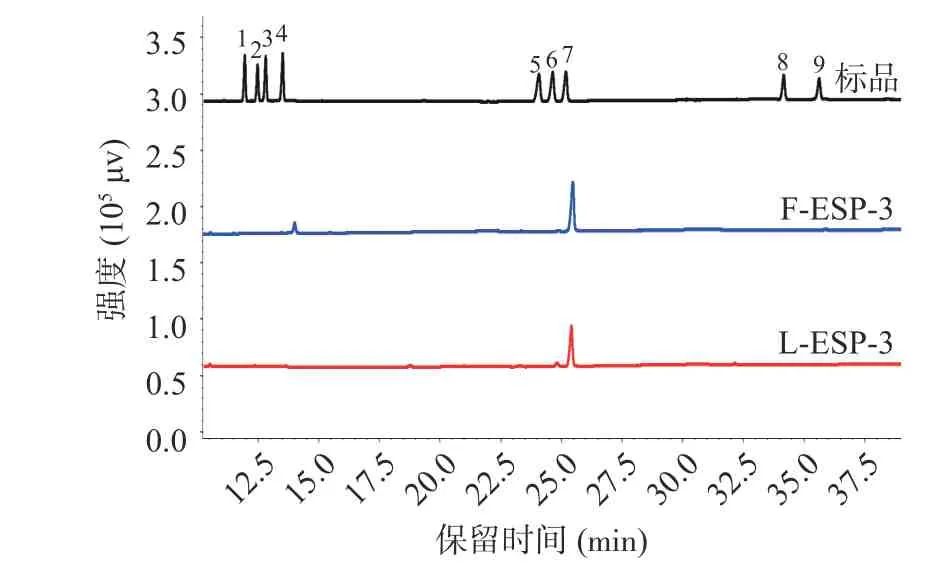
图4 L-ESP-3 及F-ESP-3 单糖组成的气相色谱图Fig.4 GC of monosaccharide composition of L-ESP-3 and F-ESP-3注:标准品:1.鼠李糖,2.岩藻糖,3.阿拉伯糖,4.木糖,5.甘露糖,6.葡萄糖,7.半乳糖,8.葡萄糖醛酸,9.半乳糖醛酸。
如表4 所示,L-ESP-3 与F-ESP-3 的总糖含量均达到98%左右,证明两种方法均得到了纯度较高的刺麒麟菜硫酸多糖,F-ESP-3 的还原糖含量为7.87%±0.09%较L-ESP-3(1.45%±0.10%)极显著提升(P<0.01);二者硫酸根含量分别为28.76%±2.23%和28.40%±1.40%,硫酸根结构均未被破坏,说明这两种方法均能够保护多糖的硫酸根。同时发酵法还提高了刺麒麟菜硫酸多糖中还原糖的比例,乳酸菌发酵的酸性环境有效去除一部分蛋白质,且内毒素含量小于0.03 EU/mg,符合中华人民共和国药典标准[33]。
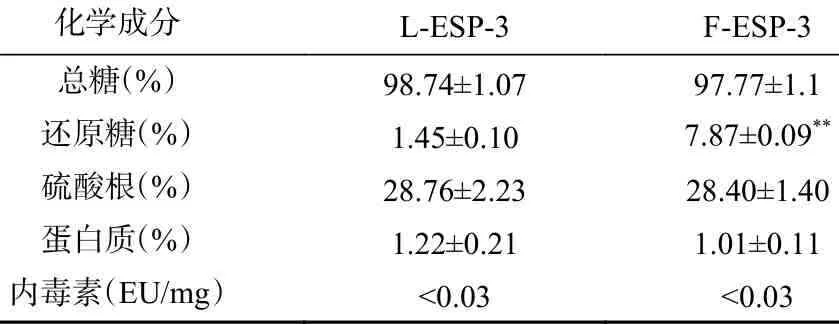
表4 刺麒麟菜硫酸多糖化学组成成分表Table 4 Chemical composition ofEucheuma spinosumsulfate polysaccharides
2.5 发酵刺麒麟菜硫酸多糖的物理性质分析
分子量测定结果如图5 所示,L-ESP-3 分子量大于670 kD,与陈玉芳等[16]得到的刺麒麟菜多糖分子量相似(690.12 kD);F-ESP-3 的分子量为33.58 kD明显降低,分析可能是因为鼠李糖乳杆菌属于乳酸菌,乳酸菌在代谢过程中可以产生大量胞外酶系,如纤维素酶、果胶酶、淀粉酶等,这些非特异性酶能够随机降解多糖糖苷键[34]。同时也有相关报道认为发酵的酸性环境能够使复杂多聚糖水解为低聚糖,导致分子量进一步降低[35]。孙菁雯[36]利用发酵复合酶解法制备的铜藻和龙须菜多糖<3 kD 的组分含量上升,表明多糖被降解,本研究获得了相似的结果。

图5 刺麒麟菜硫酸多糖的分子量分布图Fig.5 Molecular weight distribution of sulfated polysaccharides fromEucheuma spinosum
经计算,L-ESP-3 溶解度为56.51%±3.8%,F-ESP-3 的溶解度为89.33%±3.1%;L-ESP-3 和F-ESP-3 的比浓粘度分别为3.85±0.25 dL/g 和0.01±0.002 dL/g(P<0.01),由此可知,益生菌发酵法制备的刺麒麟菜多糖黏度极显著降低,溶解度极显著提高。有研究表明聚合物溶液的粘度较高的原因在于当分子链长度远大于溶剂分子,加上溶剂化作用,使其在流动时受到较大的内摩擦阻力,分子量大,分子链缠结越严重,使流动阻力变大,粘度升高[37]。所以分子量的降低可能是F-ESP 黏度降低的主要影响因素。
如图6 所示,L-ESP-3 的微观结构整体呈片状,3000 倍放大后,可以看到结构非常完整且表面光滑致密,而F-ESP-3 微观结构截然不同,呈现不规则颗粒状,3000 倍放大后,发现表面粗糙有裂纹,内部结构具有大量孔隙。刺麒麟菜多糖作为卡拉胶多糖的一种,属于天然高分子凝胶,有研究报道,天然高分子凝胶的表面粗糙度增加可能是因为糖链间一般通过氢键连接,当糖苷键断裂后,导致糖链间氢键交联密度变小,畴结构变大[38]。

图6 刺麒麟菜硫酸多糖的扫描电镜图Fig.6 Scanning electron microscope picture ofEucheuma spinosumsulfate polysaccharide
2.6 发酵刺麒麟菜硫酸多糖的红外光谱分析
如图7 所示,在特征谱带区3450 cm−1为O-H的伸缩振动,2923 cm−1为C-H 的伸缩振动[39],这部分为多糖类的特征吸收,1641 cm−1为C=O 的特征吸收[40],在指纹区1249 cm−1为O=S=O 的伸缩振动,说明该多糖含有硫酸酯基[41],在1071cm−1处的特征吸收说明在主链中存在吡喃半乳糖,929 cm−1为C-O 上的3,6 内醚半乳糖残基的特征吸收[42];846 cm−1为吡喃糖环C4 上的C-O-SO3的特征吸收[43],成苷的半缩醛羟基为α构型[44],804 cm−1为吡喃糖环C2 上的C-O-SO3的特征吸收[43],这与ι-卡拉胶的特征光谱相似[45]。综上所述,两种方式制备的多糖结构相似,发酵并未改变多糖的糖链结构,FESP-3 是一种含3,6 内醚半乳糖残基的α硫酸吡喃糖。
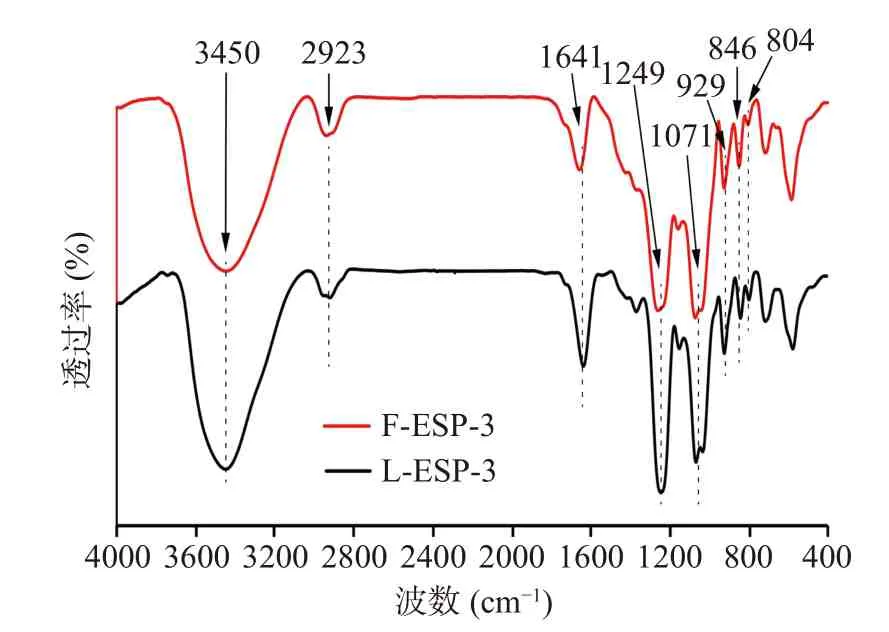
图7 刺麒麟菜硫酸多糖的红外光谱图Fig.7 Infrared spectra ofEucheuma spinosumsulfate polysaccharides
2.7 发酵刺麒麟菜硫酸多糖的抗过敏活性评价
如图8 所示,在10~400 μg/mL 浓度范围内,LESP-3 和F-ESP-3 均无明显细胞毒性,且RBL-2H3细胞活力均在90%以上,说明对细胞活力无显著影响(P>0.05)。
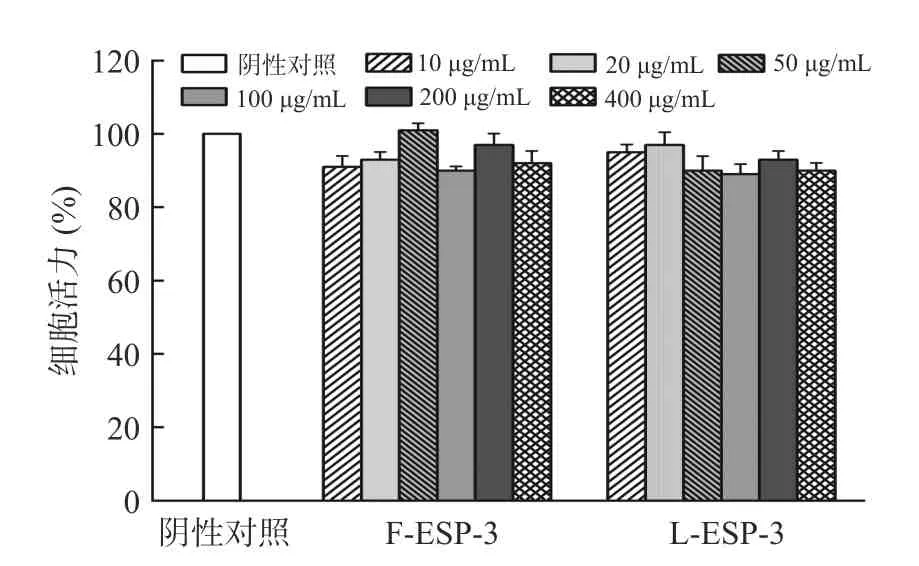
图8 刺麒麟菜硫酸多糖对RBL-2H3 细胞活力的影响Fig.8 Effect of polysaccharide sulfate fromEucheumaspinosumon the viability of RBL-2H3 cells
肥大细胞在效应阶段受到致敏原刺激后脱颗粒,β-氨基己糖苷酶的大量释放是肥大细胞脱颗粒的经典标志,可以引发体内炎症风暴,导致严重的过敏反应,而抑制β-氨基己糖苷酶释放可以有效缓解过敏症状[46]。大鼠嗜碱性粒细胞与肥大细胞相似,受抗原刺激同样释放β-氨基己糖苷酶,并被广泛用作在细胞水平上研究过敏反应的替代和可靠模型[47]。如表5 所示,L-ESP-3 和F-ESP-3 两个样品组均可以抑制β-氨基己糖苷酶的释放,抑制率均大于30%,呈浓度依赖,但F-ESP-3 较L-ESP-3 展现出更好的抑制活性,说明发酵刺麒麟菜硫酸多糖通过抑制β-氨基己糖苷酶的释放进一步发挥抗过敏活性。
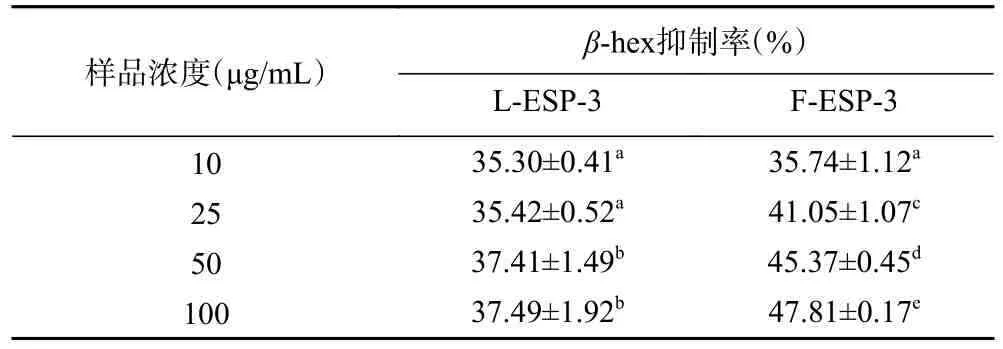
表5 刺麒麟菜硫酸多糖抑制β-氨基己糖苷酶释放的活性评价Table 5 The activity ofEucheuma spinosumsulfate polysaccharides in inhibiting the release ofβ-hexosaminidase
3 结论与讨论
通过单因素实验和Box-Behnken 响应面优化,鼠李糖乳杆菌发酵制备刺麒麟菜粗多糖最佳条件为:料液比1:70,接菌量5%,发酵时间24 h,主次因素排序为接菌量>液料比>发酵时间,最佳条件下粗多糖得率为41.70%±2.00%;纯化后的F-ESP-3 总糖含量为97.77%±1.1%,主要单糖成分为半乳糖,硫酸根含量为28.40%±1.40%,F-ESP-3 还原糖含量(7.87%±0.09%)对比L-ESP-3 的还原糖含量(1.45%±0.10%)极显著提高(P<0.01);F-ESP-3 分子量(33.58 kD)较L-ESP-3(>670 kD)极显著降低(P<0.01),溶解度为(89.33%±3.1%)对比L-ESP-3 的溶解度(56.51%±3.8%)极显著提高(P<0.01),在相同浓度下,F-ESP-3 的比浓粘度为(0.01±0.002 dL/g)对比L-ESP-3 的比浓粘度(3.85±0.25 dL/g)极显著降低(P<0.01);二者在微观形态上,L-ESP-3 呈现均匀片状结构,表面光滑结构致密,而F-ESP-3 呈现不规则颗粒状,表面粗糙且内部具有孔隙结构;红外结构上二者较为相似,均含有硫酸酯基和3,6 内醚半乳糖残基,成环方式为α构型吡喃糖环,指纹区呈现ι-卡拉胶型多糖的特征吸收。同时F-ESP-3 的β-氨基己糖苷酶抑制活性高于L-ESP-3,呈浓度依赖。
综上所述,鼠李糖乳杆菌发酵的方式并没有破坏多糖的链环结构和硫酸基团,因为多糖的分子量和微观结构的疏松多孔化,导致多糖骨架链间的氢键相互作用改变,亲水基团外露,分散性能提高,从而提高溶解度,降低粘度。同时,分子量的降低进一步提高了F-ESP-3 透过细胞膜的能力,提高了生物利用度,从而更好地抑制RBL-2H3 细胞释放β-氨基己糖苷酶,展现出良好的抗过敏活性。由于发酵多糖的糖苷键连接方式、空间构象、取代基团之间的非共价相互作用及抗过敏具体作用机理尚不清楚,因此对于发酵多糖高级结构和抗过敏活性之间的关系以及抗过敏作用靶点还需要进一步深入研究。
