大米抗性辛烯基琥珀酸淀粉酯的制备及特性分析
2022-05-29王姝雯刘庆庆李汶玥包清彬
杨 雪,王姝雯,刘庆庆,杨 浩,李汶玥,包清彬
(西华大学食品与生物工程学院,四川成都 610039)
大米淀粉是从稻谷的胚乳中提取得到,具有粒径小、致敏性低、质构柔滑等特点,但天然大米淀粉由于其性能上的单一性,存在剪应力低、溶解度低和冻融稳定性差等缺陷[1−2],限制了其在食品工业中的应用。将大米淀粉进行酯化改性,对拓展大米特别是碎米的加工用途有积极的意义。
辛烯基琥珀酸淀粉酯(Octenyl succiniate anhydrate starch,OSA 淀粉)是淀粉经辛烯基琥珀酸酐(Octenyl succinic anhydride,OSA)脂化改性而成的改性淀粉,具有优良的乳化性、流动性、稳定性并具有一定的抗消化性能,广泛用于乳化剂、增稠剂、微胶囊壁材等[3−4]。抗性淀粉(Resistant sarch,RS)是一种兼具可溶性纤维与不可溶性膳食纤维特性的淀粉,其在人体小肠无法被消化,且相对普通膳食纤维具有更高的生理活性[5],可通过物理、化学、生物等方法对淀粉改性或直接对食品原料进行改性提高RS 含量,是目前食品加工领域的研究热点之一。但RS 的制取率还普遍较低,市场上利用抗性淀粉开发的食品品种和数量也相对较少。优化RS 的加工工艺并且提高RS 在食品中的利用率是未来研究的重点。
本研究以大米淀粉为原料,制备大米OSA 淀粉,再对其进行湿热处理,进一步提高其抗性淀粉含量,制备抗性辛烯基琥珀酸淀粉酯(抗性OSA 淀粉),其兼备OSA 淀粉和抗性淀粉的特性,按不同的需求,可将其用作增稠剂、乳化剂、可食用膜、微胶囊壁材和特殊包装物[6−7]等使用,有极大的应用前景。
1 材料与方法
1.1 材料与仪器
大米淀粉(籼米) 广州市海希生物科技有限公司;异丙醇 分析纯,天津市大茂化学试剂厂;氢氧化钠、无水乙醇、3、5-二硝基水杨酸 均为分析纯,成都科隆化学品公司;葡萄糖 分析纯,成都迪维乐化学品公司;辛烯基琥珀酸酐、胰α-蛋白酶(300 U/mg)、淀粉葡萄糖甘酶(100 U/mg)、Tris-maleata 溶液、胃蛋白酶 西格玛奥德里奇贸易有限公司。
Vortex genius3、VORTEX 3 漩涡混匀器 艾卡仪器设备有限公司;HWCL-3 集热式恒温磁力搅拌器 长城科工贸易公司;UV2600 紫外可见光分光光度计 上海舜宇恒平科学仪器有限公司;5424 高速离心机 德国艾本德仪器公司;TD-5M 低速离心机 四川蜀科仪器公司;TGA/DSC 3+同步热分析仪(TG-DSC) 梅特勒-托利多精密仪器公司;PHS-3C pH 计 成都世纪方舟有限公司;MCR302 流变仪奥地利Anton Paar 仪器公司;JA2003 千分之一分析天平 上海精密科技有限公司。
1.2 实验方法
1.2.1 OSA 淀粉的制备 采用水相法制备大米OSA淀粉,参考JAIN 等[8]的方法并稍作修改,称取定量大米淀粉悬浮在蒸馏水中制成一定浓度(w/w)淀粉浆料,用1 mol/L NaOH 溶液调浆液pH。取质量为淀粉质量3%的OSA,用异丙醇稀释5 倍,缓慢加入到淀粉浆料,整个反应过程保持温度和pH 稳定(用1 mol/L NaOH 溶液调pH)。反应结束后,用1 mol/L HCl 将淀粉浆液的pH 调至6.0,将淀粉浆料离心(1500 g、10 min),下层淀粉蒸馏水洗涤2 次,70%乙醇洗涤3 次,得到的OSA 淀粉在45 ℃烘箱中干燥,粉碎后过200 目筛,收集于干燥器中保存。
1.2.2 单因素实验 以取代度(Degree of substitution,DS)为主要考评指标,反应效率(Reaction efficiency,RE)为参考考评指标,参考相关研究[3−4],结合预实验结果,依次考察反应温度、反应pH、酸酐滴加时间、淀粉浆液浓度对DS 的影响。固定反应温度40 ℃、淀粉浆液浓度35%(w/w)、反应pH8.5、酸酐滴加时间2 h 中三个因素水平值,对第四个因素进行单因素实验。实验因素条件为反应温度(30、35、40、45、50 ℃),反应pH(7.5、8.0、8.5、9.0、9.5),酸酐滴加时间(2、3、4、5、6 h),淀粉浆液浓度(20%、25%、30%、35%、40%)。
1.2.3 正交试验 在单因素实验结果的基础上,选取反应温度(A)、反应pH(B)和酸酐滴加时间(C)三个因素,设计正交试验,因素水平见表1。

表1 正交试验因素与水平Table 1 Factors and level of orthogonal test
1.2.4 酯化取代度DS 与反应效率RE 的测定 取代度反映了添加的OSA 全部与淀粉反应生成OSA淀粉的情况,采用滴定法[9]测定,参照李天贵[10]的方法。称取2.000 g(d.b.)大米OSA 淀粉,分散于150 mL 2.5 mol/L 的盐酸异丙醇溶液中,搅拌30 min,加入150 mL 90%异丙醇水溶液继续搅拌10 min。将淀粉液离心(2000 g、10 min),沉淀用90%异丙醇反复洗涤离心,直至洗出液无Cl−被检出。将所得沉淀分散于100 mL 去离子水中,沸水浴20 min 至溶解。用酚酞作指示剂,迅速用0.1 mol/L NaOH 溶液滴定至粉红色。取代度计算公式如下:
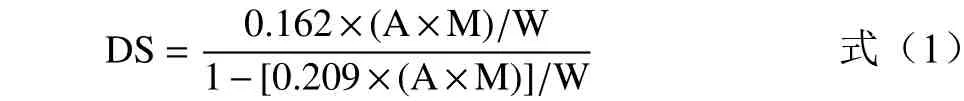
式中:0.162 是单个葡萄糖残基的摩尔质量(kg/mol);0.209 是OSA 的摩尔质量(kg/mol);A 是NaOH 标准溶液的滴定体积(mL);M 是NaOH 标准溶液的浓度(mol/L);W 是淀粉干基的质量(g)。
反应效率的计算公式如下:
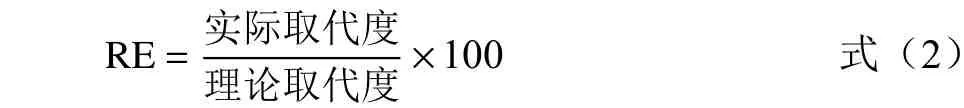
1.2.5 抗性OSA 淀粉的制备 以湿热处理法[11](Heat and moist treat,HMT)制备抗性淀粉,称取OSA 淀粉30.0 g(干基)于带盖铝盒中,用喷壶将蒸馏水喷洒到淀粉上,调整水分含量30%,密封后在120 ℃的条件下湿热处理4、8、12、18、24 h,冷却后45 ℃烘箱烘干、粉碎后过120 目筛,得到抗性OSA 淀粉样品,按处理时间将样品分别标记为HMT4、HMT8、HMT12、HMT18、HMT24。
1.2.6 指标测定
1.2.6.1 抗性淀粉含量测定 RS 测定参考GOÑI 等[12]的方法并稍作调整:准确称取淀粉样品0.500 g,分散于50 mL HCl-KCl 缓冲液,加入2 mL 胃蛋白液(3000 U/mg 的胃蛋白酶10 g 溶解于200 mL HCl-KCl 缓冲液(pH1.5)中),37 ℃下恒温振荡60 min,用0.1 mol/LTris-maleata 溶液调节pH 至6.9,加入10 mL 胰α-淀粉酶溶液,37 ℃水浴振荡42 h;取出离心(3000×g,10 min),沉淀用蒸馏水洗涤3 次后,分散于15 mL 4 mol/L 的KOH 溶液中,室温振荡至沉淀充分溶解。然后用2 mol/L 的HCl 溶液调节pH至4.5~4.8,加10 mL 淀粉葡萄糖甘酶溶液,在58 ℃下恒温水浴振荡60 min 后冷却至室温,取出离心(3000×g,10 min),收集上清液;用蒸馏水洗涤沉淀3 次,离心后收集合并上清液,定容至500 mL。
参照DNS 法[13−14]测定上述溶液中的还原糖含量:按照薛慧等[13]的方法以540 nm 处的吸光度为纵坐标,葡萄糖浓度为横坐标制作葡萄糖标准曲线,其回归方程为:y=13.719x−0.0174,R2=0.9977。取1 mL的上清液于25 mL 的试管中,加入1 mL 蒸馏水和5 mL DNS[14]试剂,将各试管摇匀,在沸水浴中加热5 min 后,用流水迅速冷却,再用蒸馏水定容至25 mL测量各溶液的吸光度,利用标准曲线计算出葡萄糖的含量。再根据以下公式计算抗性淀粉含量:

式中:M 为葡萄糖含量(g/mL,由葡萄糖标准曲线求得);W 为分析样本的干质量=质量×(100−含水量)/100 (g);V 为待测液的体积(mL)。
1.2.6.2 溶解性测定 将待测样品配制成质量浓度1%的悬浮液,置于250 mL 带盖三角锥中,于25 ℃恒温水浴振荡60 min,将溶液离心(1500×g,15 min)。取上层清液在105 ℃下烘干至恒重,称量得到已溶解的淀粉质量A。溶解度按以下公式计算:

式中,A 为上清液中溶出物质量(g);W 为样品干重(g)。
1.2.6.3 凝沉性测定 凝沉性测定参考尹沾合等[15]的方法,在带有回流搅拌装置的三口烧瓶中加入质量分数为1%的淀粉乳95 ℃保温30 min 水浴加热糊化,冷至室温得糊化液。取25 mL 糊化液加入具塞刻度试管中室温静置,每经24 h(1 d)记录具塞试管中上层清液体积数,该数即为凝沉性。
1.2.6.4 膨胀度测定 将待测样品配制成质量浓度1%的悬浮液,置于250 mL 带盖三角锥中,置于50~90 ℃的不同温度水浴锅恒温振荡30 min,冷却后将溶液离心(1500×g,15 min)取上层清液在105 ℃下烘干至恒重,称量记为A,离心管内的湿淀粉质量记为P。按以下公式膨胀度:
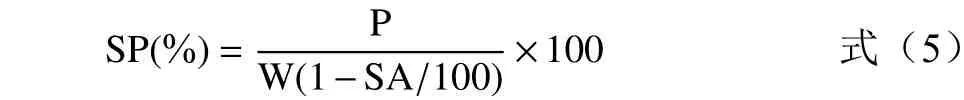
式中:W 为样品干重(g);P 为离心管中沉淀物质量(g)。
1.2.6.5 糊化特性测定 使用MCR3 流变仪测定淀粉的糊化特性。称取1.77 g 淀粉样品置于仪器配套的圆心筒系统中,加16 mL 蒸馏水配置成淀粉浆料进行测定,使用圆心筒转子,前10 s 转速960 r/min,使淀粉分散。参数设定参考白婷等[16]的方法。
1.2.7 淀粉体外消化试验
1.2.7.1 模拟消化液的配制 人工模拟胃液的制备:用4 mol/L 盐酸溶液调节0.2%(w/v)NaCl 溶液的pH至2.0,加入一定量的胃蛋白酶,调节浓度为3 mg/mL。人工模拟肠液的制备:将复合胰酶和胆盐均匀分散于磷酸缓冲液(0.1 mol/L,NaH2PO4-Na2HPO4,pH7.0)中,复合胰酶和胆盐浓度分别为2 mg/mL 和4.5 mg/mL,再添加淀粉葡萄糖苷酶(100 U/mg)使浓度为400 U/mL,用1 mol/L 的NaOH 溶液调pH 至7.4。
1.2.7.2 淀粉的体外消化 两段式体外消化参考俞安珍[17]和LOPEZ 等[18]的方法并稍作修改。准确称取0.100 g 样品13 份置于离心管中,编号1~13,加入2 mL 蒸馏水,于95 ℃水浴振荡30 min 后自然冷却。
胃段消化:样品用0.2 mol/L HCl 溶液调节pH至2.0。加入2 mL 模拟胃液,混均后在37 ℃下恒温水浴振荡30 min。在5、15、30 min 时依次取出1~3 号管,加入3 mL 95%乙醇灭酶后,离心(4000 r/min,15 min)后取上清液1 mL,参照薛慧等[13]的方法测定还原糖含量,计算消化水解率。
小肠段消化:其余样品迅速加入适量的0.01 mol/L NaOH 溶液将混合液pH 调至7.4 左右。加入4 mL 模拟肠液,混匀后置于37 ℃恒温水浴振荡150 min。在消化过程中第10、20、30、40、50、60、90、120、150 及180min 时依次取出4~13 号管,加入3 mL 95%乙醇灭酶后,离心(4000 r/min,15 min)后取上清液1 mL,同上,计算消化水解率。
在小肠中20 min 内被消化吸收的淀粉为快速消化淀粉(Rapidly digestible starch,RDS),20~120 min内被消化吸收的淀粉为慢消化淀粉(Slowly digestible starch,SDS),120 min 内不能被小肠消化吸收的淀粉称为RS。
1.3 数据处理
每组实验重复3 次,数据表示为“平均值±标准偏差”,采用SPSS 22 对数据进行统计分析,采用最小显著差数法在显著性水平为P<0.05 的条件下进行显著性检验,用Origin2019 绘图。
2 结果与分析
2.1 酯化条件对DS 和RE 的影响
反应温度、反应pH、酸酐滴加时间、淀粉浆液浓度对DS 和RE 的影响见图1。
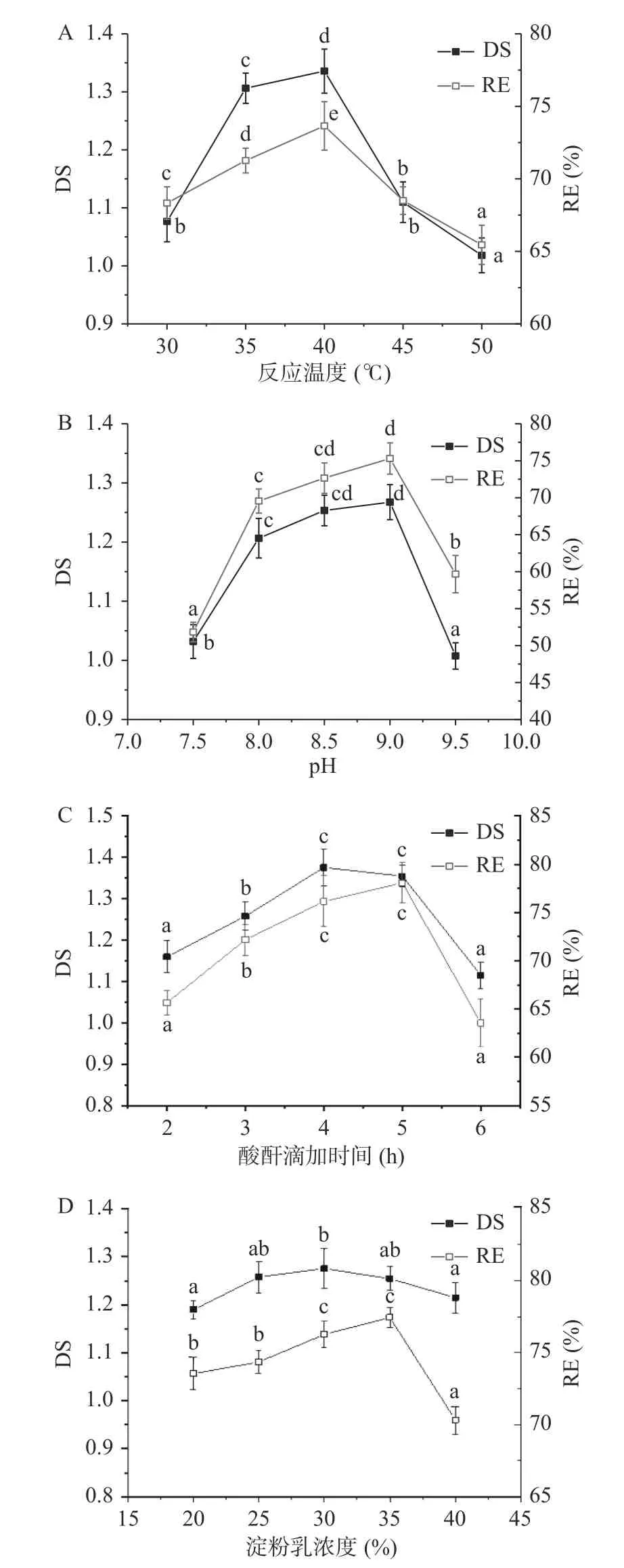
图1 酯化条件对取代度(DS)和反应效率(RE)的影响Fig.1 Effect of esterification conditions on degree of substitution and reaction efficiency注:不同小写字母表示同一指标差异显著(P<0.05);A、B、C、D 分别表示温度、pH、酸酐滴加时间及淀粉浆液浓度对DS 和RE 的影响。
图1A 为温度的影响,当温度较低时,DS 和RE 均随着温度升高显著增加(P<0.05),在40 ℃达到最大,DS 为1.3407,RE 为73.5%。当温度超过40 ℃时,DS 和RE 降低。升高温度可促进体系中淀粉的溶解和膨胀以及OSA 在体系中扩散,与淀粉分子接触增加,从而提高了酯化反应的效率[4],同时在高温条件下,淀粉发生糊化、酸酐水解加速并且与碱试剂反应[4,19],使得OSA 淀粉的DS 和RE 降低。图1B 为pH 的影响,当体系pH9.0 时,OSA 淀粉的DS 和RE 最高,分别为1.2588 和75.1%。酯化反应过程中,淀粉分子的羟基需要在碱性条件下活化,当pH 较低接近中性时,羟基活化不完全,pH 升高,DS 和RE 相应升高。当pH 达到9.5 时,酸酐先与碱发生反应,与淀粉分子的接触进一步降低,并且酯在碱性的条件下,容易发生水解,溶液碱性过强也会使部分淀粉糊化,使淀粉浆液粘度上升降低OSA 与淀粉分子接触[20−21]。图1C 为酸酐滴加时间的影响,DS 和RE 随着酸酐滴加时间的延长逐渐升高,DS 在滴加时间4 h 达到最大值。酸酐开始滴入反应体系时,可以充分和淀粉分子接触反应,持续滴加酸酐可以促进反应正向进行;反应到后期,淀粉酯的水解反应也在同时进行,导致DS 下降。滴加时间为5 h时,产品取代度开始下降。由于酸酐滴加完成后,还会继续反应一段时间,考虑到实验持续的时间,因此正交因素水平以3 h 为中心。由图1D 可看出,DS 随淀粉浆液浓度先升高后降低,淀粉浆液浓度在25%~35%时DS 变化不显著(P>0.05),DS 值在1.19 至1.27 之间小幅变化。RE 在浓度为35%时达到最大77.1%,当淀粉乳质量分数增加到一定程度,反应体系中水分含量相对减少,淀粉颗粒会出现收缩,这不利于OSA 进入到淀粉颗粒的无定形区[21]。故选择30%的淀粉乳浓度用于后续实验。
2.2 大米辛烯基琥珀酸制备工艺优化
在单因素实验结果的基础上,淀粉乳浓度为30%,选取反应温度(A)、反应pH(B)和酸酐滴加时间(C)三个因素,设计L9(34)正交优化试验,正交试验结果见表2。

表2 正交试验结果Table 2 Results of orthogonal test
对表2 结果进行极差分析可知,三个因素对取代度DS 影响大小的顺序为反应温度>反应pH>酸酐滴加时间。以取代度为指标确定酯化反应的最佳水平为A2B3C2,即反应温度40 ℃、反应pH9.0、酸酐滴加时间3 h。由于此最优工艺组合并未出现在正交方案里,因此需要按照此条件进行验证试验,验证结果表明按照A2B3C2工艺条件制得的OSA 淀粉取代度DS 为1.3915±0.045,平均反应效率RE 为78.2%,高于正交实验结果的最大值1.3875,对应水平组合为A2B3C1。将此条件制备的OSA 淀粉样品标记为DS-1.39。
2.3 酯化及湿热处理后抗性淀粉含量的变化
大米淀粉(Rice starch)、OSA 淀粉(DS-1.39)及不同湿热处理时间抗性淀粉含量见图2。

图2 湿热时间对抗性淀粉含量的影响Fig.2 Influence of heat-moisture treatment time on resistant starch content注:不同小写字母表示差异显著(P<0.05),图3 同。
原大米淀粉的抗性淀粉含量为12.7%,从图2中可以看出,酯化反应获得的OSA 淀粉其抗性淀粉含量增加到25.2%,这是因为淀粉酯化后引入OSA基团,在α-淀粉酶与葡萄糖单元的糖苷键之间形成空间位阻,两者结合能力下降,淀粉的可消化性下降,使OSA 淀粉抗性增加[22],这与HEACOCK 等[23]提出的OSA 酯化反应可以用来制备抗性淀粉的结论相似。
将含水量30%的OSA 淀粉在120 ℃条件下湿热处理4 h 后,淀粉样品中的抗性淀粉含量显著升高至34.2%(P<0.05),并且随着湿热时间的增加,抗性淀粉的含量也逐步增加,处理18 h 后基本平缓,达到42.2%。这是因为在高水分和高热的共同作用下,大米淀粉团粒内无定形区中淀粉链之间的相互作用发生改变[24],使淀粉直链淀粉含量增加。另一方面,湿热处理使体系自由能变大,淀粉分子链形成新的微晶和单螺旋结构,增加淀粉分子的稳定性,提高淀粉的抗酶解能力[5]。HUNG[25]对红米进行湿热处理,发现红米RS 含量同湿热处理的含水量与加热温度呈正相关。
2.4 酯化及湿热处理对淀粉溶解性和凝沉性的影响
大米淀粉、OSA 淀粉及不同湿热处理时间淀粉的溶解性和凝沉性见图3。

图3 湿热处理时间对淀粉溶解性和凝沉性的影响Fig.3 The effect of moisture heat treatment time on starch solubility and retrogradation注:a:淀粉的溶解性;b:淀粉的凝沉性。
由图3 可知,与原大米淀粉相比,酯化反应后,OSA 淀粉的溶解性和凝沉性都显著升高(P<0.05),而湿热处理对OSA 淀粉的凝沉性没有显著影响(P>0.05)。由于酯化反应引入了亲水基团,淀粉溶解性由13%升高到17%。随着湿热处理时间增加,溶解性进一步增加,可能是湿热处理过程中,淀粉的氢键结构遭到破坏,分子链的自由度增大,特别是非晶区的分子链,而辛烯基琥珀酸淀粉酯的亲水基团多接枝于非晶区分子链上[24−26],从而使亲水基团伸展,与水分子的结合增强。有研究表明,酯化反应主要发生在淀粉非结晶区分子间聚集程度较低的位置,溶解性的上升可能归因于非晶区直链淀粉的溶解[27]。
大米淀粉酯化后凝沉性从74.6%提高到98.1%,即OSA 淀粉糊室温存放24 h 后基本无水分析出。酯化后,大米淀粉分子接上的OSA 基团具有较强的疏水性,阻止了淀粉分子间氢键的形成,促进淀粉分子间相互排斥[28],有效地阻碍了淀粉糊的凝沉现象。
2.5 酯化及湿热处理对淀粉膨胀度的影响
淀粉的膨胀度反映了淀粉的溶胀能力,大米淀粉、OSA 淀粉及不同湿热处理时间抗性淀粉的膨胀度见表3。
从表3 可以看出,大米淀粉酯化反应后,膨胀度显著增加(P<0.05)。这是由于酯化反应引入亲水基团,弱化了淀粉分子之间的作用力,使水分子更易穿过被酯化的直链淀粉所在的非结晶区,从而渗透到颗粒内部,使淀粉颗粒发生膨胀[29−30]。而湿热处理后,膨胀度随着处理时间的增加逐渐降低,这可能是因为在高温高湿度的条件下,淀粉的支链淀粉发生断裂,形成较短的直链淀粉,淀粉内的分子链相互交织程度加大,键能增加,淀粉的双螺旋结构更加紧密,不利于淀粉糊化后从颗粒中溶出,从而降低了淀粉的膨胀度[31]。此外在湿热处理处理之后,淀粉中的脂质复合物增多,抑制淀粉颗粒的膨胀[31−32]。
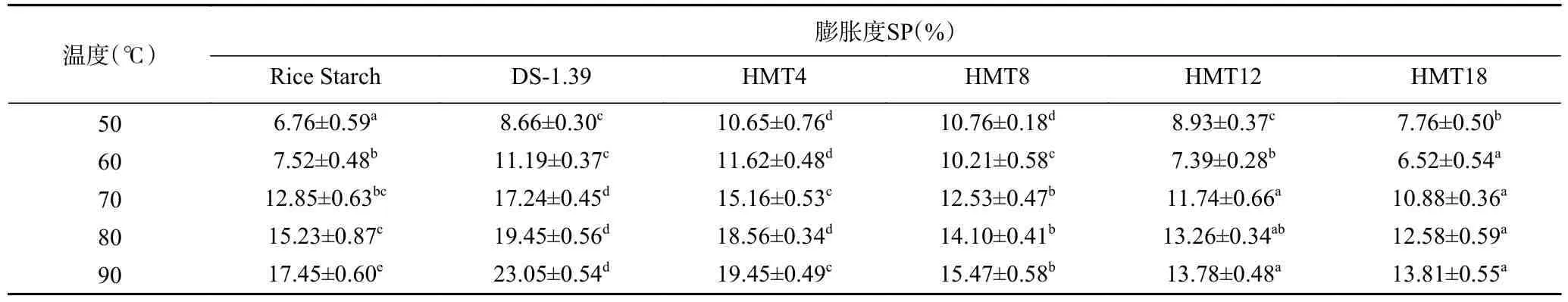
表3 湿热处理时间对淀粉膨胀度的影响Table 3 The influence of heat-moisture treatment time on starch swelling force
2.6 酯化及湿热处理对淀粉糊化特性的影响
如表4 所示,大米淀粉脂化处理及湿热处理后,糊化特性均出现较大改变。

表4 湿热处理对糊化特性的影响Table 4 The influence of heat-moisture treatment on gelatinization characteristics
与原大米淀粉相比,DS-1.39 的峰值黏度和最终黏度显著增加(P<0.05),峰值黏度反映淀粉的持水性,最终黏度反映淀粉形成凝胶的强度,表明OSA淀粉持水性明显增加,凝胶强度增强[33];崩解值和回升值上升表明OSA 淀粉热稳定性降低,热糊的抗剪切力下降;OSA 淀粉的糊化温度有所下降,可能是因为OSA 基团接入后,部分淀粉分子因带有同种负电荷而相互排斥,结构变松散,水分子更易渗入,加热使颗粒裂解,在较低的温度下熔融糊化,且DS 值越大,OSA 基团越多,糊化温度越低[1]。宋晓燕等[34]发现不同取代度的糯玉米淀粉酯的糊化温度随着取代度的升高而降低。
OSA 淀粉湿热处理4 h 后,峰值黏度、最终黏度和回升值显著升高(P<0.05),但随着湿热处理时间延长,其值又逐渐降低。研究表明,湿热处理后淀粉的糊化性质的变化不仅与淀粉分子链的结构有关,还与其聚集态结构的形态密切相关[34−35]。长时间湿热处理使OSA 淀粉糊化温度升高,峰值黏度、最终黏度以及崩解值下降,表明湿热处理后,淀粉糊的稳定性增强。
2.7 抗性OSA 淀粉体外消化试验
大米淀粉、OSA 淀粉及不同湿热处理时间的抗性OSA 淀粉体外消化实验结果如图4 所示。前30 min 为模拟胃液消化,30~180 min 为模拟肠液消化。从图中可以看出,大米淀粉在经过OSA 酯化和后续湿热处理后,在胃肠道的消化总趋势基本相同,淀粉在胃中消化较低(前30 min),进入肠道后消化水解率快速上升,在肠道120 min 后各样品的消化水解率趋于平衡。

图4 淀粉样品在模拟胃肠液中的消化情况Fig.4 Digestion of starch samples in simulated gastrointestinal juice
通过样品的水解率计算得出各淀粉样品的RDS、SDS、RS 含量如表5 所示,原大米淀粉在胃肠道的最终水解率为87.57%,在模拟肠液中,前20 min内水解的快消化淀粉含量为47.15%,120 min 后仍未消化的淀粉含量为18.76%,与测定的抗性淀粉含量12.7%相符。经过酯化后,DS-1.39 的抗消化性显著增强,OSA 淀粉的抗消化性来源于OSA 基团的疏水性和空间位阻,减缓了α-淀粉酶与淀粉分子的接触[19,36],因此前期消化速率大大降低,随着淀粉的水解,淀粉的结构被破坏后消化速率逐渐加快,最终未消化的淀粉含量为24.57%,所以酯化主要是降低了快消化淀粉的含量。

表5 淀粉样品的RDS、SDS、RS 含量Table 5 RDS, SDS, RS content of starch samples
OSA 淀粉经过湿热18 h 后,在肠液前20 min的消化水解率从28.52%降低至22.34%,证明湿热处理也可以减少部分快消化淀粉,而在模拟肠液中120 min 之后,该样品消化水解率从73.1%降低到56.11%,因此湿热处理减少的主要为慢消化淀粉[23],湿热处理的OSA 淀粉的最终消化率为58.8%,可得到抗性淀粉为41.2%的OSA 淀粉,与直接测定抗性淀粉的结果42.2%接近。抗性OSA 淀粉的抗消化性提高使其在益生菌微胶囊包埋应用中具备了良好的抗消化稳定性[6,37],还可以扩大其在保健食品上的应用途径。
3 结论
制备大米OSA 淀粉的最佳工艺条件为温度40 ℃、反应pH 为9.0、酸酐滴加时间为4 h、淀粉乳浓度30%。此工艺条件下制得的OSA 淀粉的DS为1.3915、RE 为78.2%。对OSA 淀粉进行湿热处理18 h 后,OSA 淀粉的抗性淀粉含量从25.2%增加至42.2%。
酯化后OSA 淀粉的溶解性、凝沉性和膨胀度均显著优于原大米淀粉,抗性OSA 淀粉溶解性进一步增加,膨胀度降低;糊化特性测试结果表明,OSA 淀粉经湿热处理后,糊化温度升高,峰值黏度、最终黏度,回升值随湿热处理时间的增加先升高后逐渐降低,但仍显著优于原大米淀粉。消化实验表明抗性OSA 淀粉在胃肠道的消化水解率大幅下降,经过模拟胃肠液消化180 min 后水解率为58.8%。本研究采用OSA 酯化和湿热处理相结合的方式对大米淀粉进行改性处理制备抗性OSA 淀粉,淀粉的各种理化性质得到显著改善,对OSA 淀粉和抗性淀粉的制备及利用提供了参考,也为大米加工利用提供了一种新思路。
