人参提取物胁迫培养对副干酪乳杆菌JLUs66 菌株生长特性及耐受性的影响
2022-05-29董舒月朱梓燚冀瑶瑶刁梦雪叶海青张铁华
董舒月,朱梓燚,杨 涛,冀瑶瑶,刁梦雪,叶海青,张铁华
(吉林大学食品科学与工程学院,吉林长春 130062)
乳酸菌在提升发酵食品的风味、改善机体胃肠道生态环境、提高宿主免疫力等方面具有显著的功效[1−3],现已广泛应用于食品、药品、饲料等领域[4−5]。人参作为百草之王,其抗肿瘤、抗氧化、降血糖等作用已被充分挖掘,尤其在提高人体抗应激能力方面具有重要的调节作用[6−9]。乳酸菌存在着保藏周期短、环境耐受性不强等缺点,限制了应用效果和应用范围,因此,提高乳酸菌环境耐受性成为了当下的研究热点,特别是低温、高温、低pH、高胆盐及高盐条件对乳酸菌存活率的影响。前期研究表明,人参提取物在酸奶发酵过程中对乳酸菌的发酵特性存在一定的影响[10],但人参提取物对乳酸菌的生存能力及抗应激性的影响并未有研究报道。
乳酸菌在其生长环境发生改变时,细胞本身会通过多种适应机制对胁迫信号做出反应,如胞外多糖合成量的改变、多种胁迫相关基因的表达[11],从而发生一定的应激能力,保护细胞免受外界环境的刺激[12],而产生的这种应激能力又影响着乳酸菌对其他不良环境的抵抗能力,出现交叉保护的现象[13]。通过利用乳酸菌的交叉保护现象,可以影响其菌株生长特性及环境耐受性等生存能力。
副干酪乳杆菌JLUs66 具有显著的降胆固醇功能[14],良好的菌株特性及环境耐受性是其发挥活性的重要前提。本研究以副干酪乳杆菌JLUs66 为研究对象,考察了在培养基中添加不同浓度的人参提取物胁迫培养的副干酪乳杆菌JLUs66 的生长曲线、活菌数、产酸能力、产胞外多糖能力及其低温耐受性、高温耐受性、低pH 耐受性、胆盐耐受性和NaCl 耐受性,探究了在培养基中添加不同浓度的人参提取物对胁迫培养的副干酪乳杆菌JLUs66 的菌株生长特性及耐受性的影响。本研究阐述了人参提取物对乳酸菌环境适应性的变化规律,为提高乳酸菌菌株耐受性提供了理论依据。
1 材料与方法
1.1 材料与仪器
副干酪乳杆菌JLUs66 吉林大学食品科学与工程学院实验室保藏;人参提取物(人参多糖含量51%,人参皂苷含量40%) 人参研究院;MRS 肉汤培养基、琼脂 青岛海博生物技术有限公司;脱脂乳粉 新西兰恒天然乳业集团;胃蛋白酶(猪胃黏膜)3000 U/g,上海源叶生物科技有限公司;盐酸、牛胆盐、氯化钠 分析纯,南京建成科技有限公司。
BSD-25 恒温培养箱 常州杰博森仪器公司;MDF-382E(N)超低温冰箱 日本三洋公司;BSC-1000IIA2 生物安全柜 苏净科学器材公司;AvantiJE 离心机 美国贝克曼库尔特有限公司;Bio-Rad Universal Hood II 凝胶成像仪 美国Bio-Rad 公司;SlgP033RB 0.22 μm/0.45 μm 过滤器 美国Millipore公司;pHS-3C pH 计 上海精密科学仪器公司;BioTek Synergy HT 多功能酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 添加人参提取物培养基的制备 将人参提取物按2%(w/v)的比例溶于水,用0.45 μm 滤膜过滤,得到人参提取物母液。将母液按一定比例添加到脱脂乳培养基中,配制得到终浓度(w/v)分别为0‰、1‰、3‰、5‰、8‰和10‰的脱脂乳-人参提取物培养基。
1.2.2 菌株的处理 用脱脂乳培养基活化副干酪乳杆菌JLUs66,以2%的接种量在37 ℃下培养12 h,活化3 次以备实验使用。将活化好的副干酪乳杆菌JLUs66 以2%的接种量分别接种于不同浓度的脱脂乳-人参提取物培养基中,37 ℃连续培养3 代,每次培养12 h,得到处理后的副干酪乳杆菌菌株,分别记为JLUs66-0、JLUs66-1、JLUs66-3、JLUs66-5、JLUs66-8 和JLUs66-10。将处理后的菌株在4 ℃,8000×g 的条件下离心10 min,弃上清,用0.9%的生理盐水洗涤沉淀,离心后得到菌泥。
1.2.3 菌株生长特性
1.2.3.1 菌株的生长曲线 将1.2.2 中得到的菌泥重悬于0.9%的生理盐水中,并将菌体浓度调整为109CFU/mL。以2%的接种量接入到脱脂乳培养基中,37 ℃下连续培养24 h,每隔2 h 取样,测定OD600值,绘制生长曲线。
1.2.3.2 菌株的活菌数 采用稀释涂布平板法计数,对1.2.3.1 中培养24 h 后的副干酪乳杆菌菌株进行活菌计数,并使用凝胶成像仪对平板进行拍照。
1.2.3.3 菌株的产酸能力 方法同1.2.3.1,每隔2 h取样,测定发酵液的pH。
1.2.3.4 菌株代谢过程中胞外多糖产量的测定 胞外多糖粗品的提取制备根据前人的方法略做调整[15]。将1.2.2 中得到的菌泥重悬于0.9%的生理盐水中,并将菌体浓度调整为109CFU/mL。以2%的接种量接入到脱脂乳培养基中,37 ℃下连续培养24 h,将待测菌液在90 ℃下水浴加热15 min,4 ℃下10000 r/min 离心20 min 去除细胞。在上清液中添加4%(w/v)的三氯乙酸,4 ℃下放置12 h 沉淀蛋白质,离心后取上清液,添加3 倍体积的冷乙醇,4 ℃下放置过夜。离心后取下层沉淀,即为胞外多糖粗品。将粗品溶解在去离子水中,10000 Da 膜透析。通过苯酚-硫酸法,依据葡萄糖浓度与吸光度的线性关系(y=1.3478x+0.0486,R2=0.9998),计算得出胞外多糖含量。
1.2.4 乳酸菌耐受性测定
1.2.4.1 耐低温能力的测定 将1.2.2 中得到的菌泥分别重悬于脱脂乳培养基中,并将菌体浓度调整为109CFU/mL。将其分装后置于4 ℃冷藏,−18 ℃缓冻,−80 ℃超低温环境下储存,在第0.5、1、2、7、15、30 d 分别取出,测定低温处理前后的活菌数,计算存活率。
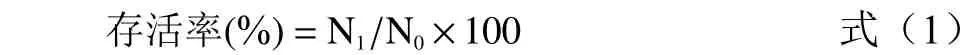
式(1)中:N1为低温培养后的活菌数,CFU/mL;N0为低温培养前的活菌数,CFU/mL。
1.2.4.2 耐热能力的测定 菌株的耐受性评价温度及其耐热性实验方法根据安璟[13]的方法调整,副干酪乳杆菌JLUs66 的耐热性评价温度为55 ℃。将1.2.2 中得到的菌泥分别重悬于脱脂乳培养基中,并将菌体浓度调整为109CFU/mL。将其分装后置于耐受性评价温度下水浴处理10 min,测定耐热性评价温度下处理前后的活菌数,计算存活率。
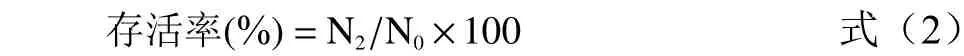
式(2)中:N2为耐热性评价温度下培养后的活菌数,CFU/mL;N0为耐热性评价温度下培养前的活菌数,CFU/mL。
1.2.4.3 耐低pH 能力的测定 菌株的低pH 耐受性是通过菌株在人工胃液环境下的存活率所测得的[16]。人工胃液的配置:氯化钠0.2%,胃蛋白酶0.3%,用1 mol/L 盐酸调整pH 至2.5 后,过0.22 μm 滤器后除菌备用。将1.2.2 中得到的菌泥重悬于0.9%的生理盐水中,并将菌体浓度调整为109CFU/mL。将其分装后置于人工胃液中37 ℃孵育。测定人工胃液环境下1 h 的活菌数,计算存活率。

式(3)中:N3为人工胃液孵育后的活菌数,CFU/mL;N0为人工胃液孵育前的活菌数,CFU/mL。
1.2.4.4 耐胆盐能力的测定 菌株的胆盐耐受性根据Argyri[17]和Wang[18]的试验方法测得。将1.2.2中得到的菌泥分别重悬于含有0.3%、0.5%(w/v)胆盐的脱脂乳培养基中,测定其在0、4 h 的活菌数,计算存活率。
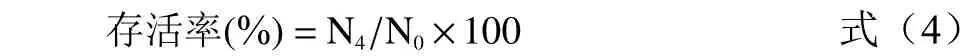
式(4)中:N4为含胆盐培养基培养4 h 后的活菌数,CFU/mL;N0为含胆盐培养基培养0 h 时的活菌数,CFU/mL。
1.2.4.5 耐NaCl 能力的测定 菌株的耐NaCl 能力的测定参考了熊蝶等[19]的方法。将1.2.2 中得到的菌泥分别重悬于含有20、40、60、80 g/L NaCl 的MRS肉汤培养基中,在37 ℃下培养24 h,测定其在24 h的OD600值。
1.3 数据处理
实验数据以3 次重复的平均值±标准差表示,采用SPSS 21.0 进行统计分析,应用单因素ANOVA方差分析进行组间比较,使用GraphPad prism 8.0 软件及Origin 8.0 软件进行绘图。
2 结果与分析
2.1 人参提取物对菌株生长特性的影响
2.1.1 人参提取物对菌株生长曲线的影响 如图1所示,由人参提取物胁迫培养的副干酪乳杆菌JLUs66 的生长曲线可知,菌株经人参提取物胁迫培养对其进入不同的生长阶段的时间造成无显著性影响(P>0.05)。经不同浓度人参提取物胁迫培养的副干酪乳杆菌JLUs66 均在2 h 进入对数期,12 h 进入稳定期。JLUs66-0 的OD600值在进入稳定期后一直保持最高的趋势,而高浓度人参提取物胁迫培养的菌株JLUs66-8 及JLUs66-10 在稳定期的OD600值显著低于其他组别(P<0.05)。16 h 后,JLUs66-8 及JLUs66-10 的OD600值出现了更为明显的下降的趋势,这可能是因为JLUs66-8 及JLUs66-10 中出现了菌体自溶的现象[20]。
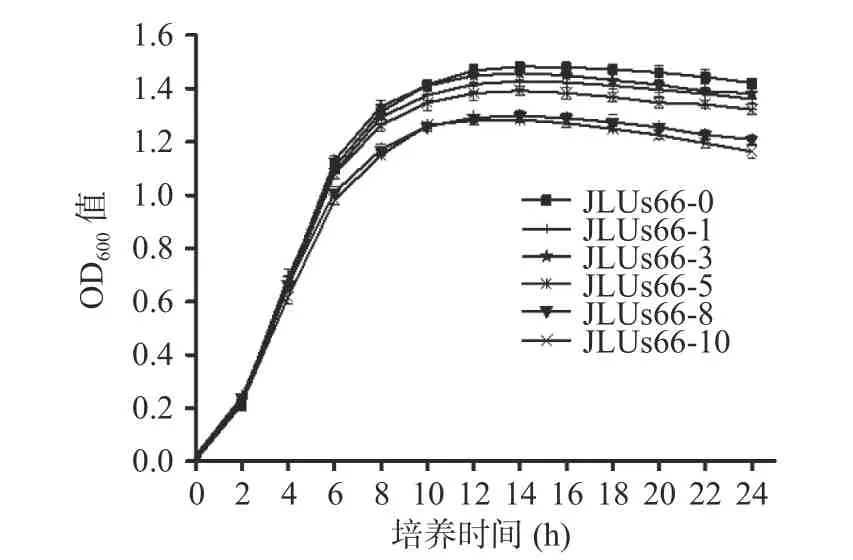
图1 人参提取物胁迫培养的副干酪乳杆菌JLUs66的生长曲线Fig.1 Growth curves ofLactobacillus paracaseiJLUs66cultured under stress by ginseng extract
2.1.2 人参提取物对菌株活菌数的影响 如表1、图2 所示,添加不同浓度的人参提取物胁迫培养的副干酪乳杆菌JLUs66 在24 h 后的生长会受到显著的抑制(P<0.05),人参提取物的浓度越高,抑制程度越大,菌株的活菌数越少。
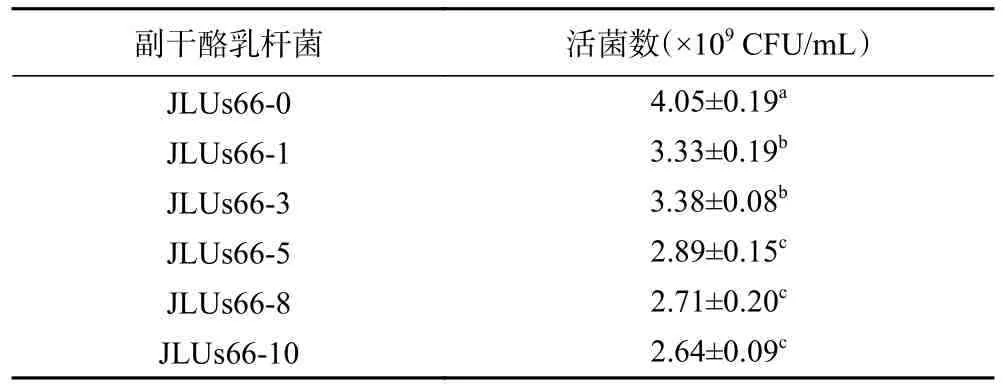
表1 人参提取物胁迫培养的副干酪乳杆菌JLUs66的活菌数Table 1 Viable counts ofLactobacillus paracaseiJLUs66cultured under stress by ginseng extract

图2 人参提取物胁迫培养的副干酪乳杆菌JLUs66 平板图Fig.2 Plate ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract
2.1.3 人参提取物对菌株产酸能力的影响 在培养基中添加不同浓度的人参提取物胁迫培养的副干酪乳杆菌JLUs66 的发酵液pH 变化曲线见图3,随着培养时间的增加,发酵液pH 不断降低。其中,JLUs66-3 的pH 与JLUs66-0 的无显著差异(P>0.05),其余组别pH 下降的幅度小于JLUs66-3 和JLUs66-0 组。且呈现出随着培养基中人参提取物浓度的增加,菌株产酸越慢,菌液的pH 越高的规律。培养24 h时,JLUs66-0 菌液的pH 最低,降至4.91±0.06,而JLUs66-10 的pH 仅降至5.29±0.07。
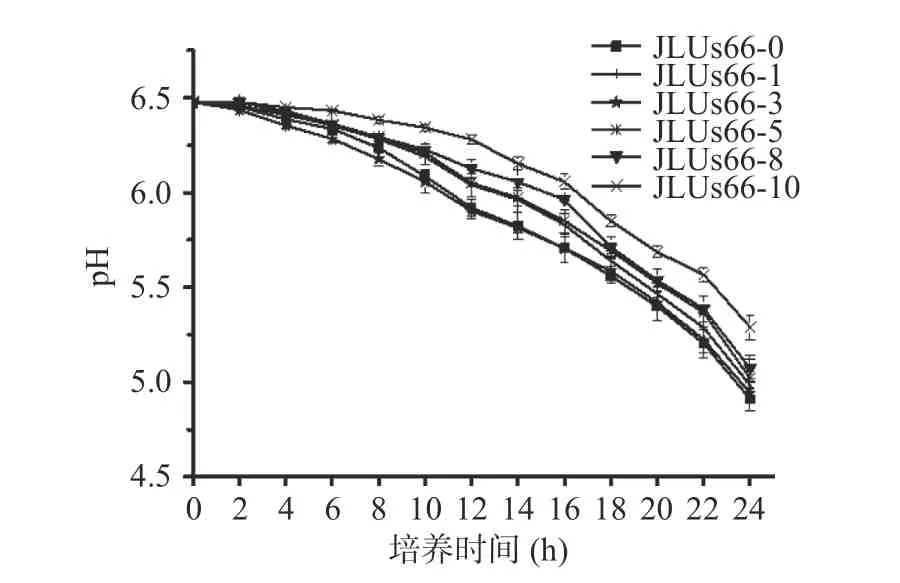
图3 人参提取物胁迫培养的副干酪乳杆菌JLUs66 的发酵液pH 变化曲线Fig.3 pH change curves of fermentation broth ofLactobacillusparacaseiJLUs66 cultured under stress by ginseng extract
2.1.4 人参提取物对菌株产胞外多糖能力的影响经不同浓度的人参提取物胁迫培养的副干酪乳杆菌JLUs66 在培养24 h 后胞外多糖的含量如图4 所示。副干酪乳杆菌JLUs66 在经较低浓度的人参提取物胁迫培养后,其胞外多糖的合成量也显著增加(P<0.05),这可能是因为在菌株处理过程中,人参提取物中含有的某些营养物质能够提高乳酸菌菌株合成多糖类物质的能力[21]。但是菌株的利用能力有限,故而当人参提取物胁迫培养的浓度高于一定值时,菌株的胞外多糖合成量不再发生显著的变化(P>0.05)。其中,当人参提取物胁迫培养的浓度为5‰时,JLUs66-5 的胞外多糖的合成能力达到拐点,其胞外多糖的含量为0.80±0.04 mg/mL。
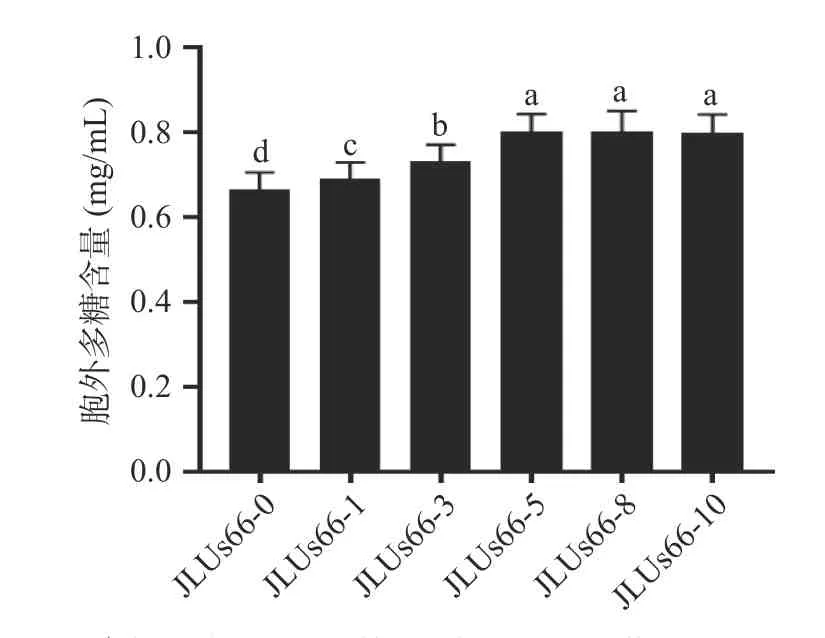
图4 人参提取物胁迫培养的副干酪乳杆菌JLUs66 的胞外多糖含量Fig.4 Extracellular polysaccharide content ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract注:不同小写字母表示差异显著(P<0.05),图6~图8 同。
2.2 人参提取物对菌株耐受性的影响
2.2.1 人参提取物对菌株耐低温能力的影响 本试验测试了在培养基中添加不同浓度的人参提取物胁迫培养的副干酪乳杆菌JLUs66 在4 ℃冷藏、−18 ℃缓冻、−80 ℃超低温的环境下的耐低温能力。
如图5a 所示,在4 ℃的储存条件下,副干酪乳杆菌JLUs66 的存活率呈现先上升后下降的趋势,并在储存2 d 时出现最大值。当储存时间较短时,添加人参提取物胁迫培养在不同程度上可以抑制菌株的耐低温能力。随着储存时间延长,JLUs66-1 和JLUs66-3 的存活率略高于JLUs66-0,但在储存30 d时,菌株的存活率均降低至11%左右。
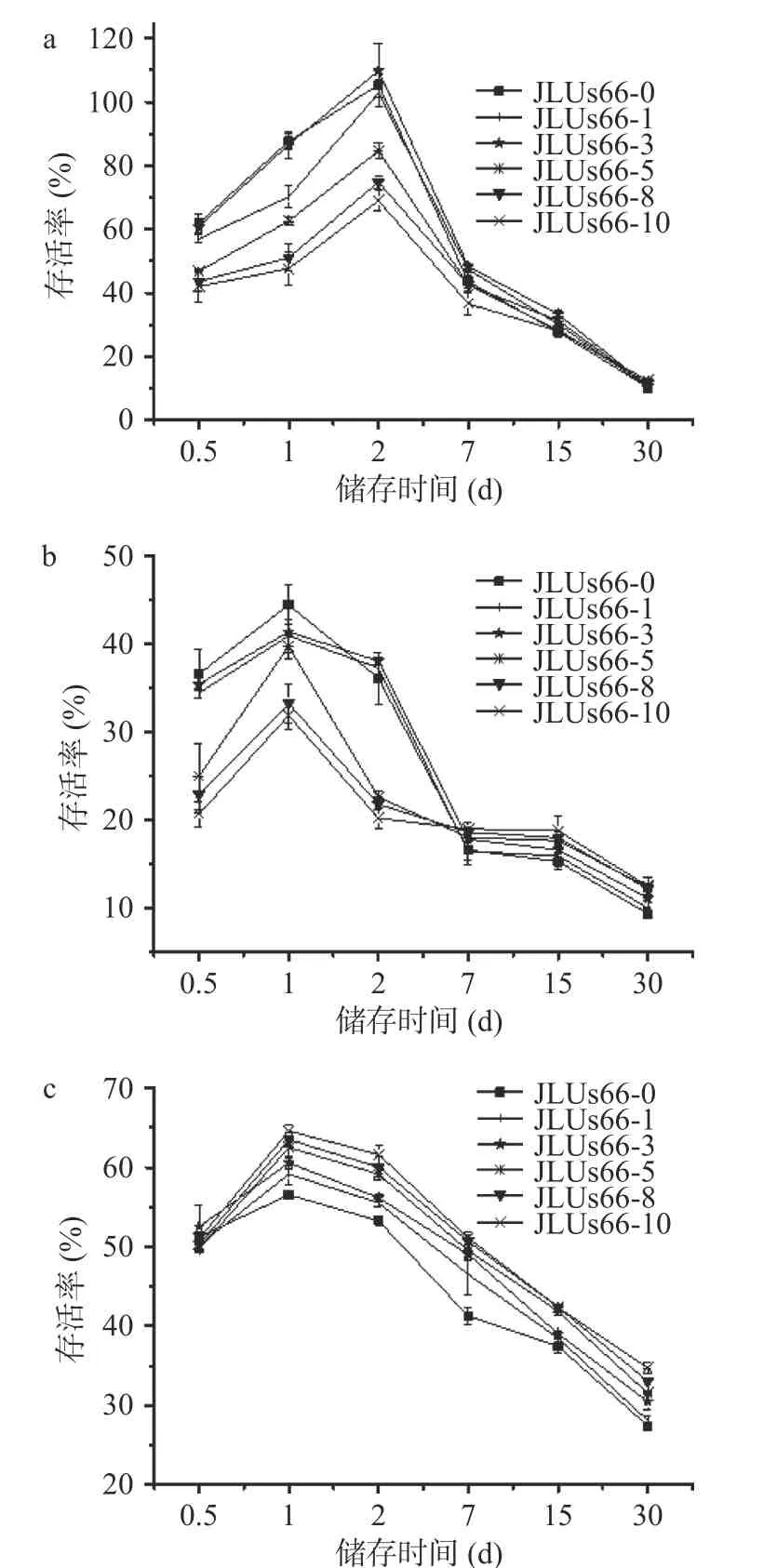
图5 人参提取物胁迫培养的副干酪乳杆菌JLUs66 在不同低温条件下存活率的变化Fig.5 Changes in the survival rate ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract at low temperatures注:a 为4 ℃冷藏;b 为−18 ℃缓冻;c 为−80 ℃超低温环境下储存。
如图5b,未经胁迫培养的JLUs66-0 在储存时间较短时,存活率高于其他菌株,经胁迫培养的菌株则随着胁迫培养浓度的不同呈现不同程度的差异。但从2 d 开始,随着储存时间的延长,JLUs66-0 的存活率逐渐低于经胁迫培养的菌株。当储存时间在7 d及更久时,菌株存活率呈现出和胁迫培养的浓度成正相关的趋势。添加人参提取物胁迫培养的副干酪乳杆菌JLUs66 的耐低温能力在不同程度上有所提高。
菌株储存于-80 ℃条件下时,由于速冻,细胞膜损失较小,故在同样储存时间下的存活率高于−18 ℃。如图5c,当储存时间为24 h 时,副干酪乳杆菌JLUs66 的存活率均在50%以上,随着储存时间的延长,存活率整体呈现出先上升后下降的趋势。其中,高浓度人参提取物的胁迫培养使其低温存活率升高,JLUs66-10 在30 d 时的存活率比未经胁迫的JLUs66-0高26%。
低温条件下,菌体细胞可能同时面临着低温所形成的冰晶及细胞内部高渗透压改变所带来的危害[22]。菌体的低温条件下的存活率的变化可能与人参提取物胁迫培养下菌体的胞外多糖合成量有一定的关系,在代谢过程中胞外多糖合成量增多,分泌到细胞壁外的胞外多糖对菌体形成包裹,防止低温条件下细胞膜的破裂造成的存活率降低。
2.2.2 人参提取物对菌株耐高温能力的影响 在培养基中添加不同浓度的人参提取物胁迫培养的乳酸菌耐热性存活率如表2。55 ℃水浴加热10 min 后,副干酪乳杆菌JLUs66 的存活率均下降至40%以下,随着人参提取物浓度的增加,菌株的存活率呈现下降的趋势,且整体都处于未经胁迫培养的JLUs66-0 以下。培养受到高浓度人参提取物的胁迫后,JLUs66-10 的高温存活率仅为未经胁迫的JLUs66-0 的存活率的43.93%。
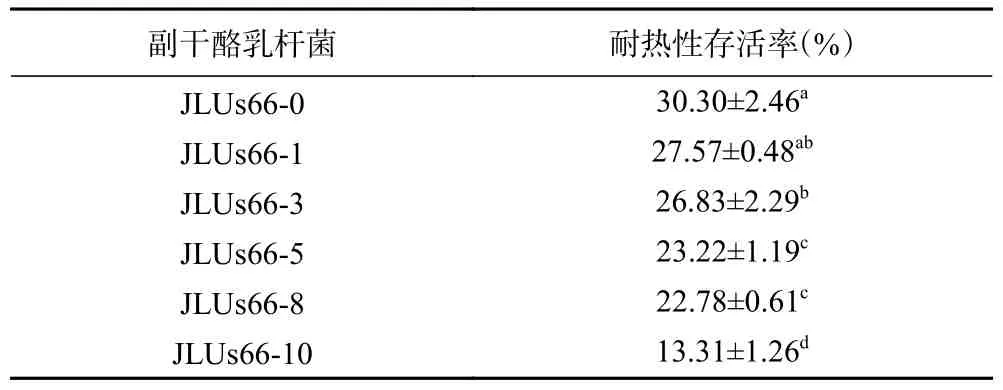
表2 人参提取物胁迫培养的副干酪乳杆菌JLUs66 的耐高温能力的变化Table 2 Changes in the heat tolerance ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract
乳酸菌的耐热性主要由其细胞热休克蛋白的水平、蛋白质的稳定性及生物膜的流动性决定[23]。培养基中添加不同浓度的人参提取物胁迫培养的乳酸菌耐热性存活率发生变化可能是由于胁迫培养时,菌株产生了DnaK、DnaJ 等热应激蛋白和蛋白酶[24]。也有研究将植物乳杆菌分为高产胞外多糖组和中产胞外多糖组进行耐热性试验,结果表明菌株的胞外多糖产生量越高,其耐热能力越低[15],这与本研究的胞外多糖含量的结果有一定的相似性,故胁迫培养后的乳酸菌的耐热性的改变也有可能与胞外多糖的含量有关。
2.2.3 人参提取物对菌株耐低pH 能力的影响 乳酸菌在抵达人体消化道发挥益生功能之前,需要通过胃部的低pH 环境,对低pH 条件的耐受性是衡量益生菌的重要指标[25]。
将处理后的菌株在pH2.5 的环境下37 ℃培养1 h,菌株的存活率如图6 所示。在培养基中添加人参提取物胁迫培养对JLUs66 的耐低pH 能力有一定的影响,整体呈现出低浓度人参提取物胁迫培养提高其低pH 耐受性,高浓度人参提取物胁迫培养降低其低pH 耐受性。其中,未经胁迫培养的JLUs66-0 的存活率为6.47%±0.30%,而经3‰浓度人参提取物胁迫培养的JLUs66-3 的存活率为25.67%±0.82%,高于高浓度人参提取物胁迫培养的JLUs66-10,约21.32 倍。
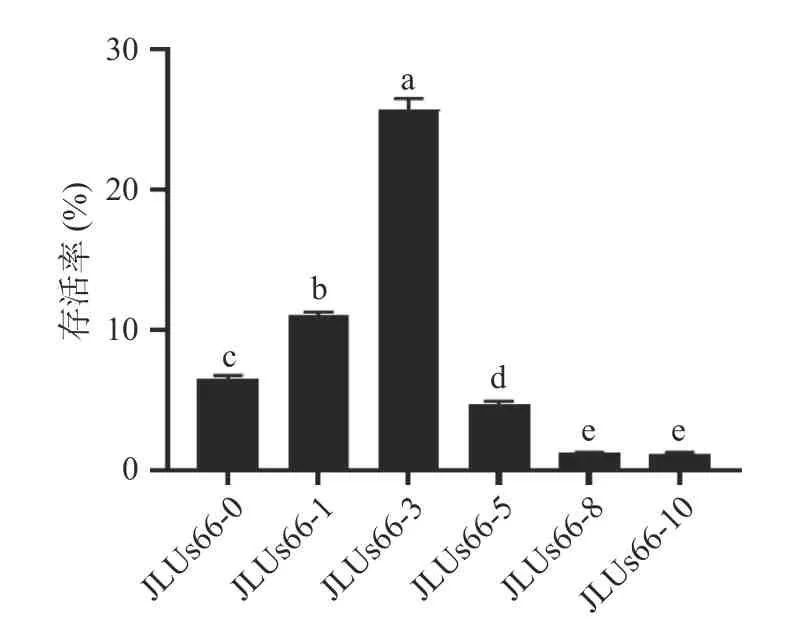
图6 人参提取物胁迫培养的副干酪乳杆菌JLUs66 在低pH 条件下存活率的变化Fig.6 Variation in the survival rate ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract at low pH conditions
Nguyen 等[26]认为,乳酸菌可以产生特定的胞外多糖来抵抗外界的酸胁迫。本研究中的较低浓度人参提取物胁迫培养的副干酪乳杆菌JLUs66 存活率随着人参提取物胁迫培养的浓度的上升有着不同程度的上升,推测可能是因为胁迫培养后的菌株胞外多糖含量上升,其生成的特定种类的胞外多糖,在细胞表面产生了负电荷,防止了低pH 环境下质子扩散到细胞中对菌体造成危害。但当人参提取物胁迫培养浓度超过一定值时,耐酸性结果与已有研究并未表现出完全的一致性,这需要进一步的试验探究。
2.2.4 人参提取物对菌株耐胆盐能力的影响 肠道是乳酸菌在机体内定殖的最终部位,而肠道内的胆盐残留量约为0.05%~2.0%[27],胆盐条件下的高存活率是乳酸菌发挥益生功能的重要前提[28]。如图7 所示,在0.3%和0.5%的胆盐环境下,不同浓度的人参提取物胁迫培养的JLUs66 的存活率呈现出随人参提取物浓度的增高而升高,最终趋于稳定的趋势。其中,JLUs66-10 在0.3%胆盐环境下表现出最优的存活率,为62.68%±0.67%,而在0.5%胆盐环境下,JLUs66-8 存活率最高,为18.43%。菌株的胆盐耐受性规律与其产胞外多糖能力变化趋势相似,推测其胆盐耐受能力受胞外多糖含量的影响。
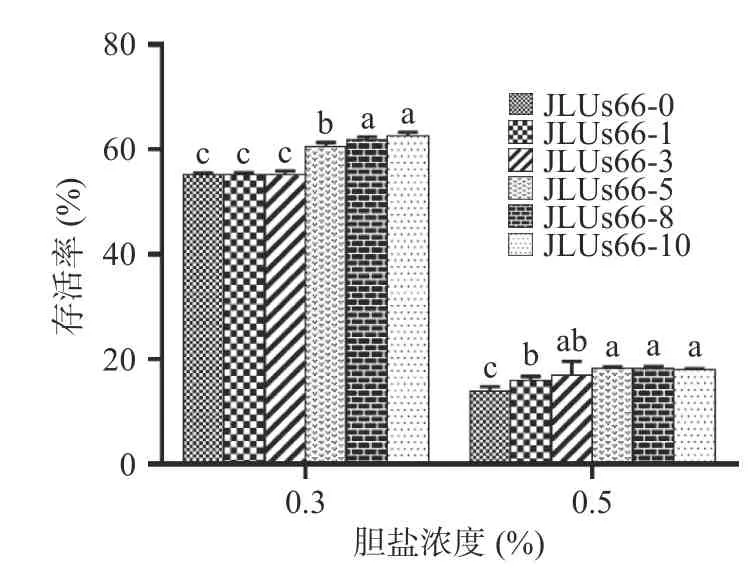
图7 人参提取物胁迫的副干酪乳杆菌JLUs66 的胆盐耐受性变化Fig.7 Changes of bile salt tolerance ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract
2.2.5 人参提取物对菌株耐NaCl 能力的影响 乳酸菌时常应用于高盐环境中,如发酵泡菜等,因此其具有一定的耐NaCl 能力也至关重要[29]。
由图8 可知,在20~80 g/L NaCl 培养基中,副干酪乳杆菌JLUs66 均可以生长。在含有20 g/L NaCl的培养基中,菌株的OD600值均能达到1.4 以上,但经人参提取物胁迫培养的菌株的OD600值显著低于未经胁迫培养的JLUs66-0 的OD600值(P<0.05)。培养基中NaCl 浓度升高至40 g/L 时,菌株的OD600值降低,且部分经人参提取物胁迫培养的菌株耐NaCl 能力有所提高,其中,JLUs66-3 的OD600值最高,为1.06,显著高于该浓度下未经胁迫的JLUs66-0的OD600值(P<0.05)。培养基中NaCl 浓度升高至60 g/L 时,菌株的OD600值降低,且部分经人参提取物胁迫培养的菌株耐NaCl 能力均有所提高,其OD600值显著高于该浓度下未经胁迫的JLUs66-0(P<0.05),且整体呈现出人参提取物胁迫培养的浓度越高,菌株的耐NaCl 能力越强的趋势。当培养基中NaCl 浓度升高至80 g/L 时,副干酪乳杆菌的OD600值均在0.13 左右,无显著差异(P>0.05)。
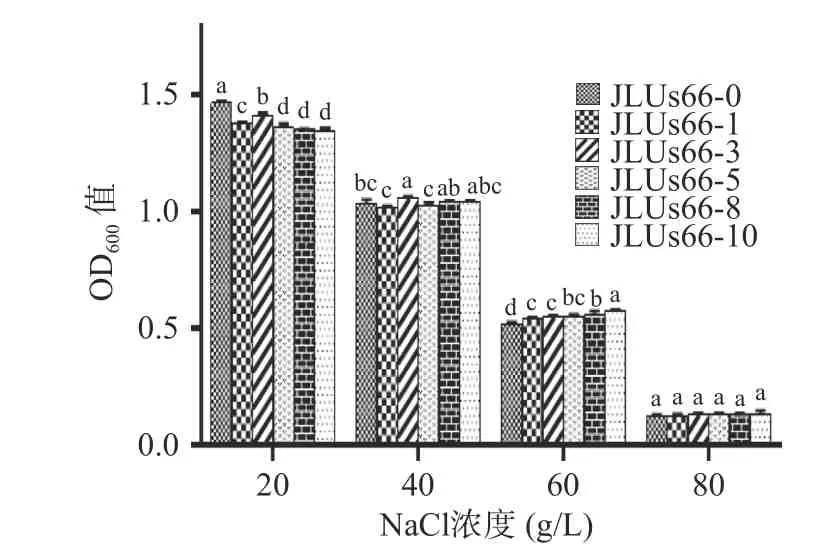
图8 人参提取物胁迫培养的副干酪乳杆菌JLUs66 在不同质量浓度NaCl 中的生长Fig.8 Growth ofLactobacillus paracaseiJLUs66 cultured under stress by ginseng extract in different mass concentrations of NaCl
乳酸菌的耐NaCl 能力主要受其高渗环境的影响,目前的研究表明,乳酸菌调节胞内渗透压机制主要与相容性溶质调控系统、热休克蛋白调控系统相关[30−31]。本研究中人参提取物胁迫培养的菌株的耐NaCl 能力整体处于增强的趋势,这可能与在胁迫过程中,LuxS/AI-2等基因的转录水平随着人参提取物的浓度的提高而上升,从而其耐NaCl 能力得以提高[32]。
3 结论
研究可知,人参提取物胁迫处理对副干酪乳杆菌JLUs66 的生长速率、活菌数、产酸速率及耐热性的影响是负向的,人参提取物的浓度越低,乳酸菌的生长特性及耐受性越好;人参提取物的胁迫培养对菌株的胞外多糖产量、低温耐受性及胆盐耐受性的影响是正向的,但是,当人参提取物浓度超过5‰时,这些变化并不明显;菌株的耐低pH 能力随人参提取物浓度的升高呈现先上升后下降的变化,尤其在3‰浓度时,耐低pH 能力最高;菌株的耐盐能力与耐低pH 能力的趋势有相似性,而当NaCl 浓度足够高时,菌株的耐盐能力差别不大。综合比较,人参提取物胁迫培养浓度为3‰时,副干酪乳杆菌JLUs66 的菌株特性及其耐受性最优。本研究为人参提取物对乳酸菌菌株生长特性的改变及菌株耐受性的提高提供科学依据,在实际生产过程中,可根据工业应用的需要,在培养基中添加不同浓度的人参提取物胁迫处理乳酸菌,有选择性地改变其菌株生长特性及耐受性,从而提高乳酸菌的环境适应性。
