内外源酶制备海参肽的组成及抗氧化性质研究
2022-05-29张慧艳常雨晴邓献辉宋志远赵前程祁艳霞
刘 畅,张慧艳,常雨晴,邓献辉,宋志远,2,赵前程,2,3,祁艳霞,2,3,
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.辽宁省水产品分析检验与加工技术科技服务中心,辽宁大连 116023;3.海洋食品精深加工关键技术协同创新中心,大连工业大学,辽宁大连 116034)
海参(Sea cucumber,holothurians),属棘皮动物门海参纲,是具有悠久历史的海洋无脊椎动物。海参在我国南北方均有分布,其中,北方海参品种主要为仿刺参(Apostichopus japonicus),被誉为“参中之冠”[1]。海参中有很多对人体有益的活性成分。海参皂苷被认为具有抗肿瘤[2]的作用,除此之外还有降血压[3]和改善高尿酸血症[4]等作用。海参多糖中的硫酸软骨素对于关节炎和软组织恢复[5]具有良好效果,另外也有抗血栓[6]和抗血小板聚集[7]等作用。海参肽是由海参制备的,由2~12 个氨基酸或者更多氨基酸组成的小肽或多肽[8]。海参肽的制备有水解法和酶解法,因为水解法中会用到酸或碱,危险性较大,而且会对实验设备造成一定的腐蚀,所以现在大部分海参肽制备都采用蛋白酶酶解法[9],常用的蛋白酶有胰蛋白酶、木瓜蛋白酶、中性蛋白酶等。除了利用外源酶,海参内源酶也能对其自身进行酶解,常被称作海参的自溶,也被叫做海参的“吐肠”现象。海参可以在几分钟内进行自溶,体壁逐渐粘稠直至将自身溶为液态[10],这也就造成了海参不易保存和运输的特点。
但海参自溶并非只有缺点,王静等[11]利用均匀设计法对海参自溶制备海参肽工艺进行优化,水解度可达38.8%;郑杰等[12]以可溶性寡肽溶出率和还原糖溶出率为评价指标,发现自溶方法中可溶性寡肽和还原糖溶出率均显著提高。这说明海参的自溶现象极有被研究和利用的价值。海参肽还具有一定的生物活性,例如抗氧化、抗疲劳、抗衰老等,史亚萍等[13]报道酶解的海参肽具有羟基自由基清除能力、DPPH 自由基清除能力、ABTS 自由基清除力以及超氧阴离子清除力等多种良好的抗氧化能力。海参的生物活性也与肽的分子量有着密切的关系[14],付学军等[15]利用超滤的方法将不同分子量的海参肽分别进行了抗氧化测定,结果显示分子量(Mr)≤5 kDa 的海参多肽溶液具有更高的超氧阴离子清除能力,而Mr>10 kDa 的海参多肽羟基自由基清除能力较强。
为了制备高活性海参肽,本文采用人工引发海参体壁自溶获得海参自溶肽,并与利用外源酶(胰蛋白酶、碱性蛋白酶、中性蛋白酶)对海参体壁进行酶解得到的海参肽进行对比,比较两个过程中所产生的海参肽在分子量、氨基酸组成和体外抗氧化活性方面的差异,从而筛选海参肽的最优制备方法,以期为海参肽的制备工艺提供理论支撑。
1 材料与方法
1.1 材料与仪器
海参,属檐手目 大连开发区圈养;胰蛋白酶(2×106U/g)、碱性蛋白酶(2×106U/g)、中性蛋白酶(2×106U/g) 天津诺奥酶生产力促进有限公司;三氯乙酸(TCA) >97%,天津市科密欧化学试剂有限公司;间苯三酚 >98%,上海麦克林生化科技有限公司;香草醛 98%,天津市大茂化学试剂厂;人参皂苷>99.5%、硫酸软骨素>99.5%、肽分子量>99.5% 均为标准品,北京宝希迪商贸有限公司;氨基酸标准品及氨基酸试剂盒 大连依利特股份有限公司;McⅡvaines 缓冲液:pH6.8 的磷酸二氢钠-柠檬酸。
1260 高效液相色谱仪 美国安捷伦公司;BS224S 型精密电子天平 德国赛多利斯仪器系统有限公司;JYL-C16V 匀浆机 九阳股份有限公司;STARTER2100 实验室pH 计 奥豪斯仪器(上海)有限公司; HH-ZK4 数显恒温水浴锅 巩义市予华仪器有限责任公司;ELx800 酶标仪 美国伯腾仪器有限公司;SB-120D 超声波清洗机、scientz 真空冷冻干燥机 宁波新芝生物科技有限公司;CR21N 高速冷冻离心机 日立工机株式会社。
1.2 实验方法
1.2.1 海参多肽的制备 低温保存的海参解冻去头,去内脏后将体壁清洗干净。匀浆后均分为六份,自溶处理三份,酶解处理三份。自溶处理:采用紫外照射30 min 后,加入三倍体积的McⅡvaines 缓冲液在pH6.8,添加NaCl 至浓度为2%,温度45 ℃静置条件下进行自溶,自溶时间分别为2、4、8 h。加入2 倍体积10% TCA 溶液终止自溶,静置30 min,8000 r/min 离心15 min,取上清液冻干。酶解处理:热水漂烫沥干海参体壁水分后加入三倍体积水匀浆,匀浆液于100 ℃加热10 min,冷却至室温后分别加入海参体壁质量0.2%的碱性蛋白酶、胰蛋白酶和中性蛋白酶,在各自最适条件(碱性蛋白酶:温度45 ℃,pH10.0;胰蛋白酶:温度37 ℃,pH8.0;中性蛋白酶:温度45 ℃,pH7.0)下搅拌酶解,酶解4 h,沸水煮10 min 灭酶,加入2 倍体积10% TCA 静置30 min,8000 r/min 离心15 min,取上清液冻干。
1.2.2 水解度(DH)的测定 水解度采用TCA 沉淀法[16]。N0采用凯氏定氮法测得;N1为海参体壁经过匀浆后加入10% TCA 静置反应30 min 后的上清;N2为酶解或自溶反应后加入10% TCA 静置反应30 min 后的上清。N1和N2均采用吸光光度法。利用双缩脲法测定样品在540 nm 处吸光度值,以牛血清蛋白为标准溶液制作标准曲线,测得肽的质量。设定三组平行来保证实验的准确性。
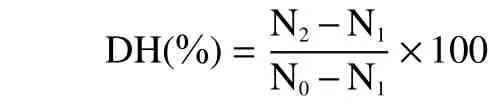
式中:DH 表示水解度,%;N0-海参体壁总蛋白质量,mg;N1-海参体壁中10% TCA 可溶性多肽质量,mg;N2-反应后自溶物或酶解液中10% TCA 可溶性多肽质量,mg。
1.2.3 粗肽中活性成分含量测定
1.2.3.1 肽含量测定 取浓度为10 mg/mL 的各个海参肽粗品,利用Thermo Scientific NanoDrop 2000/2000c 软件,通过检测肽键在紫外205 nm 处的波长来确定样品中实际的肽(寡肽和多肽)浓度,与粗肽浓度10 mg/mL 相比较,进而确定海参肽粗品中肽的含量。
1.2.3.2 皂苷含量测定 利用人参皂苷标准品配制成0.2 mg/mL 标准品溶液,分别吸取0、0.2、0.4、0.6、0.8、1.0 mL,依次加到6 支试管中后水浴蒸干试剂,再依次加入5%香草醛-冰醋酸溶液0.2 mL,高氯酸0.8 mL,60 ℃水浴加热15 min 后再立即用冰水冷却5 min,加入5 mL 冰醋酸摇匀,静置10 min,于560 nm 处测定吸光度[17]。准确吸取200 μL 样品,加入200 μL 正丁醇进行萃取,反复三次氮气吹干后进行同样方法测定。
1.2.3.3 硫酸软骨素含量测定 分别吸取1 mg/mL硫酸软骨素标准品溶液80、160、240、320、400 μL于10 mL 离心管中,用蒸馏水稀释至400 μL,加入间苯三酚溶液1.2 mL,盖塞混匀。将其置于沸水中水浴30 min,取出后立即冰水水浴冷却5 min,用冰醋酸稀释至4 mL,混匀,于558 nm 处测定吸光度[18]。样品中硫酸软骨素含量采用同样的方法测定。
1.2.4 高效液相色谱测定海参肽分子量 色谱柱:Asahipak GS320-HQ;尺寸:7.5 mm×300 mm;柱温:25 ℃;流动相:0.07 mol/L 磷酸钠缓冲溶液(pH7)+0.15 mol/L NaCl 溶液;流速为0.5 mL/min,进样体积为20 μL,检测波长220 nm。
1.2.5 高效液相色谱测定氨基酸组成 按照国家标准进行氨基酸成分测定[19],具体洗脱条件见表1。前处理参考黄小兰等[20]的方法进行。
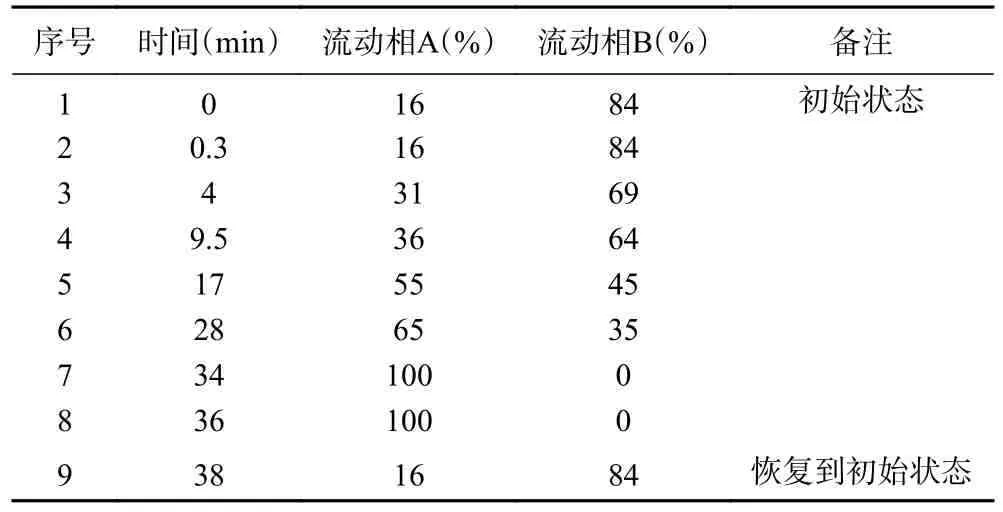
表1 色谱梯度洗脱条件Table 1 Gradient elution condition
1.2.6 抗氧化活性的测定
1.2.6.1 羟基自由基的清除力测定 对羟自由基清除能力的测定主要参考夏吉安[21]的水杨酸法。具体操作略有修改:选取VC溶液作为对照品,浓度梯度为2、4、6、8、10 mg/mL 的多肽样品和对照品各0.5 mL,分别依次加入0.5 mL 9 mmol/L FeSO4溶液,0.5 mL 9 mmol/L 水杨酸-乙醇溶液和0.5 mL 8.8 mmol/L H2O2溶液,37 ℃水浴反应30 min,然后摇匀,510 nm 处分别测定它们的吸光度值,每个样品做三个平行。
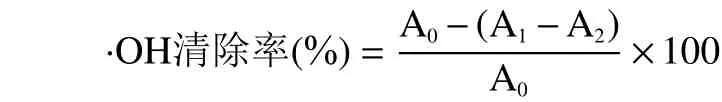
式中:A1:加入样品和H2O2溶液的吸光度;A2:加入样品,将H2O2换成等量蒸馏水溶液的吸光度;A0:未加入样品溶液的吸光度。
1.2.6.2 DPPH 自由基清除能力的测定 利用1.2.6.1配制好的VC对照组溶液,酶解液和自溶物的浓度梯度溶液来进行DPPH 自由基清除能力的测定,在JOSÉ等[22]方法基础上进行改进,不同梯度样品加入1 mL 0.1 mmol/L DPPH,摇匀后静置30 min,于517 nm处测定吸光值,每个浓度的样品做三个平行,按如下公式计算。
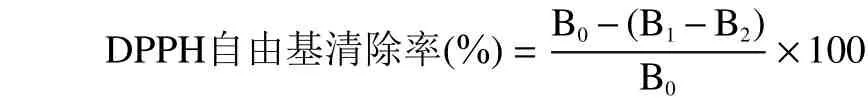
式中:B1:加入样品和DPPH 溶液的吸光度;B2:加入样品,将DPPH 换成等量无水乙醇溶液的吸光度;B0:未加入样品溶液的吸光度。
1.2.6.3 Fe3+还原力的测定 Fe3+还原力的测定在KRISHNAMOORTHY 等[23]的方法上进行改进:取不同浓度的酶解液、自溶物和VC对照溶液0.2 mL,各加入0.5 mL PBS 缓冲液(0.2 mol/L,pH6.6)和0.2 mL 1%铁氰化钾溶液,进行50 ℃、20 min 的水浴,再加入1 mL 10 %三氯乙酸(TCA)溶液后离心(3000 r/min,10 min)。C1是取离心后上清液0.5 mL,加入0.5 mL 蒸馏水和0.1 mL 0.1%的三氯化铁溶液,后摇匀后静置10 min,用酶标仪于700 nm 波长下测定吸光度值,C2采用同样的方法获得,但其中不加入0.1 mL 0.1%的三氯化铁溶液,每个浓度样品做三组平行,利用公式求得Fe3+的还原能力。

1.3 数据处理
所有试验均重复3 次,试验结果用平均值±标准偏差表示,使用Origin 9.1 和SPSS Statistics 22 对试验数据进行分析和处理。
2 结果与分析
2.1 水解度差异比较
对不同方法制备海参肽的蛋白水解度进行了比较,结果如表2 所示。通过不同来源的酶制备海参肽,海参蛋白的水解度由高到低的方法依次为:自溶8 h>自溶4 h>自溶2 h,胰蛋白酶酶解>中性蛋白酶酶解>碱性蛋白酶酶解。从自溶2 h 到8 h,水解度呈逐渐上升的趋势,自溶8 h 样品的水解度最大,可以达到51.0%。这是因为经过紫外照射,海参体壁中部分内源酶家族通路被激活,从而导致一系列内源酶对胶原蛋白的降解,所以随着时间的增加,水解度逐渐增高。胰蛋白酶对于海参的水解效果较其它两种外源酶效果更好,可达到18.8%,但整体外源酶对海参酶解的水解度较内源酶低。采用内源酶得到肽的水解度高与海参体内含有的多种蛋白酶有关,海参体内不仅含有能够酶解胶原Ⅰ型蛋白的基质金属蛋白酶,还含有既能酶解胶原Ⅰ、Ⅱ型蛋白,又能酶解非胶原蛋白的组织蛋白酶K 等[10]。
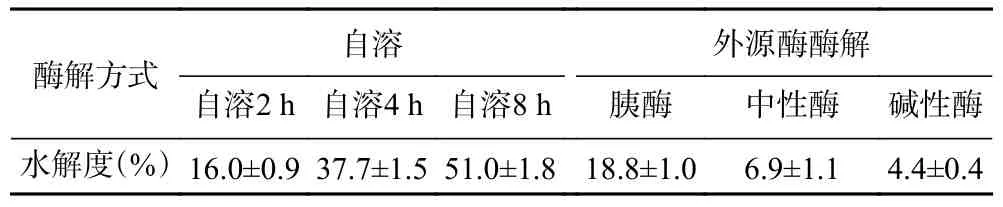
表2 内外源酶制备海参多肽的蛋白水解度Table 2 Proteolysis of sea cucumber peptides prepared by internal and external enzymes
2.2 粗肽组成分析
不同制备方法对海参肽组成的影响,结果如表3 所示。自溶和外源酶酶解方法中,整体来看,自溶所制备的粗肽中肽含量要高于外源酶酶解法,自溶8 h 得到的海参肽粗品中肽的含量最高,达到898.3 mg/g;碱性酶酶解制备的海参肽粗品中肽的含量最低,为142.0 mg/g。自溶所制备的粗肽中肽含量高的原因与自溶方法的水解度高于酶解方法有关,在利用10%TCA 来沉淀没有被酶解的蛋白质过程中,外源酶酶解海参所产生的部分大分子肽以及没有被酶解的蛋白质一起下沉变为沉淀,在离心过程中被除去,导致外源酶酶解的方法中肽的含量没有自溶方法高。除了肽以外,海参肽粗品中还含有硫酸软骨素和皂苷等活性物质。与自溶方法相比,外源酶酶解方法会产生更高含量的硫酸软骨素和皂苷。其中胰酶酶解制备的海参粗肽中硫酸软骨素和皂苷含量最高,分别为160.9 mg/g 和43.9 mg/g,其中皂苷含量与高子阳[24]测定的格皮氏海参中总皂苷含量结果相近。自溶方法所产生的硫酸软骨素和皂苷含量整体偏低,可能是因为内、外源酶酶切位点不同,导致硫酸软骨素和皂苷从组织上脱落下来的较少[25−26]。由于制备过程加入了一定量的缓冲液,所以粗肽中除了以上活性成分以外,可能还含有一定量的盐类物质。

表3 不同方法制备的海参粗肽的组成Table 3 Contents of active ingredients in sea cucumber peptides prepared by different methods
2.3 高效液相色谱测定分子量结果
利用高效液相色谱对6 种方法制备的海参肽的分子量进行分析,结果如图1 所示。
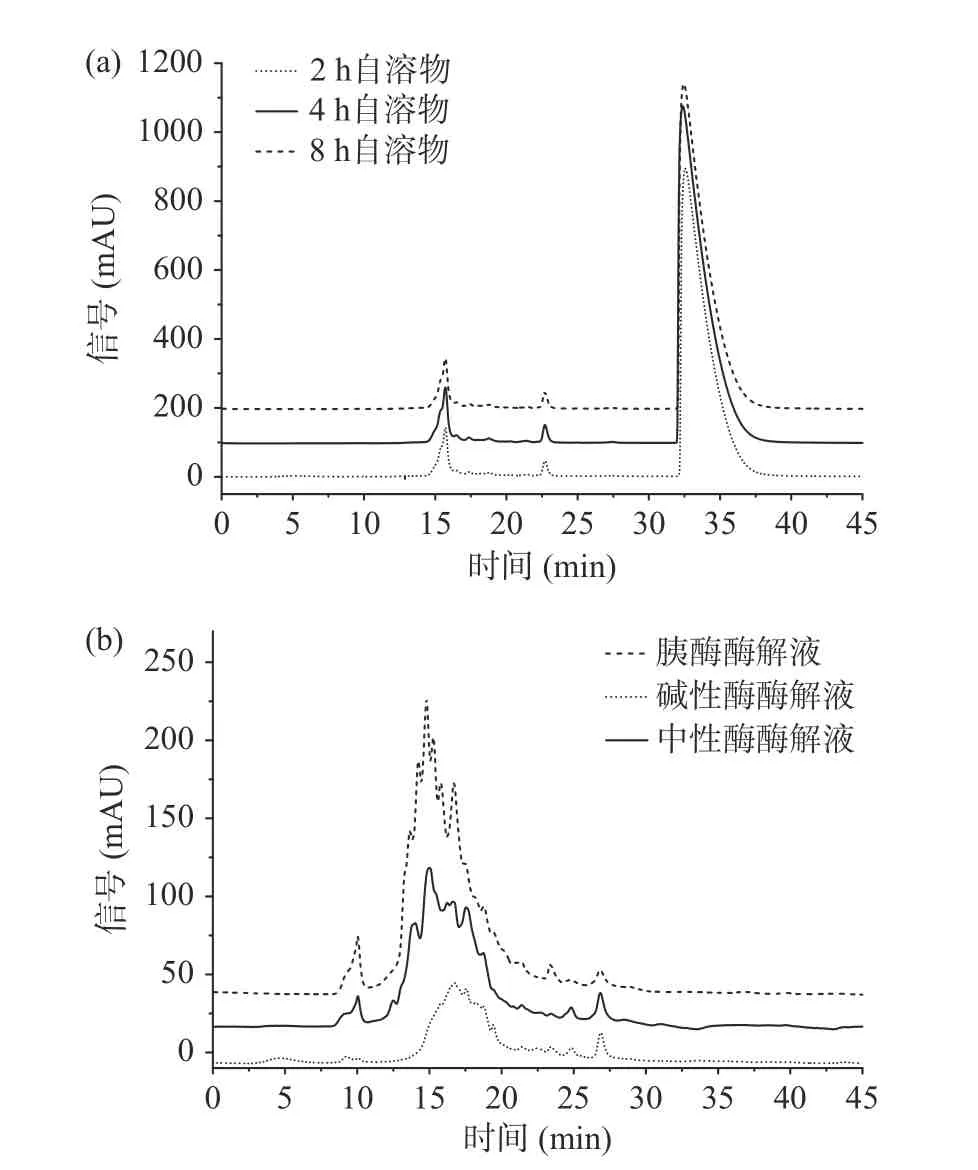
图1 内外源酶制备海参肽分子量色谱图Fig.1 Molecular weight chromatogram of sea cucumber peptide prepared by internal and external enzymes
自溶方法制备的海参肽出峰时间在15~35 min之间,分子量较小,94 %左右的肽在35 min 左右出峰,对应分子量<314 Da。自溶制备的海参肽分子量虽然较小,但通过测定发现,其中并无游离氨基酸,所以可以推测大部分为二肽、三肽。酶解法制备的海参肽出峰时间主要在10~20 min 之间,对应的肽段分子量主要集中在1~8.15 kDa,具体分子量分布如表4所示。

表4 不同方法制备的海参肽分子量分布Table 4 Molecular distribution of sea cucumber peptides prepared by different methods
由10 个以上氨基酸组成的肽是多肽,而一些小肽仅有2~4 个氨基酸[27]。从分子量分布来看,自溶制备的海参肽大部分为小肽,这与郑丽等[28]所测得的自溶扇贝加工废弃物分子量很相近;外源酶酶解法制备的海参肽大部分为多肽,这与曹学彬等[29]利用酶解法获得的海参肽分子量结果相似。一般来说,小肽具有更高的生物活性,小肽可以被肠粘膜直接吸收,更利于人体消化[30]。自溶所产生的小肽可能会在药学,生理等方面具有更大的利用潜力。
2.4 高效液相色谱测定主要氨基酸结果
通过对六种样品的主要氨基酸组成(图2、图3)分析发现,主要氨基酸组成测定结果与分子量测定结果相符。不同方法制备的海参肽中氨基酸所占比例如表5 所示。
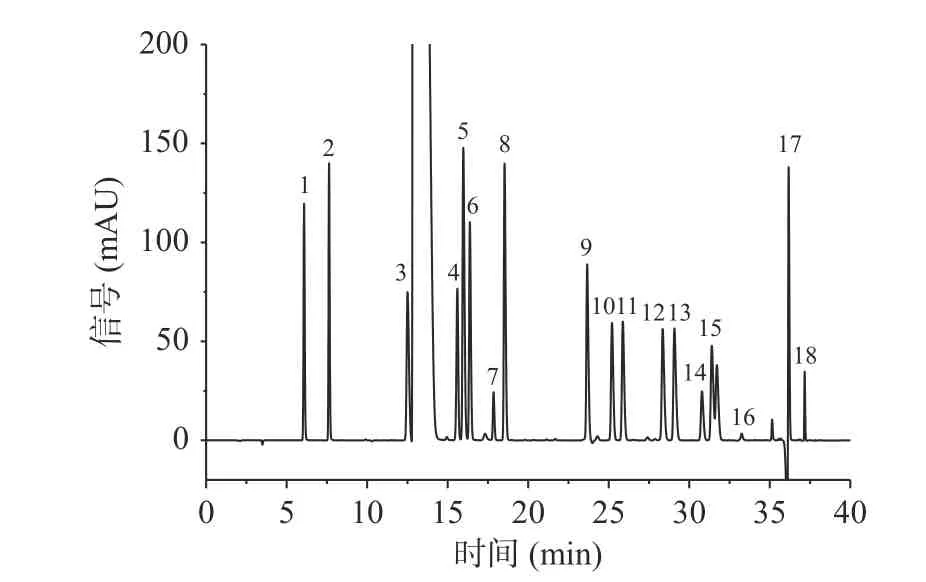
图2 混合氨基酸标准品分离谱图Fig.2 Separation spectrum of mixed amino acid standard products注:1. Asp 天冬氨酸,2. Glu 谷氨酸,3. Ser 丝氨酸,4. Arg 精氨酸,5. Gly 甘氨酸,6. Thr 苏氨酸,7. Pro 脯氨酸,8. Ala 丙氨酸,9. Val 缬氨酸,10. Met 蛋氨酸,11. Cys 半胱氨酸,12.Ile 异亮氨酸,13. Leu 亮氨酸,14. Trp 色氨酸,15. Phe 苯丙氨酸,16. His 组氨酸,17. Lys 赖氨酸,18. Tyr 酪氨酸。
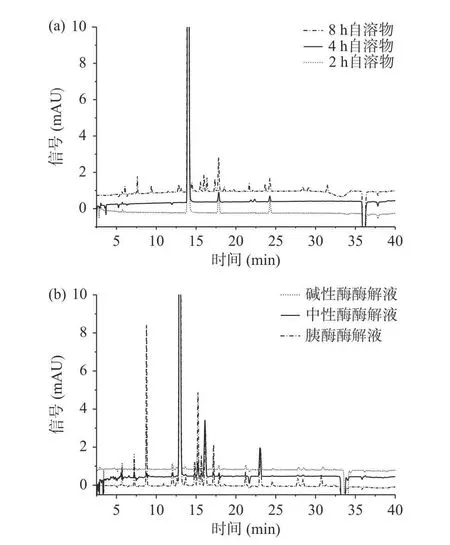
图3 不同方法制备海参肽氨基酸色谱图Fig.3 Chromatograms of amino acids of sea cucumber peptides prepared by different methods
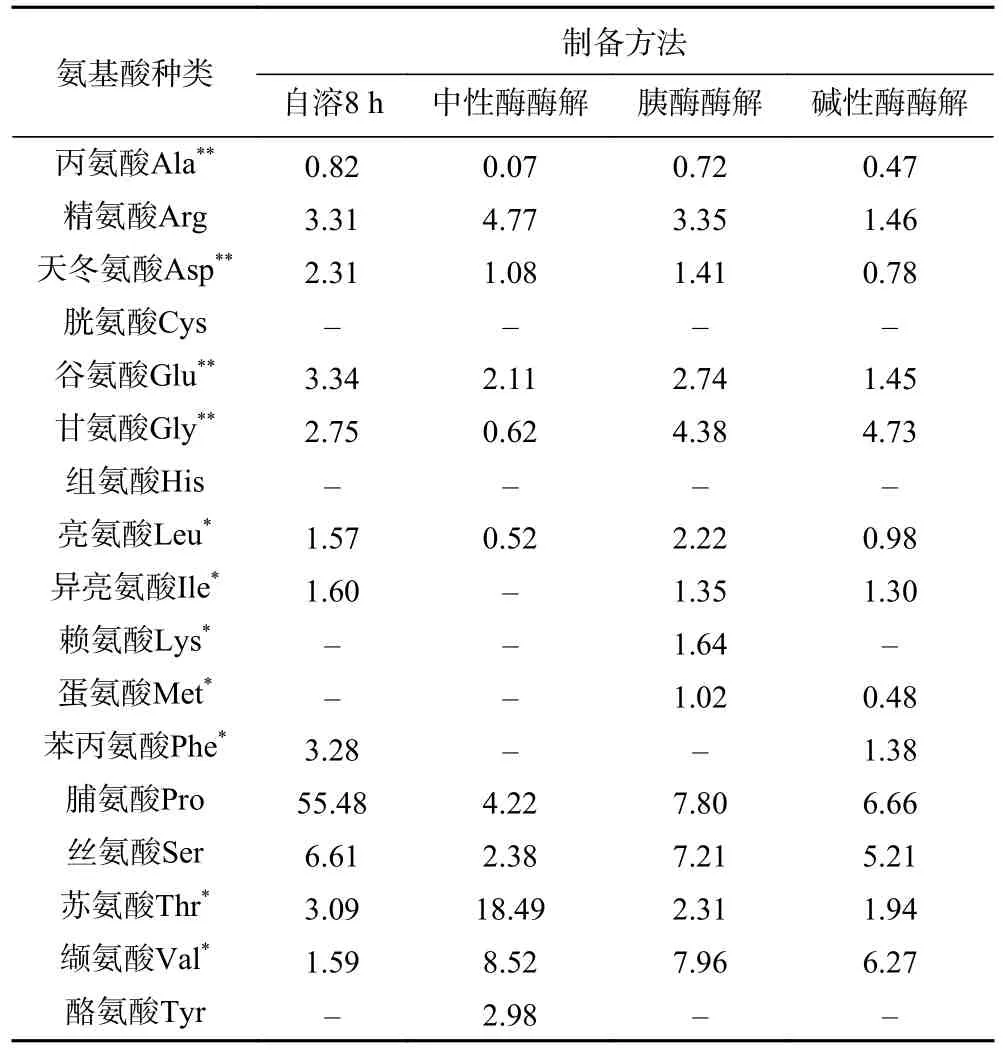
表5 不同方法制备海参肽中氨基酸组成分析(mg/100 mg)Table 5 Analysis of amino acid composition in sea cucumber peptide prepared by different methods (mg/100 mg)
除了自溶2 h 和4 h 方法制备的海参肽,其它方法制备的海参肽都具有较全面的氨基酸组成。对所有样品进行游离氨基酸测定后发现,所有海参肽中几乎不含有游离氨基酸。在自溶2 h 和4 h的海参水解产物中只检测到脯氨酸和缬氨酸,这可能是因为海参的结蹄组织中胶原纤维是由海参多糖和胶原蛋白组成的,自溶时间较短的情况下,海参中的多糖水解酶先对多糖进行水解,产生少量的肽段,在自溶8 h 时,胶原蛋白被内源酶水解,肽段中氨基酸不断脱落,氨基酸种类增多[10]。自溶8 h 制备的海参肽含有12 种氨基酸,其中脯氨酸、丝氨酸、谷氨酸、精氨酸和苯丙氨酸含量较高,脯氨酸含量高达55.48 mg/100 mg,占自溶法所得的氨基酸总量的65%,作为蛋白质中唯一的亚氨基酸,脯氨酸主要来自胶原蛋白的降解,说明自溶法主要降解的是海参体壁中的胶原蛋白[31]。外源酶酶解制备的海参肽含有11~13 种氨基酸,含量较高的氨基酸有脯氨酸、苏氨酸、缬氨酸、丝氨酸、甘氨酸。虽然外源酶方法制备的海参肽中也含有较高含量的脯氨酸,但含量低于8.00 mg/100 mg,远低于自溶法海参肽中脯氨酸含量。自溶8 h 和外源酶酶解制备的海参肽中均检测到四种呈味氨基酸:丙氨酸、天冬氨酸、谷氨酸和甘氨酸,其中天冬氨酸和谷氨酸是参与脑组织生化代谢的重要氨基酸[32]。海参肽的氨基酸组成和序列对其抗氧化活性有较大影响[33],但具体的抗氧化活性也和肽分子量大小、氨基酸特性和序列有关。
2.5 抗氧化能力测定
2.5.1 羟基自由基清除能力测定 羟基自由基具有极高的氧化点位,是人体内最为活跃的一种自由基,因此羟基自由基清除能力是判定抗氧化能力的重要指标。整体来看(图4),自溶法制备的海参肽羟基自由基清除能力要强于外源酶酶解法。在浓度10 mg/mL时,按照自溶2 h、自溶4 h 和自溶8 h、中性酶酶解、碱性酶酶解、胰酶酶解方法排序,羟基自由基清除率分别达到94.3%、93%、93.4%、73.0%、51.5%和63.5%。因为肽分子量对于羟基自由基清除能力影响很大,低分子量的肽通常比高分子量肽具有更高的羟基自由基清除能力[34]。自溶肽和外源酶酶解肽的羟基自由基清除率随着浓度的增加而逐渐增加,但在低浓度范围内自溶法对于羟基自由基的清除效果较酶解法更明显。这是由于产生的肽可以作为电子和自由基结合成更稳定的产物,阻止氧化反应继续发生[35]。
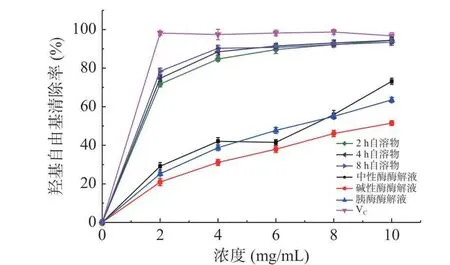
图4 不同方法制备海参肽羟基自由基清除能力Fig.4 The scavenging ability of hydroxyl radical of sea cucumber peptide prepared by different methods
2.5.2 DPPH 自由基清除能力测定 如图5 所示,随着浓度不断增加,三种自溶肽和外源酶酶解肽均呈现出良好的DPPH 自由基清除效果,DPPH自由基清除率在10 mg/mL 时最高,按照自溶2 h、自溶4 h 和自溶8 h、中性酶酶解、碱性酶酶解、胰酶酶解方法排序,DPPH 自由基清除率分别达到83.1%、82.1%、85.8%、63.4%、53.2%和68.3%。有研究报道,极性氨基酸的DPPH 自由基清除能力会比非极性氨基酸高出1.2 倍左右[36]。自溶与酶解所产生的极性氨基酸含量虽相近,但自溶物呈现出更高的DPPH 自由基清除效果,这与前面自溶方法的水解度更高以及分子量更低有关,氨基酸序列对自溶物活性也具有一定影响,具体机理有待近一步研究。

图5 不同方法制备海参肽DPPH 自由基清除能力Fig.5 DPPH free radical scavenging ability of sea cucumber peptide prepared by different methods
2.5.3 Fe3+还原力测定 铁氰化钾在抗氧化剂作用下被还原成亚铁氰化钾,Fe3+能和亚铁氰化钾反应生成普鲁士蓝色,所以Fe3+的还原力可以代表样品的抗氧化能力[37]。如图6 所示,自溶法和外源酶酶解法制备海参肽的Fe3+还原力都随着样品浓度的增加而增大,自溶肽的Fe3+还原力大于外源酶酶解肽。Fe3+还原力在10 mg/mL 时最高,按照自溶2 h、自溶4 h 和自溶8 h、中性酶酶解、碱性酶酶解、胰酶酶解方法排序,Fe3+还原力分别达到0.737、0.742、0.740、0.146、0.138 和0.176。Fe3+还原力活性高低与前面两种抗氧化能力测定结果基本一致。外源酶酶解肽中大分子多肽含量较高,直接影响了它的Fe3+还原力。因为肽的Fe3+还原力除了受氨基酸亲水性的影响,也与氨基酸的分子量密切相关[38]。有研究表明,分子量在1 kDa 左右时Fe3+还原能力相对较好,而酶解物中肽段分子量较大,从而导致整体的Fe3+还原能力降弱[35]。
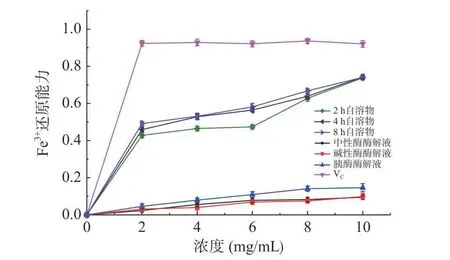
图6 不同方法制备海参肽铁还原能力测定Fig.6 The iron reducing ability of sea cucumber peptide prepared by different methods
3 结论
本文采用自溶、外源酶酶解制备海参肽,并对其性质及活性进行比较,发现自溶和外源酶酶解制备的海参肽在组成和生物活性上有较大差异。自溶方法得到的海参肽大部分为分子量小于314 Da 的二肽和三肽,在自溶8 h 时,氨基酸种类丰富,其羟自由基清除能力、DPPH 自由基清除能力和Fe3+还原力较高;外源酶酶解制备的海参肽分子量大部分大于1 kDa,其羟自由基清除能力、DPPH 自由基清除能力和Fe3+还原力较自溶肽低。通过对两类方法制备海参肽的分析比较可知,自溶法制备的小分子海参肽活性较高,在医药及功能性食品等方面可能具有更高的利用潜力,但具体的机理有待进一步研究。该研究为海参肽的制备及海参的综合利用提供了新的参考。
