微波-热风联合干燥茉莉花干燥特性及品质分析
2022-05-29盛金凤雷雅雯王雪峰唐雅园叶冬青
盛金凤,陈 坤 ,雷雅雯,王雪峰,唐雅园,叶冬青,陈 茜,孙 健
(1.广西农业科学院农产品加工研究所,广西南宁 530007;2.广西果蔬贮藏与加工新技术重点实验室,广西南宁 530007;3.广西农业科学院玉米研究所,广西南宁 530007;4.广西农业科学院,广西南宁 530007)
茉莉花(Jasminum sambac(L.) Ait.)属木樨科茉莉花属,在全世界茉莉花约有706 种,是著名的花茶原料和重要的香精原料,我国茉莉花栽培面积约占全球种植面积的2/3[1]。目前大面积栽培茉莉花的地区主要有广西、云南、福建等南方省区,四大主产区为广西横州、四川犍为、福建福州、云南元江。2019 年,中国茉莉花种植面积达到1.29 万公顷,总产量12.8 万吨;其中横县茉莉花种植面积7533 公顷,占全国的58.4%,产量9.6 万吨,占全国总产量的3/4[2]。
茉莉花属于气质型花,清爽宜人的香气是它的主要特征。前人己经在茉莉花释香机理、茶坯吸香机理、简化加工工序、优化加工工艺等方面进行了大量研究[3−6]。但对茉莉花干燥和干花品质评价方面的研究较少[7]。近年来,花茶类代用茶越来越受到年轻群体的欢迎。干燥是延长花卉类产品贮藏期的重要方式。不同的干燥方式对花卉品质影响差异显著,不同干燥方式对款冬花主要化学成分分析得出阴干可最大程度地保留款冬花成分不受破坏,55 ℃的烘干温度可降低烘干对款冬花成分的影响[8];采用6 种干燥方式对盛花期白及花干燥,得出不同的加工方法对白及花各指标的影响存在显著性差异,而微波干燥时间最短,且ABTS 自由基清除能力最强[9]。ZHENG等[10]采用四种干燥方法制备枇杷花茶,得出冷冻干燥和420 W 微波干燥能较好地保护有效成分。微波干燥应用在杜仲雄花能最大限度地保持其功能成分,且花的雄蕊形状完整,花香浓郁[11]。热风干燥和微波干燥是农产品干制加工中的常用干燥方法,热风-微波联合干燥集2 种干燥方法优点于一体,广泛用于农产品加工干燥领域[12]。WANG 等[13]采用的热风和微波结合热风对菊花进行干燥,得出微波30 s 与热风75 ℃联合干燥的菊花的有效成分含量较高,整体构象变化较小。朱玉丽等[14]采用热风-微波联合干燥的富硒金银花与单独微波干燥相比,其外观品质、绿原酸含量和硒含量均有改善;与单独热风干燥相比,干燥时间和能耗显著降低。SHI 等[15]对茶花干燥研究得出与风干和冷冻干燥茶花相比,微波-热风联合干燥的茶花中儿茶素、黄酮醇苷、三萜皂苷等活性成分含量较高,并改善了茶花的颜色,保留了更多的花香。由以上研究结果可知微波-热风联合干燥在不同花茶干燥方面表现出明显优势,目前尚未有微波-热风联合干燥茉莉花的研究报道。
怡人的香气是茉莉花的主要特征,因此在开发茉莉花干花产品中对挥发性香气成分的分析是评价其品质的主要方式,顶空固相微萃取与气质联用技术(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)结合电子鼻(electronic nose,E-nose)技术近年来成为评价果蔬、粮油、肉制品挥发性成分发挥的重要手段[16−18]。本文以中国最大茉莉花产区广西横县的双瓣茉莉花为原料,对比分析微波-热风联合干燥与单独热风干燥茉莉花干花产品色泽、理化成分、抗氧化能力及氨基酸组成,并以HS-SPME-GC-MS 结合电子鼻技术分析茉莉花挥发性成分的差异性,筛选茉莉花干花产品适宜的干燥方式,为茉莉花干花产品的开发和技术推广提供理论参考。
1 材料与方法
1.1 材料与仪器
茉莉花 2020 年5 月广西茉莉花交易市场购买,为当天采摘的双瓣茉莉花半开放花苞,运回实验室后4 ℃存放,3 d内完成原料处理实验;没食子酸、碳酸钠、苯酚、硫酸、碳酸钙、甲醇、乙醇、丙酮、碳酸钠、乙腈、乙酸钠、三乙胺、醋酸、四氢呋喃 均为分析纯,成都市科隆化学品有限公司;磷酸氢二钠、磷酸二氢钠 均为分析纯,成都金山化学试剂有限公司;17 种氨基酸标准品 美国Sigama 公司;总抗氧化能力试剂盒、羟自由基测试试剂盒、抑制与产生超氧阴离子自由基测定试剂盒(比色法) 南京建成生物工程研究所;福林酚 北京索莱宝科技有限公司。
G80 F20 CSL-B8(R1)微波炉 广东格兰仕微波生活电器制造有限公司;WGLL-230 BE 电热鼓风干燥箱 天津市泰斯特仪器有限公司;PILOT10-15M 中式冻干机 北京博医康实验仪器有限公司;Pegasus HRT 4D Plus 全二维气相-高通量高分辨质谱联用仪 美国力可公司;Agilent 1100 高效液相色谱仪 美国安捷伦公司;FLBP-350A 万能高速粉碎机 上海菲利博食品机械有限公司;CM-3600A 分光测色计 日本柯尼卡美能达株式会社;HH-S4 数显恒温水浴锅 金坛市万华实验仪器厂;SHZ-DⅢ真空泵 巩义市予华仪器有限责任公司;UV-1800紫外分光光度计 上海美析仪器有限公司;PEN3 电子鼻系统 德国AIRSENSE 公司;F1650 扫描电镜 荷兰飞利浦电镜技术有限公司。
1.2 实验方法
1.2.1 茉莉花的干燥
1.2.1.1 热风干燥(HAD) 取1 kg 新鲜茉莉花均匀摊放在干燥托盘上,厚度控制在1.0~1.5 cm,温度60 ℃,风速0.8~1.0 m/s,相对湿度50%~60%,干燥至茉莉花湿基含水量8%停止干燥,冷却后密封袋保存备用。
1.2.1.2 微波-热风联合干燥 茉莉花均匀置于微波干燥盘中,厚度控制在1.0~1.5 cm,控制茉莉花干燥初期微波功率2.4 W/g,分别干燥1.5、2.0、2.5 min后转入热风干燥箱,热风干燥条件同1.2.1.1,干燥至茉莉花湿基含水量8%停止干燥。微波干燥1.5 min后转热风干燥标记MVD1.5+HAD,微波干燥2.0 min 后转热风干燥标记MVD2.0+HAD,微波干燥2.5 min 后转热风干燥标记MVD2.5+HAD,冷却后密封袋保存备用。
以上4 种干燥方式条件的设置是在前期干燥优化的基础上得出的。干燥后的茉莉花各取50 g 经高速粉碎机粉碎过100 目筛,−20 ℃贮藏用于理化指标的测定。挥发性成分和电子鼻分析采用干燥后的整花测定。
1.2.2 茉莉花干燥特性测定
1.2.2.1 茉莉花含水率测定 称取干燥至一定时刻(t)样品10 g,放入105 ℃干燥箱干燥至恒定质量,按式(1)计算t 时湿基含水率Mt:

式中:mt为干燥t 时刻物料的质量,g;md为物料干基质量,g;当t 为0 时,M0即为样品初始湿基含水率。
1.2.2.2 水分比的计算 MR 用于表示在干燥过程中物料残余水分,一般用来反映物料干燥速率的快慢,计算公式如下:

式中:Mt为干燥t 时刻茉莉花干基含水率,%;Me为茉莉花平衡干基含水率,%;M0为茉莉花干燥初始干基含水率,%。
由于干燥后茉莉花的平衡含水率Me远低于Mt和M0,因此MR 可简化如下:

1.2.2.3 干燥速率 Nd通常用来表示干燥速率,定义为单位时间内每单位面积湿物料汽化的水分质量。

式中:Nd为干燥速率,g/(g·h);Md,i+1和Md,i分别为ti+1时刻和ti时刻干基含水率,%。
1.2.3 色泽测定 使用分光测色计进行样品Lab 值测量,亮度L*、红绿a*、黄蓝b*,L*、a*、b*值为正数即分别表示色泽偏白、红、黄,反之偏暗、绿、蓝,每组样品测量平行8 次;色差△E 表示与鲜品的参考颜色差距程度,△E 越大表明与参考颜色差距越大。△E 计算公式见式(5)。
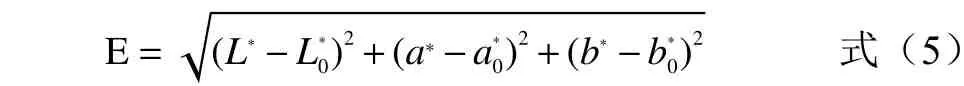
式中:L*、a*、b*值分别为干燥后茉莉花的亮度、红度、黄度;L0*、a0*、b0*值分别为新鲜茉莉花的亮度、红度、黄度。
1.2.4 水溶性浸出物测定 称取0.2 g 茉莉花粉末(精确0.0001 g)于锥形瓶中,加入50 mL 蒸馏水后立即沸水浴45 min,期间间隔10 min 摇匀1 次,浸提完成后立即减压过滤,用沸蒸馏水洗涤样品渣数次,将样品渣连同滤纸放入提前烘干并称量的铝盒中,120 ℃烘干1 h,加盖取出,冷却1 h 后再烘1 h,取出移至干燥器冷却后称量,平行3 组;计算公式如下。
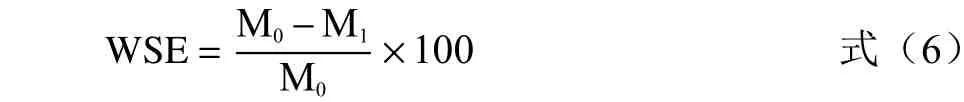
式中,WSE 为水溶性浸出物,%;M0为样品的初始质量,g;M1为浸提后样品残渣质量,g。
1.2.5 可溶性糖测定 采用苯酚硫酸法,称取0.1 g茉莉花粉末,加50 mL 蒸馏水,于沸水中提取40 min后冷却过滤,用蒸馏水定容100 mL 即为样液。取0.5 mL 样液加1.5 mL 蒸馏水混匀后加入1 mL 0.09 g/mol 苯酚溶液摇匀,20 s 内加入5 mL 浓硫酸混合均匀,室温下反应30 min,调零管用蒸馏水代替样液加入各试剂同步反应。在485 nm 处测定吸光值,平行3 组。100 μg/mL 蔗糖标准液制作标曲,得到标准曲线线性回归方程:
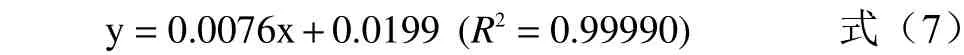
式中:x 为蔗糖质量,g;y 为485 nm 处所测的吸光值。
1.2.6 抗氧化测定 精确称取1 g(精确0.0001 g)粉碎的茉莉花粉末,加10 mL 80%甲醇提取液避光放置24 h,25 ℃、10000 r/min 离心30 min 取上层澄清液体,使用总抗氧化能力试剂盒、羟自由基测试试剂盒、抑制与产生超氧阴离子自由基测定试剂盒(比色法),按照说明书的方法测定总抗氧化能力、羟自由基抑制能力、抗超氧阴离子活力。每个样品平行3 次。
1.2.7 氨基酸组分分析 安捷伦高效液相色谱仪:游离氨基酸分析样品前处理方法:精确称取样品1.0 g(精确至0.0001 g)加入10 mL 5%(v/v)的三氯乙酸沉淀2 h。吸取一定的量于10000 r/min 离心15 min。取一定体积的上清液调pH 至2.0 左右定容,用0.45 μm 微膜过滤至样品杯中上机测定。
四元泵,自动进样器进样1 μL,荧光检测器,hypersil ODS C184.6 mm×250 mm 柱OPA 自动衍生,色谱工作站(安捷伦公司,美国)。柱温40 ℃;流速1.0 mL/min。紫外检测器:0~22.5 min 波长338 nm,22.5 min 后波长262 nm。荧光检测器:激发波长340 nm 发射波长450 nm;22.5 min 时激发波长266 nm 发射波长305 nm;
流动相:A 相:称取2.0 g 乙酸钠(三个结晶水)置于800 mL 毫升烧杯中;加入500 mL 水,搅拌至所有结晶水溶解;加入90 μL 三乙胺并混合;滴加1%~2%的醋酸,将pH 调到7.20±0.05;加入2.5 mL四氢呋喃,并混合。
流动相:B 相:称取2.00 g 乙酸钠(三个结晶水)置200 mL 烧杯中;加入100 mL 水,搅拌至所有结晶溶解;滴加1%~2%醋酸将pH 调到7.20±0.05;将此溶液加入200 mL 乙腈和200 mL 甲醇,并混合。
流动相进液采用梯度法:0~27 min 流动相百分比例A:B=92:8,流速1.0 mL/min;27~31 min A:B=50:50,流速1.0 mL/min;31~33.5 min A:B=0:100,流速1.5 mL/min;33.5~35 min A:B=100:0,流速1.0 mL/min[19]。
1.2.8 挥发性成分分析 取2 g 干燥后的茉莉花置于20 mL 顶空瓶中,将老化后的50/30 μm CAR/PDMS/DVB 萃取头插入样品瓶顶空部分,于60 ℃吸附30 min,吸附后的萃取头取出后插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器采集数据。
色谱柱:DB-Wax(30 m×0.25 mm,0.25 μm);柱温:初始温度40 ℃,初始时间3 min,速率10 deg/min:最终温度230 ℃,保持时间6 min;载气:He;柱流量1.00 mL/min,进样口温度250 min,不分流进样。质谱条件:电子电离(electron ionization,EI)离子源,发射电流1 mA,电子能70 eV,界面温度250 ℃,源温度200 ℃,检测电压2000 V。
1.2.9 电子鼻分析检测 电子鼻测定方法:称量2.0 g干燥后的茉莉花放入100 mL 样品瓶内,25 ℃平衡30 min,依次进行3 次平行测定以获取数据[20]。
电子鼻条件:初始进样流量300 μL/min,取样间隔时间1 s,清洗时间90 s,检测时间80 s,零点修剪时间10 s。在数据分析与处理时,选择传感器信号稳定后的值(一般在50 s 后基本稳定),每组样品做3 次平行重复。
1.3 数据处理
采用SPSS 22 软件的Duncan 检验分析进行方差分析,P<0.05 表示差异显著;使用Origin 9.1 作图;电子鼻数据分析:运用Winmuster 软件对数据进行主成分分析(principal component analysis,PCA)和线性判别分析(linear discriminant analysis,LDA)和Loading 分析。
2 结果与分析
2.1 微波-热风联合干燥茉莉花干燥特性
从图1 微波-热风联合干燥茉莉花微波干燥阶段水分比曲线可知,第一阶段微波干燥前30 s 水分比变化较小,30 s 后水分比随着时间的增加逐渐下降;微波加热1.5 min 后茉莉花水分比为0.986,微波加热2 min 后水分比为0.974,2.5 min 后水分比降至0.959;由此可知微波干燥阶段水分含量下降较快。微波干燥后切换至第二阶段的热风干燥(图2),4 组茉莉花的水分比前期呈现均匀平行下降的趋势;干燥3 h 后MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 水分比分别为0.52、0.45、0.41;干燥6 h 后水分比分别为0.25、0.18、0.16,而HAD 对照组干燥3 h和6 h 后的水分比分别为0.55、0.26;由此可知,茉莉花微波-热风联合干燥第二阶段在相同时间的水分比均小于对照组,且微波干燥时间越长,热风干燥阶段茉莉花水分比越低。干燥速率曲线,从图中的结果可知,茉莉花随着微波干燥时间的延长干燥速率逐渐增加,在前30 s 干燥速率为0,说明微波加热的前30 s 主要以茉莉花温度上升为主,温度升高至一定程度后茉莉花才开始水分的逸散。茉莉花微波干燥结束转热风干燥,结果见图4。从图中可知,MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 干燥的茉莉花30 min 时的干燥速率分别为0.87、1.04、1.26 g/(g·h),而HAD 对照组干燥速率仅为0.55 g/(g·h),这可能是由于微波干燥破坏了茉莉花的细胞结构,促进了水分的散失。微波-热风联合干燥前1 h 的干燥速率均大于单独的热风干燥组;而热风干燥阶段3 h 后,微波-热风联合干燥茉莉花的干燥速率开始低于HAD 组,结合图1 水分比曲线的结果,热风干燥3 h 时,MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 水分比分别为HAD组的94.54%、81.81%、74.54%,干燥6 h 时,MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 水分比分别为HAD 组的96.15%、69.23%、61.54%;说明热风干燥3 h 后微波-热风联合干燥干燥速率低于对照组与水分比密切相关,茉莉花水分比低,则茉莉花内部水分向外迁移速度慢,从而导致干燥速率低于HAD 对照组。
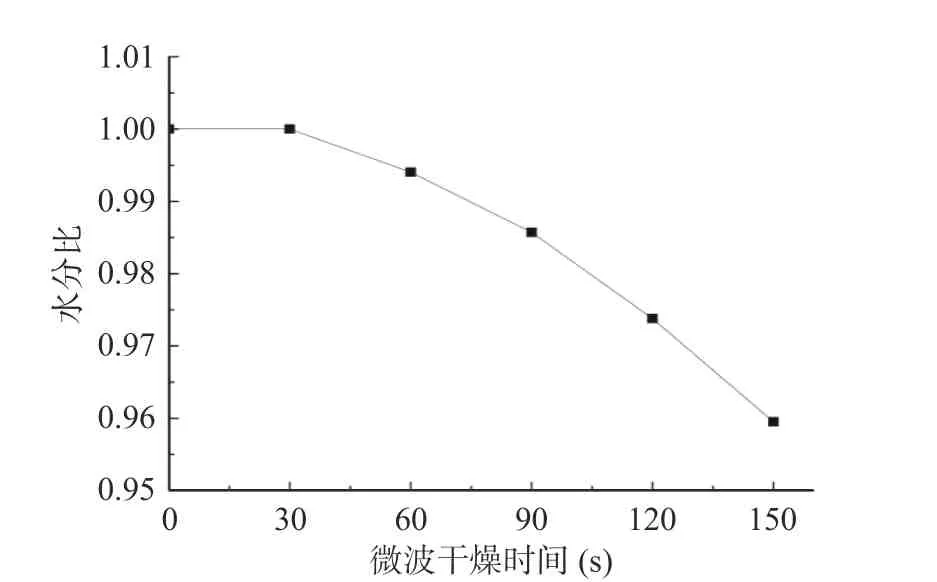
图1 微波-热风联合干燥茉莉花微波干燥阶段水分比曲线Fig.1 Effect of combined microwave and hot air drying in microwave drying stageon water ratio of jasmine
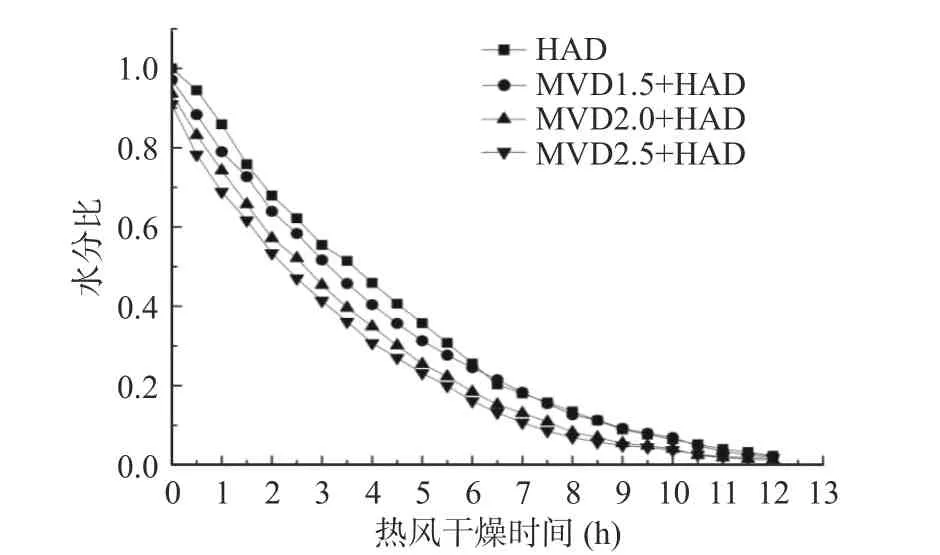
图2 微波-热风联合干燥茉莉花热风干燥阶段水分比曲线Fig.2 Effect of combined microwave and hot air drying in hot air drying stageon water ratio of jasmine图3 为微波-热风联合干燥茉莉花微波干燥阶段

图3 微波-热风联合干燥茉莉花微波干燥阶段干燥速率曲线Fig.3 Effect of combined microwave and hot air drying in microwave drying stageon drying rate of jasmine
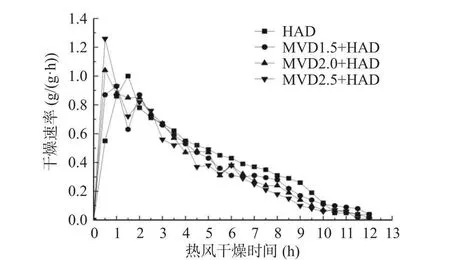
图4 微波-热风联合干燥茉莉花热风干燥阶段干燥速率曲线Fig.4 Effect of combined microwave and hot air drying in hot air drying stageon drying rate of jasmine
2.2 微波-热风联合干燥对茉莉花色泽的影响
色泽是衡量干花品质的重要指标,干燥过程中的酶促和非酶促反应程度不同、叶绿素的降解、维生素C 的氧化、美拉德反应均会影响产品的色泽[21]。从表2 的结果可知微波-热风联合干燥随着微波干燥时间的延长,茉莉花L*从78.99 增加至80.75,a*从−0.15 降低至−0.99,b*从25.39 降至23.36,△E从8.31降至5.44。HAD 茉莉花a*为−0.46,介于MVD2.0+HAD 和MVD2.5+HAD 组a*之间,而HAD 组茉莉花L*、b*、△E值大小介于MVD1.5+HAD 和MVD 2.0+HAD 之间。说明MVD1.5+HAD 干燥的茉莉花褐变度最大,而MVD2.0+HAD 和MVD2.5+HAD组的色泽优于HAD 对照组。微波处理具有钝酶的作用,但短时间的微波加热不能完全钝化酶的活性;MVD1.5+HAD 干燥的茉莉花色差△E大于HAD 对照组,可能是由于1.5 min 微波处理没有完全钝化茉莉花氧化酶的活性,同时微波处理致使茉莉花细胞结构被破坏,在热风干燥阶段进一步加速了氧化酶与酚类物质结合形成黑色物质,从而使MVD1.5+HAD茉莉花比单独热风干燥茉莉花色差更大,褐变更严重[22−23]。
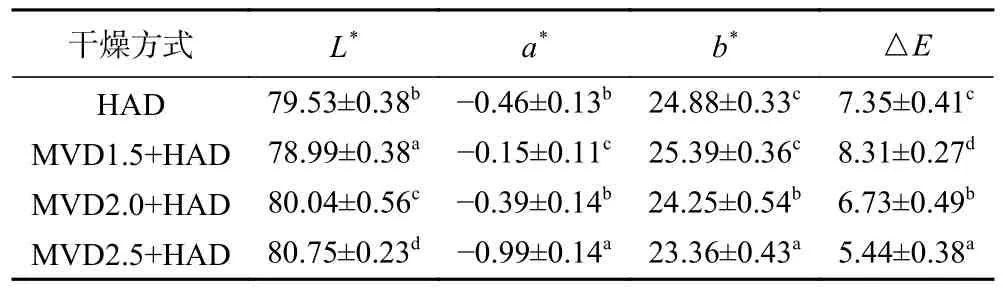
表2 微波-热风联合干燥对茉莉花色泽的影响Table 2 Effect of combined microwave and hot air drying on the color of jasmine
2.3 微波热风联合干燥茉莉花成分及抗氧化能力分析
水溶性浸出物是反映样品在水相体系中溶于水的物质质量,从表3 可以看出HAD 水溶性浸出物为42.63%,MVD1.5+HAD、MVD2.0+HAD 和MVD2.5+HAD 组茉莉花水溶性浸出物在44.00%~44.92%之间,三者之间没有显著性差异(P>0.05),但与HAD组有显著性差异(P<0.05)。微波干燥时间越长,茉莉花可溶性糖含量越低从17.13%降低至9.58%,HAD对照组茉莉花可溶性糖含量为13.01%,介于MVD 1.5+HAD 和MVD2.0+HAD 之间,各组之间均存在显著性差异(P<0.05),这可能是由于较长时间的微波干燥使茉莉花组织结构破坏,细胞汁液流失从而使干燥后茉莉花可溶性糖含量降低。茉莉花中含有β-谷甾醇、β-胡萝卜苷、齐墩果酸、槲皮素、芦丁等化合物,是茉莉花酚类化合物的主要成分,从而使新鲜茉莉花具有一定的抗氧化活性[24−25],从茉莉花总抗氧化能力结果可知,微波-热风联合干燥随着微波干燥延长,总抗氧化能力从499.09 mg/g 降至476.07 mg/g,均小于HAD 组;说明微波-热风联合干燥降低了茉莉花的总抗氧化能力。羟基自由基(•OH)是一种重要的活性氧,抑制羟自由基能力是衡量样品抗氧化能力的重要指标,微波-热风联合干燥茉莉花抑制羟自由基能力在5.27~5.48 U/mg 之间,而HAD 组为4.99 U/mg,3 种微波-热风联合干燥的茉莉花抑制羟自由基能力均与对照组存在显著性差异(P<0.05)。MVD2.5+HAD 组茉莉花抗超氧阴离子能力为2.15 U/g,大于对照组且存在显著性差异(P<0.05);而MVD1.5+HAD、MVD2.0+HAD 与对照组没有显著性差异(P>0.05)。
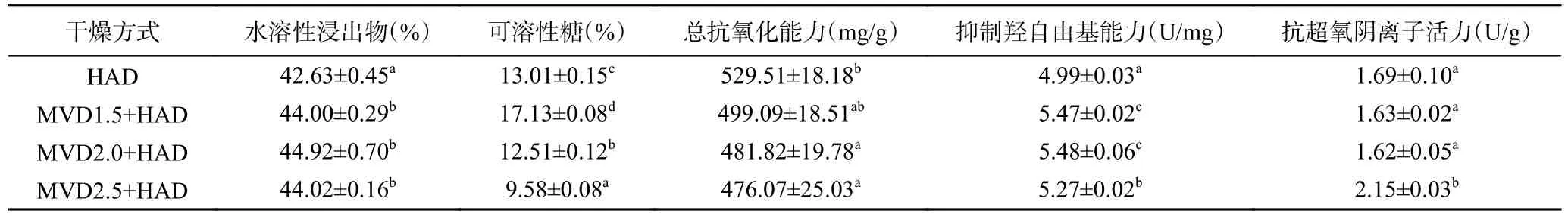
表3 微波-热风联合干燥对茉莉花品质及抗氧化能力的影响Table 3 Effect of combined microwave and hot air drying on the quality and antioxidant capacity of jasmine
2.4 微波热风联合干燥游离氨基酸组分分析
氨基酸是构成蛋白质的基本组成单位,也是人体必需的重要营养元素[26]。茉莉花中各氨基酸的含量如表4 所示,从结果可以看出,茉莉花含有天冬氨酸、谷氨酸、丝氨酸、组氨酸、甘氨酸、苏氨酸、精氨酸、丙氨酸、酪氨酸、缬氨酸、蛋氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸等16 种氨基酸(色氨酸、半胱氨酸未检测)。MVD1.5+HAD、MVD2.0+HAD 和MVD2.5+HAD 组茉莉花氨基酸总量(AA)分别为10.1、8.32、9.40 mg/g,均高于HAD 对照组(6.46 mg/g);相比于沙枣花、茶树花、黄花菜等,茉莉花中氨基酸含量偏低[27−29]。
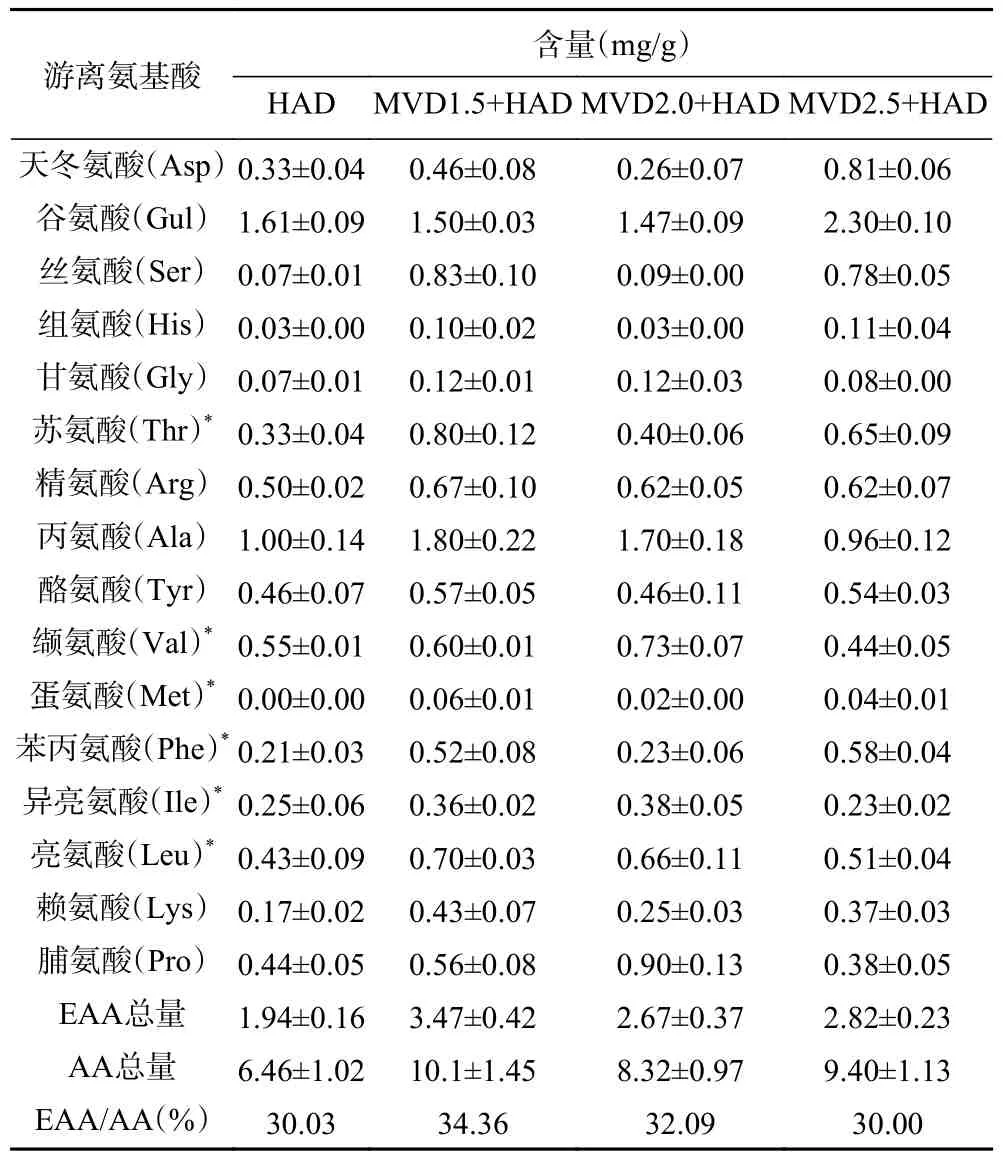
表4 微波热风联合干燥对茉莉花氨基酸组分的影响Table 4 Effect of combined microwave and hot air drying on amino acid component of jasmine
MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD茉莉花中人体必需氨基酸(EAA)含量分别为3.47、2.67、2.82 mg/g,分别占总氨基酸含量的34.36%、32.09%、30.00%,均高于HAD 组茉莉花必需氨基酸总量(1.94 mg/g);而MVD1.5+HAD 组总氨基酸含量、必需氨基酸含量、必需氨基酸占比均为最高。从单个氨基酸含量来看,谷氨酸和丙氨酸2 种氨基酸含量较高,MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 谷氨酸含量分别为1.50、1.47、2.30 mg/g,丙氨酸含量分别为1.80、1.70、0.96 mg/g,HAD 组谷氨酸、丙氨酸含量分别为1.61、1.00 mg/g。MVD1.5+HAD、MVD2.0+HAD 谷氨酸含量低于对照组,丙氨酸含量高于HAD 组,而MVD2.5+HAD 谷氨酸高于HAD 组,丙氨酸含量低于HAD 组。
氨基酸不仅具有各种生理功能,也是食物重要的呈味物质的来源,其呈现出的鲜、甜、酸、苦及涩等味感形成了食物丰富的味觉层次[30],根据氨基酸呈味特性不同,将其分为鲜味、甜味、芳香族氨基酸等。天冬氨酸和谷氨酸可呈现很强的鲜味,丙氨酸、甘氨酸、丝氨酸和脯氨酸则表现出浓厚的甜味,芳香族氨基酸为包括苯丙氨酸和酪氨酸[31]。微波-热风联合干燥茉莉花呈味氨基酸组成结果见表5,从表中结果可知MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 鲜味氨基酸含量分别为1.96、1.73、3.11 mg/g,鲜味氨基酸相对含量为19.41%、20.79%、33.09%;MVD1.5+HAD 鲜味氨基酸含量与HAD 组接近,但相对含量差别较大;MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 甜味氨基酸含量分别为3.31、2.81、2.20 mg/g,呈现出随着微波加热时间的延长含量逐渐降低的趋势,但微波-热风联合干燥的茉莉花甜味氨基酸含量均大于HAD 组;MVD1.5+HAD 和MVD 2.0+HAD 组甜味氨基酸相对含量接近,MVD2.5+HAD 甜味氨基酸相对含量略低于对照组。芳香族氨基酸含量和相对含量低于鲜味氨基酸和甜味氨基酸,微波-热风联合干燥的茉莉花芳香族氨基酸含量在0.69~1.12 mg/g 之间,均比HAD 对照组含量高,MVD1.5+HAD、MVD2.5+HAD 干燥的茉莉花芳香族氨基酸相对含量高于HAD 对照组,MVD2.0+HAD 组的相对含量仅为8.29%低于HAD 对照组。MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 组呈味氨基酸总含量分别为6.43、4.19、6.36 mg/g,MVD1.5+HAD、MVD2.5+HAD2 组含量高于HAD对照组(5.23 mg/g),而MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 组呈味氨基酸相对含量高于对照组。

表5 微波-热风联合干燥茉莉花呈味氨基酸组成Table 5 Effect of combined microwave and hot air drying on flavor amino acid composition of jasmine
2.5 微波热风联合干燥茉莉花挥发性成分分析
采用HS-SPME-GC-MS 技术对干燥后的茉莉花进行挥发性成分分析,离子色谱图见图5~图8。其 中 MVD1.5+HAD、 MVD2.0+HAD、 MVD2.5+HAD 鉴定出的化合物总峰面积分别为4.39×108、3.13×108和2.79×108,由此可知,微波干燥时间越长,茉莉花香气成分损失越多;HAD 鉴定出的化合物总峰面积为2.80×108,相比于对照组,MVD1.5+HAD、MVD2.0+HAD 提高了茉莉花物质的含量。表6 为不同微波-热风联合干燥茉莉花挥发性成分的大类分组,从结果可知,干燥后的茉莉花相对含量最多的为醇类,MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 3 种方式干燥的茉莉花醇类相对含量分别为51.30%、51.32%、34.50%;而HAD 对照组茉莉花中醇类相对含量为31.77%;MVD1.5+HAD、MVD2.0+HAD、MVD2.5+HAD 干燥的茉莉花挥发性成分相对含量排名第二大类的物质分别为酯类(13.93%)、烯烃类(9.95%)、烯烃类(11.86%),排名第三的的大类物质分别为烯烃类(13.63%)、烷烃类(9.10%)、烷烃类(11.70%);而对照组相对含量排第二和第三的大类物质分别为烯烃类(13.88%)、烷烃类(13.18%)。由此可知,短时间的微波干燥(1.5 min)可提高茉莉花干燥后醇类和酯类的相对含量,2.0 min 微波干燥时能提高醇类的相对含量,而微波干燥时间较长(2.5 min),各大类挥发性成分的相对含量与HAD 组接近。
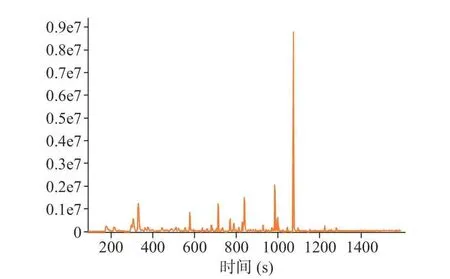
图5 HAD 组茉莉花总离子色谱图Fig.5 Total ion chromatograms of jasmine dried by HAD
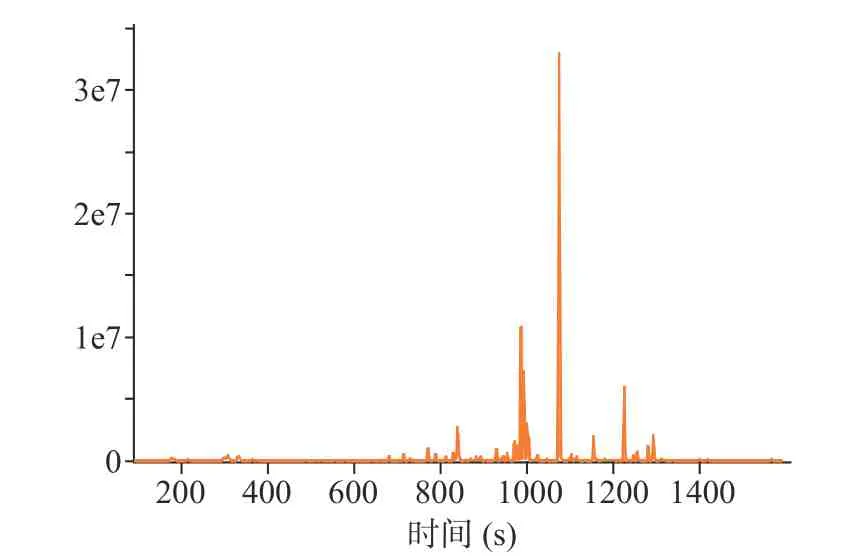
图6 MVD1.5+HAD 组茉莉花总离子色谱图Fig.6 Total ion chromatograms of jasmine dried by MVD1.5+HAD
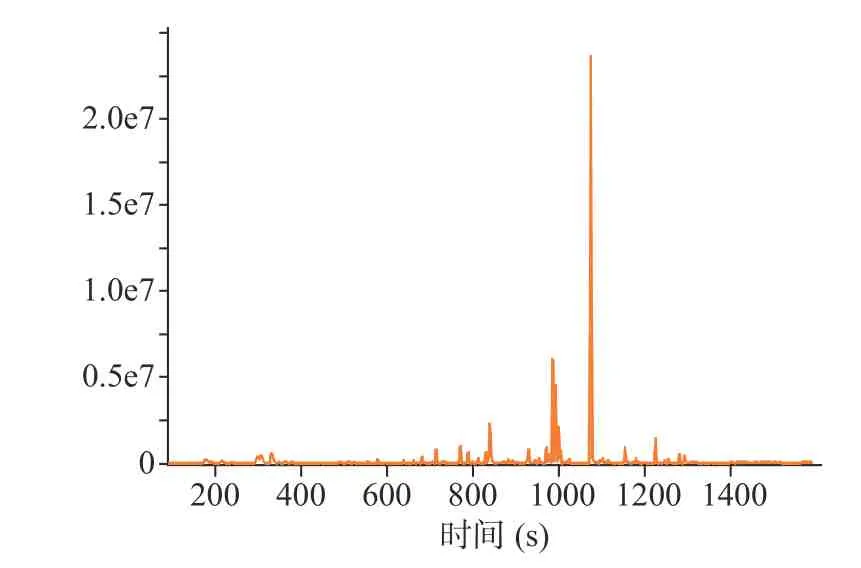
图7 MVD2.0+HAD 组茉莉花总离子色谱图Fig.7 Total ion chromatograms of jasmine dried by MVD2.0+HAD
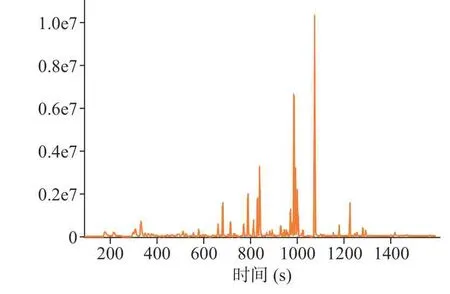
图8 MVD2.5+HAD 组茉莉花总离子色谱图Fig.8 Total ion chromatograms of jasmine dried by MVD2.5+HAD
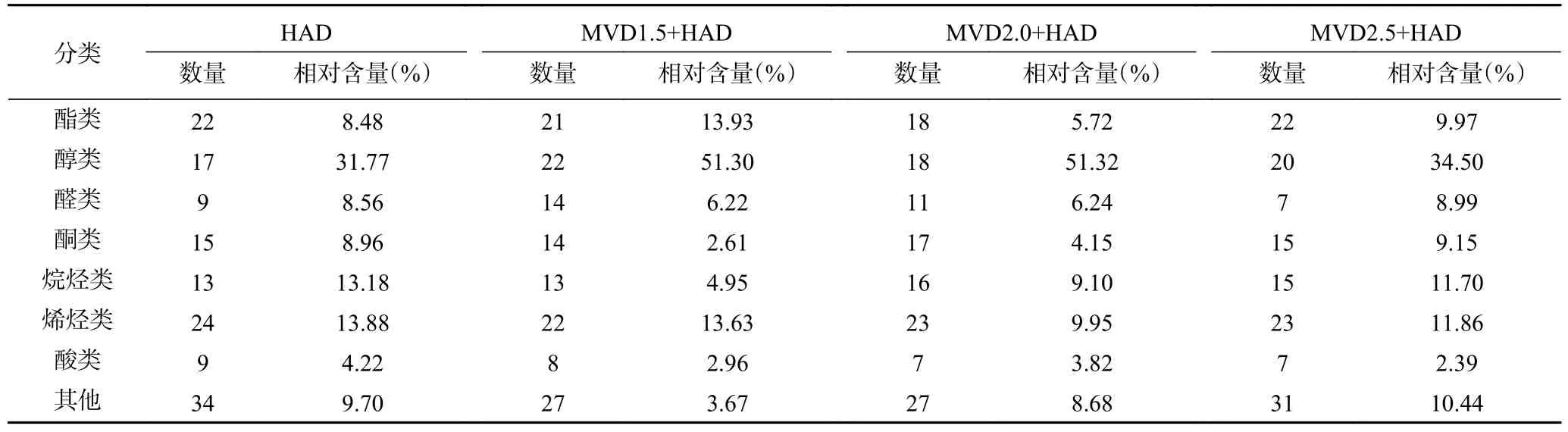
表6 微波-热风联合干燥对茉莉花挥发性成分的影响Table 6 Effect of combined microwave and hot air drying on volatile component of jasmine
从单个化合物的相对含量来看,HAD 干燥的茉莉花前五大相对含量高的物质为苄醇(18.66 %)、2,2,4,6,6-五甲基庚烷(8.96%)、反式-2,4-庚二烯醛(6.18%)、α-法尼烯(5.53%)、乙醇(4.88%);MVD1.5+HAD 干燥的茉莉花前五大相对含量高的物质为苄醇(38.62%)、顺式-3-己烯醇苯甲酸酯(7.39%)、α-法尼烯(6.20%)、乙醇(4.39%)、2,3-二甲基-3-丁烯-2-醇(4.21%);MVD2.0+HAD 干燥的茉莉花前五大相对含量高的物质为苄醇(33.08%)、乙醇(6.650%)、2,2,4,6,6-五甲基庚烷(6.03%)、α-法尼烯(4.79%)、N-苄叉二甲基氯化铵(3.61%);MVD2.5+HAD 干燥的茉莉花前五大相对含量高的物质为苄醇(19.30%)、反式-2,4-庚二烯醛(7.74%)、2,2,4,6,6-五甲基庚烷(7.39%)、α-法尼烯(5.89%)、乙醇(5.27%)。前人研究表明苄醇、α-法尼烯、苯甲酸甲酯、芳樟醇、丁酸顺-3-己烯酯、吲哚等是茉莉花香气的主要成分[6,32−34]。4 种干燥方式的茉莉花相对含量最高的化合物均为苄醇,作为茉莉花的典型性香气物质,苄醇在MVD1.5+HAD、MVD2.0+HAD 和MVD2.5+HAD 组样品中峰面积分别为1.69×108、1.03×108和5.93×107,均高于对照组中的HAD 组茉莉花苄醇峰面积(4.56×107);同时微波-热风联合干燥的茉莉花α-法尼烯峰面积也均大于HAD 组。从以上结果可知,MVD1.5+HAD 和MVD2.0+HAD 2 种干燥方式能较好的保留茉莉花典型性香气。
2.6 不同干燥方式茉莉花电子鼻分析差异性
图9 为微波-热风联合干燥茉莉花电子鼻PCA二维图,PCA 累计贡献率越大,越能反映样品的信息,样品间坐标上距离越大,则差异越大[35]。通过PCA 图可以判定电子鼻是否能区分不同干燥方式茉莉花的香气,从图中可以看出,第一主成分(横坐标PC1)的贡献率为84.60%,第二主成分(纵坐标PC2)的贡献率为15.07%,第一主成分与第二主成分的累积贡献率达99.67%,说明2 个主成分能够较好反映微波-热风联合干燥茉莉花挥发气体的主要信息特征。且不同样品在PCA 图中的分布呈现明显区别,说明不同微波-热风联合干燥改变了茉莉花挥发性香气物质。不同干燥组组内一致性较好且各处理组之间具有较好区分度,MVD1.5+HAD 干燥的茉莉花挥发性成分在PC1 上贡献率最高,HAD 在PC2 上贡献最大,MVD2.0+HAD、MVD2.5+HAD 2 组在PC1和PC2 上贡献率都较低。但MVD1.5+HAD、MVD 2.5+HAD 在PCA 图中有部分重叠和交叉,因此PCA法还不能完全区分不同的微波-热风联合干燥条件下茉莉花的香气的差异性。
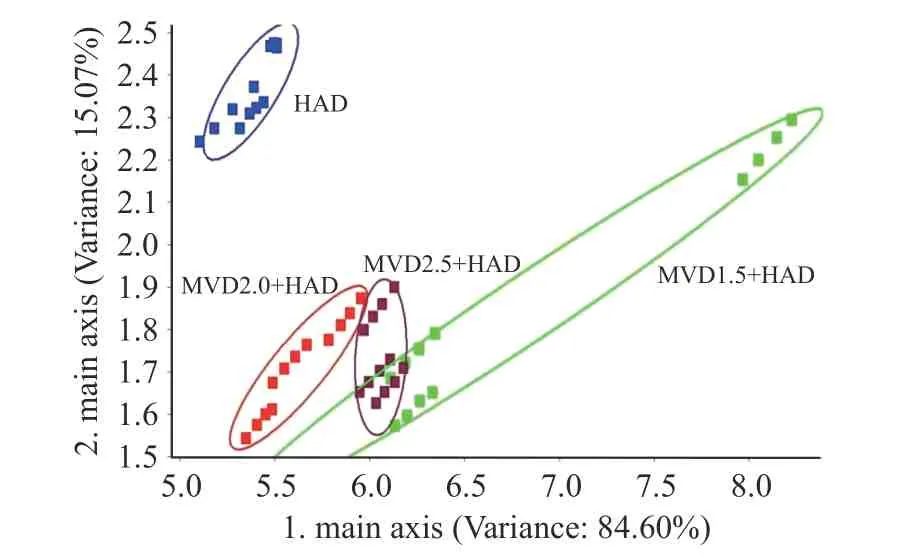
图9 微波-热风联合干燥电子鼻PCA 二维图Fig.9 Two-dimensional PCA map of E-nose of jasmine dried by combined microwave and hot air drying
由图10 微波-热风联合干燥茉莉花LDA 分析二维得分结果可知,第一线性判别因子(横坐标)的贡献率为62.55%,第二线性判别因子(纵坐标)贡献率为33.69%,累积贡献率为96.24%,代表了微波-热风联合干燥茉莉花挥发气体的主要信息特征。由于LDA 分析可尽量缩小组内差异,扩大组间差异,因此无论是横坐标还是纵坐标,不同组干燥的茉莉花被很好的区分开来,二者之间没有重叠的区域,说明LDA 分析可很好的区分微波-热风联合干燥茉莉花挥发性成分的差异。
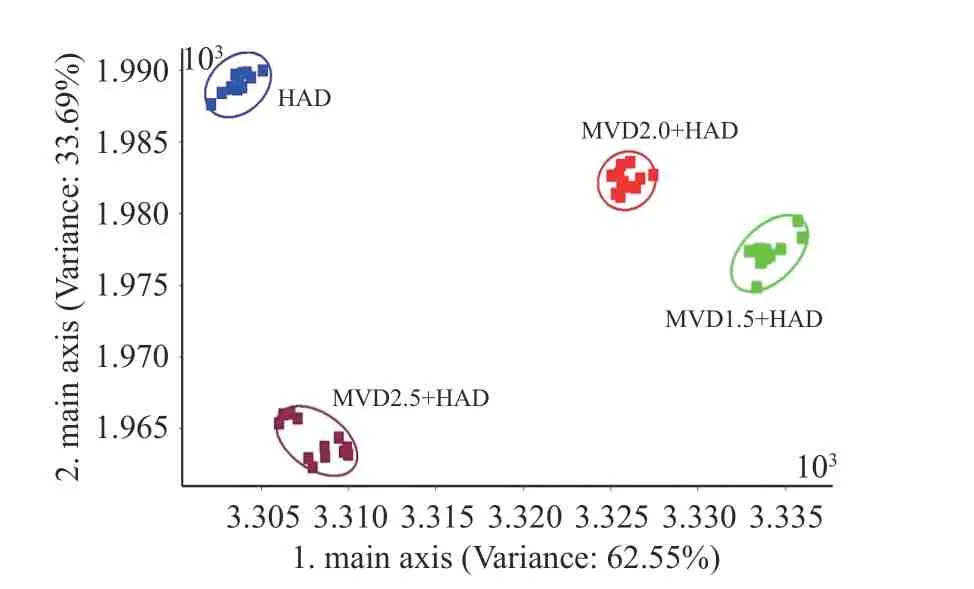
图10 微波-热风联合干燥茉莉花LDA 二维图Fig.10 Two-dimensional LDA map of jasmine dried by combined microwave and hot air drying
PEN3 型号的电子鼻设备有10 种型号的传感器组成,每个型号响应物质类型不同,具体见表1。通过传感器贡献率的分析,可区分当前模式下传感器的相对重要性,传感器贡献率越高,则该传感器的识别能力越强[36]。从图11 不同微波-热风联合干燥茉莉花样品的传感器贡献率分析图可知,第1 主成分和第2 主成分总贡献率为99.67%,说明利用该方法可以有效区分10 种型号的传感器对不同干燥方式的茉莉花挥发性成分的敏感程度。从图8 中可以看出W1W 传感器对第1 主成分贡献率最大,W2W 和W5S 次之;W1S 传感器对第2 主成分贡献率最大,W2S 次之。W1W 对无机硫化物灵敏,W2W 主要对芳香族、有机硫化物灵敏,W5S 对氮氧化合物灵敏;W1S 主要对甲基类灵敏,W2S 对醇类、醛酮类灵敏,由此可说明不同微波-热风联合干燥的茉莉花挥发性物质差异主要表现在无机硫化物和甲基类短链化合物上,同时有机硫化物、氮氧化合物、醇类、醛酮类也存在一定差异。
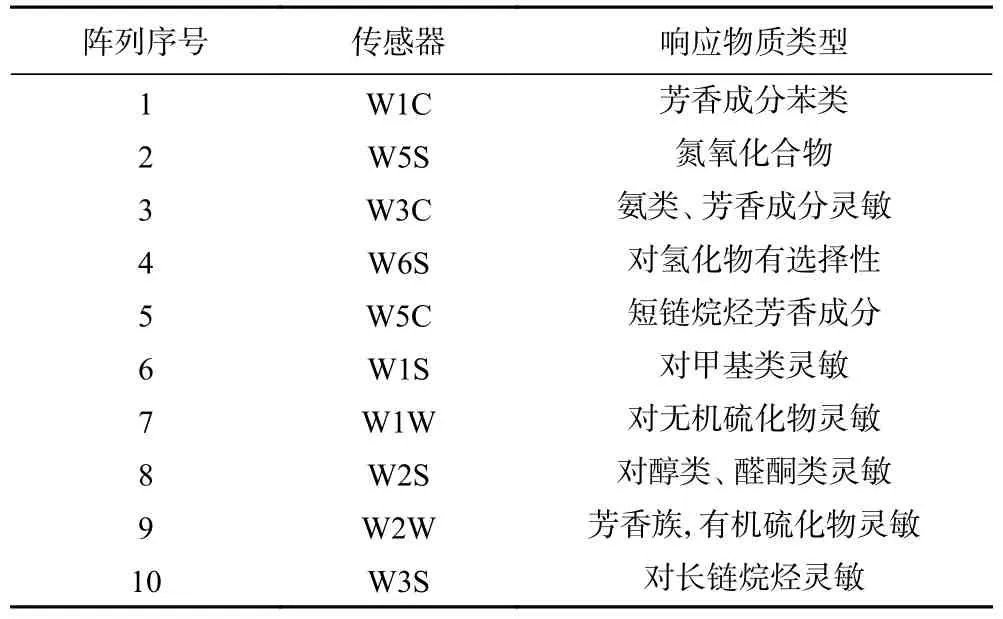
表1 化学传感器对不同物质的响应类型Table 1 Chemical sensors corresponding to different typers of volatile substances

图11 微波-热风联合干燥茉莉花传感器贡献率分析图Fig.11 Loading analysis of jasmine dried by combined microwave and hot air drying
3 结论
对比分析3 种微波(1.5、2.0、2.5 min)与热风(60 ℃)联合干燥对茉莉花干燥特性和品质的影响,得出微波干燥阶段茉莉花水分下降较快,2.5 min 后水分比降至0.959,微波-热风联合干燥的茉莉花在热风干燥相同时间的水分比均小于对照组,且微波干燥时间越长热风干燥阶段相同干燥时间点的茉莉花水分比越低。微波-热风联合干燥茉莉花水溶性浸出物和抑制羟自由基能力高于HAD 对照组,并存在显著性差异(P<0.05)。微波干燥时间越长,L*越大,a*、b*、△E 越小,MVD2.0+HAD 和MVD2.5+HAD 组茉莉花的色泽优于对照组。微波-热风联合干燥茉莉花氨基酸总量(AA)和人体必需氨基酸(EAA)含量均高于HAD 对照组,其中MVD1.5+HAD 组总氨基酸含量、必需氨基酸含量、必需氨基酸占比均为最高。
微波干燥时间越长,茉莉花挥发性成分峰面积越小,典型性香气成分苄醇含量越低;MVD1.5+HAD和MVD2.0+HAD 总挥发性成分物质峰面积以及典型性香气成分苄醇、α-法尼烯峰面积均大于HAD 对照组,说明MVD1.5+HAD 和MVD2.0+HAD 2 种干燥方式能较好的保留茉莉花典型性香气。电子鼻分析中 LDA 分析可很好地区分微波-热风联合干燥茉莉花挥发性成分的差异;不同微波-热风联合干燥的茉莉花挥发性物质差异主要表现在无机硫化物和甲基类短链化合物上。综合研究得出MVD2.0+HAD干燥条件比较适宜茉莉花干燥,该方法干燥后的茉莉花富含氨基酸、气味芳香褐变度低,具有较高开发利用价值。
