盐度对鱼鸟河上覆水细菌群落结构的影响
2022-05-29王文静盛彦清中国科学院烟台海岸带研究所山东烟台264003
王文静,盛彦清 (中国科学院烟台海岸带研究所,山东 烟台 264003)
海岸带水体在维持近海资源与环境的可持续发展过程中具有重要作用。受气候变化和人类活动的双重胁迫,海岸带水环境面临巨大挑战。入海河流由于海水侵蚀等原因,盐度从内陆到河口呈逐渐升高趋势,盐度梯度变化导致滨海河流生态系统的特殊性。但随着沿海地区人口增长和经济快速发展,导致大量污染物排入水体,影响河流水质和生态系统稳定性。富含高营养盐的水体在河口地区汇入近海,增加了海洋水体富营养化的风险[1]。
海岸带河口地区生活着大量可耐受一定盐度的细菌,在近海水体的生物地球化学循环过程中具有重要作用。依据细菌对盐度耐受范围不同可分为嗜盐型和耐盐型。嗜盐型在近于饱和的NaCl溶液和相同盐度环境中生长繁殖[2],嗜盐菌包括Halobacterium、Halococcus和Extothiorhodospimhalophila等菌群;耐盐菌能够在有盐和无盐环境中生长繁殖,耐受的盐度最高达到20‰[3],常见细菌如短杆菌(Brevibacterium)、假单胞菌(Pseudomonas)、芽孢杆菌(Bacillus)、CandidatusNitrotoga、Porticoccus、Roseimaritim、Haliea、Marivita和Algoriphagus等可耐受不同程度的盐度[3-4]。
细菌是水体生态系统的重要组成部分,具有体积小、种类多、分布广和代谢能力强的特点,其快速生长繁殖的特性,导致随环境条件改变其群落结构迅速发生变化。诸多研究发现水体细菌的生长速率主要由生态系统的营养水平决定,但盐度同样是影响微生物种群组成的重要环境因子[5-6]。由于水体细菌生活空间不同,常被区分为浮游细菌和附生细菌。浮游细菌是水体营浮游生活的原核生物类群,是表征生态系统稳定性的重要指标[7]。附生细菌是生活在水体颗粒物、各种基质及藻类表面的原核生物类群,可直接反映水体颗粒物和基质变化[8]。了解入海河流浮游细菌和附生细菌群落组成,对探明海岸带滨海河道生态过程具有重要意义。
鱼鸟河是黄海位于山东省烟台市牟平区的入海河道,鱼鸟河下游河段人类活动频繁,导致夏季水温较高时,水体富营养化及藻华现象时有发生。该文以盐度梯度为采样点选择依据,分析鱼鸟河藻华暴发时下游河段上覆水浮游细菌和附生细菌群落结构。另外,以原位采样点盐度作为可控变量,研究盐度对鱼鸟河上覆水细菌群落结构的影响,以阐明盐度对细菌群落结构和功能的影响。
1 材料与方法
1.1 研究区域及采样点
原位采样点选取山东省烟台市牟平区的入海河道鱼鸟河。2019年6月,S0采样点暴发藻华(图1)。在藻华暴发位点及下游河段分别设置S0、S1、S2和S3采样点,采样河段区域水深为10~20 cm。每个点取3个样品作为重复。S0样品在光学显微镜下经过形态学鉴定,其中,微囊藻属相对丰度约在90%以上,S0样品ρ(叶绿素)为2.14 mg·L-1。
1.2 水质理化指标
在采样现场,采用水质检测仪测定水体盐度。采用水杨酸分光光度法测定水体氨氮指标,采用紫外分光光度计法测定硝态氮,采用磷钼蓝-抗坏血酸分光光度法测定正磷酸盐,采用连续流动分析仪测定其他指标。
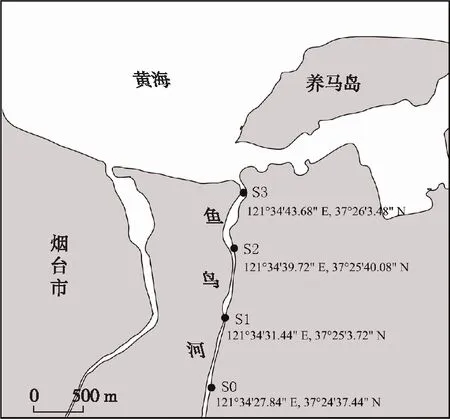
图1 采样位点
1.3 浮游细菌和附生细菌群落
1.3.1样品的收集
采用小型水质采样器,取河道0~10 cm表层水样,每个点采集3个样品作为重复。根据文献[10]报道,利用滤膜1(孔径为5.0 μm, 直径为47 mm,TMTP04700,Millipore,MA,USA)及抽滤泵过滤500 mL水样,获得滤液1和滤膜1,滤液1含浮游细菌,滤膜1含附生细菌。由于滤膜1含有较多碎树叶等杂质,为提高细菌DNA 提取效率,用无菌水对滤膜1进行重悬,150 W超声振荡,间隔1 min超声10 s后上下颠倒混匀,实验过程持续10 min,水溶液重悬后用于过滤滤膜2(孔径为0.22 μm,HVLP04700,Millipore,MA,USA),收集滤膜2,该操作重复3遍,滤膜2保存于-80 ℃条件下,用于提取附生细菌DNA。用滤液1过滤滤膜3(孔径为0.22 μm,HVLP04700,Millipore,MA,USA),获得滤膜3。提取浮游细菌DNA前,所有滤膜均保存于-80 ℃条件下。
1.3.2DNA的提取和细菌群落结构分析
利用无菌剪刀和镊子等在无菌管内剪碎滤膜,按照DNA提取试剂盒(QIAamp DNA Mini Kit,QIAGEN,Germany)说明书要求,分别提取滤膜2和滤膜3的细菌基因组DNA。以提取的DNA作为模板,选取16S rRNA基因V4-V5区的通用引物515F(5′-GTGNCAGCMGCCGCGGTA-3′)和926R(5′-CCGYCAATTYMTTTRAGTTT-3′)为扩增目标DNA片段。20 μL PCR扩增体系反应条件:95 ℃条件下预变性3 min,95 ℃条件下变性30 s,55 ℃条件下退火30 s,72 ℃条件下延伸45 s,共27个循环,72 ℃条件下延伸10 min。将得到的PCR产物,经质量分数w=2%琼脂糖凝胶电泳检测,切胶回收,用Tris-HCl洗脱后收集DNA纯化产物,利用北京诺禾致源科技股份有限公司测序平台进行高通量测序。将原始测序数据上传至 NCBI数据库(SRR14297333-SRR14297322)。
1.4 不同盐度条件下细菌群落分析
为验证环境因子盐度对细菌群落结构的影响,模拟原位采样点相同的盐度梯度,分析盐度对同一原位水样菌群的影响。用0.22 μm孔径滤膜(HVLP04700,Millipore,MA,USA)过滤多份500 mL S0水样,4 ℃条件下保存滤膜备用。利用海盐(Sigma-Aldrich,USA)调整培养基盐度,配制500 mL不同盐度无菌培养基。设置2.5‰(处理组Sal.2.5,对应S0位点)、5‰(处理组Sal.5,对应S1位点)、12‰(处理组Sal.12,对应S2位点)和20‰(处理组Sal. 20,对应S3位点)4个盐度处理组。将过滤后收集的S0水样的滤膜放入各处理组,每个处理组3个重复。所有处理组放入25 ℃恒温光照箱中进行培养,光照强度为2 000 lx,光周期为12 h∶12 h,培养48 h,将培养液过滤至新滤膜(孔径为0.22 μm,HVLP04700,Millipore,MA,USA),收集细菌[7-8]。滤膜在-80 ℃条件下保存用于提取DNA,滤膜细菌提取测定等方法同1.2节。
1.5 数据处理与分析
对Illumina NovaSeq 测序的原始数据(raw tags)进行拼接和质控,得到clean tags,再进行嵌合体过滤,得到用于后续分析的有效数据(clean data)。为研究各样本物种组成,对所有样品的有效数据,以97%的一致性进行OTUs(operational taxonomic units)聚类,然后对OTUs 序列进行物种注释,得到对应物种信息和基于物种丰度的分布情况。利用Uparse软件对样品有效序列进行OTUs聚类,采用Mothur方法与Silva 软件的SSUrRNA数据库进行物种注释,利用Qiimer 1.9.1软件对不同样本采用97%一致性阈值进行Alpha多样性指数分析(如Shannon、Chao1和Goods coverage)进行统计。分析原位浮游细菌(BA)、原位附生细菌(AB)和模拟实验所获得菌群的种间差异,利用R软件对细菌群落结构(属水平)进行主成分分析(principal component analysis,PCA)。采用SPSS 16.0(Statistical Product and Service Solutions)软件对环境因子与细菌Alpha多样性指数之间进行相关性分析。采用Origin 9.1软件进行数据统计。
2 结果与分析
2.1 原位水体理化性质
河段水体理化指标见表1。S0、S1、S2和S3这4个位点盐度从S0至入海口S3逐渐升高,分别为2.5‰、5.1‰、12.3‰和20.9‰。流速均值为1.48 m·s-1。硝态氮浓度从S0至S3逐渐升高,氨氮浓度从S0至S3逐渐降低。总氮浓度从S0至S3随着盐度的增加而升高,可能是因为S1与S2之间存在工厂、居民区等人类活动,导致S2位点总氮浓度升高。S0位点总磷浓度最高,S2位点最低。正磷酸盐浓度在入海口位置逐渐升高,可能是由于S1至S2之间工厂、居民区等区域排放正磷酸盐所致。与之前研究相比,鱼鸟河下游河段氨氮、总氮、总磷浓度高于王祺斌等[9]研究中2018年全河段均值。
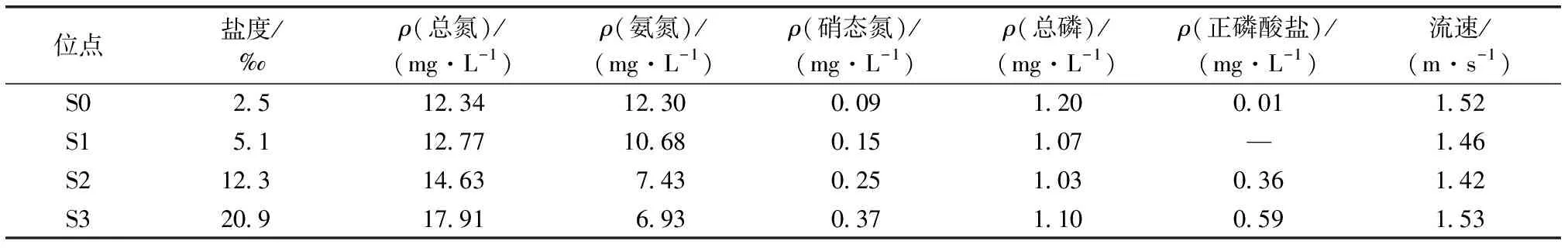
表1 不同位点河段表层水的理化性质
2.2 河道浮游细菌的群落结构
采用高通量测序技术分析河道浮游细菌群落结构(表2)。测序结果共获得369 604条原始序列,S0位点最多,S2位点最少。获得355 356条有效序列,S0位点最多,S2位点最少。覆盖度以S0位点为最高,S3位点最低。物种数量均值为1 221种,S2位点最高,S1位点最低。Chao1多样性指数表明,S3位点物种丰富度最高,S1位点最低。Shannon指数表明S3位点物种多样性最高,S2位点最低。不同盐度位点河道浮游细菌物种丰富度和多样性差别较大,随着盐度增加,细菌群落丰富度升高;细菌群落多样性由S1至S2随着盐度增加而降低,由S2至S3随盐度增加而升高。
河道水体浮游细菌群落结构见图2。

表2 细菌群落的测序条带及Alpha多样性指数
覆盖度指估测序深度是否足够;物种数量指群落中丰度大于0的物种数之和,只有物种种类信息,没有丰度信息;数值范围一般从几百至几千不等;对4个样本在97%一致性阈值下Alpha多样性指数进行统计均一化时选取的数据量为80 842;Chao1指数为对稀有物种很敏感的度量物种丰富度的指标;Shannon指数为衡量种群多样性的指数。

图2 河道水体浮游细菌群落结构
浮游细菌隶属10个门,包括变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、Hydrogenedentes、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)和酸杆菌门(Acidobacteria)(图2)。所有样品中变形菌门相对丰度最高,随盐度增加而升高,S0位点最低,S3位点最高。蓝藻门次之,蓝藻门相对丰度随盐度升高而降低,S0位点较高。由于S0位点是以微囊藻为优势藻的藻华,导致蓝藻门相对丰度在S0位点较高,随盐度升高,蓝藻门相对丰度降低。S1位点拟杆菌门相对丰度低于S0,自S1至S3相对丰度增加。张磊[10]研究发现变形菌门和拟杆菌门对盐度具有较高耐受性,导致变形菌门和拟杆菌门相对丰度在S3位点升高。S1位点浮霉菌门相对丰度低于S0位点,S2位点最高,S3位点最低。S1位点疣微菌门相对丰度低于S0位点,自S1至S3升高。绿弯菌门与疣微菌门相对丰度变化相似,绿弯菌门与疣微菌门细菌具有较高耐盐性。
在属分类水平上,优势菌隶属于微囊藻属(Microcystis)、亚硝化单胞菌属(Nitrosomonas)、CandidatusNitrotoga、Porticoccus、Roseimaritima、Haliea、Marivita、Algoriphagus、Methyloversatilis和生丝单胞菌属(Hyphomonas)(图2)。微囊藻属相对丰度以S1位点为最高,与显微镜下观察到的S1位点微囊藻为优势藻的结果一致。部分具有氨氧化功能的亚硝化单胞菌作为耐盐菌,可耐受高盐环境[11]。具有较高相对丰度的CandidatusNitrotoga是一类可耐受最高32‰盐度的嗜盐氮氧化菌[12]。海岸带地区常见菌Roseimaritima相对丰度与盐度变化一致,在盐度较高的环境下,相对丰度较高。参与异养硝化的Marivita[13]和硝酸盐还原菌Algoriphagus[14]相对丰度具有相似变化趋势,S3位点相对丰度最高,S1位点最低。结果表明,参与氮循环的氨氧化菌和氮氧化菌等相对丰度较高,活跃的细菌代谢过程可能会导致入海河流到入海口的氨氮浓度下降,而硝态氮浓度上升。
2.3 河道附生细菌的群落多样性
附生细菌群落测序条带及Alpha多样性指数见表2。所有样品共得到 113 970条原始序列,S2位点(30 329条)最高,S3位点(26 158条)最低。所有样品共得到108 023条有效序列,S0位点(29 133条)最多,S3位点(25 491条)最少。覆盖度以S0位点为最高,S3位点最低。物种数量均值为360种。Chao 1指数值显示S1位点细菌丰富度最高,S3位点最低;Shannon指数值表明S1位点细菌多样性最高,S3位点最低。在不同盐度采样点,附生细菌群落物种丰富度和多样性不同。之前的研究表明,附生细菌群落组成与其附着的颗粒有机质性质关系密切,颗粒有机质性质影响附生细菌群落组成[15]。
附生细菌隶属于变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、装甲菌门(Armatimonadetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)和厚壁菌门(Firmicutes)7个门(图3)。

图3 河道水体附生细菌群落结构
变形菌门相对丰度以S0位点为最高,S1位点最低。蓝藻门相对丰度以S2位点最高,S0位点最低。拟杆菌门相对丰度以S1位点为最高,S3最低。装甲菌门、放线菌门、芽单胞菌门和厚壁菌门相对丰度在不同采样点变化较大。与浮游细菌群落组成相同,变形菌门、蓝藻门和拟杆菌门是附生细菌群落的优势菌。蓝藻门相对丰度在附生细菌群落中高于浮游细菌,说明影响浮游细菌和附生细菌群落结构的因素不同,菌群结构变化受多种环境因子的影响。
在属分类水平上,优势附生细菌隶属于产卟啉杆菌属(Porphyrobacter)、玫瑰单胞菌属(Roseomonas)、Mariniradius、水单胞菌属(Aquimonas)和微囊藻属(Microcystis)等(图3)。微囊藻属是附生细菌群落的优势菌,其相对丰度在盐度较高的S3位点显著低于S1和S2位点,微囊藻耐受的盐度最高为17.2‰,S3样品中微囊藻可能主要来自于上游。产卟啉杆菌在各个位点均为优势菌,是藻华暴发时的常见菌,可刺激藻细胞胞外聚合物质的释放,促进藻华发生[16],由于产卟啉杆菌有较高耐盐性[17],在S3位点属于优势细菌。S0位点玫瑰单胞菌属相对丰度为24.38%,在其他3个位点均未检测到,说明玫瑰单胞菌属耐盐性较低。Mariniradius仅在S0和S1位点检测到,S1位点相对丰度(11.31%)高于S0位点(7.28%)。水单胞菌属在S0和S1位点均能检测到,S0位点相对丰度(7.86%)高于S1位点(2.44%)。
2.4 模拟盐度对细菌群落组成的影响
不同盐度细菌群落信息见表2。其中,Sal.5原始序列(102 366条)最多,Sal.20(73 024条)最低。所有样品共得到315 397条有效序列,Sal.5最多,Sal.20最少。Sal.20覆盖度最高。共得到物种数量1 014种,Sal.20最高,Sal.2.5最低。物种丰富度指数Chao 1以Sal.20为最高,Sal.2.5最低。Sal.20样品Shannon多样性指数最高,Sal.12最低。上述结果表明,盐度对水体细菌物种丰富度和多样性均有影响。
模拟实验共检测到蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁杆菌门(Firmicutes)、浮霉菌门(Planctomycetota)、Spirochaetota、Synergistota和梭杆菌门(Fusobacteria)9个门(图4)。
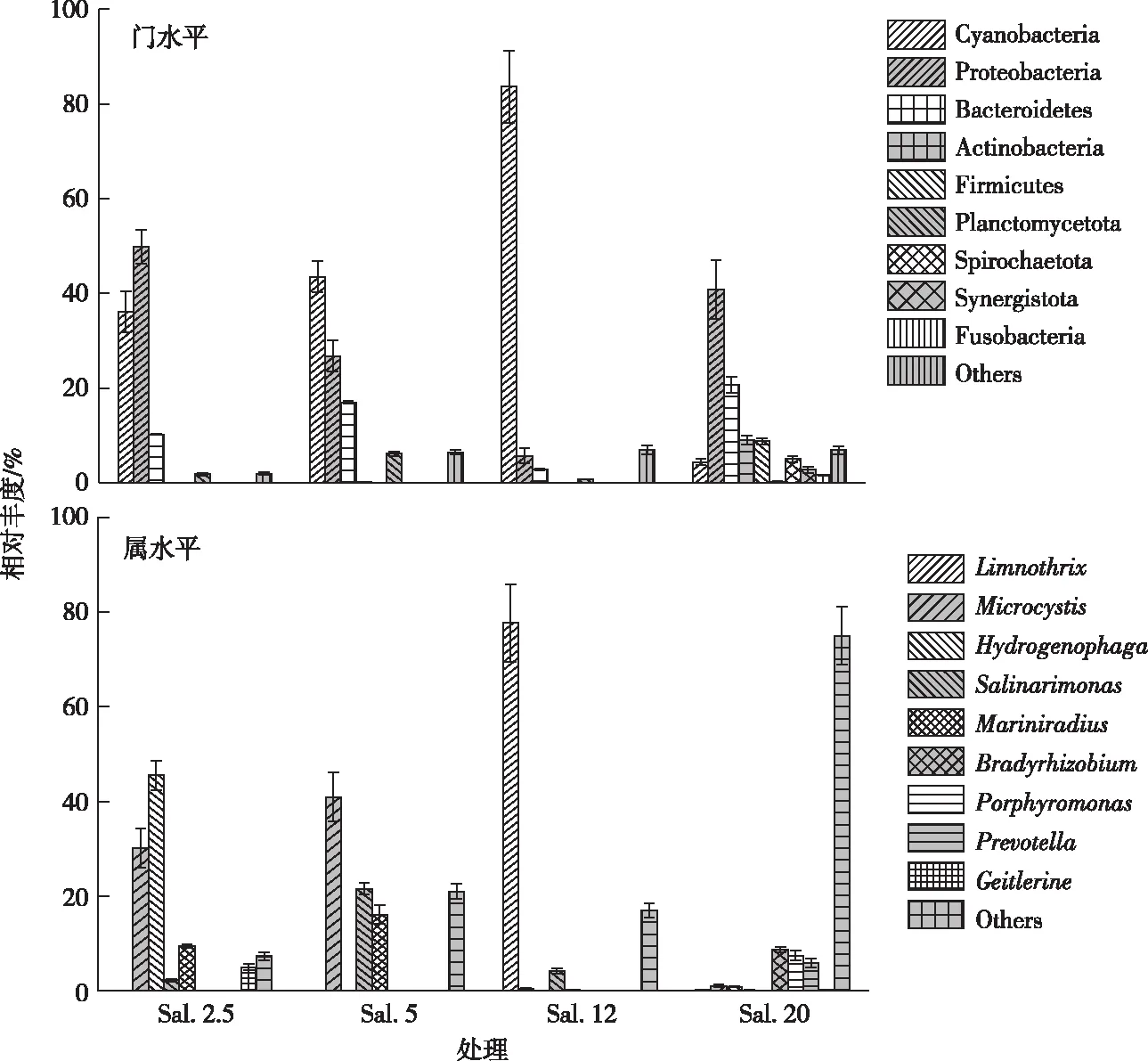
图4 室内模拟盐度对水体细菌群落结构的影响
当盐度由2.5‰升高至12‰时,蓝藻门相对丰度从36.11%升高至83.61%,Sal.20处理降至4.39%,由于模拟实验充足的光照增强了蓝藻光合作用效率,导致蓝藻耐盐性较高。Sal.2.5处理变形菌门相对丰度(49.87%)最高,Sal.20处理次之,Sal.12处理最低。拟杆菌门相对丰度在不同盐度条件下变化较大,Sal.5处理(16.98%)较高,Sal.12处理降至2.88%,Sal.20处理升至20.68%。Sal.2.5、Sal.5和Sal.12处理放线菌门相对丰度均低于0.43%,Sal.20处理升高为9.03%。厚壁菌门相对丰度随盐度升高而增加,Sal.20处理最高,厚壁菌门是蓝藻常见共生菌[18],与蓝藻门协同生长,其相对丰度变化与蓝藻门相一致。Spirochaetota、Synergistota、梭杆菌门相对丰度以Sal.20处理为最高,说明它们的耐盐性较高。上述结果表明,在模拟实验环境下优势菌蓝藻门、变形菌门和拟杆菌门与原位样点相同,相对丰度均较高。
在属分类水平上,检测到湖丝藻属 (Limnothrix)、微囊藻属(Microcystis)、氢噬菌属(Hydrogenophaga)、Salinarimonas、Mariniradius、根瘤菌属(Bradyrhizobium)、产卟啉菌属(Porphyromonas)、普雷沃菌属(Prevotella)和Geitlerine共9类优势菌(图4)。Sal.2.5处理氢噬菌属相对丰度最高,为45.53%,微囊藻属次之,其后为耐盐菌Mariniradius[19]。Sal.5处理微囊藻属相对丰度(40.95%)最高,其后依次为Salinarimonas和Mariniradius。Sal.12处理湖丝藻属相对丰度(77.70%)最高,其后依次为Salinarimonas和微囊藻属。Sal.20处理根瘤菌属相对丰度(8.79%)最高,其后依次为产卟啉菌属和普雷沃菌属。上述结果显示,模拟实验和原位实验均表明在相同盐度条件下优势细菌群落相近。
2.5 细菌群落与水体理化性质的相关性
表3显示,盐度、氨氮和总磷与Chao1指数和Shannon指数呈正相关,Chao1指数与盐度呈显著正相关,Shannon指数与盐度的相关性未达显著水平;模拟实验结果表明,盐度影响细菌群落的丰富度。浮游细菌群落Chao1指数与总磷呈显著正相关。Chao1指数和Shannon指数与总氮和硝态氮呈负相关,浮游细菌群落Shannon指数与硝态氮呈显著负相关。
2.6 主成分分析
PCA分析表明,原位浮游细菌(BA)和原位附生细菌(AB)、模拟实验细菌分布于不同象限,其相似度较小,差异较大,说明各处理组样本间菌群结构存在差异(图5)。原位附生细菌与模拟实验细菌样品相似度较高,差异较少,说明各处理组样本间细菌群落结构相似度较高。相同盐度菌群差异较小,说明相同盐度条件下细菌群落组成结构的相似度较高。该结果与之前研究相似,海岸带环境中细菌群落结构与环境的盐度变化有关[20]。
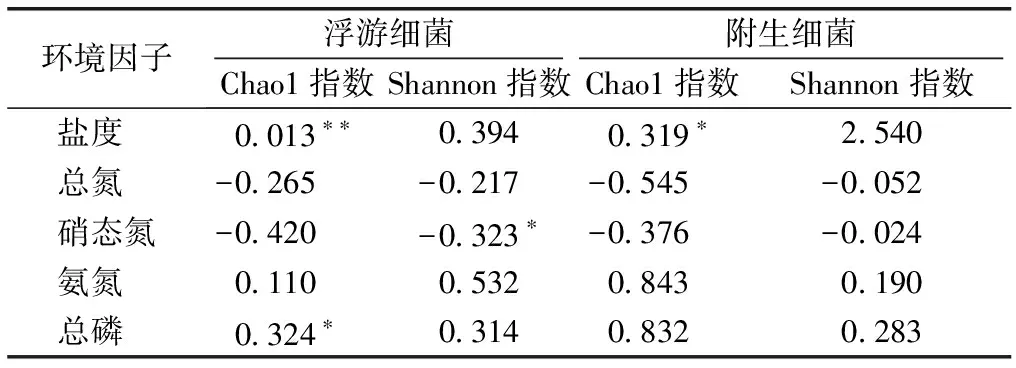
表3 环境因子与浮游细菌/附生细菌Alpha多样性指数相关性

BA为原位浮游细菌,AB为原位附生细菌,S1~S4为原位采样点, Sal.2.5、Sal.5、Sal.12和Sal.20为室内模拟实验处理代号。
3 结论
(1)不同盐度梯度条件下,河流原位样品细菌群落丰富度和多样性发生显著变化。蓝藻门、变形菌门和拟杆菌门在浮游细菌和附生细菌群落均占优势,但浮游细菌和附生细菌的优势细菌明显不同,浮游细菌亚硝化单胞菌和CandidatusNitrotoga为优势菌,附生细菌产卟啉菌为优势菌。相关性分析、主成分分析及模拟实验均表明,盐度影响水体细菌群落结构组成。
(2)模拟实验优势菌与原位水体浮游优势菌差异较大,与附生细菌群落结构相似,由于附生细菌依附于颗粒物或藻细胞表面,其主要有机物来源为颗粒物与藻类的营养物质,而模拟实验中细菌的主要有机物来源也是颗粒物及藻类,营养成分影响细菌群落组成。
(3)该研究涉及细菌盐度耐受性,可获得某盐度环境下指示性细菌,如部分细菌玫瑰单胞菌属、水单胞菌属和Mariniradius在盐度小于5‰条件下生长,而在大于5‰盐度环境下检测不到。研究盐度对细菌群落结构的影响,对弄清滨海河道蓝藻水华暴发过程中水体细菌群落结构变化及未来在耐盐或嗜盐功能菌的分离应用等方面具有重要意义。
