花色苷提取物对大鼠发育关键期铅致肝脏和肾脏损伤的保护作用研究
2022-05-28陈娜张云雷李冰魏亚男曹云飞
陈娜, 张云雷, 李冰, 魏亚男, 曹云飞*
1.镇江市食品药品监督检验中心,江苏 镇江212013;2.江苏大学化学化工学院,江苏 镇江212013
铅是人类较早提炼出来并大量使用的重金属之一,在环境介质及生物机体中广泛检出,易对神经、免疫、消化等多系统产生毒性[1]。临床和流行病学研究证实,作为生物体代谢的重要器官,肝、肾组织是引起铅中毒的重要目标器官,铅暴露易降低肾脏组织中抗氧化酶的活性[2]。此外,肝脏组织中谷胱甘肽(glutathione,GSH)含量以及总氧自由基清除能力(total oxyradical scavenging capacity,TOSC)值也会因铅暴露降低,过氧化氢酶(catalase,CAT)等酶活性减弱,使生物体肝脏的抗氧化系统受到伤害[3]。由此可见,铅使生物体内活性氧(reactive oxygen species,ROS)含量聚集,引起氧化应激。因此,临床常采用抗氧化剂来预防或缓解铅中毒。目前,临床常用二丁基化羟基甲苯、丁基化羟基茴香醚、没食子酸丙酯、叔丁基对苯二酚等铅抑制剂通过清除自由基或阻止ROS的产生,进而激活排毒蛋白,达到延缓或抑制铅对细胞氧化损伤的作用。然而,这些广泛使用的合成抗氧化剂同样存在危害人类健康的潜在毒性。鉴于此,科研工作者更倾向于开发天然且安全的抗氧化剂,用于清除铅对机体引起的危害和毒性。
花色苷(anthocyanins,ACNs)是一种自然界存量与来源丰富的膳食性色素,其具有独特的缺电子特性,易与机体内的自由基等还原性物质反应,因此氧自由基吸收能力和抗氧化能力较强[4-5]。Blando 等[6]测定了黑胡萝卜和太阳黑番茄中花青素的等羧酸等效抗氧化能力(trolox equivalent antioxidant capacity,TEAC)和氧自由基吸收能力(oxygen radical absorbance capacity,ORAC),研究结果显示,两种蔬菜中的花青素均具备强抗氧化活性,且非酰化的花青素抗氧化能力高于结构复杂的或酰化的花青素。Boo等[7]测定了黑米、紫甘薯等15 种天然植物中的色素的抗氧化能力,发现桑叶中花青素的超氧化物歧化酶(superoxide dismutase,SOD)活性最高,可达67.1%,且与其他植物色素相比,仙人掌、桑树和红甘蓝中花青素的CAT 和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性较高。花色苷在生物体及细胞的抗氧化研究中也展现了优异的抗氧化活性。郭宏辉等[8]研究发现,蔓越莓花色苷对ROS 的清除能力很强,且能有效降低动脉粥样硬化的发病率。Amorini等[9]发现黑莓花色苷可显著抑制Cu2+诱导的低密度脂蛋白(low density lipoprotein,LDL)氧化作用,且其抑制效果高于白藜芦醇和维生素C。Cai 等[10]发现花色苷可明显提高乙醇诱导肝损伤小鼠模型中小鼠肝脏中SOD 的活性,降低丙二醛(malondialdehyde,MDA)水平(P<0.05),改善肝脏的氧化损伤,可见花色苷对哺乳动物的肝脏氧化损伤具有良好的保护效果。
因此,铅在机体内蓄积易引起肝脏和肾脏的氧化损伤,而ACNs 具有非常好的抗氧化效果。本文通过研究ACNs 对大鼠铅致肝和肾氧化损伤的保护效果,以期为ACNs 的应用和开发提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验仪器 Tissue-Tearor 型高速组织匀浆机购自上海净信实业发展有限公司;Sigma 1-13型高速离心机购自德国Sigma 公司;Spectra Max 190型酶标仪购自美国Molecular Device公司。
1.1.2 实验动物 SD 健康大鼠,雌雄各半(清洁级,6 周龄),购自常州卡文斯实验动物有限公司。实验前在温度21±1 ℃,湿度60%±5%环境下连续检疫并适应性喂养3 d。所有动物程序均按照江苏大学《实验动物护理和使用指南》(SYXK(SU)2018-0053)执行,并经中国立法和国家卫生研究院(NIH)的动物伦理委员会批准。
1.1.3 实验试剂与药品 ACNs(纯度>95%)购自精方生物科技有限公司(上海);醋酸铅(分析纯,AR)购自国药集团化学试剂有限公司(上海);二巯基丁二酸(dimercaptosuccinate,DMSA)购自上海笛柏化学品技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛、超氧化物歧化酶购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 实验分组与给药方式 每组10只SD大鼠,每日称量大鼠体质量,并将ACNs溶解于蒸馏水中,按照大鼠体质量给药,具体给药(连续3 周)方式如下:实验1 组(空白组):自由饮用正常水,每日以去离子水灌胃;实验2组(Pb对照组):自由饮用500 mg·L−1的醋酸铅水,每日以去离子水灌胃;实验3 组(DMSA 阳性对照组):自由饮用500 mg·L−1的醋酸铅水,每周前3 天以强驱铅解毒药DMSA(250 mg·kg−1)灌胃;实验4组(ACNs对照组):饮用正常水,每日以150.0 mg·kg−1ACNs灌胃;实验5组(ACNs 低剂量组,L-ACNs):自由饮用500 mg·L−1的醋酸铅水,每日以25.0 mg·kg−1ACNs灌胃;实验6组(ACNs中剂量组,M-ACNs):饮用醋酸铅水,每日以50.0 mg·kg−1ACNs灌胃;实验7组(ACNs高剂量组,H-ACNs):自由饮用500 mg·L−1的醋酸铅水,每日以150.0 mg·kg−1ACNs灌胃。
1.2.2 组织病理学观察 取大鼠海马组织,依次置于体积分数为4%的多聚甲醛中固定、质量分数为20%的蔗糖溶液中浸泡,备用。处理过的组织样本,经石蜡包埋,苏木精染色后,观察肝脏和肾脏组织形态,并用光学显微镜拍照。
1.2.3 金属元素含量测定 末次给药结束24 h后,大鼠安乐死,解剖,随后取出肾脏和肝脏组织,并于4 ℃条件下保存,备用。取1 g 新鲜的肝脏、肾脏组织,分别置于锥形瓶中,加入10 mL 硝酸/高氯酸(体积比=4∶1)混合溶液于室温下硝解过夜,随后,锥形瓶中的溶液在150 ℃加热条件下热消化至液体变成澄清,然后用2.5%硝酸水溶液定容至固定体积,备用。采用ICP-AES 检测消化样品中的铅含量。
1.2.4 组织生化指标测定 末次给药结束24 h后,使用毛细血管采集各组大鼠眼眶静脉血0.5~1.0 mL,3 000 r·min−1条件下离心15 min,吸取血清备用。大鼠安乐死后解剖,将肝和肾脏置于0.9%的NaCl 溶液中,冰水浴中匀浆,备用。根据酶联免疫试剂盒说明书,测定血清、肝脏、肾脏组织中的生化指标。
1.2.5 血液指标测定 末次给药结束24 h 后,使用毛细血管取各组大鼠眼眶静脉血0.5~1.0 mL于抗凝管中,充分混匀后,分析血常规。
末次给药结束24 h 后,使用毛细血管取各组大鼠眼眶静脉血0.5~1.0 mL 并放置4 h,离心机设置条件为3 000 r·min−1,并离心15 min,收集血清,分析血生化指标。
1.2.6 综合生物标志物响应(integrated biomarker responses,IBR)分析 IBR 值计算过程参考Hou等[11]提出的方案。计算步骤如下:①标准化每个指标的平均值Xi,记为Yi:Yi=(Xi−m)/s,m为总平均值,s为相应的标准差;②当生物标志物对铅暴露的毒性效应正响应时,Zi=Yi,当生物标志物对铅暴露的毒性效应负响应时,Zi=−Yi,将每组样本标准化后的最小值Min 的绝对值与Zi相加,计算得到生物响应值Si:Si=Zi+|Min|,当Si<0 时,记Si=0;③采用星图面积Ai值表示IBR 值:Ai=,其中,α= 2π/n,n为生物标志物的个数,且Sn+1=S1。本文中,IBR值越大,表示花色苷对Pb致大鼠脏器损伤的改善程度越小。
1.2.7 统计学处理 采用SPSS 16.0 统计软件进行数据分析,符合正态分布的数据采用平均值±标准差表示,组间差异显著性分析采用LSD-t检验。P<0.05表示数据之间有统计学差异。
2 结果与分析
2.1 花色苷对组织结构的影响
2.1.1 花色苷对肝脏组织结构的影响 ACNs 对铅暴露大鼠肝脏病理形态的影响见图1,由图1可知,空白组中肝小叶分界清楚,排列规则,肝细胞圆润;肝板排列整齐,肝窦无明显扩张或挤压;未见相邻肝小叶之间的门管区存在异常;且未见明显的炎性改变。Pb 对照组大鼠肝脏出现多量的血管淤血(红色箭头);小叶内偶见坏死灶,少量的肝细胞胞核固缩深染、碎裂或溶解,胞质嗜酸性加强(黑色箭头),四周可见些许淋巴细胞浸润(蓝色箭头)。DMSA 阳性对照组大鼠出现少量的血管淤血(红色箭头);未见明显的炎性改变。而在实验剂量范围内,低剂量ACNs 组大鼠出现大面积的肝窦轻度淤血(红色箭头);大量的肝细胞脂肪变性,胞质内可见体积较小的圆形空泡(黑色箭头);但未见明显的炎性改变。而ACNs 高剂量组大鼠肝脏中则出现肝细胞脂肪变性,胞质内可见体积较小的圆形空泡(黑色箭头);未见明显的炎性改变。结果表明,铅暴露引起发育期大鼠肝脏组织发生结构性病变,而花色苷有效缓解了铅暴露导致的组织病变。
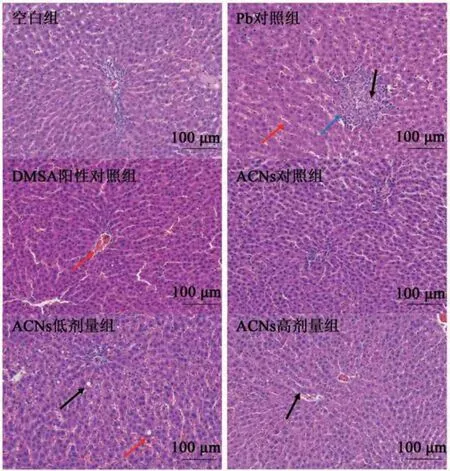
图1 ACNs对铅暴露大鼠肝脏病理形态的影响(200×,HE)Fig.1 Effect of ACNs on Pb-induced liver pathological morphology changes in rats(200×,HE)
2.1.2 花色苷对肾脏组织结构的影响 ACNs 对大鼠发育关键期铅致肾脏病理形态的影响见图2,由图2可知,空白组皮质中肾小球分布均匀,且肾小球中细胞数量以及基质均匀,肾小管排列紧凑;髓质未发现显著改变,间质无明显增生;未见明显的炎性改变。Pb 对照组肾小管上皮细胞肿胀,胞质蓬松淡染(蓝色箭头)。DMSA 对照组则出现少量的肾小管上皮细胞胞质呈空泡状(蓝色箭头);但未见明显的炎性改变。在实验剂量范围内,低剂量ACNs 组大鼠肾脏损伤有所好转,中等量的肾小管上皮细胞出现水肿,胞质蓬松淡染(蓝色箭头),但未见明显的炎性改变。而高剂量ACNs 组的肾脏损伤明显好转,只有少量的肾小管上皮细胞出现水肿,且未见明显的炎性改变。实验结果显示,铅暴露引起发育关键期大鼠肾脏组织结构性损伤,而花色苷有效改善了铅暴露导致的损伤。

图2 ACNs对铅暴露大鼠肾脏病理形态的影响(200×,HE)Fig.2 Effect of ACNs on lead-induced kidney pathological morphology changes in rats(200×,HE)
2.2 花色苷对大鼠体内金属元素的影响
图3 为ACNs 对大鼠肝脏、肾脏中Pb 含量的影响。由图3 可知,铅暴露导致大鼠肝脏、肾脏组织中Pb 含量显著上升(P<0.05);而ACNs 单独增补对健康大鼠体内的铅含量无明显影响。然而,在实验剂量范围内,相比较于Pb 对照组,低、中、高剂量的ACNs 能显著降低大鼠肝脏和肾脏中的Pb含量(P<0.05);ACNs干预组与DMSA 阳性对照组相比,差异无统计学意义。结果表明ACNs 增补可明显减少发育关键期大鼠肝肾组织中的铅含量。
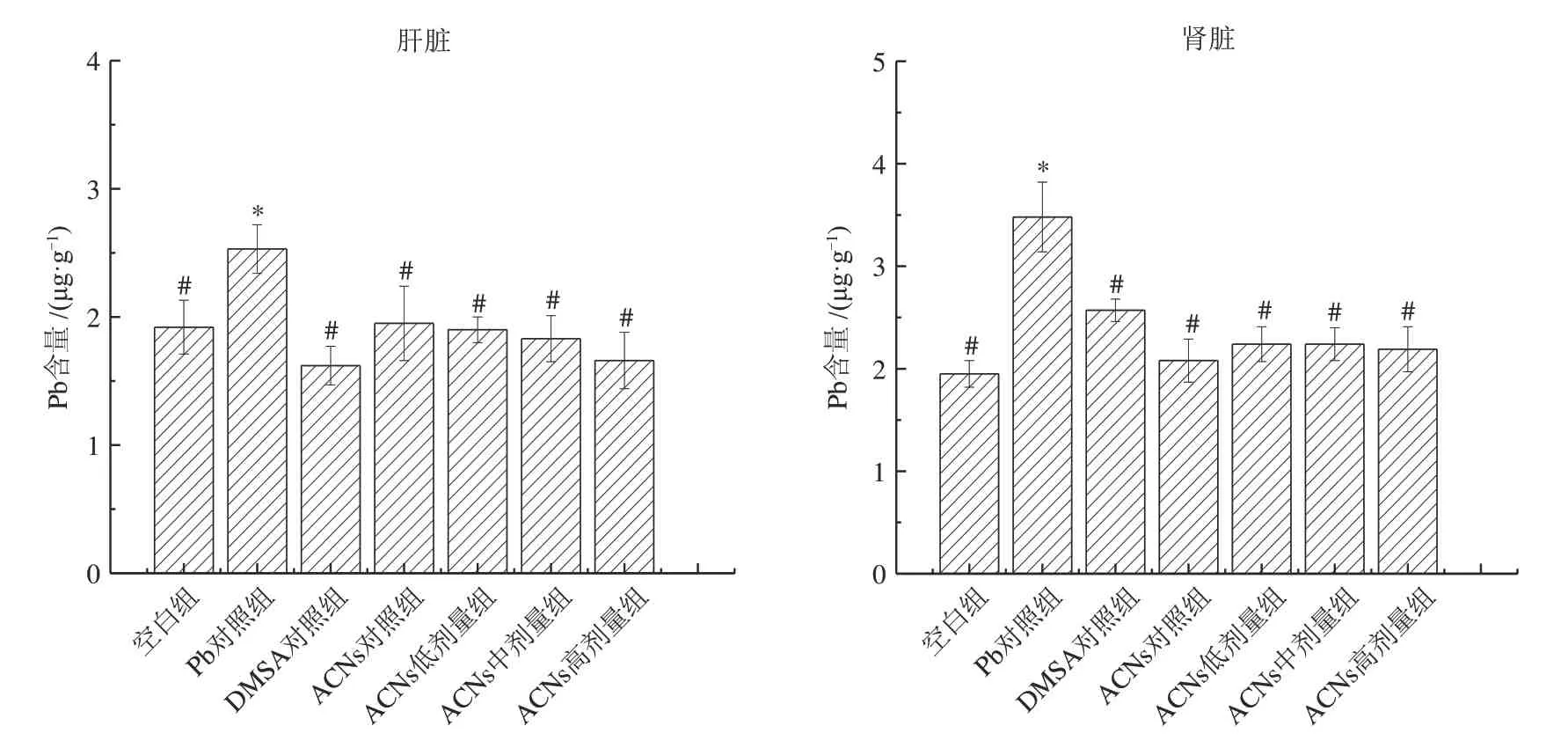
图3 ACNs对大鼠肝脏和肾脏中Pb含量的影响Fig.3 Effect of ACNs on the Pb concentrations in liver and kidney in rats
2.3 对大鼠脏器生化指标的影响
重金属铅进入生物机体后,导致机体内产生MDA、活性氧等大量还原性产物,使机体发生氧化损伤。而SOD、GSH-Px 是机体正常运行必不可少的抗氧化酶,能够有效去除还原性物质,而铅能破坏SOD、GSH-Px 等构成的抗氧化防御体系,诱导机体发生氧化应激。而ACNs 的抗氧化活性,可以很好地改善由于氧化-抗氧化失衡引起的机体损伤,因此,本文通过对各处理组大鼠组织抗氧化能力的考察,研究ACNs 对铅诱导大鼠组织氧化损伤的影响。
2.3.1 肝组织生化指标 图4 为ACNs 增补对铅诱导大鼠肝脏中生化指标的影响效果,由图4 可见,铅暴露导致大鼠肝脏组织中的SOD、GSH-Px的活性明显降低(P<0.05),而MDA 含量明显上升(P<0.05),结果表明,发育关键期大鼠的肝脏组织在重金属铅暴露环境中会产生氧化应激反应。而在实验剂量范围内,与Pb 对照组相比,增补ACNs可大幅提高大鼠肝脏组织中SOD 和GSH-Px 的活性(P<0.05),并使MDA 含量大幅减少(P<0.05);而ACN 的肝脏抗氧化效果与排铅药DMSA 相比,无统计学意义差异。结果表明ACNs 可有效改变铅导致的肝脏氧化损伤。

图4 ACNs对大鼠肝组织中SOD、GSH-Px和MDA的影响Fig.4 Effect of ACNs on the SOD,GSH-Px and MDA of liver in rats
2.3.2 肾组织生化指标 图5 为ACNs 对发育关键期大鼠肾脏组织中生化指标损伤的影响效果,由图5 可知,铅暴露会明显降低大鼠肾脏中的抗氧化酶SOD 的活性(P<0.05),大幅提高MDA 水平(P<0.05),结果表明铅进入机体后,促进机体发生氧化损伤;ACNs 对照组对健康大鼠肾脏中SOD的活性及MDA 水平无显著影响。然而与Pb 对照组相比,在实验剂量范围内,ACNs 表现出在不同程度调节大鼠肾脏生化指标的作用,其中,中、高剂量ACNs 作用下大鼠肾脏组织中抗氧化酶(SOD)的活性(P<0.05)明显提高,MDA 大幅减少(P<0.05);而ACNs 的肾脏抗氧化效果与排铅药DMSA 相比,无统计学差异(P>0.05)。以上实验结果表明,ACNs 能够有效改善Pb 诱导发育关键期大鼠肾脏组织产生的氧化损伤。

图5 ACNs对大鼠肾组织中SOD、GSH-Px和MDA的影响Fig.5 Effect of ACNs on the SOD,GSH-Px and MDA of kidney in rats
2.3.3 血生化指标 Pb 暴露会引起机体的脏器功能损伤,血生化指标是检测心脏功能、肾功能、肝功能等的重要指标,因此本文通过测定Pb暴露大鼠的血生化指标,探究ACNs 对改善Pb 暴露致大鼠脏器功能损伤的作用效果。如图6 所示,经Pb 暴露后,Pb 对照组血液中CK 及CK-MB 含量无显著变化,而谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)的水平明显升高(P<0.05)。ALT、AST 及ALP转氨酶作为检测肝脏功能的重要指标显著变化,结果表明Pb 进入血液系统后,会进一步损伤大鼠的肝脏功能。与Pb 对照实验组相比,ACNs在实验剂量范围内,可不同程度调节大鼠的生化及血常规指标,其中,在ACNs 低、中、高剂量作用下,大鼠血液中ALT 和AST 转氨酶含量明显降低(P<0.05),与强力排铅药DMSA 相比,无统计学差异(P>0.05)。以上结果表明,ACNs可有效提高发育关键期大鼠血液中转氨酶的水平,进而改善Pb中毒引起的肝脏功能损伤。铅中毒引起机体血清中BUN 和CRE 的水平升高,损伤大鼠肾脏的正常代谢功能,而在ACNs 低、中、高剂量作用下,大鼠血液中BUN 和CRE 的含量明显降低(P<0.05),与强力排铅药DMSA 相比,无统计学差异(P>0.05)。以上结果表明,ACNs 可有效改善Pb 中毒引起的肾脏功能损伤。

图6 不同剂量ACNs对大鼠血生化指标的影响Fig.6 Effect of ACNs on the biochemistry parameters of blood in rats
2.4 IBR分析
图7 中的6 个方向轴表示肝脏和肾脏中3 种与氧化应激相关的生物标志物(SOD、GSH-Px、MDA),星状图围成的面积为IBR 值。从图7 中可以看出,在花色苷不同干预剂量下的IBR 值均小于铅模型组的IBR 值,表明花色苷对铅暴露致机体氧化损伤具有修复作用,且在实验剂量范围内,ACNs增补剂量越高,对铅毒性效应的改善效果越明显。

图7 ACNs干预铅致大鼠IBR星状图Fig.7 IBR of lead-induced rats after nutritional intervention of ACNs
3 讨论
有毒重金属铅大量存在于环境介质中,可通过多种途径进入人体,并在机体内长期蓄积,严重损害人类健康[12]。研究显示,铅主要在肾脏和肝脏组织中蓄积,并在不断蓄积的过程中损伤肾脏和肝脏器官,而氧化损伤是铅使机体发生中毒的重要原因之一[13]。一方面,铅可导致抗氧化剂防御系统的枯竭或ROS 的增加[14];另一方面,Pb 可以取代组织或器官中的Ca2+、Fe2+、Zn2+等二价阳离子,参与生物代谢过程并诱发自由基的产生,抑制体内抗氧化物的生成,最终导致生物机体各组织、器官氧化-抗氧化水平失衡[15]。因此,在充分研究Pb 的毒性效应机制基础上,寻找合适的Pb 拮抗剂,是目前解决铅环境污染问题的重要途径。本文以来源丰富的ACNs 为对象,建立发育期大鼠铅中毒模型,研究ACNs 对由铅引起的大鼠脏器毒性效应的保护作用。
肝脏能够生产机体正常活动所需的各种代谢酶,一旦受损,造成ALT、AST 等转氨酶在血液中的水平大幅提升。本研究显示,过量铅可导致血清中转氨酶含量大幅度上升,严重损伤发育关键期大鼠肝脏组织细胞的代谢活动。研究显示,铅暴露会诱导肝脏组织产生大量的ROS 和自由基,诱导脂质过氧化并产生大量自由基或还原性物质,同时降低生物体的抗氧化水平,并导致肝脏组织出现淋巴细胞浸润,引发门静脉炎症,同时会引起细胞水样变性以及脂肪变性,最终造成肝脏损伤[16-17]。而ACNs 分子是多羟基结构,可用于清除自由基,有效抑制Pb暴露致小鼠肝脏组织氧化损伤,明显提高铅暴露抑制的抗氧化酶SOD 的活性。且ACNs 的摄入可以有效地抑制血清中转氨酶ALT 和AST 水平的持续升高,改善代谢功能异常,从而有效地保护了铅暴露导致的大鼠肝脏组织损伤。
而肾脏能够保证机体正常的新陈代谢,肾脏受损会影响机体内废弃物的排泄及氨基酸等物质的重吸收,从而导致机体代谢系统的稳定性被破坏。铅中毒使肾小球的过滤作用退化,损伤大鼠肾脏的正常代谢功能。本研究显示,铅暴露后,肾脏中的抗氧化酶SOD 活性大幅下调,还原性物质含量大幅上调,主要是由于作为SOD 的重要辅助因子Zn2+被Pb 替代,引起SOD 失活,进而降低肾组织清除超氧化物自由基的能力[18]。而MDA 是在氧衍生自由基和脂质氧化降解过程中产生的物质[19]。自由基浓度的大幅提高导致过量还原性物质MDA 的产生,进而干扰营养物质的正常代谢与吸收,降低酶活性。而花色苷的摄入可以有效预防铅致大鼠肾脏组织SOD 水平的降低,抑制铅致小鼠肾脏组织MDA 水平的升高,主要是由于花色苷分子结构中酚羟基将孤对电子供给Pb2+,形成配位键作用[20]。同时,花色苷C 环上的C=C 与C=O 的共轭以及邻苯二酚结构具有强力的抗氧化活性和配位能力,分子中羟基可以通过提供电子的方式稳定自由基和配位金属离子,从而使机体因过量自由基导致氧化损伤[21-22]。同时,对Pb 暴露大鼠每天经口灌胃ACNs 可以显著降低血清中BUN 和CRE 的含量,有效抑制了Pb 对肾脏组织的损伤。
IBR 是一种可通过简单计算将不同层面的多种生物标志物整合为单个指标的综合分析方法。通过综合分析,IBR 可反映从细胞到个体的状况,并通过简单的多元图形(星状图)实现各种生物标记物变化的可视化分析[23]。本文选取了肝脏和肾脏中与氧化应激相关的3 个生物标志物(SOD、GSH-Px 和MDA)进行IBR 分析。经铅暴露后,IBR 值明显高于空白组的IBR 值,而经花色苷干预 后,IBR 值 均 小 于Pb 暴 露 组 的IBR 值,且 随ACNs 补充剂量的增加而降低,表明花色苷对铅暴露引起机体肝脏和肾脏的氧化损伤具有良好的改善能力。
花色苷拮抗铅诱导的肝脏损伤在已有的研究中也多有体现,与本文的结果一致,如Chen 等[24]用桑葚花色苷粗提物干预铅诱导的小鼠,发现桑葚花色苷粗提物可显著降低肝脏和肾脏中的铅含量。蔺怀等[25]在探讨矢车菊素-3-葡萄糖苷对铅致大鼠肝肾损伤的保护作用中发现,矢车菊素-3-O-葡萄糖苷对铅诱导的血清损伤和形态学损伤具有较好的改善作用。综上,ACNs对由铅暴露致机体肝脏和肾脏的损伤(血生化指标和形态学分析结果)具有一定的改善作用,可能通过以下两种途径:①直接拮抗重金属,对重金属进行促排、迁移及螯合等作用,并通过本身的抗氧化等活性减少重金属对机体的损伤;②发挥抗氧化活性,减少由于Pb在机体内累积引起的ROS积累,并激活相关的抗氧化酶,平衡氧化应激系统。
