槲蕨孢子育苗关键技术研究
2022-05-28刘燕琴唐祥友刘正宇杨美森
刘燕琴,曹 敏,唐祥友,刘正宇,张 军*,杨美森
(1.重庆市药物种植研究所,重庆408435;2.特色生物资源研究与利用川渝共建重点实验室,重庆408435;3.秀山土家族苗族自治县农委,重庆409900)
骨碎补始栽于《开宝本草》,后收入《本草纲目》;《中国药典》2020 版槲蕨[Drynaria fortune(Kunze)J.sm],也是《中国植物志》记载槲蕨[Drynaria roosii],干燥根状茎入药,柚皮苷(C27H32O14)≥0.50%为质量控制;性苦、温;归肝、肾经。功效:疗伤止痛,补肾强骨;外用消风祛斑;用于跌扑闪挫,筋骨折伤,肾虚腰痛,筋骨痿软,耳鸣耳聋,牙齿松动;外治斑秃,白癜风[1-2]。现代医学研究证明中药骨碎补在抗炎症、预防和治疗骨质疏松、促进骨折愈合方面疗效显著[3-4]。因野生资源采集、破坏严重,其资源日益下降,已于2002 年建议列入珍稀植物三级保护[5],发展人工种植成为必然趋势,而当前育苗技术不成熟,急需开展相关技术研究[6]。
骨碎补资源稀少,块茎繁殖数量受限;孢子数量大,自然条件下成苗率低[7-8](因为槲蕨孢子萌发到形成孢子苗,经过萌发-原叶体生长-原叶体成熟受精-孢子苗长出-块茎长出等复杂过程,且条件不可控)。而当前孢子人工育苗缺乏相关技术,孢子萌发基质、原叶体受精条件等成为孢子育苗的关键,故开展此研究。
1 材料与方法
1.1 试验材料
于2021 年3 月(孢子成熟期)采集重庆市药物种植研究所及酉阳木叶乡槲蕨孢子叶(经重庆市药物种植研究所刘正宇老师鉴定)。
1.2 试验方法
1.2.1 孢子保存方法
于孢子成熟期,采集孢子叶(孢子黄色),置于通风、透气的室内,防止霉变。方法Ⅰ:在通风阴凉处晾15~20 d,用牛皮纸包好,置于4℃冰箱保存;方法Ⅱ,在通风阴凉地放置30 d 左右,叶片表面风干、孢子有自然散落时,软毛刷刷下孢子,装入信封,置于4℃冰箱保存。
1.2.2 孢子萌发
1.2.2.1 培养条件
光照1 000~2 000 Lx,8~10 h/d;温度25±2℃,空气湿度80%左右。
1.2.2.2 基质配方及处理
基质种类:“A1 细河沙”(过3 号筛),“A2 中河沙”(过1 号筛),“A3 粗河沙”(粒径0.5~1 mm);“B1细蛭石”(过3 号筛),“B2 中蛭石”(过1 号筛),“B3粗蛭石”(粒径0.5~1 mm);“C1 紫色细壤土”(过3号筛),“C2 紫色中壤土”(过1 号筛),“C3 紫色粗壤土”(粒径0.5~1 mm);“D1 黄色细壤土”(过3 号筛),“D2黄色中壤土”(过1号筛),“D3黄色粗壤土”(粒径0.5~1 mm);“E1 细腐殖土”(过3 号筛),“E2中腐殖土”(过1 号筛),“E3 粗腐殖土”(粒径0.5~1 mm)。每个处理设置重复3个。
基质处理方法:方法1,用无纺布包好,间歇高温灭菌法(121℃),消毒1 h-冷却-消毒1 h-冷却-再消毒1 h;方法2,采用0.1%~0.2%的高锰酸钾溶液进行土壤消毒,拌匀后塑料袋密封放置1~2 d。
1.2.2.3 播种方法
在培养盘中铺上3~5 cm 厚的基质;把孢子用细纱布包好置于“50%多菌灵可湿性粉剂500 倍溶液+ 恶霉灵30%水剂2 000~3 000 倍液”浸泡震荡30 min后捞出,清水冲洗干净风干;然后将4.0 mg孢子配成500 mL 孢子悬浮液喷洒播种(8 dm2),控制密度;盖上透明塑料盖子保湿。
日常管理,每隔5~7 d,喷湿表面。
1.2.2.4 萌发率统计方法
在显微镜下观察:1 mg 槲蕨孢子粉(含孢子囊壳及无法分离的杂物),孢子数量统计约1 600个。
萌发率(%)=萌发孢子数/孢子数×100
1.2.3 原叶体受精期管理
孢子萌发后生长40 d 左右,原叶体逐步进入成熟期,促进原叶体受精形成孢子苗尤为重要,开展原叶体营养、湿度管理,以1/2MS、1/4MS、1/8MS 营养液、清水定期喷施(每个处理设置重复3个),管理60 d 时,统计孢子苗数量,筛选出提高原叶体受精的方法。
其他条件及光照、温度条件同1.2.2.1。
1.3 数据分析
各组数据采用SPSS 19.0 软件进行分析,结果以x±s 表示,多组间比较采用One‑way ANOVA,以P<0.05表示显著性差异。
2 结果与分析
2.1 不同基质孢子的萌发情况
从表1试验结果看出,不同基质孢子直播,其萌发率有显著差异,其中以“E1 细腐殖土”、“E2 中腐殖土”萌发率高;其次为A1、A2 河沙组,随后以C1、C2和D1的萌发率较高。
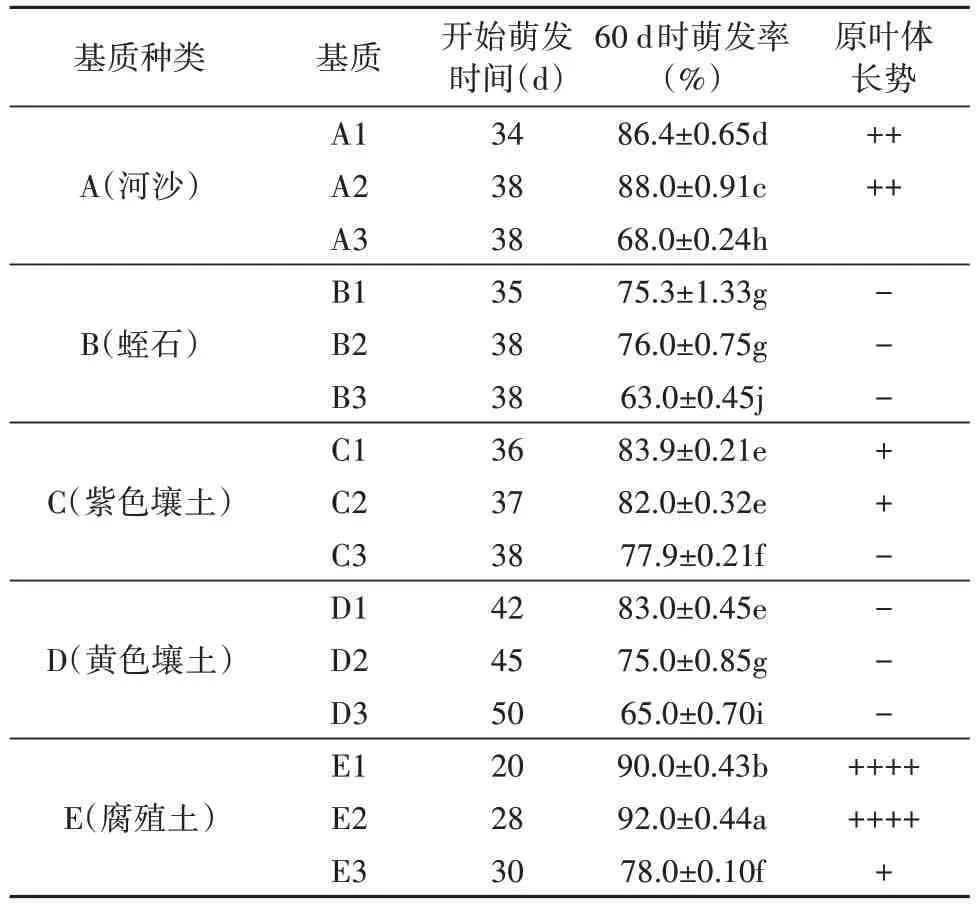
表1 不同基质对槲蕨(骨碎补)孢子萌发的影响Tab. 1 The effects of different substrates on the spore germination of Drynaria fortune
原叶体长势比较:E1、E2 长势好,然后是A1、A2,其次C1、C2、E3。其他组萌发后生长势较差。
综上研究可以发现,骨碎补(槲蕨)孢子萌发以“细腐殖土”(过3 号筛)、“中腐殖土”(过1 号筛)、“细河沙”(过3 号筛)、中河沙(过1 号筛)、紫色细壤土(过3 号筛)、紫色中壤土(过1 号筛)为基质,孢子萌发率高,原叶体长势好。
2.2 不同管理下原叶体生长情况及受精形成孢子苗情况

图1 孢子萌发过程Fig.1 Spore germination process
孢子萌发形成原叶体,每1 dm2约400 个原叶体。均在4 dm2的原叶体分布面积上,进行湿度和营养管理,统计不同处理下每1 dm2孢子苗(原叶体受精长出)数量、原叶体受精率。
从表2可以看出,湿度对槲蕨原叶体生长、受精、孢子苗成苗率有明显的影响。环境湿度小,不利于原叶体生长和受精;环境湿度保持在90%左右,原叶体受精率升高(≥17.5%),孢子苗的数量增加。

表2 不同处理的原叶体受精率及孢子苗数量Tab. 2 The fertilization rate and the number of spore seedlings in different treatments
同时研究发现,喷施营养液对原叶体生长有好处,原叶体叶色浓绿,而清水组的原叶体生长瘦弱;在原叶体受精率方面,喷施不同浓度MS 营养液组比清水组的高,其中以1/4MS 营养液、间隔3 d 喷1次的综合效果最好。这可能与1/4MS营养液的施用能促进原叶体的发育和生长需求有关。

图2 原叶体受精及孢子苗生长Fig.2 Prothallus fertilization and sporulation growth
3 结论与讨论
本研究发现,槲蕨孢子直播育苗与常规种子育苗有差异,其萌发基质、原叶体生长及受精微环境等直接影响孢子苗数量。
槲蕨孢子在多种基质上均可萌发,其中以细腐殖土、中号腐殖土效果最好;而在原叶体生长成熟期,加强湿度和营养管理,可促进受精,提高原叶体受精率,从而增加孢子苗数量。
3.1 直播基质对萌发的影响
槲蕨(骨碎补)孢子囊群细小,直径约0.5~1.0 mm,孢子囊大小约为0.01 mm,正常孢子囊含有十几个孢子;而孢子萌发需要一定条件,除温度、湿度、光照条件外,基质对萌发微环境起到一定调控作用。
现有文献发现,基质对槲蕨的孢子萌发有较大影响,如刘保东[9]研究发现采用水培法和土培法槲蕨孢子能萌发;张银丽[10]研究发现,槲蕨无菌萌发以低无机盐的培养基萌发时间短,但高无机盐培养基有利于配子体发育;在槲蕨小苗移栽技术研究中发现,草炭土:素沙=1:1 基质中的小苗植株生长发育最快,有利于槲蕨小苗生长[11]。不同基质对孢子萌发的微条件供给有差异,如湿度、营养、透气性、pH 等均有一定差异,这可能导致孢子萌发、后期原叶体生长有差异。
本研究发现,骨碎补孢子萌发以“细腐殖土”(过3 号筛)、“中腐殖土”(过1 号筛)、“细河沙”(过3号筛)、“中河沙”(过1 号筛)、“紫色细壤土”(过3 号筛)为基质,孢子萌发率高,原叶体长势好。
3.2 槲蕨(骨碎补)原叶体受精的影响因素
刘保东[9]研究发现,增加环境湿度和人工干预原叶体受精,可以提高受精率即增加孢子苗数量。有关槲蕨原叶体受精相关报道较少,而在其他蕨类植物有少量研究,如边珂研究发现不同N含量的MS培养基,对蕨菜孢子萌发后的原叶体受精有一定的影响,合适浓度的N含量能促进原叶体生长和受精[12]。该研究还发现,采用1/4MS营养液定期喷施,槲蕨原叶体生长良好,同时也能促进受精,增加孢子苗数量。
因此,采用合适萌发基质并在原叶体生长期加强营养管理可提高原叶体受精率,从而提高孢子萌发的成苗率,将为槲蕨(骨碎补)的人工质 苗及种植发展提供支持。
