胺碘酮对房颤大鼠的药效与肝脏伴随毒副作用研究
2022-05-28戴雨晨沈月红徐一娇
戴雨晨,沈月红,桑 明,徐一娇,秦 瑜,曹 鹏,2*,周 谦*
(1.南京中医药大学附属中西医结合医院,江苏南京210028;2.南京中医药大学药学院,江苏南京210023)
房颤是一种在老年人群中常见的心律失常[1]。研究显示房颤会导致中风、心力衰竭[2]、心肌梗死等严重并发症[3]。近年来,房颤的全球流行率和治疗成本激增[4],在中国,35 岁及以上的居民中有526 万人患有房颤。其患病率与高龄、心肌梗死、左心室肥大(LVH)、肥胖和饮酒等有关[5]。作为经典的III类抗心律失常药物,胺碘酮具有延长动作电位持续时间和复极时间、维持窦性心律、延长有效不应期、减慢传导速度、消除折返激动等作用,是有效的房颤治疗药物[6]。然而,长期临床实践表明胺碘酮代谢缓慢、心外毒性高、易与华法林等药物相互作用[7]、易导致肝硬化[8]、肺纤维化[9]和甲状腺功能障碍[10]等。因此,胺碘酮在临床上的应用是一把“双刃剑”,近三分之一的患者由于严重的不良反应无法维持长期治疗[11-12]。
Ammi visnaga是原产于北非、亚洲和欧洲地中海地区的一年生或两年生伞形花序植物,在很久之前就被用于亚洲和中东的民族医学制剂,如今被广泛种植以获得提取物或活性成分[13]。呋喃并色酮(Khellin)是从Ammi visnaga的果实中分离的含有苯并呋喃部分的化合物[14-15]。Anrep 最初发现Khellin对狗的冠状动脉具有选择性扩张作用,临床研究表明Khellin 能够明显缓解心绞痛患者疼痛症状,之后Labze 实验室在Khellin 结构基础上增加了苯呋喃基团合成了Khellin 衍生物-乙胺碘呋酮,简称胺碘酮(图1)[16-18]。胺碘酮的毒副作用可能与胺碘酮的结构有关[19]。胺碘酮结构中亲脂性的一端易集中在脂肪含量高的器官中,导致肝脏、肺和脂肪等组织广泛的脂质沉积等超微结构变化[20]。此外,由于胺碘酮分子富含碘且结构与甲状腺素相似,会干扰甲状腺素的合成及释放,导致游离三碘甲状腺原氨酸(FT3)和游离四碘甲状腺原氨酸(FT4)降低,促进肝硬化的形成[21-22]。Li-Qin Jiang 等在探讨胺碘酮和决奈达隆单独或与肝保护剂多烯磷脂酰胆碱联合使用对甲状腺功能和脂质代谢的影响时发现胺碘酮易引起血脂异常和甲状腺功能不全,增加胆固醇(TC)、低密度脂蛋白受体(LDL-C)等的水平[23]。Kannan R 等发现胺碘酮会导致健康新西兰兔血清TG 和TC 含量升高,指出胺碘酮可能会对血脂产生不利影响[24]。Amira Motawea 等发现胺碘酮治疗组大鼠的脂质谱中TG 含量高于对照组[25]。Philippe Lettéron 等指出小鼠单剂量服用胺碘酮(1 mmoL/Kg)后可显著抑制脂肪酸氧化,导致脂肪变性[26]。临床研究直接指出,胺碘酮会导致房颤患者血清胆固醇升高[27]、剂量依赖性增加TC[28]等。
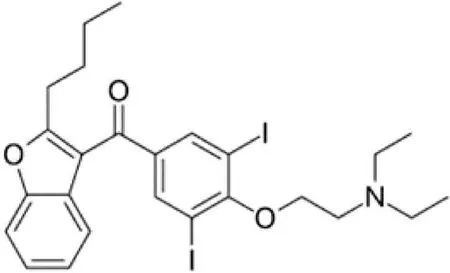
图1 胺碘酮的化学结构Fig.1 The chemical structure of amiodarone
固醇调节元件结合蛋白2(SREBP2)的上调可以驱动HMGCR 的转录和胆固醇生物合成,促进胆固醇积累[29]。SREBPs 裂解激活蛋白(SCAP)和胰岛素诱导基因蛋白(INSIGs),包括INSIG1 和INSIG2,对SREBPs从内质网(ER)到高尔基体的运输至关重要[30]。INSIGs 通过结合HMGCR 和SCAP,以固醇依赖的方式调节胆固醇稳态[31-32],当INSIGs 与SCAPSREBPs复合物结合,SREBPs从ER到高尔基体的运输被阻断,脂质合成降低[33]。同时,胆固醇稳态由SREBP 途径控制,当胆固醇水平下降时,SCAP 和INSIG 分离,SREBP2-SCAP 复合物转运至高尔基体,SREBP2 水解形成游离形式转运至细胞核激活胆固醇合成和摄取[34]。Allen LB 等在探究胺碘酮对培养的神经元和非神经元细胞以及服用胺碘酮的个体胆固醇代谢的影响时发现,胺碘酮以剂量依赖性方式抑制24-脱氢胆固醇还原酶(DHCR24)增加胆固醇前体[35]。但是胺碘酮是如何影响胆固醇合成,是否与HMGCR、INSIG1、SCAP 和SREBP2 的基因和蛋白表达相关尚无报道。
目前,关于胺碘酮对血脂和肝脏毒性影响的机制尚不明确,本研究试图通过给予房颤大鼠胺碘酮灌胃治疗,探讨其治疗房颤的药效、对血脂和肝脏毒性的影响以及影响胆固醇合成的可能机制。
1 仪器与试剂
1.1 试验药材与试剂
胺碘酮(纯度≥98%,批号HY-14188,MCE 公司);乙酰胆碱(纯度≥98%,批号A6625,SIGMA 公司);氯化钙(批号10043-52-4,西陇科学股份有限公 司);Trizol Reagent(批 号15596018,Ambion 公司);RIPA 裂解液(批号P0013C,Beyotime 公司);多聚甲醛(纯度≥95%,批号20161012,上海凌峰化学试剂有限公司);Western 一抗稀释液(批号P0023A,Beyotime 公司);INSIG1、HMGCR、SCAP、SREBP2 抗体(批号A16278、A19063、A18401、A13049,Abclonal公司);大鼠AST、ALT、TC、TG ELISA 试剂盒(批号AE4091、AE4102、AE4104、AE4105,南京善本生物科技有限公司);LDL-C 试剂盒(批号A113-1-1,南京建成生物工程研究所);HiScript III RT SuperMix for qPCR(+gDNA wiper)试剂盒、ChamQ Universal SYBR qPCR Master Mix 试 剂 盒(批 号R323-01、Q711-02,南京诺唯赞生物科技股份有限公司);IN‑SIG1、HMGCR、SCAP、SREBP2、GAPDH 引物(南京金斯瑞生物科技股份有限公司)。
1.2 试验仪器
十二导自动分析心电图机(FX-7402,北京福田电子医疗仪器有限公司);Vevo 3100 高分辨动物超声影像系统(加拿大VisualSonics公司);Multiskan全波长酶标仪(美国Thermo Scientific 公司);Eppendorf小型台式高速冷冻离心机(5417R,德国Eppendorf公司);Western blot 电泳仪(Mini Protean 3 Cell,BIO‑RAD);转膜仪(Trans-Blot Turbo全能型蛋白转印系统,BIORAD);Odyssey 近红外双色激光成像系统(美国LICOR 公司);Applied Biosystems VeritiPro PCR 仪(美国Applied Biosystems 公司);ABI 7500 Real-Time PCR system PCR 仪(美国Applied Biosys‑tems公司)。
1.3 试验动物
雄性SD 大鼠,8周龄,体质量(200±20 g),适应性喂养7 d,购于上海西普尔-必凯实验动物有限公司,生产批号SCXK(沪)2013-0016。实验动物饲养于江苏省中医药研究院实验动物中心,饲养温度为23℃~25℃,湿度40%~70%。实验过程符合《江苏省实验动物管理条例》等实验动物道德伦理的相关规定,动物实验伦理审查表编号:AEWC-20210716-159。
2 方法
2.1 造模、分组与给药
健康雄性SD 大鼠18 只,随机分为对照组(n=5),模型组(n= 6)和胺碘酮组(n= 7)。采用Ach(33 μg/mL)-CaCl2(5 mg/mL)混合溶液(0.1 mL/100 g,新鲜配置)尾静脉注射的方法制备大鼠房颤模型[36-39]。模型组大鼠尾静脉注射造模药物,隔天注射1 次,共注射10 次。胺碘酮组大鼠隔天注射造模药物,并在第7 天起每日口服50 mg/kg 胺碘酮[36,40]。对照组大鼠给予同体积的生理盐水。
2.2 大鼠心功能的检测
末次给药后24 h,采用吸入式麻醉的方法使大鼠吸入氧气和异氟烷混合气体并使其进入轻度昏迷状态,使用Vevo 3100 高分辨动物超声影像系统对大鼠进行超声心动图检查。测量LAD、LA Area、左心室收缩期前壁厚度(LVAW;s)、左心室舒张期前壁厚度(LVAW;d)、左心室收缩期后壁厚度(LVPW;s)和左心室舒张期后壁厚度(LVPW;d),计算射血分数(EF)和左心室短轴缩短率(FS)。
FS =(VLVd- VLVs)/VLVd×100%。 EF =(LVEDd -LVESd)/LVEDd×100%。
2.3 心电图数据收集
吸入式麻醉的方法使大鼠进入轻度昏迷状态,电子心电图机连接大鼠肢体导联,尾静脉注射Ach-CaCl2溶液或生理盐水,同时记录心电图,给药后恢复窦性心律时停止记录。记录房颤诱发时间和持续时间,计算RR间期。
2.4 大鼠体质量及肝系数的测定
隔天对大鼠的体质量进行称量并记录。末次给药后24 h 眶静脉取血,处死大鼠剖取肝脏,拍照观察肝组织外观形态并称量质量,计算肝脏系数。肝系数=(肝脏质量/体质量)×100%。
2.5 大鼠肝脏组织病理学形态观察
4%多聚甲醛固定肝脏组织,经梯度脱水、浸蜡包埋、切片贴片、常规脱蜡、二甲苯透明后,再经梯度乙醇脱水,中性树胶封片后在光学显微镜下进行肝脏组织形态学观察。H&E 染色观察肝细胞形态变化;Masson染色和Sirius Red染色检测肝脏中胶原纤维,并使用ImageJ 1.53a 进行定量评分。
2.6 大鼠血清生化指标检测
离心30 min(2000 rpm)分离血清,ELISA法测定AST、ALT、TG、TC和LDL-C水平。
2.7 qRT-PCR 检测大鼠肝脏组织中INSIG1、HMGCR、SCAP、SREBP2 等胆固醇合成相关基因的表达
取肝脏组织适量,加入Trizol 1 mL进行研磨,提取上层RNA 溶解物后测浓度。提取总RNA 进行逆转录,反应条件是37℃反转录15 min,85℃5 s 合成cDNA。设定PCR 反应条件为95℃预变性2 min;95℃15 s;57℃20 s;72℃30 s;60℃15 s。平均相对含量采用2-ΔΔCt公式,以GAPDH 为内参,计算mRNA的相对表达量。PCR引物序列设计见表1。
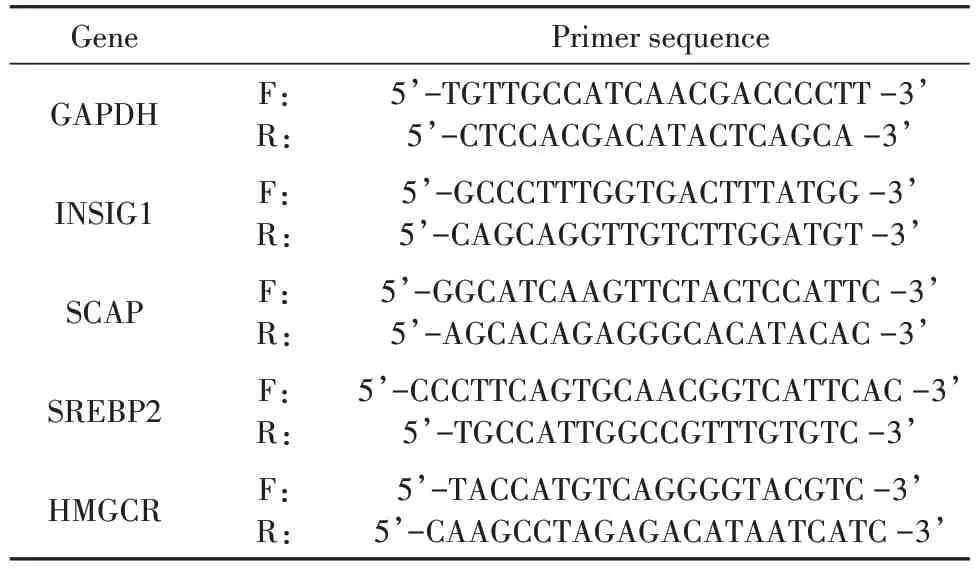
表1 用于实时定量PCR 检测的引物序列Tab.1 Primer sequences for Real-time quantitative PCR assay
2.8 Western blot 检测大鼠肝脏组织中INSIG1、HMGCR、SCAP、SREBP2 等胆固醇合成相关蛋白的表达
各组大鼠取肝脏组织,剪碎并按质量与体积比1:9 比例加入RIPA 裂解液,匀浆后12000 rpm 30 min 取上清,采用BCA 定量法将蛋白调整到统一浓度,加入上样缓冲液混匀,100℃条件下煮样8 min后进行电泳。电泳结束后冰浴环境将蛋白转至PVDF膜上,脱脂牛奶室温封闭1 h,4℃孵育一抗(INSIG1、HMGCR、SCAP、SREBP2)过夜,后用TBST清洗3次,室温孵育二抗2 h,TBST 清洗后用Odyssey 近红外双色激光成像系统显影,ImageJ 1.53a 分析蛋白条带强度。
2.9 统计学方法
Graphpad Prism 8.0 统计软件进行数据处理,数据以均数±标准差(±s)表示,两组间比较采用独立样本资料t 检验;多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
3 试验结果
3.1 胺碘酮对房颤大鼠心脏结构和功能影响
与对照组相比,模型组大鼠LAD 显著增加(P<0.01),LA Area 显著增加(P<0.05)(图2),LVPW;d显著减小(P< 0.05)。较模型组,胺碘酮组LAD 缩短约13.1%(P< 0.01),LA Area 缩小约22.7%(P<0.01),表明胺碘酮改善了房颤大鼠的心房扩大现象。值得注意的是,胺碘酮同时延缓了AF 大鼠的心功能下降趋势(表2)。LVAW、s 和LVAW、d 和LVPW、s 在各组中没有统计学差异,详细超声数据见表2。
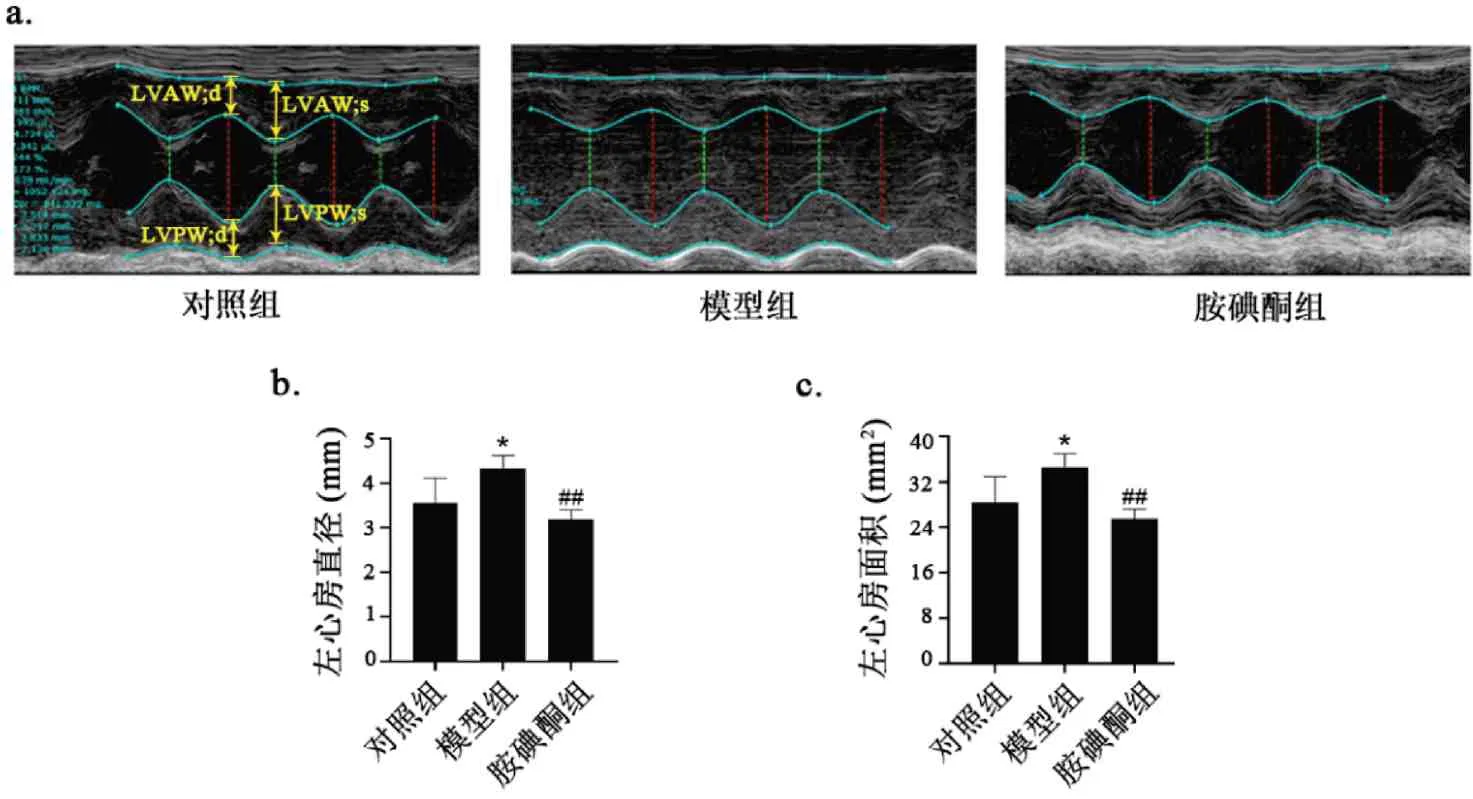
图2 胺碘酮改善AF大鼠心脏形态和功能Fig.2 Amiodarone improved cardiac morphology and function in AF rats注:与对照组相比,*P<0.05;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
表2 房颤大鼠的超声心动图参数Tab.2 Echocardiographic parameters of atrial fibrillation rats(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)
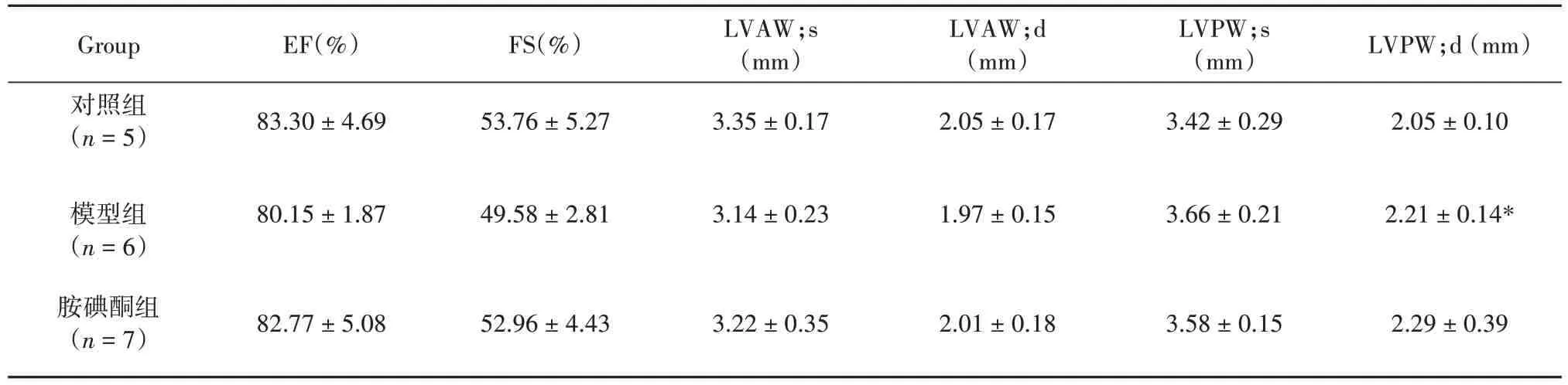
表2 房颤大鼠的超声心动图参数Tab.2 Echocardiographic parameters of atrial fibrillation rats(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)
注:与对照组相比,*P<0.05。
Group对照组(n=5)EF(%)FS(%)LVAW;s(mm)3.35±0.17 LVAW;d(mm)2.05±0.17 LVPW;s(mm)3.42±0.29 LVPW;d(mm)83.30±4.69 53.76±5.27模型组(n=6)胺碘酮组(n=7)80.15±1.87 49.58±2.81 2.05±0.10 3.14±0.23 82.77±5.08 52.96±4.43 1.97±0.15 3.66±0.21 2.21±0.14*3.22±0.35 2.01±0.18 3.58±0.15 2.29±0.39
3.2 胺碘酮对房颤大鼠心电活动的影响
房颤发生时,心电图特征包括p波消失、出现一系列不规则f 波、心室律绝对不规则(R-R 间期不等)[24]等。模型组和胺碘酮组大鼠尾静脉给予Ach-CaCl2混合液,对照组大鼠尾静脉给予生理盐水,给药同时监测心电图。可知生理盐水不对大鼠心电图造成影响(图3a);Ach-CaCl2导致大鼠心电图p 波消失,代之以波形较小且不规则的基线波动,形态与振幅均变化不定的f 波(房颤波),R-R 间期不等,表现出了典型的房颤的心电图,之后恢复窦律(图3a)。较模型组,胺碘酮组的房颤诱发时间延缓了72.6%(图3b,P< 0.01),房颤持续时间缩短了37.3%(图3c,P< 0.01),RR 间期趋于相等(图3a)。以上结果提示,胺碘酮能够显著抑制由Ach-CaCl2诱发的大鼠房颤。
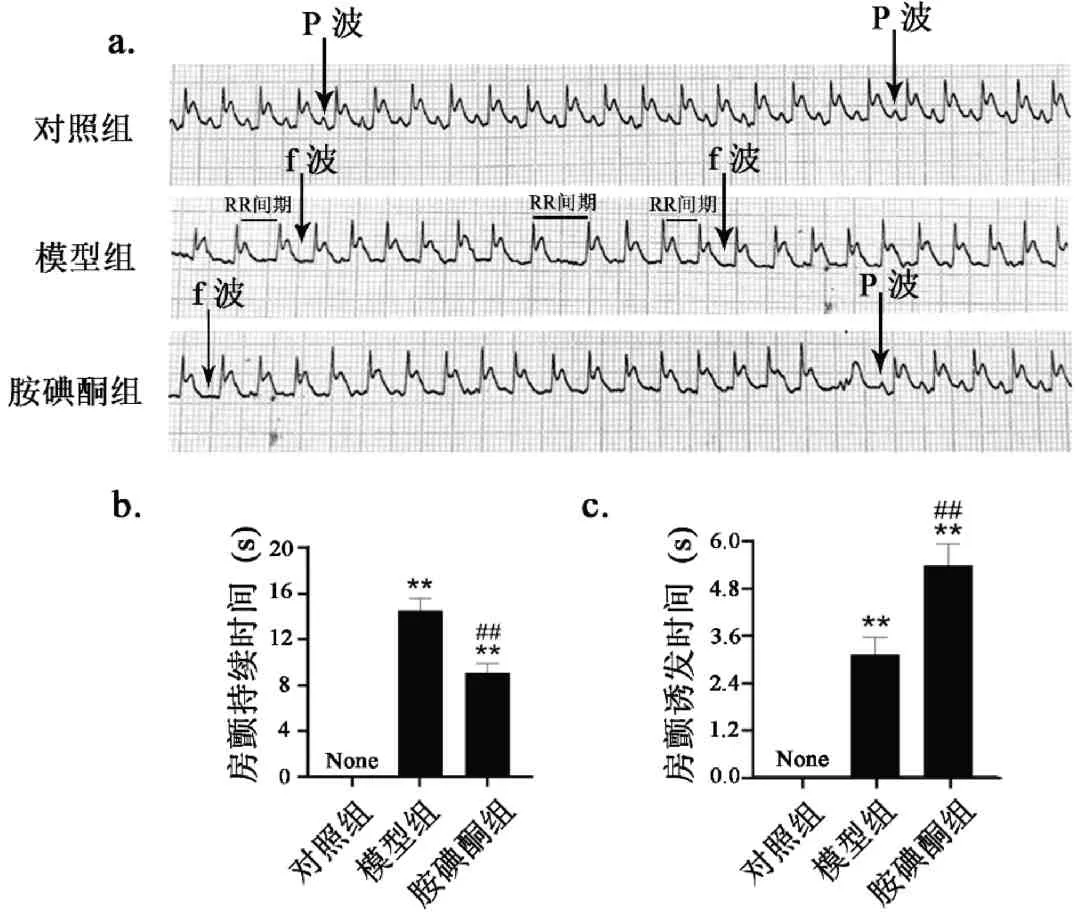
图3 胺碘酮对AF大鼠心电图的影响Fig.3 The effect of amiodarone on the electrocardiogram in AF rats注:与对照组相比,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.3 胺碘酮对房颤大鼠体质量和肝系数的影响
图4a 所示,实验大鼠肝脏组织颜色红润,质地较软,表面光滑,边缘整齐且厚薄一致。与对照组相比,模型组大鼠肝脏呈现弥漫性肿大,表面尚光滑,颜色和质地无明显变化;胺碘酮组大鼠肝脏虽然颜色、质地等无明显变化,但相比对照组和模型组大鼠肝脏表现出了不同程度的肿大现象。各组大鼠在给药期体重间无明显差异(图4b,P>0.05)。图4c 显示,与对照组相比,模型组大鼠肝系数增加了7.36%(P<0.01)。与模型组相比,胺碘酮组大鼠肝脏系数进一步上升了约9.18%(P<0.01),提示胺碘酮可能导致了肝脏组织扩大现象。
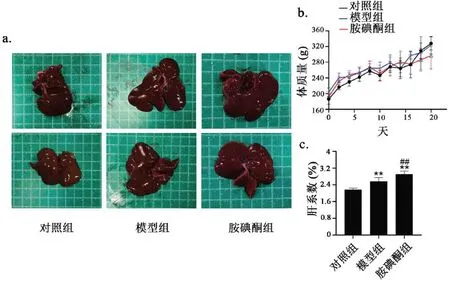
图4 胺碘酮增加AF大鼠的肝系数Fig.4 Amiodarone increased liver coefficient in AF rats注:与对照组相比,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.4 胺碘酮对房颤大鼠肝组织病理学变化的影响
H&E 染色结果显示,对照组肝细胞形态正常,结构完整,肝细胞围绕中央静脉呈放射状整齐排列,胞质均匀,肝细胞无脂肪变性、坏死;与对照组相比,模型组可见肝脏呈弥漫样的脂肪变性,肝小叶结构破坏并肿大,肝小叶及汇管区内有大量炎性细胞浸润;与模型组相比,胺碘酮组上述形态学变化更加明显(图5a)。Masson 染色结果显示模型组肝脏组织存在明显的胶原纤维自汇管区周围向外延伸,纤维条索较粗且染色着色较深,肝组织间质纤维化明显(图5a-b,P< 0.01);与模型组相比,胺碘酮组间质纤维化比例进一步加重(图5a-b,P<0.01)。Sirius Red 染色结果显示模型组大鼠肝结缔组织、肌束和血管膜中出现I 型及III 型胶原纤维沉积(图5a 和5c,P<0.01);与模型组相比,胺碘酮组大鼠结缔组织、肌束和血管膜中I 型及III 型胶原纤维沉积比例加重(图5a和5c,P<0.01)。
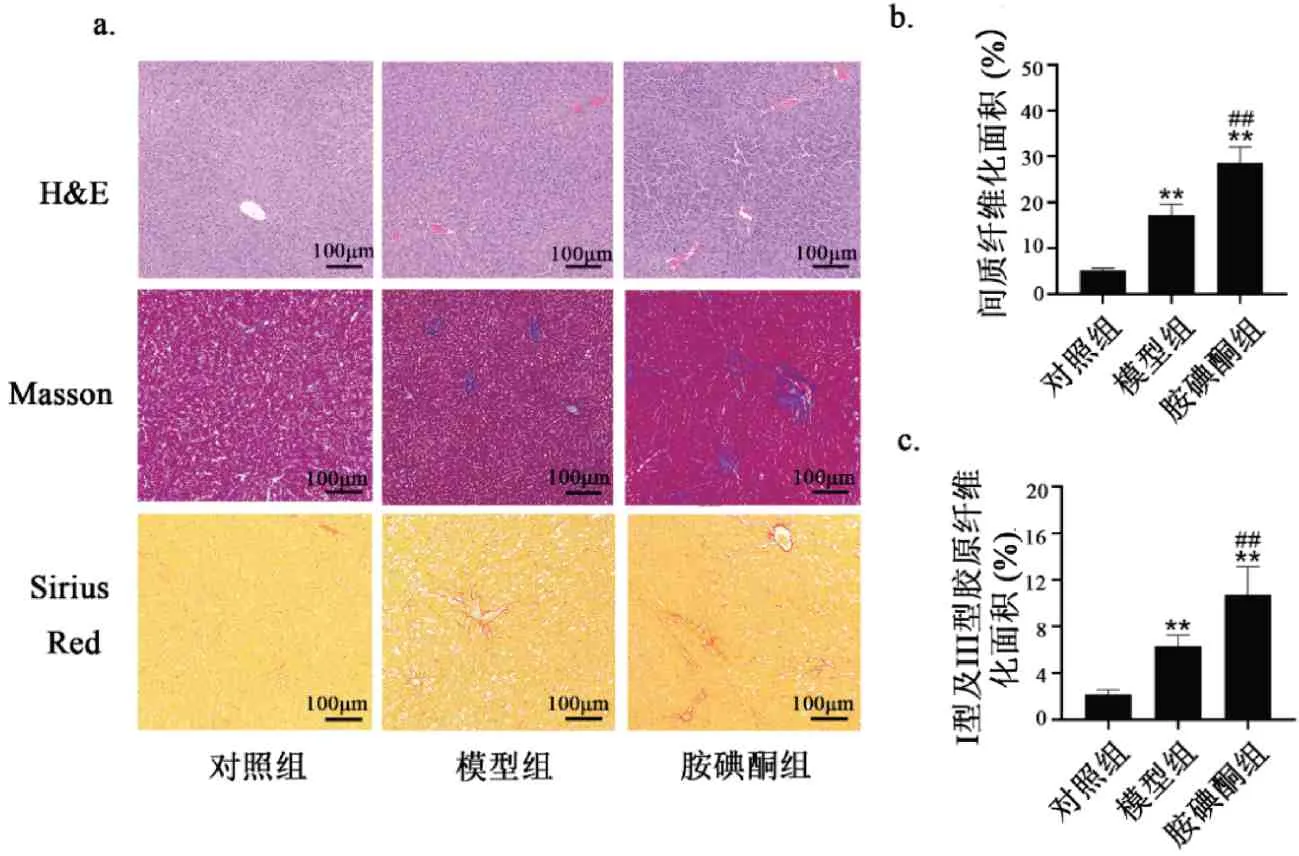
图5 胺碘酮致AF大鼠肝组织病理学改变Fig.5 Amiodarone caused histopathological changes in liver tissue in AF rats注:与对照组相比,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.5 胺碘酮对房颤大鼠血清AST 和ALT 水平的影响
如图6a 所示,与对照组比较,模型组血清AST轻微升高(P< 0.05),胺碘酮组血清AST 显著上调(P<0.01);与模型组比较,胺碘酮组血清AST 进一步上升5.2%(P<0.01)。图6b所示,与对照组比较,模型组血清ALT 水平有升高趋势,胺碘酮组血清ALT水平明显升高(P<0.05)。
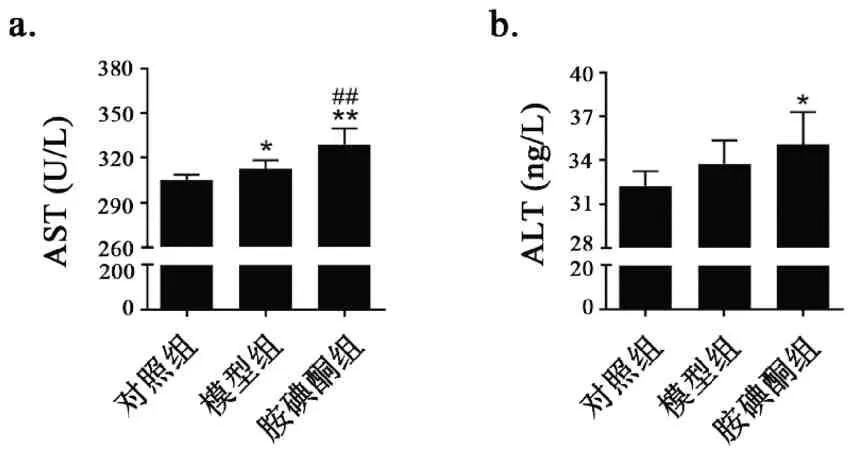
图6 胺碘酮增加AF大鼠血清AST和ALT Fig.6 Amiodarone increased serum AST and ALT in AF rats注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.6 胺碘酮对房颤大鼠血清TG、TC 和LDL-C 含量的影响
与对照组相比,模型组血清TG 有升高趋势,胺碘酮组TG 水平显著上调(图7a,P<0.01)。相比较模型组,胺碘酮组大鼠血清TG 进一步升高约29.0%(图7a,P<0.05)。与对照组相比,模型组大鼠血清TC 和LDL-C 水平显著上调(图7b-c,P<0.01)。相比较模型组,胺碘酮组大鼠血清TC水平进一步上升约31.91%(图7b,P< 0.01),LDL-C 水平进一步升高7.8%(图7c,P<0.05)。
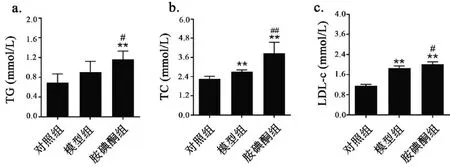
图7 胺碘酮增加AF大鼠血清TG、TC 和LDL-C Fig.7 Amiodarone increased serum TG,TC and LDL-C in AF rats注:与对照组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.7 胺碘酮对房颤大鼠肝组织INSIG1、SCAP、SREBP2、HMGCR mRNA表达的影响
如图8所示,与对照组相比,模型组大鼠肝组织INSIG1 mRNA 表达水平降低(图8a,P< 0.01),SCAP、SREBP2、HMGCR mRNA 表达水平显著升高(图8b-d,P< 0.01),其中INSIG1 含量降低约20%(图8a,P< 0.01),SCAP、SREBP2、HMGCR 含量分别上调50%,31%和160%(图8b-d,P< 0.01)。与模型组比较,胺碘酮组大鼠肝脏的SCAP 的mRNA含量约为模型组的2 倍(图8b,P< 0.01),SREBP2为模型组的1.7倍(图8c,P<0.01),HMGCR 为模型组的1.5倍(图8d,P<0.01),INSIG1为模型组的0.6倍(图8a,P<0.01)。
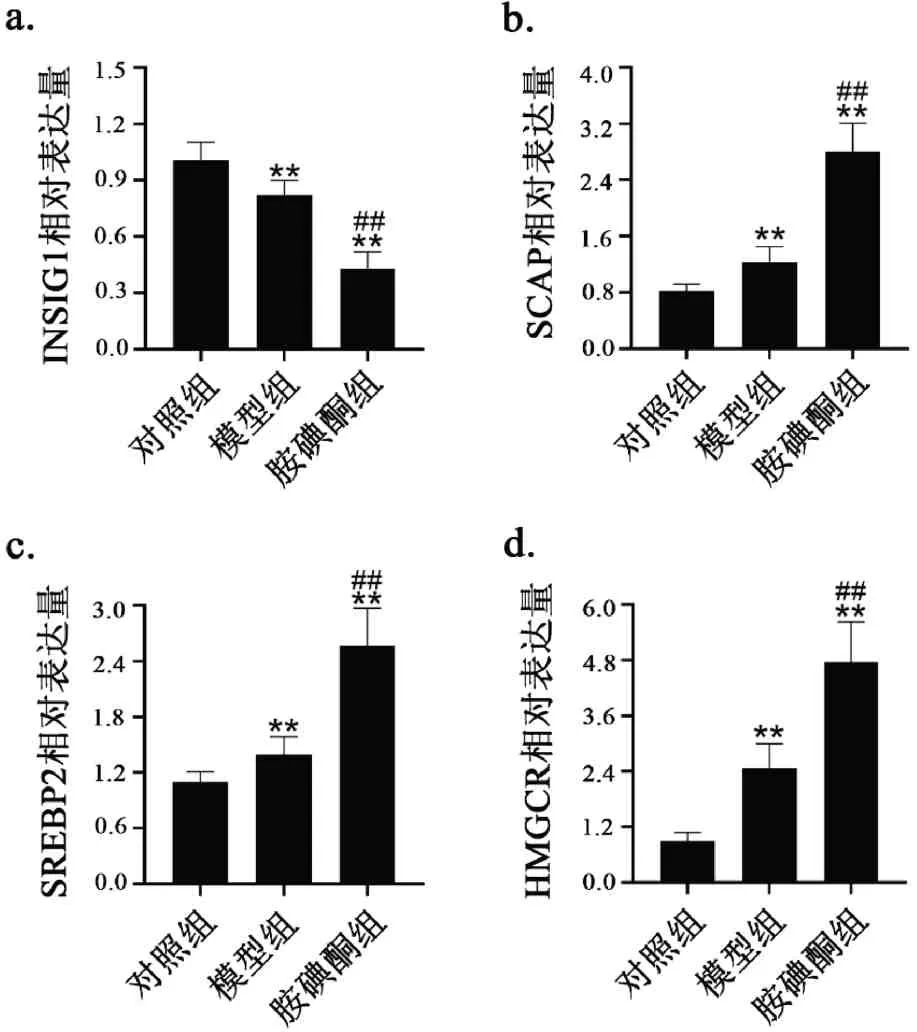
图8 胺碘酮上调AF大鼠SCAP、SREBP2、HMGCR mRNA表达,下调INSIG1 mRNA表达Fig.8 Amiodarone up-regulated the expression of SCAP,SREBP2,HMGCR mRNA and down-regulated the expression of INSIG1mRNA in AF rats注:与对照组相比,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
3.8 胺碘酮对房颤大鼠肝组织INSIG1、SCAP、SREBP2、HMGCR蛋白表达的影响
图9a 为每组随机选取2 只大鼠肝脏组织经Western 印 迹 检 测INSIG1、SCAP、SREBP2 和HMGCR蛋白表达水平代表图。与qRT-PCR结果相一致,与对照组相比,模型组大鼠肝脏内SCAP、SREBP2 和HMGCR 的蛋白相对表达量增加(图9ab,P< 0.01),INSIG1 的蛋白表达量降低(图9a-b,P<0.01);相较于模型组,胺碘酮组的SCAP 的表达量约为模型组的1.6 倍(图9a-b,P<0.01),SREBP2的表达量约为模型组的1.3 倍(图9a-b,P< 0.01),HMGCR 的表达量约为模型组的1.2 倍(图9a-b,P< 0.01),INSIG 的表达量约为模型组的7/10(图9a-b,P< 0.01)。提示,胺碘酮可能通过促进胆固醇合成路径导致肝脏毒性和血脂异常。
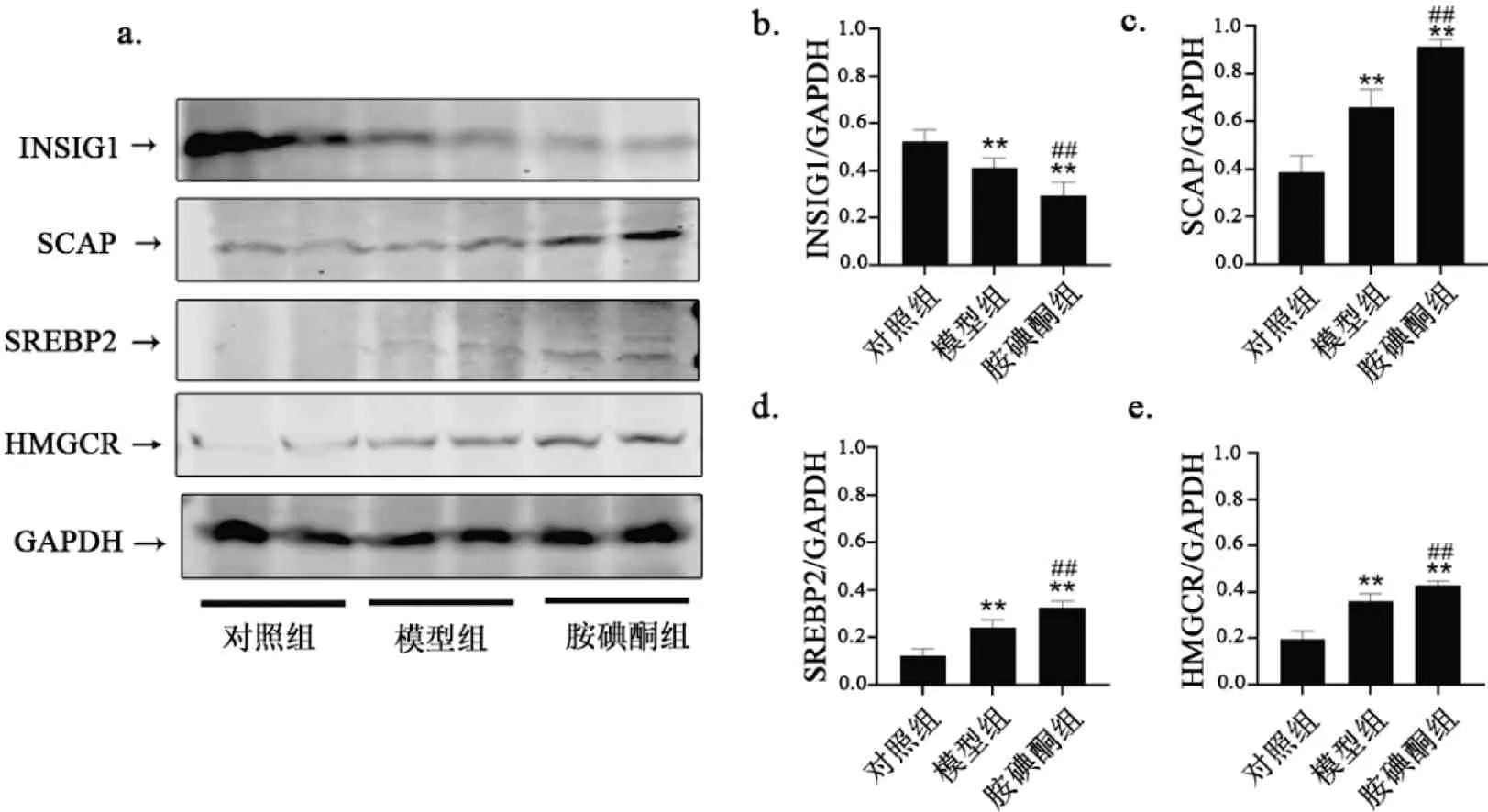
图9 胺碘酮上调AF大鼠SCAP、SREBP2、HMGCR蛋白表达,下调INSIG1蛋白表达Fig.9 Amiodarone up-regulated SCAP,SREBP2,HMGCR protein expression and down-regulated INSIG1 protein expression in AF rats注:与对照组相比,**P<0.01;与模型组相比,##P<0.01(±s,n(Control)=5,n(Model)=6,n(Amiodarone)=7)。
4 讨论
Ammi visnaga是一种来自地中海伞形科的草本植物,是血管扩张剂呋喃色酮的宝贵来源,传统上用于治疗心绞痛和作为镇痉剂[41]。从Ammi visnaga中提取出有效活性成分Khellin和Visnagin具有抗炎和镇痛特性[42-43]。现代医学常使用这些活性物质或结构衍生物治疗白癜风、支气管哮喘和肾绞痛等[43]。Duarte J 等发现Visnagin 可以通过多种机制抑制大鼠胸主动脉环收缩反应[44]。Fu HR 等首次在大鼠模型研究中指出Visnagin 可能通过诱导自噬和减少细胞凋亡对缺血/再灌注损伤后的大鼠心脏具有潜在保护作用[45]。Abukhalil MH 等发现Visnagin可以通过减轻氧化应激和炎症以及上调Nrf2 信号预防异丙肾上腺素诱导的大鼠心肌受损[46]。Anrep等发现Khellin 具有扩张冠状动脉的作用,同时相比硝酸酯具有更好的选择性,不会引起全身血管扩张和降低血压。胺碘酮源于Ammi visnaga提取物Khe‑lin[16-18]。
房颤是临床上最常见的心律失常,房颤的发生风险随年龄增长及潜在基础病的存在和严重程度而增加,男性患病率高于女性,容易导致中风、外周栓塞和死亡等[47-48]。当前,Ach-CaCl2诱导的阵发性大鼠房颤模型是近年来广泛应用的实验方法[36-39]。其中,Ach 可以作用于心房肌胆碱能M2 受体,激活受体依赖的钾通道引起钾离子外流增加,导致心房肌细胞复极加快,动作电位时程及有效不应期缩短[36]。氯化钙溶液会引起心房肌细胞钙超载,钙离子通道改变诱导心房电重构,促进房颤的发生[49]。我们通过使用Ach-CaCl2混合液诱导房颤大鼠模型,采用心电图检测,发现大鼠出现心电图p 波消失,代之以波形较小且不规则的基线波动,形态与振幅均变化不定的f 波(房颤波),心室律绝对不规则,表现出典型的房颤的心电图,表明Ach-CaCl2混合液触发了大鼠心房电重构。应用超声心动图观察,发现Ach-CaCl2导致大鼠左心房出现扩大现象,提示Ach-CaCl2混合液介导了大鼠心房结构重构。以此,我们证明了房颤模型复制成功。
胺碘酮是临床房颤治疗应用最广的复律药物,同时具有I 类和III 类抗心律失常药物的特性,可以通过降低心房肌细胞传导速度和延长动作电位时程抑制折返还路,恢复或维持房颤电复律后窦性心律[50]。采用胺碘酮维持窦律一年有效率达67.5-70.8%[51]。我们的研究表明,与模型组相比,胺碘酮组大鼠房颤持续时间显著减小、房颤诱发时间显著延长,左心房内径和面积扩大现象被有力地抑制。我们首先从实验的角度复制了胺碘酮对房颤的治疗作用。
尽管胺碘酮治疗房颤药效显著,但是其带来的毒副作用不可忽视。研究表明,使用胺碘酮的患者中高达15%存在不良反应,包括胃肠出血、肝脏毒性、甲状腺功能减退和视力改变等[52],其中脂代谢紊乱是最常见的一种[53]。我们的研究指出房颤大鼠血清TC、LDL-C 增加,而胺碘酮组大鼠血清TG、TC 和LDL-C 进一步升高,加重了房颤大鼠血脂异常。Michelle M. Angrish 等指出脂肪变性可发展为脂肪性肝炎和不可逆的肝病阶段,包括肝纤维化等[54]。我们发现,胺碘酮导致房颤大鼠血清AST 和ALT升高、肝脏肿大且肝系数增加,肝脏组织细胞形态破坏,且存在肝细胞坏死现象,胶原纤维沉积加重,表明胺碘酮导致了房颤大鼠肝脏强烈的副作用。
INSIG 是近年来发现的调控脂肪代谢的新基因,其中INSIG1 在肝脏高表达[55],且受SREBP 正调控[56]。SREBP2 可以促进胆固醇摄入和合成,在控制胆固醇和脂肪酸合成相关基因的转录中起着核心作用。SCAP 是处于ER 的一种膜蛋白,SCAPSREBP2-HMGCoA 通路对胆固醇摄入与合成的平衡起关键作用。当细胞内胆固醇浓度降低时,SCAP从ER 运载SREBP2 到高尔基体,随后SREBP2 被蛋白酶S1P 和S2P 水解,释放出具有活性的N 末端转录因子片断[57-58],进入细胞核与靶基因启动子上的固醇调节元件SRE-1 结合,激活靶基因(包括HMG‑CoA 还原酶等)的转录[33,59-60]。当细胞内胆固醇水平升高时,SCAP-SREBP2 复合物滞留在ER,LDLr/HMGCoA 还原酶基因的转录停止[54,56]。本研究证实胺碘酮通过下调INSIG1基因和蛋白表达水平,上调SREBP2、SCAP 和HMGCR 基因和蛋白表达水平从而导致体内血脂异常。
胺碘酮是临床常用药物,治疗房颤药效确切,但会导致严重的肝毒性和血脂异常。因此,胺碘酮的安全性分析需得到更多关注。本研究初步证明胺碘酮可能通过影响胆固醇合成路径,包括影响IN‑SIG1、SCAP、SREBP2 和HMGCR 的基因和蛋白表达引起血脂异常。本研究初步探讨胺碘酮治疗房颤时的肝脏副作用及可能机制,可为临床合理应用胺碘酮并降低其不良反应提供理论依据和诊疗思路。
