热电池正极材料的探索
2022-05-28孙杨张书弟杨少华赵彦龙白银祥占先知
孙杨,张书弟,杨少华,赵彦龙,白银祥,占先知
(1.沈阳理工大学 环境与化学工程学院,辽宁 沈阳 110168;2.辽宁省特种储备电源专业技术创新中心,辽宁 沈阳 110168;3.北方特种能源集团 西安北方庆华机电有限公司,陕西 西安 710025)
热电池是用电池本身的加热系统把不导电的固体状态盐类电解质加热熔融呈离子型导体而进入工作状态的一种热激活储备电池[1]。其具有贮存时间长(10~25年)、激活迅速可靠(0.2~2.0 s)、使用环境温度广(-50~100 ℃)、比能量与比功率高等优点,被广泛用于引信电源、火警电源、航天航空应急电源等[2-5],在特种化学电源行业中拥有战略性地位。热电池的大功率放电、高比能量、高比功率、使用环境温度宽、储存时间长、激活迅速可靠、结构紧凑等一些特点,使其成为现代武器非常理想的电源,在军用电源中的地位显著[6]。根据负极材料的不同,热电池可以分为镁系热电池、钙系热电池和锂系热电池,而锂系热电池为现在最常使用的热电池。热电池主要由基片、正极片、负极片、电解质(或者隔膜)、加热系统和保温材料所组成。而良好的电极材料对热电池的电化学性能和放电性能影响至关重要。理想的电极材料应该具备如下特点:较高的工作电压,良好的热稳定性,较大的容量,导电性好,价格低廉[7]。本中心研究了金属硫化物、氧化物、氯化物和氟化物作为热电池的正极材料的电化学性能和放电性能。本文介绍了以上部分热电池正极材料的研究进展。
1 热电池正极材料
作为热电池的正极材料要具有比较高的电位;相对稳定的放电平台;热稳定性能良好,以尽量避免影响热电池的放电性能;不与电解质发生反应;具有较高的理论容量;为环境友好型材料。
1.1 硫化物正极材料
目前,热电池常用的硫化物正极材料是FeS2和CoS2。FeS2存在内阻大、热稳定性低等缺点,阻碍了热电池性能的提升[8]。CoS2比FeS2具有更好的电化学性能,但CoS2只能通过人工合成且价格较高。由于铁的资源相对丰富,可以通过在FeS2中掺杂Co来提高其电导率,增大比容量,由此进行了铁钴双金属二硫化物(Fe1-xCoxS2)的研究。分别采用水热法和高温固相法合成了不同铁钴比例的Fe1-xCoxS2正极材料,通过XRD、SEM、粒度分布分析以及差热分析等手段对合成的Fe1-xCoxS2材料进行表征,研究了钴的摩尔含量对合成的Fe1-xCoxS2性能影响。
1.1.1 合成FeS2正极材料
通过水热法合成FeS2正极材料,并对其进行掺杂改性,得到性能优异的正极材料,产率高;另外,制备了FeS2薄膜电极,并通过特殊方法对薄膜电极进行处理,消除放电过程产生的电压尖峰,制备工艺简单,处理量大。合成的FeS2的SEM 如图1所示。
从图1看出,FeS2形貌为不规则的块状,颗粒大小不同,粒径尺寸在10~150 μm 之间,颗粒分布较均匀,团聚程度较低。以FeS2为正极材料,10个单体电池组成成品电池,放电效果较好。激活时间为0.28 s,峰值电压为20.5 V,单体电池电压达2.05 V,截止电压15 V 时放电时间为64.9 s,基本达到消除电压尖峰的目的。

图1 FeS2材料的SEM 图
1.1.2 合成CoS2正极材料
通过溶液法合成CoS2正极材料,并对其进行掺杂改性研究,同时制备了CoS2薄膜电极,通过特殊方法对薄膜电极进行处理,消除放电过程产生的电压尖峰。合成的CoS2的SEM 如图2。

图2 CoS2材料的SEM 图
由图2可以看出,CoS2由空心微球组成,微球的球形规则,直径达2~5 μm,同时呈现出一定的团聚现象,球壳由尺寸更小的纳米级颗粒组成。以CoS2为正极材料,8 个单体串联,最高放电电压为15.29 V,截止到最高电压的70%(10 V)时,激活时间为0.63 s,工作时间为94 s。单体电池电压为1.91 V,已消除尖峰。
1.1.3 水热法合成Fe1-xCoxS2
采用水热法合成了Fe1-xCoxS2,改变钴的摩尔含量,分别令x=0.1、0.15、0.2 和0.4,制备出4 种不同铁钴比例的双金属二硫化物。以铁钴双金属二硫化物为正极组装的单体热电池以100 mA·cm-2的电流密度放电,曲线如图3。
从图3可以看出,双金属二硫化物正极材料在放电过程中存在两个放电平台。由于热电池的放电时间一般较短,所以只需要考虑第一个发挥作用的平台的放电性能。当x=0.15 时,Fe1-xCoxS2单体电池第一个放电平台最高,初始放电电压可达1.820 7 V,电压截至1.5 V 时放电比容量为283.0 mAh·g-1。而x=0.1、0.2、0.4 时,截止电压为1.5 V 时Fe1-xCoxS2的比容量分别为204.6 mAh·g-1、252.8 mAh·g-1和197.9 mAh·g-1。因此当x=0.15 时,Fe1-xCoxS2正极材料的放电性能明显优于其余三组单体电池,具有最佳的放电性能。

图3 水热法制备Fe1-xCoxS2单体电池100 mA·cm-2放电曲线
1.1.4 固相法合成Fe1-xCoxS2
采用高温固相法制备Fe1-xCoxS2正极材料。通过改变钴的摩尔含量,分别令x=0.1、0.15、0.2 和0.4,制备4 种不同铁钴比例的双金属二硫化物。以100 mA·cm-2的电流密度放电曲线如图4。
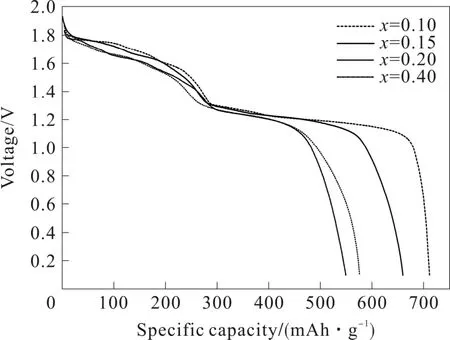
图4 固相法制备Fe1-xCoxS2单体电池100 mA·cm-2放电曲线
由图4可以看出,x=0.1 和x=0.15 时,两个单体电池的第一个放电平台相差不大,但明显高于其余两者;电压截止到1.5V 时具有较大的比容量,同时放电时间也都较长。x=0.1、0.15、0.2 和0.4 时,Fe1-xCoxS2正极材料组装的单体电池第一放电平台电压分别为1.809 3 V、1.806 5 V、1.789 1 V 和1.787 6 V;电压截止到1.5 V 时,单体电池放电比容量分别为249.2 mAh·g-1、236.9 mAh·g-1、213.4 mAh·g-1和221.7 mAh·g-1。由此可以得出,x=0.1 和x=0.15时,Fe1-xCoxS2单体电池具有较好的放电性能且两者性能相差不大。
1.2 氧化物正极材料
1.2.1 钒酸铜正极材料
对钒酸铜的制备及其性能进行了研究,分别采用溶胶凝胶法、沉淀法与水热法制备了钒酸铜,通过控制不同的合成条件,如温度、时间和pH 值等以得到最优的钒酸铜正极材料[9]。采用粉末压片工艺制成单体电池,讨论电解质、导电剂、测试温度等条件对单体电池放电性能的影响。
采用沉淀法合成钒酸铜正极材料,通过改变pH值、煅烧时间、煅烧温度来确定最佳合成条件,在合成的原料中调节测试温度、放电电流密度等条件来探究各个条件对放电性能的影响。实验表明:(1)pH 的调节对粒度有影响,随着pH 的增大,钒酸铜的粒度逐渐增大,钒酸铜粒度分布范围也逐渐增大,pH=7 时,合成的钒酸铜的颗粒尺寸最小,中粒径可达0.567 μm。(2) 高温煅烧几小时后合成的原料成不规则的枝状,颗粒表面光滑且分布较均匀。(3)对于LiSi/LiPO3-Li2SO4-LiCO3-LiF/Cu3V2O8单体电池,电解质加入的质量分数为25%时,单体电池具有最优放电性能,在520 ℃下以100 mA·cm-2电流密度放电,初始电压达2.732 2 V,电压截至2.0 V 时比容量为194.9 mAh·g-1。
采用水热法合成钒酸铜正极材料,研究了合成过程中各个因素及单体电池组装时各个因素对其性能的影响。(1) 原料在高压反应釜中反应温度与时间对其性能有影响。在180 ℃下的合成条件最优,放电时具有最高的放电平台和最大比容量。此条件下合成的原料呈不规则的块状,颗粒表面光滑且分布较均匀。(2) 电解质添加过少或过多都会使得初始放电电压较低,比容量也随之减小,经过放电性能分析,电解质添加量为25%时放电性能较优。(3)比较不同金属导电剂的放电曲线图可知,导电剂为Ag 粉时放电性能优于Cu 粉与不加导电剂的单体电池,以100 mA·cm-2电流密度放电时,截止电压为2.0 V 时放电比容量为212 mAh·g-1。(4) 在一定的温度测试范围内,随着温度升高,初始放电电压与比容量随之增大。
最后研究了电解质、导电剂等因素对正极放电性能的影响。(1) 电解质的加入可以提高单体电池的放电性能,25%质量分数的加入量最优。以100 mA·cm-2在520 ℃放电时,初始电压可达2.802 3 V,截止电压2.0 V 时的比容量为153.5 mAh·g-1。(2) 在单体电池中分别加入Cu 粉、Ag 粉与不加入导电剂进行对比测试,结果表明,加入导电剂Ag 粉的性能更优。(3) 其他影响因素如不同放电电流密度的影响,测试条件不变,初始电压与比容量随着放电电流密度增加而变小。
通过实验对比发现:沉淀法合成的颗粒最细,纯度较高;以100 mA·cm-2电流密度放电时,溶胶凝胶法的放电性能最优,截至2.0 V 的比容量可达212 mAh·g-1;而水热法合成周期较长,性能差于前2 种合成方法。
1.2.2 钒酸铜掺杂改性正极材料
针对高电位热电池技术领域,研究了与高电位钒酸铜正极材料相匹配的兼容导电剂银包铜粉,将其掺杂在钒酸铜材料中进行电化学性能测试,提高钒酸铜材料的电子导电性[10]。研究不同包覆量银包铜粉对材料性能的影响,并将其与银粉、铜粉进行性能比较如图5。

图5 钒酸铜不同包覆量银包铜100 mA·cm-2放电性能曲线
由图5可知,不同包覆量的银包铜粉掺杂在钒酸铜中的放电起始电压分别为2.648 5V、2.663 8V、2.733 8 V、2.718 3 V、截止电压为2.0 V 时,比容量分别为146 mAh·g-1、140.1 mAh·g-1、231.6 mAh·g-1、249.8 mAh·g-1,经分析可能是包覆量低时,铜表面银包覆不完全,导致银包铜粉导电性下降。包覆量为20%和30%的银包铜粉起始放电电压相差不大,但截至电压为 2.5 V 时的比容量分别为 71.3 mAh·g-1、56.8 mAh·g-1,因此,包覆量为20%银包铜粉掺杂在钒酸铜中性能稍占优势。而钒酸铜掺杂银粉与银包铜粉放电曲线相似,性能相差不大,银包铜粉完全可以作为导电剂掺杂在钒酸铜体系中进行电化学性能测试。
1.3 氯化物正极材料
NiCl2材料具有输出功率大、电极电位正、放电平台平稳等特点,热稳定性好等特点。但NiCl2正极材料也有激活时闻长,放电电压有起伏,材料制备工艺复杂等问题[11-14]。本中心对NiCl2粉体材料的导电剂进行了研究,其中非金属导电剂以导电炭黑装配的单体电池放电性能较好,金属导电剂添加镍粉时单体电池放电性能最优,在金属和非金属混合导电剂中以导电炭黑与镍粉混合导电剂的放电性能较好。组装的单体电池起始放电电压为2.53 V,放电平台也很稳定,放电电压截止到2.0 V 时放电时间约为11 min,比容量达到215.7 mAh·g-1。在单体性能测试中,研究电解质、负极对单体电化学性能的影响,结果表明电解质采用三元全锂电解质、负极采用LiB 合金的单体电池电化学性能优于电解质采用二元电解质、三元低温电解质以及负极采用LiSi的单体电池电化学性能。
通过丝网印刷制备了NiCl2薄膜电极并对其进行改性研究。对不同种类和不同含量的粘结剂做了对比实验,组装成单体电池后以100 mA·cm-2的电流密度放电,由结果可以看出,MgO 粘结剂的添加量为10%时单体电池的放电性能最好,初始放电电压为2.391 2 V,放电平台电压较高并且稳定,截止电压2.0 V 时的放电比容量为104.2 mAh·g-1。MgO 做的NiCl2薄膜正极放电性能比较稳定,而且放电比容量高,初始放电电压平台较粘结剂为白炭黑的NiCl2薄膜正极高。但就粘结性看来白炭黑效果更好,白炭黑确实对电解质起到稳定作用但白炭黑含量不宜过高,如果过高将导致激活时间长,电阻增大,导致放电性能减弱,放电时间变短,放电比容量低[15-17]。
1.4 氟化物正极材料
NiF2作为过渡金属氟化物之一,具有2.96 V 的高理论电势和554 mAh·g-1的高比容量。另外,它是最早被研究为可充电电池中一种正极材料的金属氟化物之一[18]。电子导电性差将导致较低的可逆容量,循环过程中的大体积膨胀将粉碎电极,并导致大容量损失以及能量密度降低。相比之下,应用于一次电池时,这些缺点的困扰较小,因为不需要循环可逆性和效率[19-20]。对NiF2的导电剂的种类及不同配比进行了研究,目前的导电剂中以石墨烯与金属镍粉的一定比例混合烧制出的NiF2正极材料放电性能较佳。以三元全锂为电解质的放电性能相对较好。不同温度下的以NiF2为正极组装的单体电池的放电性能曲线如图6。
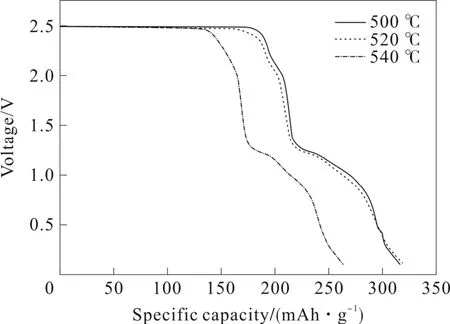
图6 不同温度NiF2单体电池100 mA·cm-2放电性能曲线
由图6可以看出,在500 ℃、520 ℃和540 ℃下的放电起始电压差别不大,其中以500 ℃下的放电性能最佳,起始电压达2.51 V,放电平台最长且稳定,放电电压截止到2.0 V(80%)时,放电时间为19 min,比容量达208 mAh·g-1。以NiF2为正极材料装配成样品热电池时,以100 mA·cm-2电流密度放电时,截止电压为18 V(80%)时,激活时间仅为0.24 s,氟化镍作为热电池正极材料具有更短的激活时间,更加满足热电池快速激活的要求。
2 结 论
对热电池正极材料的研究主要包括FeS2、CoS2以及铁钴双金属二硫化物等硫化物,钒酸铜正极材料具有高电位、大电流放电的优势,研究了钒酸铜材料的放电性能以及对钒酸铜的掺杂改性和不同导电剂的混合配比。并且对金属氯化物,如NiCl2正极材料的不同金属导电剂和非金属导电剂进行了对比研究,并且采用了不同的制备工艺制备单体电池,如粉末压片工艺和薄膜制备工艺。对于薄膜电极的制备,另考虑了不同粘结剂对薄膜电极单体电池放电性能的影响。最后研究了NiF2粉末压片技术制备的单体电池的放电性能,较之NiCl2正极材料装配的成品电池具有激活时间短,放电起始电压高且放电平台长,电压降缓慢,制备工艺简单等特点。
