马铃薯早疫病拮抗细菌WK-1的筛选鉴定及其生物学特性分析
2022-05-28王怡凡朱其立李延锋朱建强
王怡凡,刘 巍,朱其立,孙 敏,李延锋,朱建强
(1.长江大学农学院,湖北 荆州 434025;2.中化农业(临沂)研发中心有限公司,山东 临沂 276000)
【研究意义】马铃薯(SolanumtuberosumL.)是广泛消费的蔬菜之一,具有价格低、营养价值高等特点[1]。但是,马铃薯的生长发育过程极易受到病原微生物的侵染,加之不合理的种植管理模式以及自然环境恶化等因素的影响,其产量和品质受到严重损失。马铃薯早疫病(Potato early blight)是为真菌性病害,其病原菌为茄链格孢菌(Alternariasolani)。此病害在我国马铃薯主要种植区普遍发生,已成为我国限制马铃薯产业发展的重要因素之一[2]。【前人研究进展】针对马铃薯早疫病害的防治,常采用化学防治的方法,其作用效果显著。但长时间使用化学药剂极易导致病原菌的抗药性提高,防治效果愈加不理想[3-5],对食品安全和生态环境等造成严重威胁。在可持续农业系统中,施用微生物防治植物病害是与环境兼容性好、成本效益高以及对靶标病原菌专一性强的防治方法。其中,芽孢杆菌具有定殖迅速、抗逆性强等特点,已被广泛应用于农业植物病害的防治中[6]。李双东等[7]分离获得的枯草芽孢杆菌(Bacillussubtilis)EB-28对马铃薯晚疫病的生防效果可达74%以上。黄保全等[8]制成的枯草芽孢杆菌可湿性粉剂,对马铃薯晚疫病的防效可达80.59%。何建清等[9]研究表明拮抗菌株10-4的发酵原液对番茄早疫病的防效率可达77.2%。Aldiba等[10]研究结果表明,苏云芽孢杆菌和木霉复配可在一定程度上降低茄链格孢菌对马铃薯植株的侵害。此外,芽孢杆菌可改变植物根系微生物群落结构,从而增加植物根系周围有益微生物多样性,并抑制病原菌的定殖[6]。娄义等[11]研究发现,番茄植株接种芽孢杆菌后,植株根系土壤的微生物区系结构会发生变化,具体表现为有益细菌的种群数量增加,病原真菌的种群数量明显减少。【本研究切入点】现阶段,关于芽孢杆菌防治马铃薯早疫病害的研究报道还不多见,且芽孢杆菌添加后对马铃薯植株根系土壤微生物群落结构是否具有影响尚不清楚。【拟解决的关键问题】本研究以马铃薯早疫病的致病菌茄镰格孢菌(A.solani)为靶标病原物,分离筛选出对该病原菌具有明显抑制效果和对此病害具有高效防治功能的菌株,并初步探究生防菌株处理后对马铃薯植株根区土壤微生物多样性的影响,为丰富防治马铃薯早疫病功能菌种资源和开发新的植保产品提供科学基础。
1 材料与方法
1.1 材料
1.1.1 供试土样 从山东省临沂市河东区梅埠街道马铃薯种植区采集,在马铃薯早疫病植株周围共采集土壤样品10份。每份样品重20 g,装入采集袋,并放置于4 ℃冰箱备用[12]。
1.1.2 供试病原菌 茄链格孢菌ZH-Z01(GenBank登录号:MW365320),由中化农业临沂研发中心分离保存。
1.1.3 供试竞品菌剂 马铃薯专用菌剂,活菌数为8亿/g。
1.1.4 供试马铃薯品种 荷兰15号。
1.1.5 所用培养基 马铃薯葡萄糖琼脂(Potato dextrose agar, PDA)培养基:马铃薯去皮200 g、葡萄糖20 g、琼脂粉18 g、蒸馏水1000 mL[13];LB(Luria-Bertani,LB)液体培养基:胰蛋白胨1%、酵母粉0.5%、NaCl 1%、蒸馏水1000 mL[14];LB固体培养基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、琼脂粉18 g、蒸馏水1000 mL[13];燕麦琼脂(Oatmeal agar, OMA)培养基:燕麦片3%、蒸馏水1000 mL 沸水浴1 h后过滤,滤液加入琼脂粉1.4%,加热溶化,定容至1000 mL[12];无机磷培养基(Pikovskays,PKO)参照王臻[15]。以上所配制的培养基均经121 ℃灭菌20 min后备用[16]。CAS(Chrome azurol sulphonate)检测液参考余贤美[17]。
1.2 马铃薯早疫病拮抗细菌的分离筛选
1.2.1 土壤菌群分离 分别称量10 g土样装于90 mL无菌水的三角瓶(250 mL)中,30 ℃、180 r/min振荡培养30 min后,将土壤悬浮液分别10倍梯度[18],各吸取100 μL均匀涂布在LB固体培养基上[19],置于28 ℃,培养24 h后,挑选形态、大小及颜色各不相同的单菌落进行纯化培养,并编号保存[20]。
1.2.2 拮抗细菌的筛选 马铃薯早疫病菌ZH-Z01经活化培养,用d=8 mm的无菌打孔器沿病原菌ZH-Z01菌落边缘获取菌饼[19],转接于PDA(d=90 mm)平皿中央,同时用灭菌牙签在菌饼四周等距点接经过纯化的供试菌株进行对峙培养,以只接种ZH-Z01的菌饼为对照(CK),每个处理均为3次重复。28 ℃恒温倒置培养,待CK长满整个平皿时,十字交叉法测定菌落直径的大小,分别计算抑菌率。初步筛选出具有拮抗效果的菌株,重复上述步骤,对其进行复筛[21],挑选出对病原菌ZH-Z01具有明显抑制作用的菌株,4 ℃保存备用。
抑菌率=(对照病原菌菌落直径-处理病原菌菌落直径)/对照病原菌菌落直径×100%[22]
1.3 拮抗细菌的分类鉴定
1.3.1 形态学特征观察 挑选所筛选的拮抗菌株的单菌落,接种于LB固体培养基上,28 ℃培养1 d,记录菌落形态特征,并在光学显微镜下镜检菌体的形态特征[23]。
1.3.2 生理生化特性测定 使用细菌生理生化鉴定管对供试菌株进行检测,并参考《伯杰氏细菌系统鉴定手册》[23-24]初步确定菌株的分类地位。
1.3.3 分子生物学鉴定 将拮抗菌株纯化培养后,挑取单个菌落转接至装有20 mL LB液体培养基中,37 ℃、170 r/min培养1 d[25]。16S rDNA序列扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)[26];gyrB基因片段扩增引物为gyrB-F(5′-ATTTGG CGCTGGCGGTTAT-3′)和gyrB-R(5′-GGTTTCGGCTGGGCTGGTA-3′)[27],对拮抗菌株WK-1的基因组DNA进行PCR扩增。16S rDNA的PCR 反应体系为(25 μL):2×PCR Mix 12.5 μL,PrimerA(27F)1 μL,Primer B(1492R)1 μL,模板DNA1 μL,dd H2O 9.5 μL;反应程序参考王惠等[28]。gyr-B的操作过程参考16S rDNA。扩增产物与DNA marker比对后,委托北京擎科生物科技有限公司青岛分公司完成基因测序。将所获得的序列传至NCBI网站中进行BLAST序列比对[27]。使用MEGA 7.0软件,采用邻位连接法(NJ)构建16S rDNA的系统发育进化树[29],采用最大似然法(ML)构建gyrB基因的系统发育进化树[30]。
1.4 拮抗菌剂对马铃薯块茎切片的防病效果
选取健康新鲜的马铃薯,用无菌手术刀切成长宽高各为2.0、1.5、0.5 cm的块茎切片,依次使用2% 次氯酸钠溶液表面消毒10 min,75%酒精消毒5 min,无菌水清洗数次,浸泡于供试菌剂发酵液中30 min后,取出切片,接种马铃薯早疫病菌饼,空白对照组CK只接种早疫菌饼,阴性对照为市场菌剂发酵液,放置在带有无菌滤纸的灭菌玻璃培养皿中,25 ℃,黑暗培养15 d,测定病斑面积,并记录供试菌剂对马铃薯块茎切片的影响,各处理均重复3次[29]。
块茎病情分级标准如下[30]。0 级:块茎上未出现菌丝体;1 级:块茎上出现菌丝体,组织未降解;2 级:菌丝体覆盖了块茎面积的一半,组织未降解;3 级:菌丝体覆盖了整个块茎,组织未或者轻微降解;4 级:菌丝体覆盖了整个块茎,组织严重降解。
病情指数[31]=[Σ(病级数×该病级的块数)/(调查总数×最高病级数)]×100
相对保护率[32]=[(对照病情指数-处理病情指数)/对照病情指数]× 100%
1.5 拮抗细菌抑菌谱的测定
采用平板对峙培养法[33]分别测定供试菌株对马铃薯黑痣病菌(Solanumtuberosum)、水稻纹枯病菌(Rhizoctoniasolani)、玉米大斑病菌(Xanthomonasoryzae)、小麦赤霉病菌(Fusariumgraminearum)、水稻恶苗病菌(Bakanaeoryzae)5种农业病原菌生长影响(方法同1.2.2),以评价供试生防菌株的抑菌广谱性[34]。
1.6 拮抗细菌生物学功能测定
1.6.1 产铁载体能力检测 将供试拮抗菌株点接于CAS平板上,置于28 ℃,培养3 d,观察拮抗菌株周围可否产生溶解圈[35],每个处理各重复3次,并利用菌落计数器对透明圈外内直径比(D/d)进行测定。
1.6.2 解无机磷能力检测 用灭菌牙签将供试菌株点接于PKO培养基中,28 ℃培养2 d后,观测拮抗菌株周围是否产生溶解圈[36],每个处理各重复3次,并利用菌落计数器对透明圈外内直径比(D/d)进行测定。
1.7 拮抗细菌的盆栽试验验证及对土壤微生物菌群的影响
用无菌打孔器沿活化培养的病原菌ZH-Z01边缘打取d=8 mm的菌饼,接种在OMA(d=90 mm)培养基上,25 ℃倒置培养5 d[37],用无菌水洗下孢子,并将浓度调整为2.0×104个/mL,得到孢子悬浮液,置于4 ℃保存备用[38]。拮抗菌剂WK-1为实验室自行发酵并干燥的固体菌粉,有效活菌数为1180亿/g。
供试土壤为山东省临沂市河东区梅埠街道马铃薯种植区地表土(≤10 cm),土壤常规五项指标为:碱解氮13.12 mg/kg、有效磷40.32 mg/kg、速效钾85.75 mg/kg、pH为6.7、有机质8.10 g/kg,121 ℃ 灭菌3 h。盆钵规格为:盆口d=30 cm、盆底d=20 cm、盆高h=20 cm,每盆1株,室温培养。盆栽试验共有3个处理,各处理均为5个重复,每重复均为5株马铃薯植株。以只接种ZH-Z01为空白对照CK,病原菌和市场菌剂处理为T1,病原菌和拮抗菌剂WK-1处理为T2。在马铃薯植株12~16叶期时,先接种ZH-Z01孢子悬浮液,用移液枪滴加在叶片背部,并用灭菌棉签均匀涂抹,用量为40 μL,每株分别滴加4片复叶。48 h后喷施市场菌剂及拮抗菌剂WK-1。接种3 d后开始进行病害跟踪观察,30 d后进行统计植株发病率、病情指数以及防效。病叶分级标准参考刘星辰[39]。
病情指数=[∑(病级叶数×该病级值)/(最高病级值×调查总叶数)]×100[40]
防效(%)=(对照病情指数-处理病情指数)/对照病情指数×100[41]
为了验证供试菌剂施用之后对土壤细菌多样性的影响,待马铃薯盆栽防效跟踪试验结束后,去除表层土,在盆栽土壤10 cm下范围内,采集根际土壤样品混匀,土壤样本过2 mm筛子后封存于无菌取样袋,并编号标记,置于冰盒中保鲜运送至实验室。-80 ℃超低温冰箱保存,用以检测微生物多样性。将所采集的样品送往生工生物工程(上海)股份有限公司,通过Illumina MiSeq测序技术检测土壤微生物群落组成,进行微生物丰富度和多样性分析[42]。
1.8 数据统计与分析
数据处理使用DPS 7.05软件,采用Duncan’s新复极差法比较各处理间的差异性,应用MEGA 7.0软件建立菌株系统发育树。
2 结果与分析
2.1 拮抗细菌的分离与筛选
经过分离与筛选,获得一株编号为WK-1的拮抗细菌,对靶标病原菌ZH-Z01的抑菌率达89%(图1)。
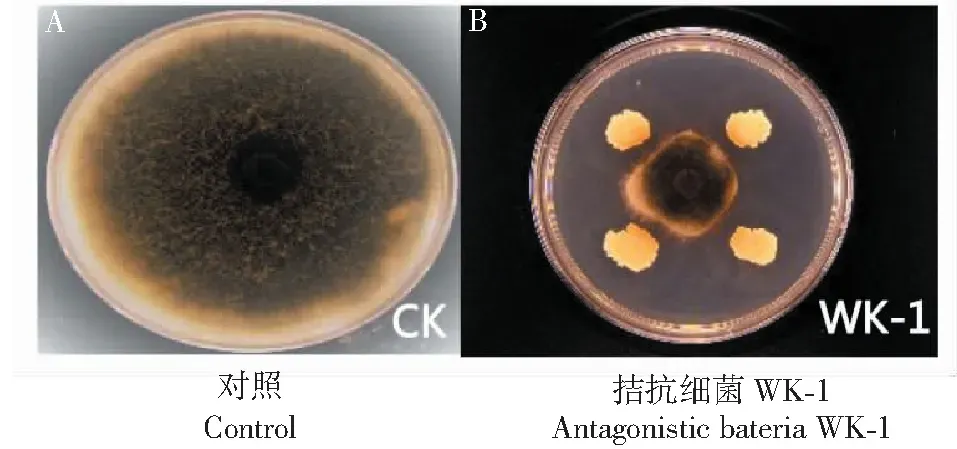
图1 拮抗细菌WK-1对病原菌平板抑菌测定
2.2 拮抗细菌WK-1鉴定
2.2.1 形态特征 将拮抗菌株WK-1接种于LB固体培养基上,30 ℃培养1 d后[43],菌落呈现微黄色(图2),表面湿润,不透明,镜检观察其菌体为杆状,两端钝圆,并且可产芽孢。
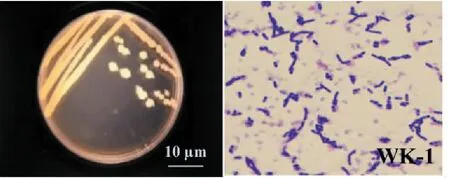
图2 拮抗细菌WK-1形态及菌体显微观察
2.2.2 生理生化特性分析 拮抗细菌WK-1菌株生理生化测定结果表明(表1),该菌株为革兰氏阳性菌,硫化氢、V-P及L-精氨酸双水解酶反应为阴性,能够利用葡萄糖、麦芽糖及乳糖等多种糖类,可还原硝酸盐及水解淀粉。该菌株的生理生化特征检测结果与卢志军等[44]描述的枯草芽孢杆菌B.subtilis特征基本一致。

表1 拮抗细菌WK-1的生理生化特性
2.2.3 分子生物学鉴定 将测序所获得的拮抗菌株WK-1的16S rDNA及gyrB基因片段序列上传至GenBank数据库中进行BLAST相似性比对分析,并用MEGA 7.0构建其系统发育树。拮抗菌株WK-1的16S rDNA基因片段序列长度为1050 bp(GenBank登录号:MW365324),gyrB基因片段序列长度为1042 bp(GenBank登录号:MW884256)。BLAST比对结果显示,拮抗菌株WK-1的16S rDNA序列及gyrB序列均与枯草芽孢杆菌B.subtilis的相似性最高。拮抗菌株WK-1系统发育树结果为,在基于16S rDNA基因序列构建的系统发育树中,该菌株与B.subtilis(HQ166109.1)的基因序列相似性最为接近,为99 %(图3);在基于gyrB基因序列构建的系统发育树中,该菌株与B.subtilis(EU711067.1)的基因序列相似性最高,为97%(图4)。根据拮抗菌株WK-1的菌落形态、菌体显微观察、生理生化特征及分子生物学鉴定,将该菌株鉴定为枯草芽孢杆菌B.subtilis。
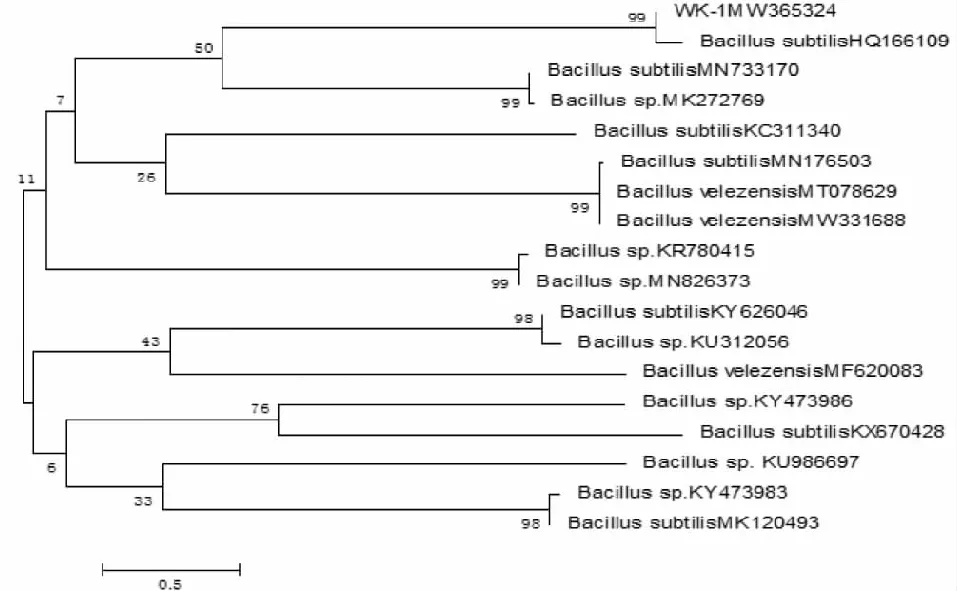
图3 NJ法建立拮抗细菌WK-1的系统发育树
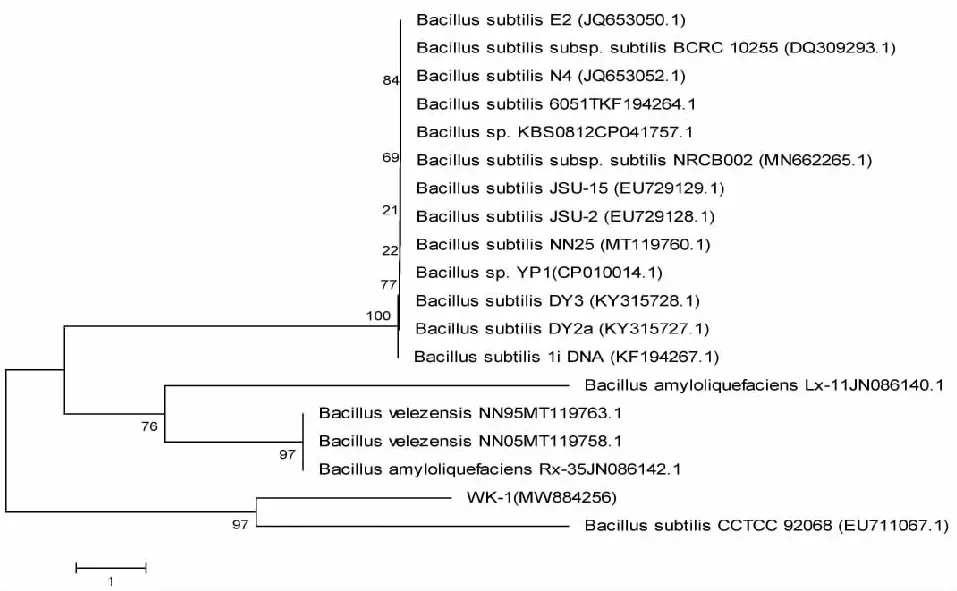
图4 ML法建立拮抗细菌WK-1的系统发育树
2.2.4 拮抗细菌对马铃薯块茎切片的防病效果 试验结果(图5)显示,空白对照组的马铃薯块茎切片被菌丝体全部覆盖,组织降解严重,有黄色液体流出,具异味。市场菌剂与拮抗细菌WK-1处理组的块茎切片水分饱满,仍保持相对新鲜状态。与市场菌剂相比,经拮抗细菌WK-1处理,病情指数降低了21.66,防效增加了36.87%(表2)。
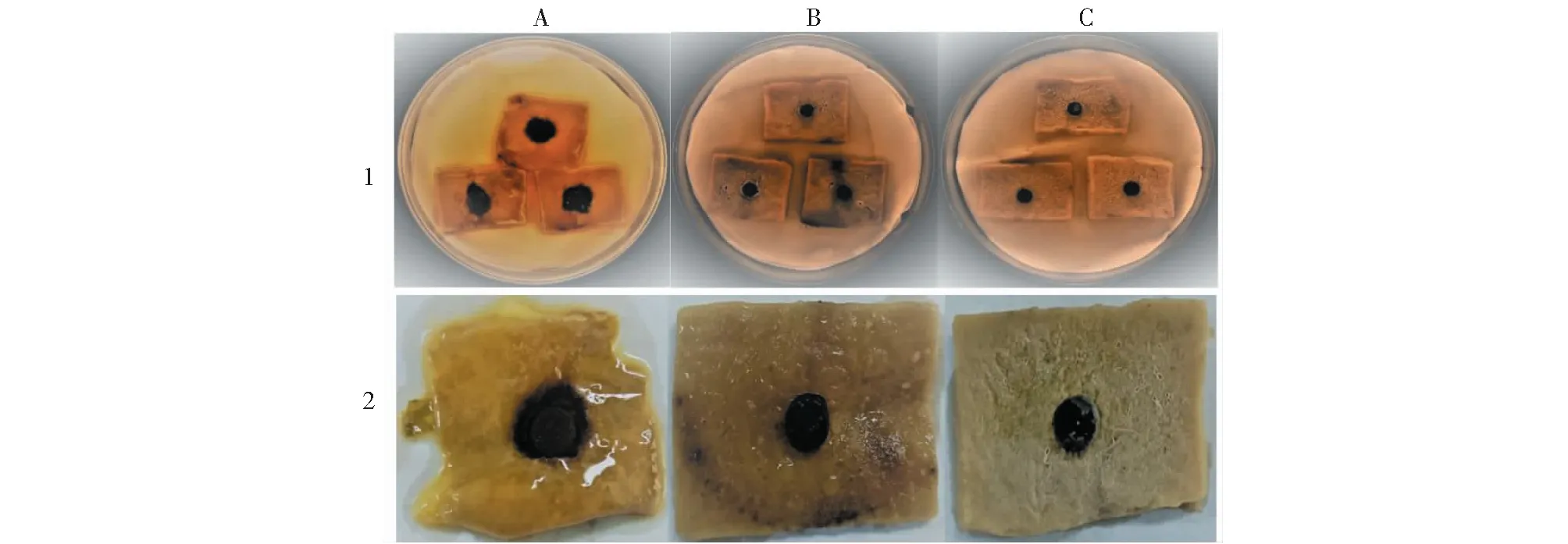
A:空白对照组,只接种病原菌;B:阴性对照,市场菌剂;C:WK-1菌剂。1:整体情况;2:为单个切片情况
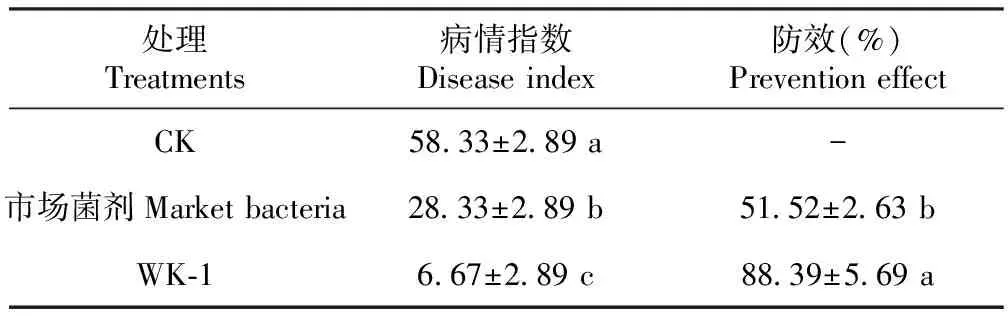
表2 拮抗细菌WK-1对马铃薯块茎切片的防病效果
2.2.5 拮抗细菌抑菌谱的测定 供试菌株抑菌图谱如表3所示,根据十字交叉法测定其抑菌率得,其对马铃薯黑痣病菌、水稻纹枯病菌、玉米大斑病菌、小麦赤霉病、水稻恶苗病菌的抑制率分别为:53.07%、50.81%、62.95%、45.06%、51.07%。可得出拮抗细菌WK-1菌株的抑菌效果具有广谱性。
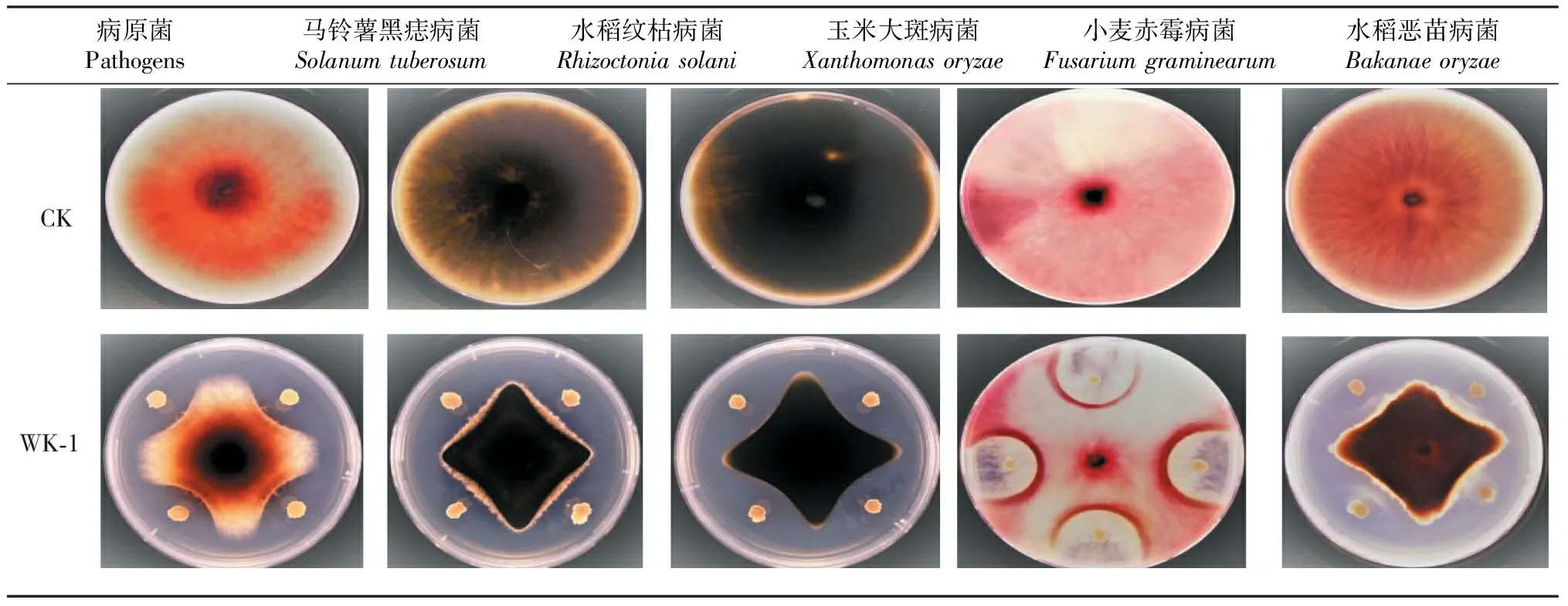
表3 拮抗细菌WK-1对5种农业病原菌生长的影响
2.2.6 拮抗细菌WK-1菌株生物学功能 (1)产铁载体能力。试验结果表明,拮抗细菌WK-1菌株菌落周围出现了透明圈(表4),相比于市场菌剂,拮抗细菌WK-1在CAS培养基上的外内直径比(D/d)增加98.27%(表5),说明该菌株具有产生铁载体的能力。
(2)解无机磷能力。试验结果表明,拮抗细菌WK-1菌株菌落周围出现了溶磷圈(表4),相比于市场菌剂,拮抗细菌WK-1在PKO培养基上的外内直径比(D/d)增加71%(表5),从而初步判断该菌株具有解无机磷的能力。
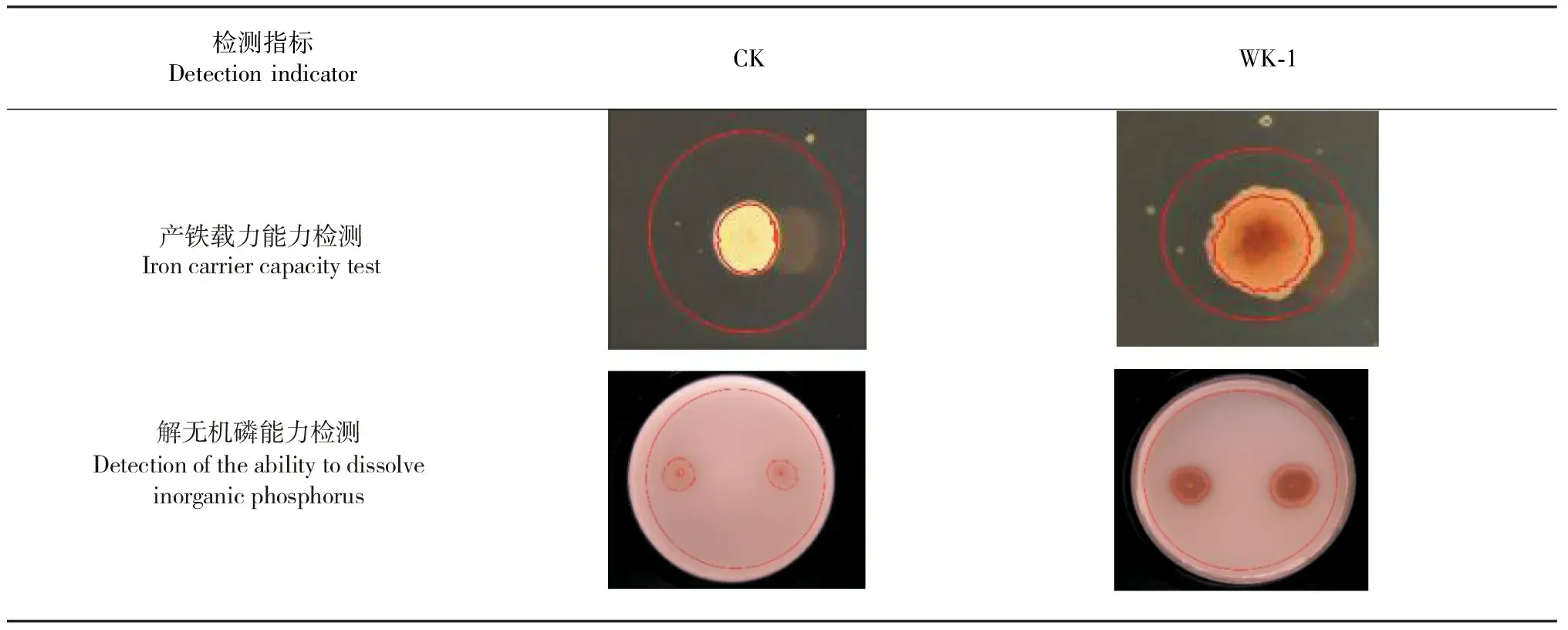
表4 拮抗细菌WK-1生物学功能定性检测
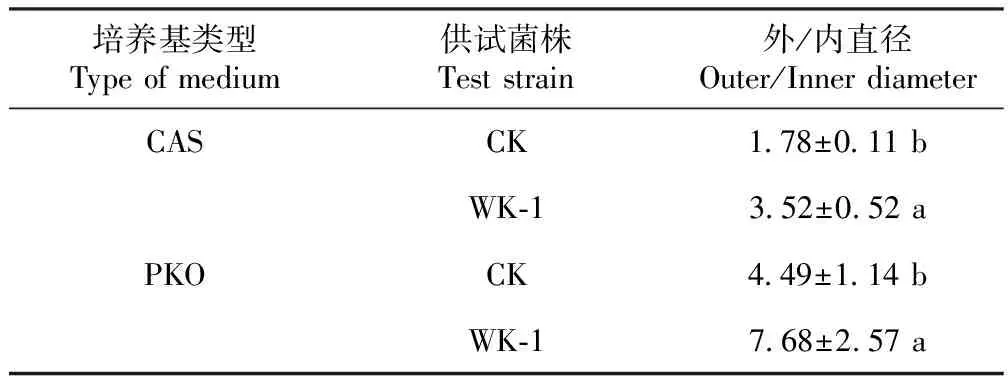
表5 拮抗细菌WK-1在CAS、PKO培养基上的外内直径比
2.2.7 对马铃薯早疫病的防效及对土壤微生物的影响 马铃薯接种拮抗菌剂WK-1 30 d之后,结果(表6)表明,只接种病原菌ZH-Z01的处理组的病情指数达83.17;接种病原菌ZH-Z01与市场菌剂的处理组,其病情指数为61.46,防治效果为25.37%;病原菌ZH-Z01与拮抗菌剂WK-1共同处理的病情指数为21.22,显著低于空白对照及市场菌剂处理的病情指数,防效达到74.49%。此结果说明拮抗菌株WK-1可有效防治对马铃薯早疫病。

表6 拮抗细菌WK-1盆栽试验验证
ACE、Chao1及Shannon指数表示微生物菌群丰富度和多样性。土壤微生物多样性测定结果(表7)表明,与对照组相比,经拮抗细菌WK-1处理后马铃薯根区土壤细菌Chao1、ACE及Shannon指数均有所上升;真菌Chao1、ACE及Shannon指数均有所下降。此外,土壤根区细菌与真菌的覆盖度均大于98.5%。同时,土壤根区细菌群落结构在属水平上有所变化,其中Gaiellalessp.(盖勒氏属)、Bacillussp.(芽孢杆菌属)以及Streptomycessp.(链霉菌属)等优势菌群的数量有所上升(图6)。
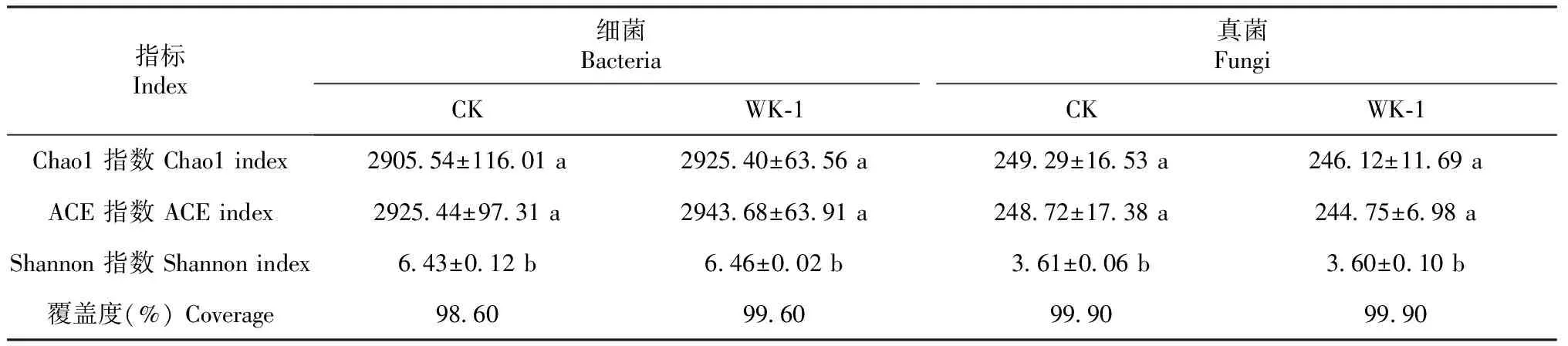
表7 拮抗细菌WK-1对马铃薯植株根区土壤微生物多样性的影响
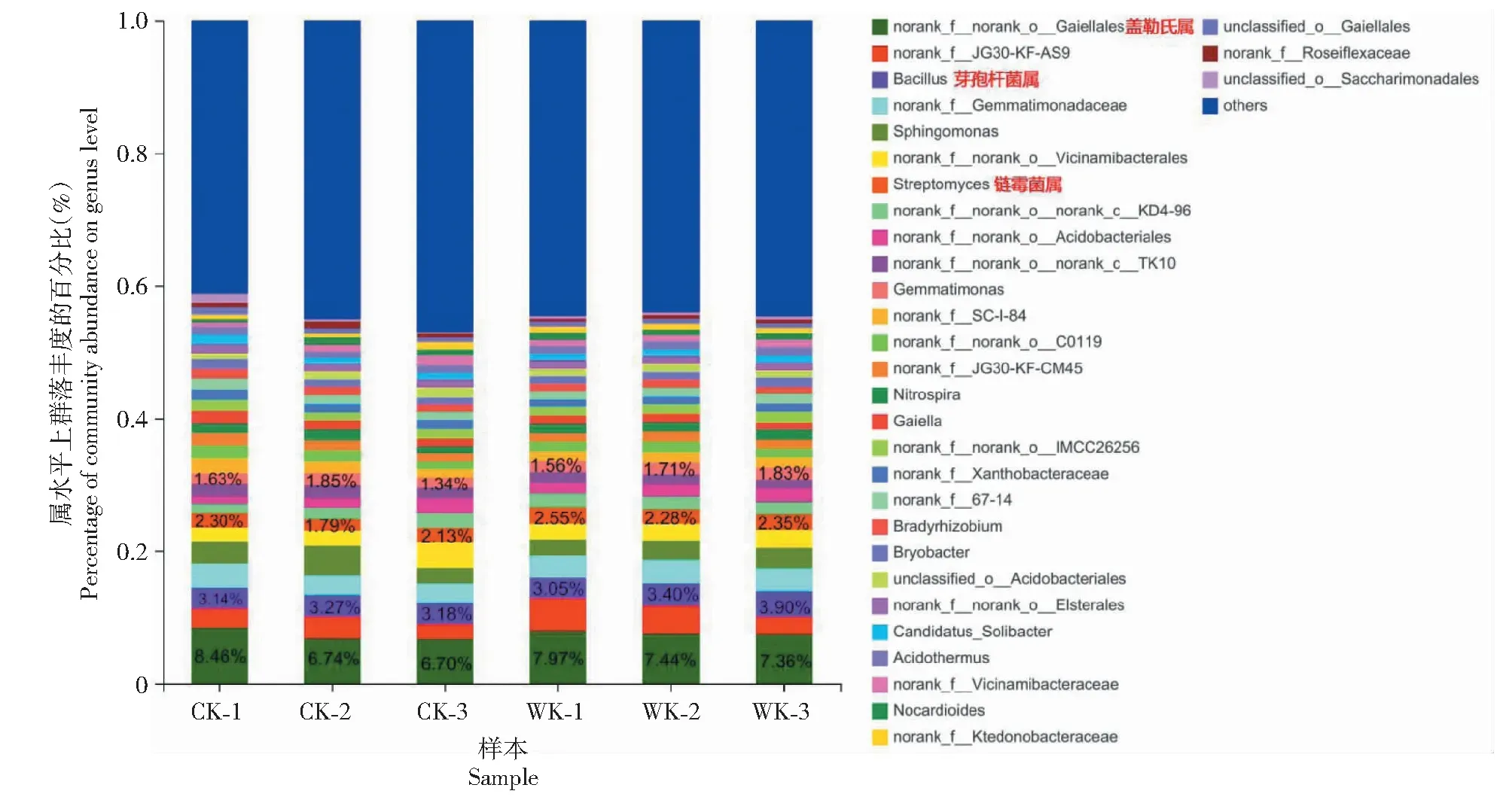
CK-1、CK-2、CK-3为对照组土壤菌群数据,WK-1、WK-2、WK-3为拮抗细菌WK-1处理组土壤菌群数据
3 讨 论
枯草芽孢杆菌(B.subtilis)具有定殖能力强,易于分离筛选等优势,在植物病害生物防治方面发挥着重要作用[45]。已广泛应用于甜瓜枯萎病、香蕉枯萎病、大豆根腐病、苹果腐烂病、马铃薯软腐病、水稻稻瘟病等多种植物病害的防治[42,46-47]。关于枯草芽孢杆菌防治马铃薯早疫病害的研究,主要集中在病害防效方面,而针对枯草芽孢杆菌的抑菌广谱性、促生与防病能力以及对土壤根区微生物多样性及群落结构的影响还较少[48]。本研究所获得的拮抗菌株WK-1对马铃薯早疫病原菌ZH-Z01具有较好抑制作用,经过多相鉴定分类体系将拮抗菌株WK-1归类为枯草芽孢杆菌(B.subtilis),同时对该菌株的抑菌谱、促生、防病能力及对土壤微生物多样性进行了相关的检测,为进一步开发马铃薯早疫病生防菌种资源提供科学依据。
李佳佳等[49]分离筛选得到的拮抗菌株F3A具有溶解无机磷的能力,表明了该菌株在促进植物生长方面的能力。王俊丽等[50]的研究表明,解淀粉芽孢杆菌QD-10可产生嗜铁素,在促进植物生长和抗病方面具有一定的作用。本研究结果表明,拮抗细菌WK-1具有产铁载体以及溶解无机磷的能力。则说明拮抗细菌WK-1具有防病及促生的潜能。盆栽试验结果说明,与其它2组处理相比,经拮抗细菌WK-1处理的植株病级较低,其病情指数为21.22,防效达74.49%。此结果表明施用拮抗菌株WK-1可有效降低马铃薯植株的病情指数。在盆栽试验中,防治效果受到拮抗菌株WK-1的定殖能力、微生物种群之间竞争以及植物体抗性能力等多种因素的影响。因此,本研究中拮抗菌株WK-1平板对峙的抑菌率与盆栽防治效果存在差异。张洁等[51]在研究报道中指出,枯草芽孢杆菌能够改变土壤中微生物种群结构分布情况,使得土壤从“真菌”型转化为“细菌”型,从而改良土壤环境。本研究施用拮抗细菌WK-1后,土壤中有益细菌多样性有所上升,有害真菌的多样性降低,这与詹发强等[52]的研究结果一致。推测其原因为拮抗细菌WK-1的添加,改善了土壤根区有益细菌的微环境,促进了有益细菌的定殖作用,不仅与病原真菌争夺空间位点,而且可产生抗菌脂肽类等物质抑制病原真菌的生长[53]。
本研究关于拮抗细菌WK-1抗病促生物质的相关功能基因及作用机理分析还有待深层次的研究,并将通过优化该菌株发酵条件,以便提高其对农业病原真菌的抑制率,且进一步设置田间试验进行防治效果的验证,为实现拮抗菌株WK-1的广泛应用提供充分的科学依据。
4 结 论
本研究筛选出1株对马铃薯早疫病具有较好拮抗效果的拮抗细菌WK-1,并关于该菌株的生物学功能、防治效果及对微生物丰富度和多样性分析的影响进行了分析,结果表明拮抗菌株WK-1具有开发为防治马铃薯早疫病的潜力。
