T1 mapping技术原理及其在心肌定量的研究进展
2022-05-28贾韬宇秦培鑫扈锋周小兵鲁玲潘存雪李绍林
贾韬宇,秦培鑫,扈锋,周小兵,鲁玲,潘存雪,李绍林
作者单位:中山大学附属第五医院放射科,珠海519000
心脏磁共振(cardiac magnetic resonance,CMR)定量成像是一项非侵入性评价心肌组织特征的有效工具[1],对于各种缺血性及非缺血性心肌病,尤其是弥漫性心肌病变的诊断和疗效追踪,发挥着越来越重要的作用[2-5]。CMR 定量序列包括T1 mapping、T2 mapping、T2*mapping 和T1ρ mapping,其中T1 mapping可测量对比剂增强前、后心肌T1值,并结合红细胞压积得到心肌细胞外容积(extracellular volume,ECV)值[6-7]。其成像序列由两部分组成,第一部分为准备脉冲部分,第二部分为读出数据部分,已有学者对准备脉冲部分进行了比较研究[8-9]及回顾综述[10-12],目前尚未见到针对T1 mapping 序列准备脉冲及数据读出序列两部分的优化发展过程进行统一回顾分析的综述,本文将重点回顾这两部分的发展历程及其在发展过程中的组合优化,并对T1 mapping 成像技术在心肌定量的最新研究进展进行总结。
1 T1 mapping序列基本原理背景
心脏T1 mapping 序列由准备脉冲和读出序列两部分组成,成像过程可简化理解为在心电门控触发后,射频线圈启动准备脉冲,使组织纵向磁化矢量偏离与主磁场方向一致的初始位置,发生一定角度的偏转,然后在纵向磁化矢量恢复到初始状态的弛豫过程中,读出序列会在多个心动周期的相同时相(一般为舒张末期)进行多次数据采集,得到不同弛豫时间的图像信息,通过拟合Bloch方程得到T1 mapping图,图中每个像素的数值代表对应的体素组织弛豫恢复曲线上纵向磁化矢量恢复到63%所用时间,即该体素组织的T1值[11]。
准备脉冲有反转恢复(inversion-recovery,IR)脉冲[10,13-16]、饱 和 恢 复(saturation-recovery,SR)脉 冲[17-20]和IR-SR 组合脉冲[21-22]三大类,常用的序列有平衡稳态自由进动(balanced steady-state free precession,bSSFP)读出序列[23]和快速小角度激发(fast low angle shot,FLASH)序列[24]两大类,每种读出序列都可以搭配不同的准备脉冲。以下将分别对不同脉冲准备及读出序列进行综述。
2 不同准备脉冲
2.1 采用IR准备脉冲的T1 mapping技术
最初用于心肌的T1定量技术是在Look-Locker[25]的基础上结合多点采集的[26]方法发展而来的,包括改良版IR脉冲准备的Look-Lock 序 列(modified Look-Locker inversion-recovery,MOLLI)[14],以及在MOLLI 基础上进行改良而衍生出缩短版MOLLI[ShMOLLI 5-(1)-1-(1)-1][15]、MOLLI 5-(3)-3[10]和MOLLI 4-(1)-3-(1)-2[10]等序列。
2.1.1 MOLLI的技术背景
最初用于心肌的T1弛豫定量技术是在Look-Locker多点采集基础上结合了心电门控技术,在心电R 波触发一次IR 准备脉冲后,进行多次等间隔信号读出,之后进行全心动周期信号采集[13],相当于将心动周期划分为多个时相,得到多个不同反转恢复程度的图像,继而进行弛豫曲线拟合。但此方法忽略了心脏运动造成的层面偏差,只能人工勾画心动周期每个时相对应节段的ROI 来确定弛豫曲线上的采样点,无法进行逐像素拟合,由于层面不能完全匹配,准确性必然受损。因此,Messroghli等[14]提出了MOLLI。
2.1.2 MOLLI序列设计原理
MOLLI 在前人的研究基础上做出了以下两点改良:第一,结合心电门控技术,限定在心动周期的舒张末期进行信号采集,有效去除心脏运动干扰,可进行逐像素拟合定量成像;第二,将多次舒张末期的信号采集分成多组数据集进行,最后再将采集到的多组不同TI 时间的图像组合处理,用于纵向弛豫曲线的拟合,有效缩短采样所需时间。其优点是定量的精确度较高,扫描可重复性较高,图像中伪影的出现率较低,在主观评价中图像质量较高;但也由于受到序列固有设置的不足及组织T1 值、T2 值、翻转角度和磁化传递(magnetization transfer,MT)等的影响,造成定量准确性不足[8-9]。现以最经典也是临床使用率最高的MOLLI 3-(3)-3-(3)-5为例[14]简要说明这类序列的设计原理。
如图1 所示,该序列在17 个心动周期内完成11 幅不同T1加权的图像采集,用于T1弛豫曲线拟合。图像采集分为三组数据集进行,每组数据集均在心动周期的R 波触发IR 脉冲准备之后,等待一定的反转时间(time of inversion,TI),于心动周期的舒张末期进行信号采集,每个采样点均采用单激发(single shot)采集方式得来,每次采样间隔相同时间。每组数据集采样间隔三个心动周期,使组织纵向磁化矢量在此期间能够自然恢复,并假设这段时间已足够其恢复到初始状态。三组数据集采样的区别在于组间的起始TI 时间不同,分别为100 ms、200 ms 和350 ms;每组数据集采样的图像数量也不尽相同,分别为3、3 和5 幅。最后将采集的11 幅具有不同TI 时间的图像,即不同T1 权重的图像,拟合成该层面的T1 mapping图。
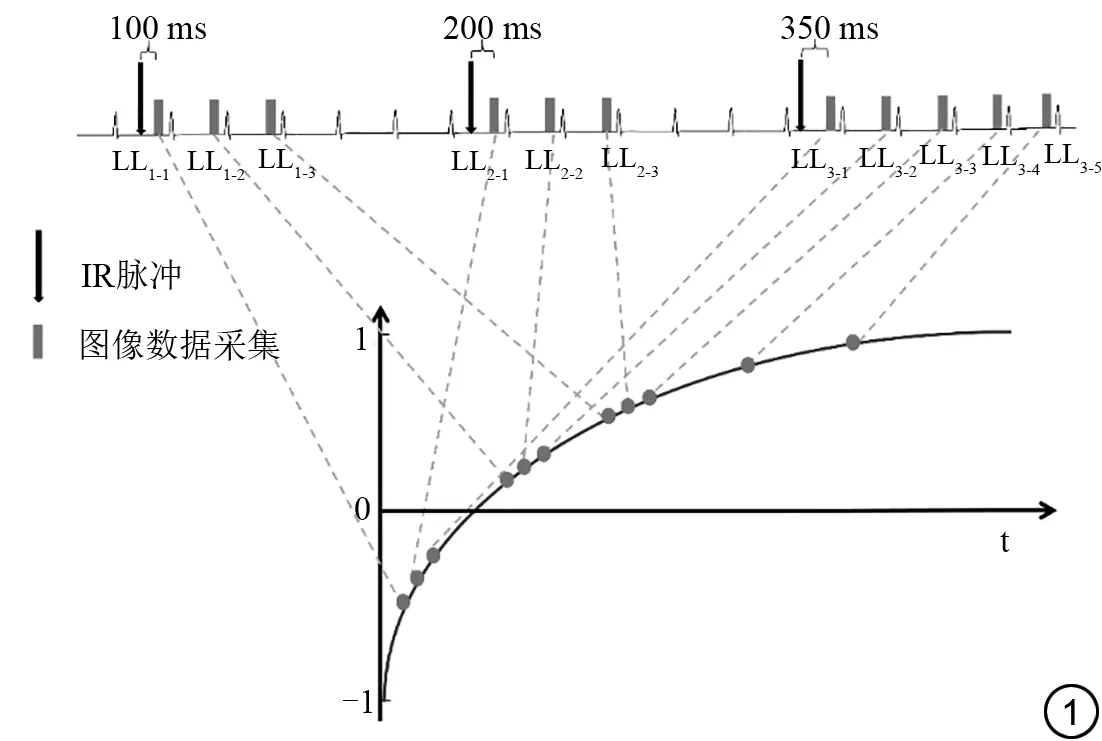
图1 改良版IR 脉冲准备的Look-Lock 序列(modified Look-Locker inversion-recovery,MOLLI)成像原理示意简图。Fig. 1 Schematic diagram of modified Look-Locker inversion-recovery(MOLLI)sequence imaging principle.
2.1.3 MOLLI定量准确性不足的原因


除此之外,MOLLI序列定量准确性不足还与另外两个因素相关:第一,该方法假设IR 脉冲作用之后可以将纵向磁化矢量百分之百反转,忽略了反转脉冲的实际反转效率;第二,该方法假设每次IR 脉冲准备之前纵向磁化矢量已完全恢复到初始状态,但实际上对于长T1 值的组织来说,每个IR 脉冲之间间隔的六个心动周期还不足以使纵向磁化矢量自由恢复如初,这便造成了在下一次IR 脉冲开始准备时纵向磁化矢量并没有完全恢复[28]。当心率较快时,纵向磁化矢量自由恢复的时间被进一步缩短,则这种假设带来的误差会愈加明显,这就是MOLLI 序列在心率越快时对组织T1 值低估越明显的原因[10]。以上三种因素共同造成MOLLI序列的拟合计算所得T1*对真实T1 值的低估,在体膜实验中定量结果比真实T1 值低4%~10%[17]。
2.1.4 MOLLI的优化发展
为了进一步提高MOLLI 序列的准确性,缩短序列的屏气采集时间从而增加患者耐受度,不少研究者通过减少采样数量、延长采样间隔时间、调整采样点排列方式、优化反转脉冲效能[29-30]、优化后处理降噪算法[31]或曲线拟合算法[28]等方式对经典的MOLLI 序列不断进行改良,衍生出许多基于经典MOLLI序列的变体序列。
有些研究针对序列采样做出调整衍生出了ShMOLLI 5-(1)-1-(1)-1[15]、MOLLI 5-(3)-3 和MOLLI 4-(1)-3-(1)-2 方案的MOLLI 序列[10]。两者都缩短了总采样时间,并且在调整了采样点的数量和排列方式之后都减弱了序列的心率依赖性,后者还在上述调整基础上,将原本以心动周期为单位的采样间隔时间修改为以s为单位[10],延长了纵向磁化矢量自由恢复的时间,更有利于减轻心率较快情况下MOLLI 序列对T1 值的低估。Piechnik 等[15]已在1.5 T 和3.0 T 设备上对上述MOLLI 变体做过对比研究,结果表明在1.5 T时ShMOLLI对心肌T1值的定量结果比MOLLI 的短(10±16) ms,在3.0 T 时,两种方法测得的结果相似。而Heidenreich 等[32]在3.0 T 上的对比研究表示MOLLI 对心肌T1 值的系统性低估没有ShMOLLI 显著,但两者测量的对比剂增强前后心肌T1 值的变化差值没有差异。Kellman 等[10]对上述两类MOLLI 变体[ShMOLLIN 5-(1)-1-(1)-1、MOLLI 5-(3)-3 和MOLLI 4-(1)-3-(1)-2]的精确度做过比较研究,结果表明ShMOLLI 定量的精确度不如后两种MOLLI 变体,这是因为精确度取决于原始图像的信噪比(signal-noise ratio,SNR)以及弛豫曲线上的样本数量和位置,而后者的采样图像数量较多,而且在后者的两种方案中,MOLLI 5-(3)-3方案在测量长T1 值组织(增强前的心肌)时的精确度较好,而增强后的组织T1 值常在较短T1 值的区间(200~600 ms),此时MOLLI 4-(1)-3-(1)-2方案的准确性和精确度较好。
然而上述的这些MOLLI 变体并不能完全消除T1 值较长的组织在有限的间隔时间内不理想的纵向弛豫恢复问题所造成的T1 值的低估。Shao 等[28]直接从造成MOLLI 定量准确性不足的根源出发,提出了一种新算法InSiL (instantaneous signal loss simulation),当心率>80 bpm和T1>1000 ms时此方法优化效果最佳,可将MOLLI定量的T1值误差从14.9%±4.5%降低到0.4%±0.3%。此方法是在经典MOLLI序列执行结束之后间隔3 s 采集一幅没有IR 脉冲准备的图像M0,用来估算可反映反转效率的反转因子δ,并且不是单纯使用原来的三参数弛豫曲线拟合算法,在加入了反转因子δ之后用Bloch方程进行四参数拟合,该方法将每次单次成像读出过程中纵向磁化矢量的损失、每次反转脉冲之前纵向磁化矢量的不完全恢复以及不完美的反转效率全部考虑其中,不仅改善了经典MOLLI 序列的心率依赖性,同时明显提高了其准确性和精确度。也有研究通过对采样点的运动校正提高MOLLI 序列在临床应用中的定量准确性[33],增加了运动校正也有助于实现对右室心肌的定量分析[34]。
上述成像方法为缩短成像时间减少了采样数量,因此因为信号数据不足而牺牲了图像SNR,造成定量精确度的损失,有学者通过控制三参数拟合曲线上采样点的位置和数量来降低精确度的损失,或结合一些降噪技术改善精确度不足[31]。最近Guo 等[35]开发出了一种结合深度学习的快速MOLLI 序列,用MOLLI 序列定量数据进行深度学习建模后,只需施加一次IR 准备脉冲,在之后连续的四个心动周期采集4 幅T1 加权图像的数据即可实现T1值定量,其T1值定量的准确性与精确度与临床常用的MOLLI 序列一致,不仅大大缩短了成像时间,且以往学者单纯通过减少采样数量以缩短成像时间的做法相比,基于深度学习建模的方法保证了定量的精确度不会损失过大。但是,由于建模是基于MOLLI 序列,所以也会保留MOLLI序列的局限性,若采用定量准确性和精确度更好的数据建模也将有助于优化此方法的定量结果。
另外,将回顾性心电门控应用于T1 mapping 技术,不仅能延长心动周期采样时长以缩短成像时间,而且有利于拟合曲线上不同采样点图像与心动周期的相同相位之间的准确匹配,有利于降低心律失常导致的测量误差。Becker 等[36]应用回顾性心电门控延长了数据采样窗口宽度,并对心脏搏动进行了运动校正,不仅实现了屏气8 s 单层高分辨率心肌定量,还进一步提高了定量精确度。Qi等[37]开发的一种回顾性心电门控下IR 准备的三维T1 mapping 技术,采用Flash 序列在自由呼吸下沿黄金角三维放射状分布进行信号采集,研究发现新方法的T1 值定量准确性明显高于二维MOLLI 序列,精确度也明显高于SR 脉冲准备的单激发(saturation recovery single-shot acquisition,SASHA) T1 mapping 技术序列,相当于对两种传统经典序列的优缺点进行了互补,且同时保留了两者的优势,目前该方法对于呼吸节律不规则或心律失常患者的诊断价值尚待进一步研究明确。
如前所述,MOLLI 序列以其心肌定量稳健性、病变检出的高敏感度和较高的阅片主观舒适性而成为目前临床应用最广泛的心肌T1 mapping,并不断从成像方式和后处理方法上进行序列优化发展,不断提高成像效率和定量准确性,并且仍会随着快速采集技术和人工智能的发展而进一步提高,而且从技术研发到临床应用的进程也会不断加快。
2.2 采用SR脉冲准备的T1 mapping技术
基于MOLLI定量准确性不足的缺陷,SR准备脉冲被应用于T1 mapping技术,其不仅能够消除前一次准备脉冲之后残存的横向磁化矢量,且在每次脉冲准备之后的单次信号读出也不会造成磁化损失[38],提高了成像效率。此类T1 mapping序列包括使用SR 脉冲准备的MOLLI 方法(modified Look-Locker acquisition with saturation recovery,MLLSR)[18]、心律失常不敏感的快速(arrhythmia insensitive rapid,AIR)心脏T1 mapping[19]、采用饱和准备的自适应恢复时间T1定量(saturation method using adaptive recovery times for T1 mapping,SMART1)[20]和SASHA[17],其中以SASHA最为经典。
2.2.1 SASHA的技术背景
Song等[18]最先提出了MLLSR方法,相较于MOLLI其不仅省去了纵向磁化矢量在下一次准备脉冲前完全恢复的时间,提高了成像效率,还纠正了由于弛豫不完全造成的定量准确性偏差。因成像效率高,MLLSR方法可充分利用患者屏气耐受程度内的所有心动周期,结合K 空间分段技术,又可进一步提高图像的空间分辨率和SNR。不过由于此方法没有实际测算饱和效率,而是直接对完全饱和的数据进行理想化假设处理,而且在一次准备脉冲后的多次信号读出的过程也会造成磁化损失,所以定量结果仍存在约5%的低估。
SR 脉冲准备的T1 mapping 成像效率高,当心律或心率异常时更具优势,因其不会被变化的心律或心率造成的不同残留磁化矢量影响下一次准备脉冲的效果。Fitts 等[19]提出的AIR cardiac T1 mapping 序列,在每次饱和脉冲准备之后仅采集一次图像,可仅在2~3 个心动周期内采集两幅不同权重的图像(即质子密度加权成像和T1WI),通过两图比值定量出T1 值,这种快速成像方式对心律不齐有很好的抵抗性。后有SMART1 序列[20],不仅增加采样数量以提高精确度,还对SR 间隔进行调整,设置为在每次饱和脉冲准备后间隔不同数量的心动周期之后进行单次采样,这样可获得更长的SR 时间的数据,可在后处理中提高曲线拟合对不规则心律的抗性,不过相较于前一种方法耗时较长。Chow等[17]在前人基础上继续进行序列改进,最终提出了这类序列中最经典的SASHA序列。
2.2.2 SASHA序列设计
SASHA 同样是将最初的单次脉冲准备后的多次采集改为单次采集,减少采集过程造成的信号损失,且设置在序列开头真实采集未施加饱和脉冲准备的数据,用此真实数据替代了MLLSR 方法中在计算时理想化假设的完全SR 时的数据,将实际的饱和效率考虑进拟合算法中。相较于IR 脉冲准备的T1 mapping,其优势在于成像效率高,定量的准确性高,拟合出的T1 值也不需要校正系数来校正,也不受组织T1 值、T2 值和翻转角度的影响;不足之处在于精确度较差,在高磁场环境中对偏共振更敏感,出现伪影的概率较高[8,17]。
如图2 所示,首先在饱和准备脉冲之前采集一次没有经过饱和脉冲准备的图像M0 作为完全SR 的数据,在接下来的9 个心动周期内设定每个R 波触发后间隔不同延迟时间施加饱和脉冲,之后固定的在舒张期某时相采集数据,这样就可在不同的SR时间获得一系列不同SR程度的图像。
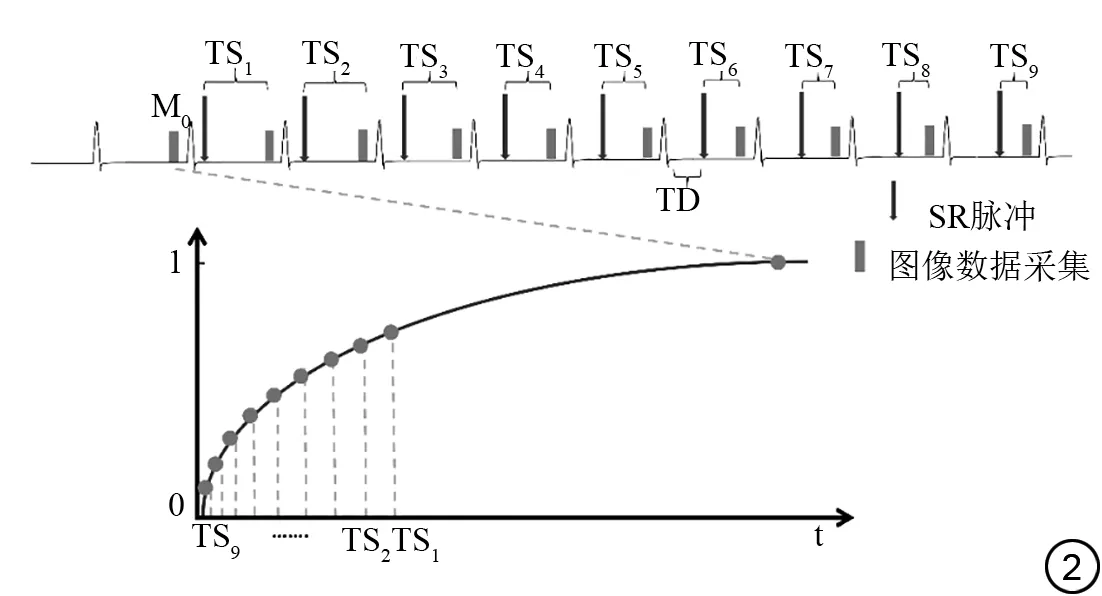
图2 饱和恢复脉冲准备的单激发(saturation recovery single-shot acquisition,SASHA)T1 mapping技术序列成像原理示意简图。Fig. 2 Schematic diagram of saturation recovery single-shot acquisition(SASHA)sequence imaging principle.
2.2.3 SASHA定量精确性不足的原因及优化方法
SR 脉冲准备的T1 mapping 序列已经在体模实验中被证实了具有出色的定量准确性,但精确度不足这一缺点却大大影响其临床使用效能。序列定量的精确程度主要取决于采样信号的SNR,而饱和脉冲准备相较于反转脉冲准备的序列存在纵向弛豫动态范围的先天不足,这使得前者采集到的信号更容易受噪声的影响造成SNR不足,从而使得精确度受损[39]。该不足可通过对原始数据进行后处理降噪重建以提高SNR 的方法改善。
Bustin 等[40]针 对SR 脉 冲 准 备 的T1 mapping 开 发 的BL-V-ANI降噪方法,就可在保留准确性的前提下,有效提高精确度和图像质量,且这种后处理运算可在短时间内全自动完成,方便用于临床。
Nordio 等[41]研发出的三维SASHA 序列,实现了自由呼吸下的全心T1 mapping,与二维SASHA 相比不仅保留了测值准确性,还在大大提高图像分辨率的同时提高了定量的精确度。增加三维Beltrami 降噪后处理之后[39],三维SASHA 序列的精确度达到了与二维MOLLI 相似的程度,此时减少饱和采样点数量不仅可以明显缩短成像时间,还不会损失精确度[42]。Ferreira da Silva等[43]结合了压缩感知快速采集技术,已在动物活体实验中实现了15个心动周期完成全心T1定量,有望实现人体单次屏气下全心采集,其定量准确性和精确度与三维SASHA序列相当,且新序列对心率变化更不敏感。但是,新序列采集的短SR 时间数据没有三维SASHA多,对存在纤维化病变的增强后短T1值组织的定量效能尚待进一步临床验证。
临床工作中也常会遇到主观感受上SR 脉冲准备不如IR脉冲准备的T1 mapping 图像质量高的情况[8],尤其是有病变造成心肌初始T1 值升高时,前者心肌与血池的对比远不如后者清晰,这必然会影响心肌勾画的准确性,或可通过后处理技术自动准确勾画心肌节段,如Bhatt 等[44]对初始T1 和增强后T1 图像的全自动匹配和分节段定量研究,既实现了临床测量工作减负,又增强了操作标准化。由于此项全自动心肌节段划分是以左心室短轴电影图像为参照的,原则上只要电影图像质量达标,将非常适合用于心肌/血池对比度较差的T1 mapping 图像的心肌节段划分,但该研究中仅使用到MOLLI 序列,并没有涉及SASHA、SMART1 等SR 脉冲准备的序列,所以对其心肌勾画准确性的优化尚待进一步验证。还有两点需要注意,心脏电影也是基于bSSFP 读出序列,图像中的条带状伪影可能对后期匹配造成干扰,而且这种对增强前后T1 mapping图像的匹配技术,并不能解决由于患者本身呼吸配合不到位等原因导致的层面不匹配问题。
2.3 采用SR-IR组合脉冲准备的T1 mapping技术
在SASHA被提出的同年,还有学者将IR和SR两种准备脉冲组合应用于同一序列中,提出了SR 准备的心率非依赖性反转恢复(saturation pulse prepared heart rate independent inversion recovery,SAPPHIRE) T1 mapping技术[21]。
2.3.1 SAPPHIRE序列设计

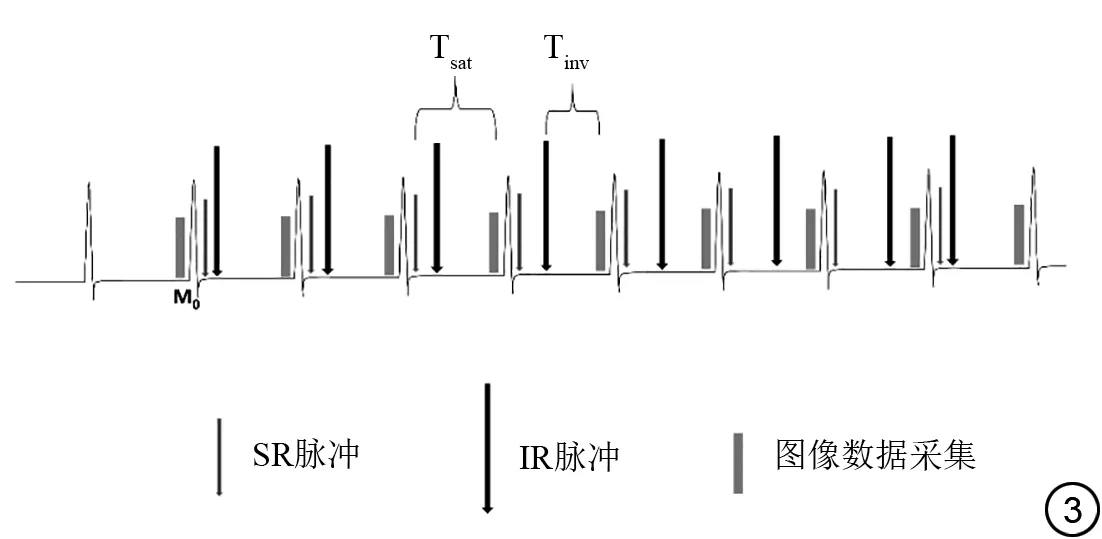
图3 饱和恢复准备的心率非依赖性反转恢复(saturation pulse prepared heart rate independent inversion recovery,SAPPHIRE) T1 mapping 技术序列成像原理示意简图。Fig. 3 Schematic diagram of saturation pulse prepared heart rate independent inversion recovery(SAPPHIRE)sequence imaging principle.
2.3.2 SAPPHIRE与MOLLI和SASHA的比较研究
这类序列即利用IR 脉冲造就较大的纵向磁化矢量动态恢复范围,以此增强信号采集对噪声的抗性,确保良好的定量精确度;又利用SR 脉冲消除历史残留磁化矢量影响,以此提高定量准确性和心律失常抗性。该序列融合了前面两类序列的优势。已有研究对比过这三种准备脉冲类型的T1 mapping,结果表明三者可重复性无差异,SAPPHIRE 对于T1 值定量的准确性与SASHA 相当或更佳,优于IR 脉冲准备的T1 mapping,精确度和图像伪影出现的概率介于两者之间[8-9],对心率敏感度降低了许多,但还是会像IR脉冲准备的序列一样受组织自身T2值和MT效应影响,但程度有所减轻[6,8]。Guo等[45]已经实现了在自由呼吸下约2 min完成SPPHIRE序列多层采集,可惜其定量准确性和精确度仍处于二维MOLLI 和SASHA 序列之间。但是,此类准备脉冲组合模式与单独的准备脉冲序列相比成像和拟合过程都较复杂,且与后文将介绍的准备脉冲组合后实现多参数定量的序列相比,综合价值较低。
3 不同读出序列
3.1 基于bSSFP读出序列的T1 mapping技术
3.1.1 使用bSSFP读出序列的优势
T1 mapping 通常都是使用bSSFP 读出序列进行信号采集的,因为读出序列梯度编码在进行信号采集的过程中会对组织自然的T1 弛豫过程造成干扰,从而加速弛豫过程,带来因信号采集过程造成的T1 值的低估,而早有研究表明采用bSSFP读出序列在信号采集过程中对纵向弛豫的干扰最小,且可获取较高的SNR[14,46],所以一般常使用bSSFP 读出序列在舒张末期进行信号读出。
3.1.2 使用bSSFP读出序列的不足及原因
该读出序列使得IR 脉冲准备的T1 mapping 易受到组织T2 值、MT 效应和偏共振频率等因素的影响,造成定量准确性不足。
3.1.2.1 组织T2值的影响
Gai 等[47]已利用Bloch 方程仿真模拟的方式明确了组织T2值对MOLLI数据拟合出的T1*的具体影响,即组织T2值越小对T1*的影响越大,最终对T1的低估越明显;而SR准备的序列不受组织T2值的影响[17]。
3.1.2.2 MT效应的影响
Robson 等[48]在Bloch 方程仿真模拟的基础之上,进行了关于MT 对MOLLI 和SASHA 序列的活体T1 定量影响的研究,表明在施加IR 脉冲后存在于细胞内的大量本没有被IR 脉冲激发的结合型质子(束缚池)与脉冲激发的自由质子(自由池)之间发生能量交换,即MT。由于磁共振信号采集时只能采集到横向磁化矢量切割磁感线产生的信号,而束缚池的T2 时间极短,磁化矢量很快就可完成弛豫过程,回复到初始状态,故其信号不能被采集到,但却造成了自由池最终被探测到的信号减弱,使拟合曲线变形。这种效果与读出序列对纵向弛豫造成的加速效果叠加,共同导致IR准备的序列得到的表观T1值降低,因Look-Lock 校正因子只是对读出序列的干扰进行校正,并不能对MT 效应进行校正,故最终造成对组织T1 值的低估。但SR 准备脉冲可使束缚池也逐渐被饱和,之后与自由池的净MT 趋近于零,因此SR 脉冲准备的序列三参数拟合的SR曲线受MT的影响不大。
3.1.2.3 偏共振的影响
随着临床上3.0 T 磁共振设备的普及,高场强在提供更高的组织SNR 的同时,也因难以绝对控制的磁场均匀性给采用bSSFP 读出序列的成像技术带来了挑战。众所周知bSSFP读出序列更容易受磁场不均匀造成的中心频率偏移的影响而产生伪影,即受偏共振频率影响而产生黑带伪影[49]。其实偏共振频率不仅会影响图像质量,甚至在偏共振频率绝对值相对较小的地方,即使没有出现伪影,也会造成一些T1 估值的误差,表现为读出序列的翻转角越大其估值受偏共振频率影响越大,偏共振频率绝对值越大造成的T1 估值误差越大[10]。如Bhuva等[50]对使用心脏植入式电子设备的患者进行研究,发现在肉眼评估无伪影的心肌节段也存在明显T1 定量值偏低的情况。
有研究显示,在3.0 T 磁场环境中,采用bSSFP 读出序列均有不同程度的伪影存在,SASHA序列出现伪影的节段比例最高,常出现在前或下外侧壁[17],SAPPHIRE序列次之,MOLLI序列最少[8]。可通过增加局部匀场或中心频率校正的方法来改善上述伪影,但尚不能完全消除偏共振的影响。Bhuva等[50]在健康志愿者中通过在胸壁上放置心脏植入式电子设备验证了采集偏共振场图可以检测T1 定量中的误差,可用于校正MOLLI序列的T1 值定量结果,这种校正方法虽不能消除条带状伪影,但可以提高没有出现条带状伪影的心肌节段的T1 定量准确性,有利于受患者心脏植入式电子设备干扰的心肌病变的检出。
3.2 基于FLASH读出序列的T1 mapping技术
3.2.1 FLASH与bSSFP相比的优势
与bSSFP 读出序列相比,FLASH 读出的SNR 以及血液与组织间的对比度较差,且采集信号时对自然弛豫干扰较大,因此一直没作为读出方式的首选。但当受磁场不均匀影响较大时,可采用FLASH 读出序列作为替代[51],因为FLASH 序列对抗因中心频率偏移而造成的偏共振伪影的能力较bSSFP 读出序列更强,而且能够显著降低MT 效应造成的信号衰减并消除组织T2值影响[24]。
基于FLASH 读出序列的T1 mapping 不仅对消除3.0 T 场强中bSSFP 相关伪影有利,由于其对磁场不均匀性的抗性相对较好,在1.5 T 场强下,结合高带宽,也可降低如植入式除颤器等金属植入物对成像区域的影响[52],而且基于FLASH读出序列与其他读出序列相比,对如今日渐普及的多层成像快速扫描更为有力[22,53],Weingärtner 等[22]采用FLASH 读出的多层成像SAPPHIRE T1 mapping 序列进行更快速且覆盖范围更广泛的心肌T1 定量,结果表明该序列可在单次屏气下完成3 层16 个美国心脏学会(American Hospital Association,AHA)节段的T1 量化,与单层扫描的结果有很好的一致性。对IR-FLASH 序列射频激发角的B1 场进行校正之后,将会提高定量的准确性[54]。
3.2.2 修改读出序列后的算法改变
当信号的读出序列改变之后,原本用于传统bSSFP 读出的曲线拟合算法便不适合直接应用于基于FLASH 读出的序列。Rodgers等[55]提出了改为FLASH读出的ShMOLLI-IE序列,并提出了相应的适用拟合算法,新算法考虑到了反转脉冲反转效率不完美的实际情况,提出优化反转脉冲和使用反映反转效率的校正因子,假设T1 corrected=T1/δ,若已知反转因子δ,就可提高反转脉冲准备序列的对T1估值的准确性,与传统的三参数指数拟合不同,采集纵向磁化矢量完全恢复情况下的图像M0 先估算δ,再用Bloch 方程进行弛豫曲线拟合。Shao 等[56]提出的适用于FLASH-MOLLI 的BLESSPC (Bloch equation simulation with slice profile correction)算法是在前人提出的算法之上,再加入层面轮廓校正,该算法大大降低了序列对心率的敏感性,可提供准确且精确的T1 值定量,并消除了3.0 T时与bSSFP相关的带状伪影。
由于磁共振定量序列表征的各项组织性质各有不同,在疾病的诊断和研究中需要综合考虑,因此同时实现多参数定量的技术[57]应运而生,如CMR指纹成像[58-59]、反转恢复脉冲[60-61]或SR脉冲[62]与T2准备脉冲相结合的定量序列等,上述技术不仅能够同时定量组织T1、T2 值,还可以同时测量更多组织参数[63-65]。Akçakaya 等[62]在单次心动周期内施加饱和脉冲和T2准备脉冲两种磁化准备,两种准备脉冲之间的间隔及T2准备脉冲的持续时间在每个心动周期各不相同,由此获得一系列不同T1和T2权重的图像,即可在单次屏气下同时定量组织T1值和T2值。Guo等[66]将多参数定量技术与多层成像技术相结合,可以实现自由呼吸下2 min 内全心T1 和T2 同时定量。Kellman等[67]在自由呼吸下多参数定量序列基础上,利用对比剂增强后的T1 mapping和T2 mapping进一步计算生成了亮血晚期钆增强(late gadolinium enhancement,LGE)图像和黑血LGE图像,可以用于替代增强后常规LGE成像,不仅缩短成像时间,还可在一次成像中同时评估弥漫性病变和局灶性病变情况。
多参数定量的技术的综合价值较高,不过尚存在一些不足,如CMR指纹成像的采样窗口时间和数据字典生成时间较长,部分研究中IR脉冲与T2准备脉冲相结合的序列虽然成像速度快,但定量准确性和精确度均不如MOLLI序列[61]。Shao等[68]关于IR 脉冲与T2 准备脉冲相结合定量序列的研究已经优化了上述不足,不仅极大地缩短了成像后的重建运算时间,而且还达到了与传统MOLLI 一致的定量效能,但由于MT 效应的影响使其仍存在测量值偏低的情况。不过多参数定量技术对临床应用而言具有一定的复杂性,且尚需进一步扩大研究样本量以验证其多参数评估的稳健性及病变检出敏感度。
4 ECV的产生及问题
以上已经从序列组成类型的角度分别介绍了心肌T1 mapping 的多种序列以及不同序列对T1 定量结果的影响,不同设备或不同序列都将造成T1 值定量结果的差异,在临床工作中很难进行标准化的对比,这些都将会影响到疾病的诊断和随访。虽然水肿、纤维化或蛋白质积累等都会造成心肌初始T1值增加,铁沉积等可致其降低[6]。但是,心肌T1值是由组织细胞和细胞外间质共同决定的,所以在导致组织T1 值变化的众多影响因素中精准分析具体因素的过程较为复杂。而ECV 值代表的是细胞外间质体积占整体心肌组织体积的百分比,是将心肌组织分为细胞成分和细胞外间质成分两部分考虑,心肌纤维化正是由于细胞外间质发生了变化,与ECV 值升高有明确相关性,且ECV 值作为一个比值,可以抵消掉因设备或序列原因造成的T1定量误差[69]。
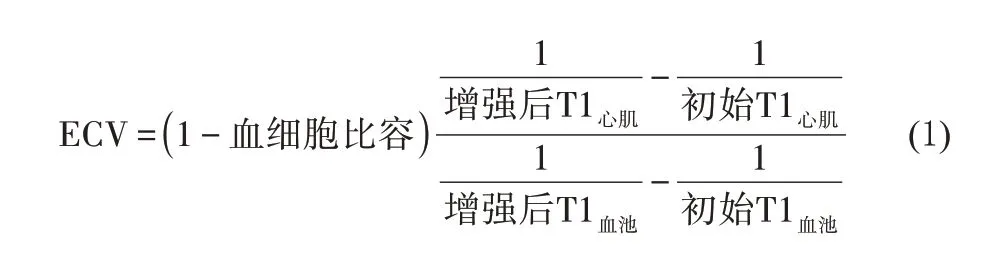
心肌纤维化与心脏疾病的不良预后密切相关,有研究[70]表明ECV 值比初始T1 和增强后T1 更适合作为心肌纤维化的量化指标,与不良预后(心源性死亡或心力衰竭)有很强的相关性。通过测量增强前后心肌和血池的T1 值,再结合血常规检查中24 h 内的血细胞比容,根据计算公式(1)[7]即可算出ECV值。甚至已有研究提出了一种可以根据血池初始T1值直接估算出血细胞比容的方法[71]。
Nordlund等[72]比较了多种T1 mapping序列测量的ECV值与猪的同位素示踪法所得ECV值,研究得出由于MOLLI序列低估了增强后的T1 值,造成了所得ECV 值偏高,而SASHA 序列得出的ECV 值较准确,且MOLLI 序列所得ECV 值会随增强后成像时间的延迟而增加,但SASHA序列所得ECV值则没有这种时间依赖性。此研究结果中导致MOLLI序列测量的增强后T1值偏低的情况,可能与该研究所使用的MOLLI 序列并不适合用于增强后表现为短T1 值的组织成像有关,而且ECV 值的时间依赖性是一个实践操作中不容小觑的问题,应尽可能标准化操作,减弱其对结果的干扰。
在临床工作中常出现因为患者呼吸配合不达标或心律不稳定导致T1 mapping 序列增强前后同层面图像匹配不理想的情况,另外心腔内血液的流动效应也会影响血液T1 值的可信度,这些都对ECV 的准确性提出了挑战。近年来陆续推出的多种自由呼吸下完成多层图像采集[16,66,73]和三维成像[39,41-42]的T1 定量序列,结合了并行采集、压缩感知等快速采集技术和呼吸门控技术,不仅使患者耐受程度提高,有希望完美解决上述问题,也可不必受单次屏气限制而获取更高的图像分辨率,为显示右室心肌定量提供技术支持。不过任何可能引起细胞外隙增宽的因素都会影响ECV值,所以ECV值可用于疾病的检出,但不具备特异性[7]。
5 T1mapping技术在心肌病中的应用进展
5.1 缺血性心肌病
T1 mapping 技术正日益广泛地应用于临床诊断和研究,已经可以用于缺血性心肌病心肌水肿、梗死[74]、心肌内出血[75]和微血管阻塞(microvascular obstruction,MVO)[4]的诊断,对疾病的诊断、治疗及预后评价都具有指导作用。
急性缺血性心肌损伤常表现为初始T1和ECV值增高[1],急性心肌梗死的预后主要取决于不可逆心肌损伤的程度和左心室重构,MVO是预后不良的重要预测因子。有研究[74]通过临床常用的ShMOLLI序列证明了初始T1可以区分出可逆性心肌损伤(心肌水肿)和不可逆性心肌损伤(心肌梗死),对于没有MVO表现的梗死心肌节段,不可逆性、可逆性和远端心肌的初始T1 值之间有明显差异(1447 ms±44 ms、1327 ms±36 ms 和1177 ms±34 ms),随病程的延长(6 个月后),不可逆区的初始T1 值将减低(1294.4 ms±58.7 ms),但也显著高于远端心肌(1173.4 ms±34.2 ms)。而同样是在心肌梗死核心区,有微血管损伤的心肌初始T1值(1048 ms±78 ms)明显低于没有微血管损伤的(1111 ms±89 ms)[75]。也有研究[4]表明,由于MVO的初始T1明显低于其周围的梗死心肌,可以在初始T1图上准确测量出MVO 面积,其结果与LGE 图像上测量的区域高度一致,这将为肾功能不全的患者提供一种无需注射对比剂的检测方法。但是对于不同的设备和成像序列,区分心肌损伤程度的阈值会有所不同,需要研究者根据实际确定合适的阈值。
5.2 非缺血性心肌病
T1 mapping 技术能够测量组织的初始T1 值、对比剂增强后的T1 值和ECV 值,可以提供多种参数用于非缺血性心肌病的诊断和鉴别诊断,已应用于肥厚型心肌病[76-80]、扩张型心肌病[81-82]、心肌炎[83-84]、心肌淀粉样变性[85-86]、结节病[87]等多种疾病的临床诊疗和研究中。
已有研究[80,88-89]显示肥厚型心肌病心肌初始T1 值较健康人群升高,LGE延迟强化节段尤著。中国医学科学院阜外医院赵世华教授团队[77]回顾性分析258 例关于肥厚型心肌病患者CMR 图像,结果显示,即使在LGE 检出为阴性且没有血流动力学阻塞的情况下,肥厚型心肌病患者的心肌初始T1 值和ECV值亦显著升高,且最大值均与左心室质量高度正相关,因此指出T1 mapping技术可用于肥厚型心肌病心肌异常改变的早期诊断,相关预后研究还指出ECV 值的升高与不良预后相关,这在其他学者的研究中也得到了证实[79]。另外一方面,肥厚型心肌病心肌初始T1值与健康人群有很大重叠,如Deborde等[76]的研究显示肥厚型心肌病患者的心肌平均初始T1值为995 ms±34 ms (952~1086 ms),而健康志愿者为966 ms±27 ms(920~1042 ms),因此研究提示有时需结合ECV 值共同诊断。如左室心肌达到病理性肥厚程度的运动员心脏与肥厚型心肌病的鉴别[78],前者因细胞肥大导致细胞外间隙相对变小,ECV值与心肌肥厚程度呈负相关,后者则是因为细胞紊乱和间质增生而导致ECV值明显升高。
关于扩张型心肌病的研究[81]表明初始T1值与扩张型心肌病患者的射血分数存在明显负相关。Li等[82]对扩张型心肌病的不同病程终点与心肌T1 mapping和ECV的相关性进行了研究,发现心肌初始T1值和ECV值均增高,且对扩张型心肌病预后是有价值的,尤其是在心肌延迟增强检查为阴性结果的患者中,其对疾病风险分级的价值尤为重要。
急性心肌炎是年轻人(≤35 岁)心源性猝死的主要原因,对比剂增强前的T1 mapping 和T2 mapping 已被纳入2018 年的非缺血性心肌炎路易斯湖标准(Lake Louise Criteria)[83],明确了其对组织性质的客观评价效能。急性心肌炎导致的心肌组织充血应该会使增强后早期的病变处心肌钆的相对含量更高,T1 弛豫时间缩短更强烈,但是增强早期的T1 mapping尚未被列入指南。Palmisano 等[84]最近提出了早期T1 缩短百分比这一概念,可以通过增强早期T1 (对比剂注射后2 min开始采集)与初始T1 的差值占初始T1 的百分比来表示增强早期单纯因为对比剂聚集量而造成的T1 值的变化,从而排除众多T1 mapping 的影响因素,实现对心肌充血情况的量化,而且其诊断效能均优于增强晚期T1 mapping (对比剂注射后15 min开始采集)和ECV定量。
除了上述直接用T1 mapping 所得测量值进行比较研究,Kranzusch 等[90]将生物统计学中的Z-score 应用于不同设备厂家的不同MOLLI 序列定量测量结果与非直观参数的研究,证明了经过数据后处理生成的相应Z-score 图定量结果可以排除设备型号、场强和成像序列对定量结果的影响,也验证了Z-score 定量对心肌淀粉样变患者的诊断准确性与传统T1 mapping 相同,是适合临床应用的标准化评价方法。但是,这项研究中仅涉及几种不同的MOLLI 序列,并没有涵盖SASHA、SAPPHIRE 等序列。也有学者[91]表示Z-score 尚不能很好地应用于MOLLI 定量标准化比较,他们通过对文献调查和相关成像参数的研究给出了几个健康人群MOLLI序列定量的T1值参考范围。但是,这些生物统计学的方法目前也只能作为参考,以增强诊断或研究者的信心,更重要的还是如何从精准成像的角度优化和分析心肌定量结果。
总之,随着设备软硬件的改良、进步,T1 mapping 技术已广泛应用于各类心肌病的临床诊疗及随访之中,虽仍存在一些不足,但已在很大程度上提高了相关疾病的诊治水平。
综上所述,T1 mapping 技术具有多种准备脉冲和读出序列模式,在该技术的发展过程中,研究者对这两项成像要素及其相应的后处理方法进行了持续改进,使得T1 mapping 的成像效能大大提升。对于该项技术发展过程的了解,将有助于心血管影像工作者深入理解T1 mapping 的成像原理与成像过程,在临床工作中,针对遇到的问题自主寻找原因及解决方案,并能够结合不同成像特点,更加准确地分析图像、诊断疾病。本文将有助于心血管影像工作者对T1 mapping 技术进行深入思考,寻找医工结合、共同实现精准成像的新思路。
作者利益冲突声明:全部作者均声明无利益冲突。
