慢性肾病患者右肾皮髓质的APT与mDixon-Quant相关性研究
2022-05-28王悦刘爱连鞠烨杜长谕姜昊洋戚伶俐卜欣淼胡文君王楠王家正
王悦,刘爱连*,鞠烨,杜长谕,姜昊洋,戚伶俐,卜欣淼,胡文君,王楠,王家正
作者单位:1.大连医科大学附属第一医院放射科,大连116011;2.大连市医学影像人工智能工程技术研究中心,大连116011;3.大连医科大学,大连116044;4.飞利浦(中国)投资有限公司,上海200040
慢性肾病(chronic kidney disease,CKD)是一个全球性的公共健康问题,我国成年人CKD 发病率约11%,发病率逐年上升且发病年龄逐渐走低[1]。因其起病隐匿,早期症状轻微而使患者常常错失最佳干预时期,最终造成不可逆性肾损害。目前通常采用基于血清肌酐水平的估算肾小球滤过率(estimation of glomerular filtration rate,eGFR)或病理活检进行肾功能评估,但eGFR 敏感度不高且难以反映初期肾损害,病理活检虽为诊断的金标准,但方法有创且取样易产生偏差,故均有一定的临床应用局限性[2]。因此,寻求一种无创且能准确评估CKD 患者肾功能的方法对疾病的诊断与预后至关重要。
近年来,磁共振功能成像(functional magnetic resonance imaging,fMRI)技术日益成熟,可无创性提供肾脏结构及功能特征。其中,mDixon-Quant是一种具有高效的采集速度、出色的压脂效果及精确的脂肪定量等特点的新型MRI 技术,具有表观弛豫率(R2*)、脂肪分数(fat fraction,FF)两个参数。酰胺质子转移(amide proton transfer,APT)成像技术基于组织中的内源性蛋白与多肽进行无创无对比剂成像。目前国内外尚未有研究将二者同时应用于CKD 中,本研究创新性地采用APT 与mDixon-Quant 技术共同评估CKD 肾损害程度,并探究二者参数APT、R2*及FF间的相关性。
1 资料与方法
1.1 研究对象
本研究经大连医科大学附属第一医院医学伦理委员会批准(批准文号:PJ-KS-KY-2021-250),免除受试者知情同意。回顾性收集2019 年8 月至2020 年10 月于大连医科大学附属第一医院行3.0 T 磁共振检查的CKD 患者病例资料共30 例,其中女15 例,男15 例,年龄19~75 (47.1±15.5)岁。同时收集22 例健康志愿者资料作为对照组,其中女17 例,男5 例,年龄24~60 (33.7±11.6)岁。
1.2 CKD患者、健康志愿者的纳入及排除标准
CKD 患者纳入标准:(1)年龄大于18 周岁;(2) CKD,符合国际肾脏基金会肾脏疾病预后质量倡议(NFK-KDOQI)[3]提出的肾脏疾病定义;(3)所接受的磁共振扫描序列齐全,包括常规肾脏扫描序列(T1WI、T2WI)及mDixon-Quant、APT 序列。排除标准:(1)有如下合并症:肾结石、肾积水、肾肿瘤、多囊肾等肾脏疾病及全身性疾病;(2)服用影响肌酐水平的药物(如西咪替丁、甲氧苄啶、头孢噻肟)或接受肾脏替代治疗;(3)图像质量较差。
健康志愿者纳入标准:问卷调查结果显示为定期体检的健康成年人(年龄大于18 周岁)。排除标准:(1)既往存在全身代谢或内分泌疾病、糖尿病或高血压病史;(2)经MRI证实存在肾脏占位性病变、肾积水、感染等所致的肾功能不全;(3)检查前三个月内使用血管性或肾毒性药物;(4)存在MRI 检查禁忌证;(5)图像质量差。
1.3 MRI扫描参数
采用3.0 T MR 扫描仪(Ingenia CX, Philips, Poland)进行肾脏扫描,使用32 通道腹部线圈,所有受试者在扫描前需禁食6 h以上。扫描序列及参数见表1。
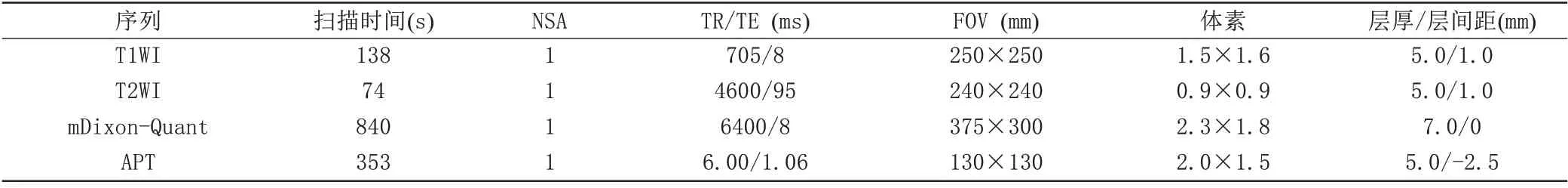
表1 所有使用序列的详细扫描参数
1.4 图像分析与数据测量
将所有原始图像导入ISP (Intellispace Portal 9,Philips Healthcare)工作站,生成伪彩图,在APT 及mDixon-Quant 图像上进行测量。因右肾的解剖位置相对固定,且受呼吸运动及腹膜内肠气影响较左肾轻微,同时为保证B0 和B1 场的均匀性,本研究仅对右肾进行图像分析及数据测量。由两名分别具有2 年和7 年腹部影像诊断经验的放射科医师对照常规MR扫描序列T1WI及T2WI识别肾脏皮髓质及其他解剖结构,并从肾的上极、中部、下极各选取一个层面,把ROI 分别放置在皮质和髓质区,面积约10~20 mm2,避开肾窦、大血管及肾周组织,取皮质或髓质三个层面各参数的均值作为最终的测量值。
1.5 eGFR的评估
所有受试者均于MRI检查当日测定血清肌酐(Scr)值,通过肾病膳食改善公式(modification of diet in renal disease,MDRD)计算eGFR。公式为eGFR=186×SCr-1.154×年龄(岁)-0.203×(0.742 女性)×(1.233 中国人)[4]。依据肾脏疾病患者生存质量指导(kidney disease outcomes quality initiative,K-DOQI)中关于CKD 的分期标准[5],按照eGFR 将CKD 患者分为轻度肾损害组[eGFR≥60 mL/(min·1.73 m2),14 例,男7 例,女7例,年龄19~75 (48.64±16.11)岁]和中重度肾损害组[eGFR<60 mL/(min·1.73 m2),16 例,男8 例,女8 例,年龄19~75(45.75±15.36)岁]。
1.6 统计学分析
数据采用SPSS 26.0 软件进行统计学分析,使用同类相关系数(intra-class correlation coefficients,ICC)检验两位观察者间测量的一致性,ICC 值>0.75 为一致性良好,ICC 值 在0.40 至0.75 间 为 一 致 性 中 等,ICC 值<0.40 为 一 致性较差。数据不符合正态分布情况下,采用斯皮尔曼检验各组皮髓质的APT 值与R2*及FF 值的相关性,P<0.05 为差异具有统计学意义。
2 结果
2.1 健康志愿者及轻度、中重度肾损害患者肾脏T2WI、APT、R2*、FF影像图
各序列所有图像清晰可测量,肾脏结构显示明确,未见明显变形及伪影。具体健康志愿者及轻度、重度肾损害患者肾脏T2WI、APT、R2*、FF图像见图1~3。
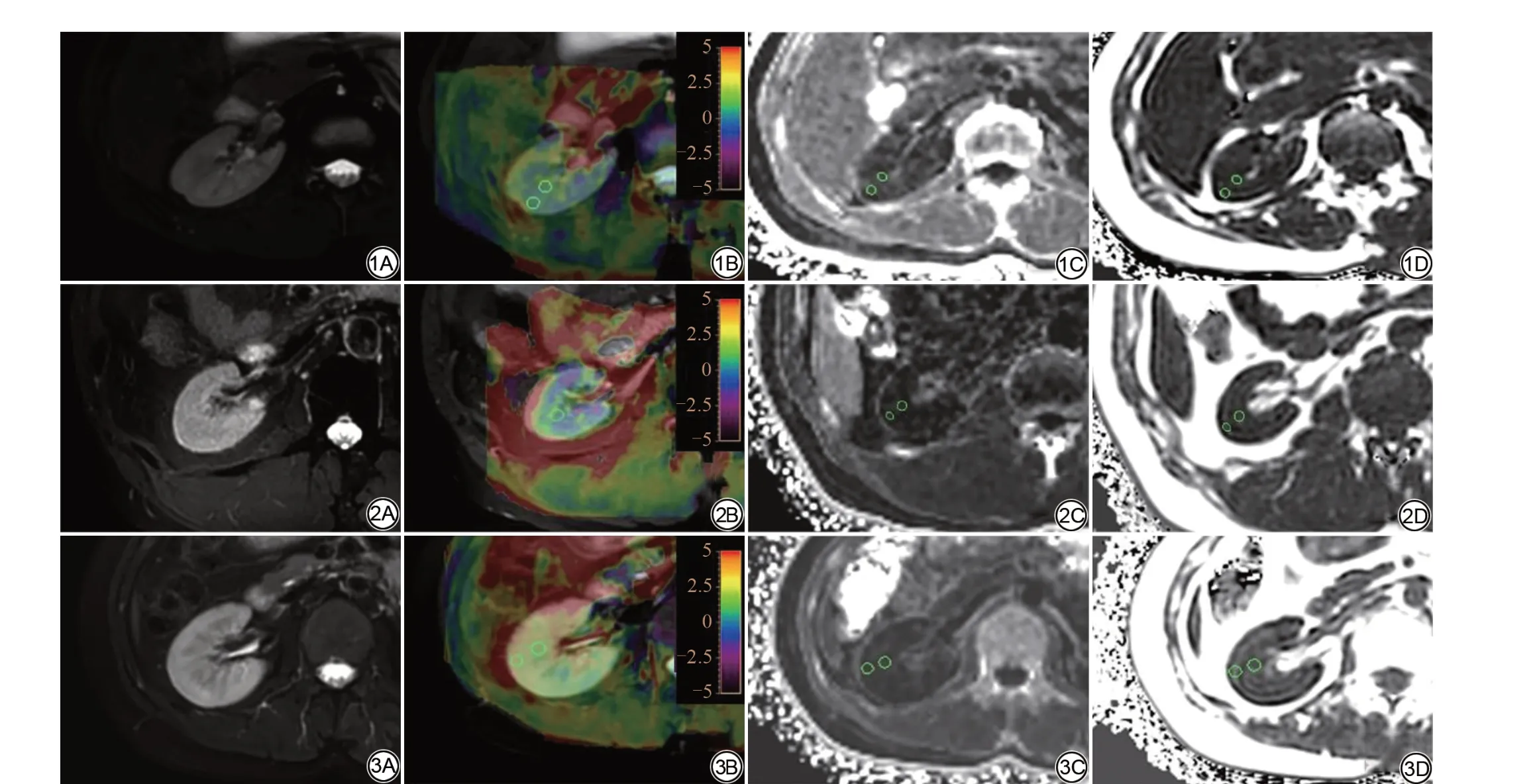
图1 女,23 岁,轻度肾损害(CKD 1 级)患者,eGFR=86.8 mL/(min·1.73 m2)。1A:T2WI 图像;1B :APT 伪彩图与T2WI 融合图像;1C:横向弛豫率(R2*)图像;1D:脂肪分数(FF)图像。皮质APT、R2*、FF 定量值分别为3.2%、12.20/s、0.18%,髓质定量值分别为2.2%、13.91/s、0.33%。 图2 男,34 岁,重度肾损害(CKD 5级)患者,eGFR 为23.2 mL/(min·1.73 m2)。2A:T2WI图像;2B:APT伪彩图与T2WI融合图像;2C:R2*图像;2D:FF图像。皮质APT、R2*、FF定量值分别为2.1%、29.05/s、1.77%,髓质定量值分别为4.1%、17.97/s、3.7%。 图3 女,26 岁,健康志愿者。3A:T2WI 图像;3B:APT 伪彩图与T2WI 融合图像;3C:R2*图像;3D:FF图像。皮质APT、R2*、FF定量值分别为1.4%、15.96/s、0.85%,髓质定量值分别为1.5%、22.74/s、2.74%。
2.2 两位观察者间测量结果一致性分析
两位观察者间各参数测量结果ICC 值均大于0.75,一致性良好,最终取观察者2的数据进行后续分析。具体见表2。
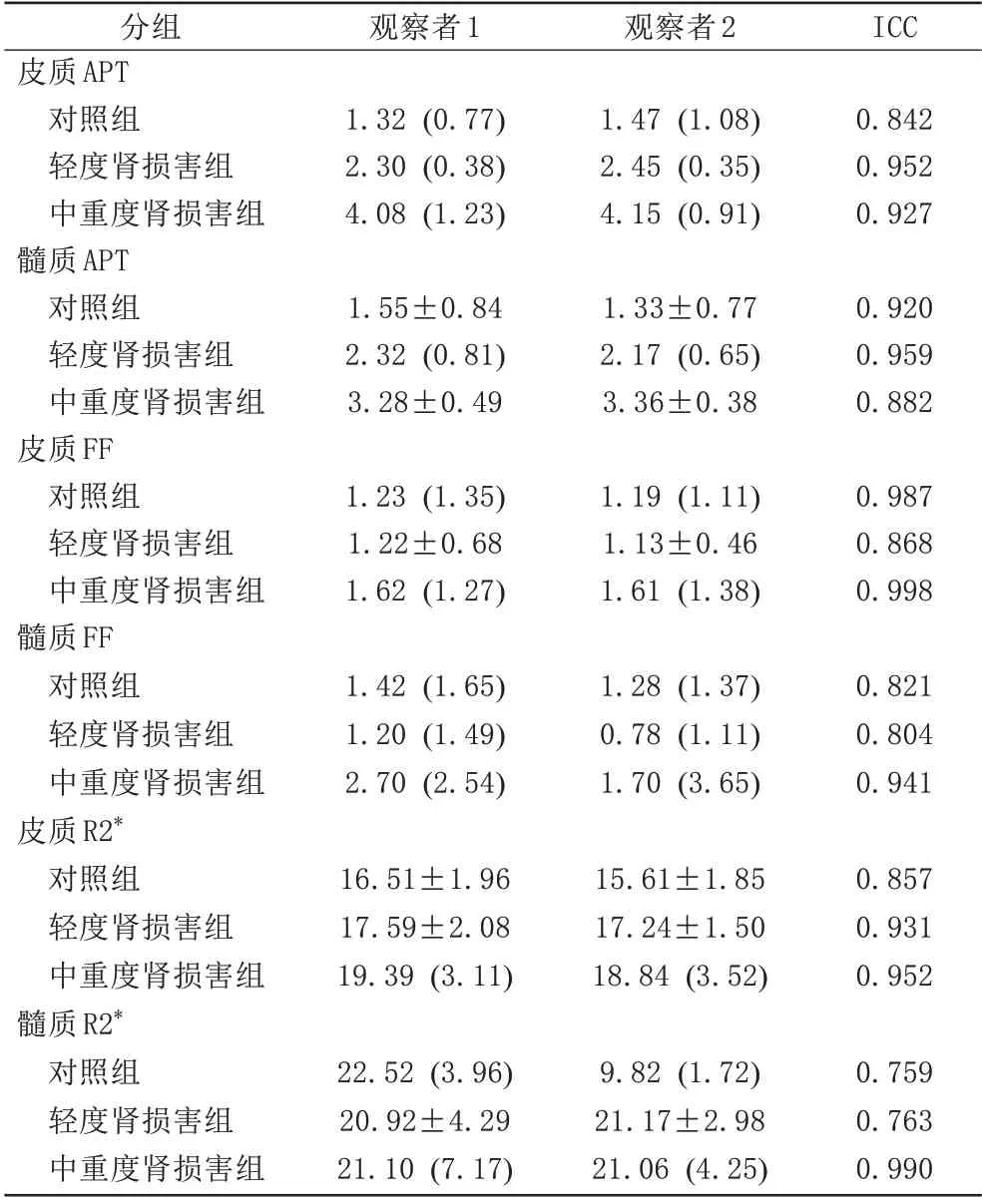
表2 两位观察者间各参数测量结果一致性分析
2.3 对照组及轻度、中重度肾损害组皮髓质APT 值与R2*、FF值相关性
斯皮尔曼相关性分析显示轻度肾损害组皮髓质APT 值与FF 及R2*值均无相关性;中重度肾损害组皮质APT 值与FF 值呈正相关,差异具有统计学意义(r=0.51,P<0.05) (图4),而皮质APT 值与R2*值无相关性,髓质APT 值与R2*及FF 值均无相关性;对照组皮髓质APT 值与R2*及FF 值均无相关性(表3)。
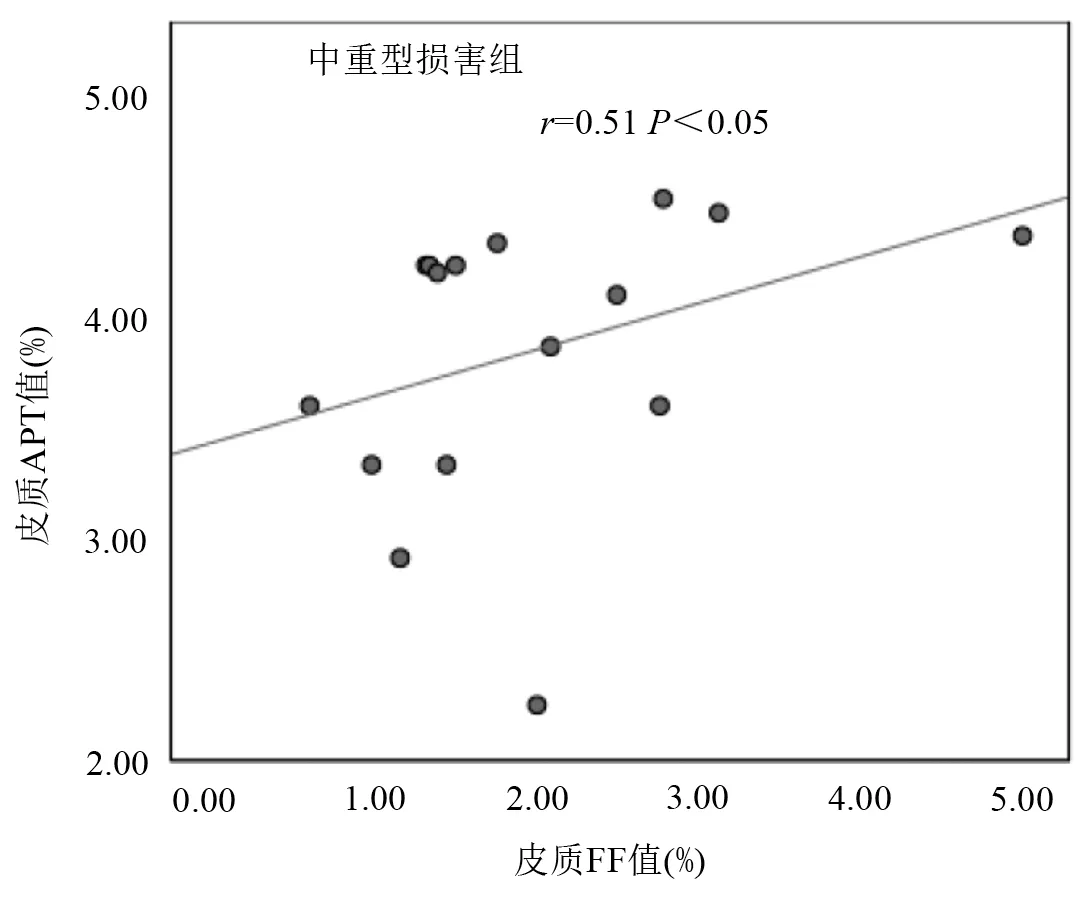
图4 中重度肾损害组皮质APT 值与FF值相关性散点图,线性回归分析得出相关系数为0.51,斜率为0.21。注:APT:酰胺质子转移;FF:脂肪分数。
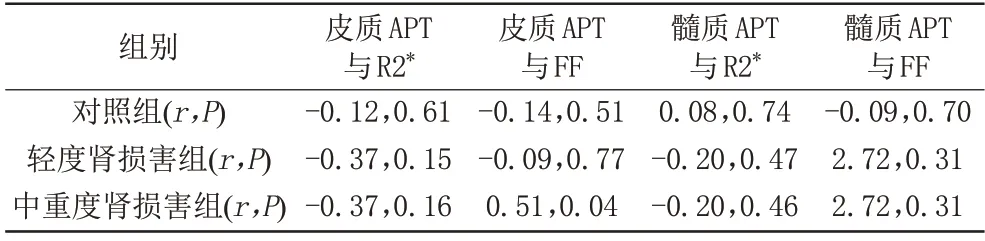
表3 各组皮髓质APT值(%)与R2*值(/s)、FF值(%)相关性
3 讨论
mDixon-Quant与APT成像均为分子水平的fMRI技术。其中,mDixon-Quant 参数R2*与脱氧血红蛋白含量呈比例,可以间接反映组织局部的氧分压,而FF 能够准确定量体内多种组织的脂肪沉积,反映机体不同状态下组织内脂肪含量变化[6-7]。mDixon-Quant 序列现已广泛应用在肝脏[8]、骨关节[9]系统的脂肪定量研究中。APT 成像基于化学交换饱和转移(chemical exchange saturation transfer,CEST)技术,其信号强度(APT 值)与酰胺质子-水质子交换速率成正比,可反映病变组织内源性蛋白、多肽含量及所处环境的PH值[10-11]。作为一种安全无创的新型fMRI技术,APT已广泛应用于神经系统[12]、子宫[13]等中。目前将APT应用于人体肾脏的研究极为少见,王楠等[14]首次报道了人体肾脏APT 成像的可行性,研究表明正常肾脏不同区域的APT 定量测量具有较好的重复性,但双侧肾脏间髓质APT 值差异较大,需后续校准试验,而本研究仅涉及右肾皮髓质的APT值测量。
本研究通过探究CKD右肾皮髓质APT与mDixon-Quant序列参数R2*、FF 间的相关性,进而评估CKD 肾功能及肾损害程度。结果显示CKD中重度肾损害组皮质APT值与mDixon-Quant序列FF 值呈正相关(r=0.51,P<0.05),其余各组皮髓质参数间均无明显相关性,APT 与FF 可分别从不同角度反映肾损害时肾脏蛋白质、酸碱环境变化及脂沉积的关系。本研究国内外首次提出探究APT与mDixon-Quant定量参数间的相关性,为CKD的早期诊断与评估提供了一定的参考依据。
3.1 CKD中重度肾损害组皮质APT值与皮质FF值呈正相关
本研究结果显示CKD 患者中重度肾损害组皮质APT 值与mDixon-Quant 序列皮质FF 值呈正相关,差异具有统计学意义(r=0.51,P<0.05)。APT 信号强度主要受组织内蛋白含量及PH 值影响。Ju 等[15]首次将APT 成像应用于CKD 肾功能及肾损伤程度的评估中,结果显示对照组、轻度、中重度肾损害组皮质和髓质APT 值均呈现逐渐升高的趋势。这可能是因为慢性肾损伤伴随着细胞外基质的累积,而细胞外基质主要由胶原、非胶原糖蛋白和蛋白多糖组成,蛋白含量的增加导致CKD 组APT值的升高[15];此外,作者推测当肾损伤程度加重时,肾小管上的离子泵功能减低影响离子交换,破坏原有酸碱平衡,导致酰胺与水质子交换速率增加,从而使APT值升高。
肾脏脂质沉积加重组织缺氧,进而诱导炎症反应和氧化应激的发生,从而促进肾小管损伤及间质纤维化,加速CKD 的进展。Yokoo 等[16]验证了mDixon-Quant 成像在肾脏脂肪定量中的可行性,并得出2 型糖尿病患者肾脏FF 值较非2 型糖尿病者高;Wang 等[17]使用Dixon 技术进行早期糖尿病肾病的肾脏脂肪定量,结果微量白蛋白尿组的FF 值显著高于正常白蛋白尿组和健康对照组;以上均可说明CKD 肾损害时存在肾脏脂肪沉积。
CKD患者存在脂代谢紊乱,多伴有甘油三酯及氧化低密度脂蛋白(oxLDL)水平升高等高脂血症表现[18],这些多余的脂质可沉积在肾脏系膜细胞、足细胞、近端小管上皮细胞等几乎所有类型的细胞中。CD36 是一种可介导oxLDL 摄取的多功能跨膜糖蛋白,也是肾脏中主要的脂肪酸摄取系统,在CKD 的发生发展中起核心作用[19]。研究表明肾损伤患者和动物肾脏中CD36水平较高[20];肾脏CD36表达水平在CKD患者中更高,并且与肾脏脂质沉积相关[21]。
综上所述,CKD 时CD36 及细胞外基质等蛋白质含量增加、酸碱平衡破坏、肾脏脂质沉积三者同步出现,APT与FF变化方向一致,理论上成正相关,正印证了本研究结果。但这种相关仅出现在中重度肾损害组皮质上,这可能是因为轻度肾损害时肾脏尚可代偿一部分病理变化,而中重度肾损害时蛋白质、脂代谢紊乱及酸碱平衡破坏程度加重,因此APT 与FF 变化趋势可能更为明显、一致;此外,肾皮质血流灌注较髓质大且对缺氧耐受也更好[22],因此髓质缺氧程度更为严重,髓质功能性肾单位数量减少,结构和功能改变更为明显,蛋白质含量及各种物质代谢反而减少,这可能在某种程度上导致APT 与FF 变化趋势产生差异、缺乏明确相关性。因此,健康志愿者、轻度肾损伤组皮髓质及中重度肾损伤组髓质区APT与FF未呈现出明显的相关性。
3.2 轻度、中重度肾损伤组及健康对照组皮髓质APT 值与R2*值均无相关性
本研究结果显示轻度、中重度肾损伤组及健康对照组皮髓质APT 值与R2*值均无明显相关性。R2*与脱氧血红蛋白含量呈正比,反映组织氧合水平,R2*除了主要受脱氧血红蛋白浓度影响之外,肾脏微组织结构含水量、血容量、红细胞压积及毛细血管分布等同样对R2*值产生一定影响[23]。CKD时肾小球硬化、间质纤维化,致使肾脏血流动力学紊乱、肾脏灌注减低,理论上肾脏处于相对缺氧状态。然而,也有学者提出CKD时肾小管萎缩及小分子主动转运减少可共同导致Na+-K+-ATP泵功能减低,耗氧量减少;此外,随着肾损害程度的增加,不仅eGFR 降低,超滤也会降低,近端小管对NaCl 的活性吸收减少,导致Na+泵功能减低,耗氧量减少[24];二者均可使得肾组织氧合水平增加,脱氧血红蛋白含量降低。
总之,肾组织蛋白含量及PH 值与脱氧血红蛋白含量变化并未呈现出明确相关,因此各组皮髓质APT 值与R2*值间相关性不显著,还需要进行多因素回归分析深入研究证实。
3.3 局限性
本研究尚存在一定局限性:第一,一些与肾功能相关的血清代谢产物浓度,如C-甘露糖基色氨酸和假尿苷[25],也可能与APT 值相关,在当前研究中未进行测量,将在未来的研究中改进;第二,APT与mDixon-Quant序列的扫描层厚不同,勾画ROI时各序列图像难以完全匹配,可能会对部分结果造成偏差;第三,肾脏结构具有一定的异质性,且随着CKD 病情的进展,皮质与髓质界限不清,这可能影响ROI 放置及测量的准确性;第四,本研究仅使用右肾APT 值(结果较为稳定)进行分析,难以与双侧肾脏的实验室检测结果准确匹配。
综上所述,CKD中重度肾损害组皮质APT值与mDixon-Quant序列的皮质FF值呈正相关,二者可从不同角度反映肾损害时肾组织蛋白质、酸碱环境变化及脂质沉积的关系,为CKD 的早期诊断与评估提供了一定的参考依据。
作者利益冲突声明:全体作者均声明无利益冲突。
