结构网络拓扑属性改变对早期帕金森病伴轻度认知障碍的预测价值
2022-05-28赵晓岩张维钟维佳郭大静李传明周百万吴小佳
赵晓岩,张维,钟维佳,郭大静,李传明,周百万,吴小佳
作者单位:重庆医科大学附属第二医院放射科,重庆400010
轻度认知障碍(mild cognitive impairment,MCI)是帕金森病(Parkinson′s disease,PD)的主要非运动症状之一[1]。约42%的PD 患者在疾病早期伴有轻度认知障碍(PD patients with MCI,PD-MCI)[2],并且约39%的PD-MCI 患者在5 年内会进展为痴呆[3],从而严重降低患者生活质量并增加残疾及死亡率。因此,进一步研究PD-MCI 发生、发展的神经病理机制,对其早诊断、早干预具有重要的临床意义。
既往脑结构磁共振成像研究发现PD患者额颞叶的灰质萎缩和白质完整性改变与认知能力下降有关[4-6]。然而,上述研究仅局限于局部脑区结构的异常,人类的认知功能是依赖各脑区之间的相互作用形成一个复杂而庞大的网络共同完成的,并可以利用图论原理进行分析。目前仅有少数文献报道过PD-MCI 网络拓扑结构的横向改变[7-9],然而对于短期内由认知正常进展为MCI 的PD 患者其脑白质网络的纵向改变仍然缺乏相关研究。因此,本研究利用图论原理对弥散张量成像(diffusion tensor imaging,DTI)数据进行分析,通过研究短期内发展为PD-MCI患者脑白质结构网络的纵向改变,以期寻找早期认知正常的PD 患者向PD-MCI 转化的影像学标志物,从而建立预测模型对疾病的早期诊断及干预治疗提供帮助。
1 资料和方法
1.1 一般资料
本研究所用被试者均来自Parkinson′s Progression Markers Initiative (PPMI)数据库(http://www.ppmi-info.org)。根据PPMI 协议,每个站点均独立获得伦理审查委员会的批准,且所有被试均签署知情同意书。
本研究共纳入83 例在该数据库基线时(2011~2013 年)认知能力正常的PD 患者,且均完成4 年后的影像学及完整的认知功能的评估随访,具体流程如图1所示。基线时PD患者纳入标准:(1)静止性震颤、运动迟缓、肌强直,或不对称的静止性震颤或运动迟缓具有两种及以上;(2) PD诊断少于2年且没有接受药物或手术治疗;(3) Hoehn 和Yahr (H & Y)分级Ⅰ或Ⅱ期;(4)影像学表现出多巴胺转运蛋白缺陷;(5) DTI和3D-T1WI结构成像的图像质量良好,且使用Siemens MAGNETOM Trio 3.0 T仪器采集。排除标准:(1)因药物或代谢紊乱、脑炎或退行性疾病引起的非典型PD 综合征;(2)近期服用PD 药物;(3)有轻度认知障碍及痴呆的临床诊断;(4)磁共振检查显示有其他神经疾病证据。
所有受试者于基线及4 年后随访时均行一系列量表评估。运动症状:(1)国际运动障碍学会统一帕金森病评估量表第三部分(the Movement Disorder Society-Sponsored Revision Unified Parkinson′s Disease Rating Scale-Ⅲ,MDS-UPDRS-Ⅲ);(2) Hoehn& Yahr (H & Y)量表。总体认知功能:蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)。区域认知状态用神经心理学量表评估:(1)记忆:霍普金斯词语学习测验修订版(Hopkins Verbal Learning Test-Revised,HVLT-R);(2)执行:语义流畅性测试(Semantic Fluency,SF);(3)工作记忆力:数字字母排序 测 试 (Letter-Number Sequencing, LNS);(4)视空间能力:Benton 直线定向判断(Benton Judgment of Line Orientation,BJLO);(5)注意力:符号数字模式测试(Symbol Digit Modalities Test,SDMT)。此外,所有受试者还收集了年龄、性别、受教育年限、病程等一般临床资料。
PD-MCI 患者依据2012 年国际帕金森病和运动障碍学会推荐的Ⅰ级标准诊断,即进行有限的神经心理测试时,至少有两项测验评分低于正常对照组平均值1.5 个标准差[10]。认知正常的PD 患者诊断标准为MoCA≥26 分,5 项神经心理测试异常数目≤1 个。最终,所有的83例基线时认知能力正常的PD患者中,有26例在4年后的随访中转换为PD-MCI,57例仍保持认知正常(PD patients with normal cognition,PD-NC)。因此,我们将所有研究对象分为两组:PD-MCI组(n=26)和PD-NC组(n=57),见图1。
1.2 仪器与方法
纳入对象的MRI数据均由Siemens MAGNETOM Trio 3.0 T核磁共振扫描仪采集。参数如下:(1) 3D-T1WI:矢状位,重复时间/回波时间= 2300 ms/2.98 ms,层厚=1 mm,翻转角=9°,体素:1.0×1.0×1.0 mm³,扫描矩阵=240×256;(2) DTI 序列:横轴位,重复时间/回波时间=500~9000 ms/88 ms,翻转角=90°,体素:2.0×2.0×2.0 mm³,扫描矩阵=1044×1044,b值=1000 s/mm²,梯度方向=64。
1.3 数据分析
1.3.1 数据预处理
采用Pipeline for Analyzing braiN Diffusion imAges (PANDA)软件对图像进行预处理(https://www.nitrc.org/projects/panda)[11]。预处理步骤包括:(1)将DICOM 格式数据转换为NIFTI 格式;(2)头动及涡流校正;(3)用Brain Extraction Tool (BET)去除非脑组织;(4)使用Diffusion Tensor Model fit (DTIFIT)计算弥散张量指标各向异性分数(fractional anisotropy,FA),并生成原始的FA图。
1.3.2 脑结构网络构建
由PANDA软件完成,使用自动解剖标定(automated anatomical labeling,AAL)模板将大脑分割为90 个脑区,即脑结构网络的节点;首先将个体的3D-T1WI图像配准到B0图像空间中,然后非线性配准到Montreal Neurological Institute 152 (MNI-ICBM152)模板上,再使用逆转换过程将AAL 模板从MNI 空间转换到DTI空间,从而得到个体AAL模板。接下来,使用PANDA中的确定性连续追踪算法(the fiber assignment by continuous tracking,FACT)进行全脑白质纤维束追踪,纤维跟踪在跟踪偏转角度大于45°或体素的FA 值小于0.2 时停止。然后结合全脑白质纤维束和个体AAL模板,提取每两个脑区之间所有纤维束的平均FA值,最后生成一个90×90的加权FA网络矩阵。
1.3.3 脑结构网络拓扑属性分析
使用GRETNA软件计算脑结构网络拓扑属性[12],其中全局属性包括:全局效率(global efficiency,Eg)、局 部 效 率(local efficiency,Eloc)、聚 类 系 数(clustering coefficients,Cp)、特 征 路 径 长 度(shortest path length,Lp)、标 准 化 聚 类 系 数(normalized clustering coefficient,Gamma),标准化特征路径长度(normalized shortest path length,Lambda)和小世界属性(small-worldness,Sigma)。节点属性包括节点度(betweenness centrality,Bc),节点介数(degree centrality,Dc)和节点效率(nodal efficiency,Ne)。
1.4 统计学分析
使用SPSS 25.0 统计软件进行分析,P<0.05 认为差异具有统计学意义。年龄、受教育年限、病程、运动和认知相关评分及网络拓扑属性在基线及第4年随访时的组间比较采用独立样本t检验,将年龄、性别、受教育年限、病程、UPDRS 评分作为网络属性分析的协变量;性别、H & Y分期采用χ²检验;PD-MCI组在4 年内网络属性的纵向改变采用配对样本t检验。为避免多重检验误差,局部属性的组间比较用FDR校正。
参考Sun 等的研究方法[13-14],我们将在三个节点属性(Bc,Dc 和Ne)中的至少两个中表现出显著差异的节点定义为差异脑区,然后在这些差异脑区之间使用基于网络统计的分析方法(network-based statistics,NBS)来检测PD-MCI 患者中有异常连接的边构成的子网络[15]。然后我们设置一个最初阈值(本文是t=2.3),找到阈值以上的边的连接成分,再使用非参数置换检验(5000 次置换)找到P<0.05 的显著异常连接的边。
为了便于计算,我们将每个时间点的各个患者的原始影像数据和认知评分转换为Z值(即原始数据减去PD-NC 组的基线平均值,再除以PD-NC 的基线标准差),然后用第4 年随访的Z值减去基线的Z值得到各数据的δ值。使用受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)来评估各认知数据(δ值)及表现出显著纵向改变的网络属性(δ值)区分PD-MCI和PD-NC 的能力,其最佳界值为约登指数(即敏感度+特异度-1)。对于ROC 分析的阳性结果,采用向前逐步逻辑回归分析,以组(PD-MCI vs. PD-NC)作为因变量,δ值作为自变量来建立最佳预测模型。
2 结果
2.1 临床资料
在基线时,PD-MCI 组的SF 及SDMT 评分低于PD-NC组(P<0.05);但其他人口统计学和临床资料差异无统计学意义(P>0.05)。在第4 年的随访时,PD-MCI 组的所有认知量表的得分均低于PD-NC 组(P<0.05);MDS-UPDRS-Ⅲ差异无统计学意义(P=0.40),详见表1。

表1 人口统计学及临床数据的统计分析结果Tab.1 Statistical analysis results of demographic and clinical data
2.2 小世界属性、全局属性分析
在基线和在第4 年的随访时,两组脑网络的Sigma、Gamma 值均大于1,Lambda 值均约为1,说明两组被试的结构脑网络均呈典型的小世界网络拓扑结构。在基线时,两组的Eloc 和Cp 差异具有统计学意义(P<0.05);其他全局属性差异无统计学意义(表2)。在第4 年的随访时,两组的Eg、Eloc 和Cp 差异存在统计学意义(P<0.05);其他全局属性差异无统计学意义(表2)。在PD-MCI 组的自身纵向对比中,PD-MCI 患者随访后的Eg、Eloc、Gamma 和Sigma 较基线时显著降低,Lp 显著增加(P<0.05);Cp 及Lambda差异无统计学意义(图2)。
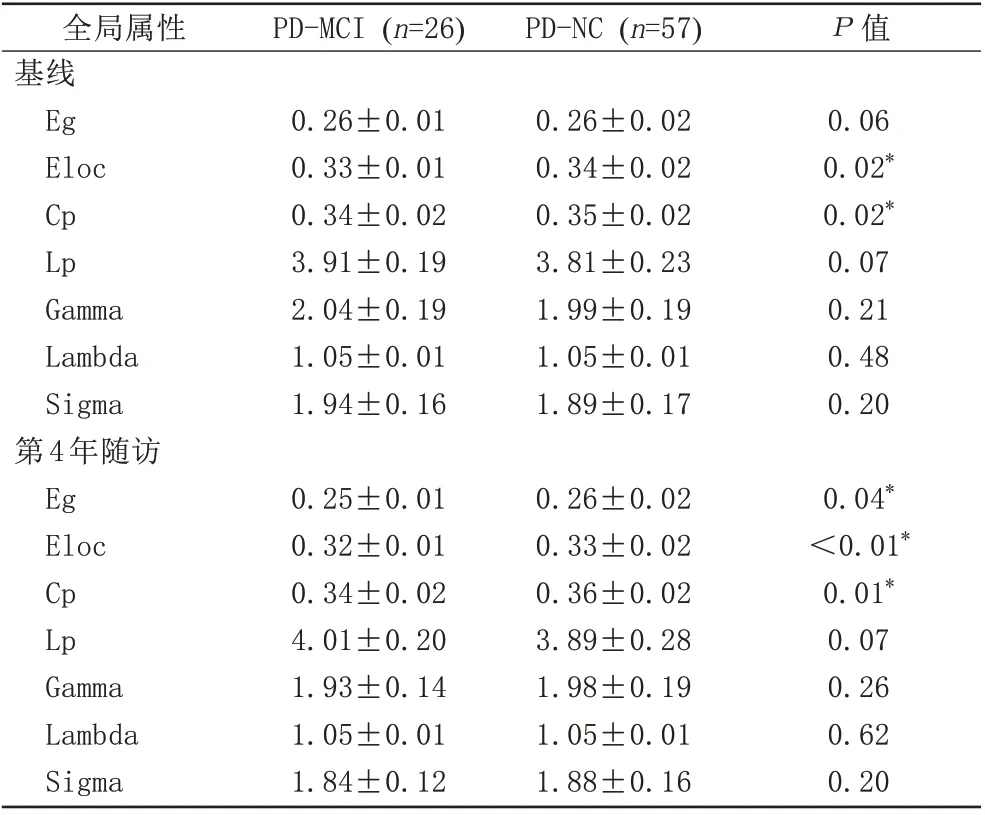
表2 PD-MCI组与PD-NC组全局属性、小世界属性参数比较Tab.2 Comparison of global and small-world attributes parameters between PD-MCI group and PD-NC group
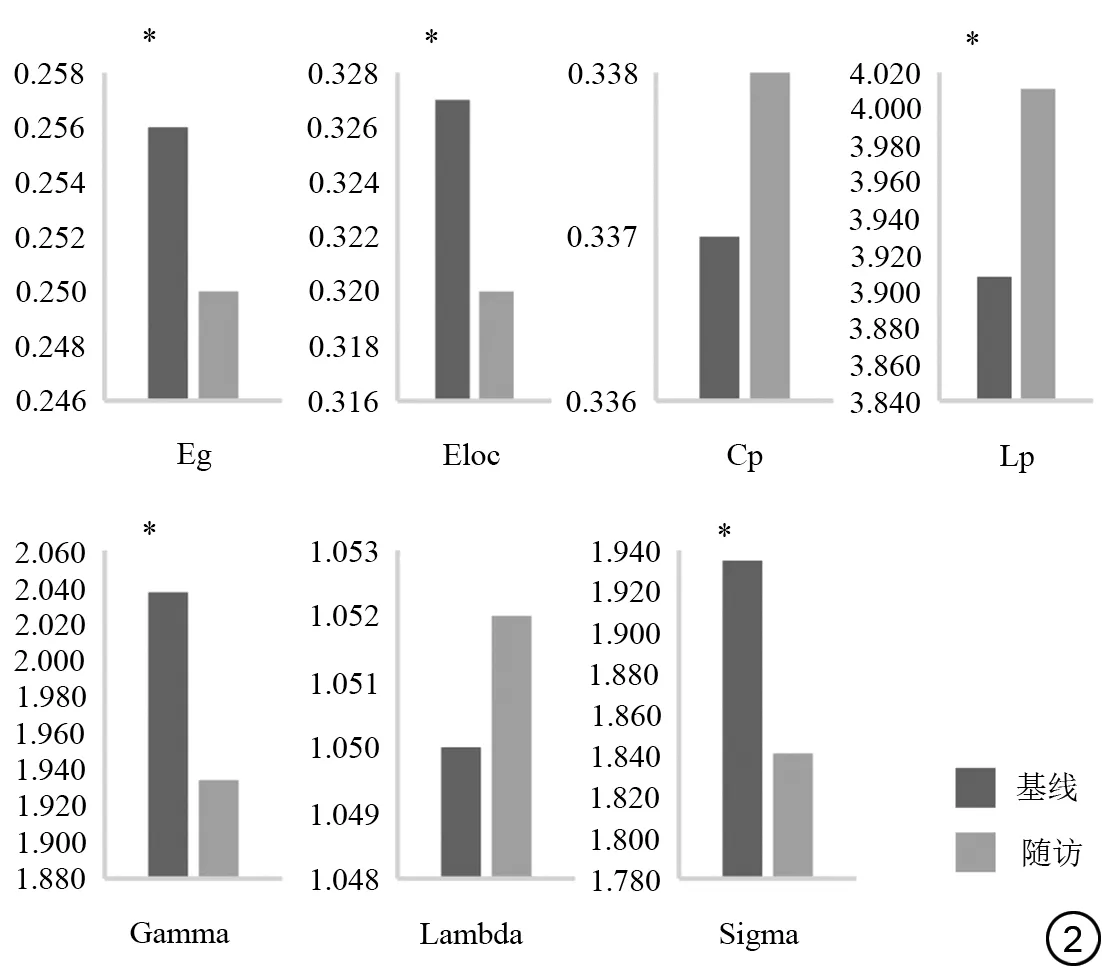
图2 PD-MCI(帕金森病伴轻度认知障碍)组患者全局属性、小世界属性参数的组内纵向改变。Eg:全局效率;Eloc:局部效率;Cp:聚类系数;Lp 特征路径长度;Gamma:标准化聚类系数;Lambda:标准化特征路径长度;Sigma:小世界属性;*:P<0.05。Fig. 2 Longitudinal changes of global and small-world properties in PD-MCI (Parkinson′s disease with mild cognitive impairment) group.Eg: global efficiency; Eloc: local efficiency; Cp: clustering coefficients;Lp: shortest path length; Gamma: normalized clustering coefficient;Lambda: normalized shortest path length; Sigma: small-worldness; * :P<0.05.
2.3 节点属性分析
我们将差异脑区定义为至少两个局部属性(Bc,Dc 和Ne)存在显著差异的大脑区域(P<0.05,FDR 校正)。在基线时,两组间差异无统计学意义的脑区。在第4 年的随访时,与PD-NC 组相比,PD-MCI 组存在广泛节点中心性的降低,主要在额枕顶叶、左侧颞上回颞极和纹状体-边缘系统等25 个脑区(图3A)。在PD-MCI 组的纵向对比中,PD-MCI 患者随访后的节点中心性在额叶:左侧眶部额上回、左侧三角部额下回、左侧和右侧眶内额上回,枕叶:左侧和右侧距状裂周围皮层、左侧和右侧舌回,顶叶:右侧中央后回、左侧顶下缘角回、左侧楔前叶,颞叶:左侧颞上回、左侧和右侧颞中回,和纹状体-边缘系统:左侧前扣带、左侧后扣带回、右侧尾状核多个区域较基线时降低(图3B)。
2.4 NBS分析
在PD-MCI 组内的纵向差异脑区中,我们使用NBS方法检测出一个由11 个点和10 个边组成的连接强度降低的子网络;未发现连接强度增加的子网络。该子网络主要涉及默认网络(default mode network,DMN),包括左侧眶部额上回、左侧和右侧眶内额上回、左侧后扣带回、左侧楔前叶,显著性网络(saliencenetwork,SN),包括左侧前扣带,中央控制网络(central-executive network,CEN),包括左侧三角部额下回、基底神经节(右侧尾状核)和枕叶脑区(左侧和右侧距状裂周围皮层、右侧舌回) (P<0.009,FDR校正;图3B)。
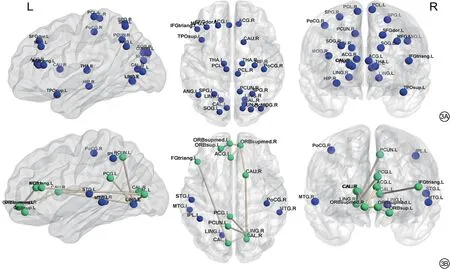
图3 节点属性及NBS 分析结果。3A:在第4 年随访时,与PD-NC(帕金森病认知正常)组相比,PD-MCI(帕金森病伴轻度认知障碍)组节点中心性显著下降的区域;3B:纵向随访中,PD-MCI 组内节点中心性显著降低的区域及连接异常降低的子网络;绿色节点代表出现在节点属性和NBS 分析结果中的大脑区域,蓝色节点代表仅出现在节点属性分析结果中的大脑区域。使用BrainNet Viewer软件包(http://www.nitrc.org/projects/bnv)将结果可视化。SFGdor.L:左侧背外侧额上回;ORBsup.L:左侧眶部额上回;MFG.L:左侧额中回;IFGtriang.L:左侧三角部额下回;ORBsupmed.L:左侧眶内额上回;ORBsupmed.R:右侧眶内额上回;ACG.L:左侧前扣带和旁扣带脑回;ACG.R:右侧前扣带和旁扣带脑回;PCG.L:左侧后扣带回;HIP.R:右侧海马;CAL.L:左侧距状裂周围皮层;CAL.R:右侧距状裂周围皮层;CUN.R:右侧楔叶;LING.L:左侧舌回;LING.R:右侧舌回;SOG.L:左侧枕上回;SOG.R:右侧枕上回;MOG.R:右侧枕中回;PoCG.R:右侧中央后回;SPG.L:左侧顶上回;SPG.R:右侧顶上回;IPL.L:左侧顶下缘角回;ANG.L:左侧角回;PCUN.L:左侧楔前叶;PCUN.R:右侧楔前叶;PCL.L:左侧中央旁小叶;PCL.R:右侧中央旁小叶;CAU.R:右侧尾状核;THA.L:左侧丘脑;THA.R:右侧丘脑;STG.L:左侧颞上回;TPOsup.L:左侧颞极,颞上回;MTG.L:左侧颞中回;MTG.R:右侧颞中回;L:左侧,R:右侧。Fig. 3 Results of regional properties and NBS analysis. 3A: Regions showing decreased nodal centralities in the PD-MCI (Parkinson′s disease with mild cognitive impairment) group compared with the PD-NC (Parkinson′s disease retained normal cognition) group at the 4-year follow-up; 3B: Longitudinally altered node centralityies within the PD-MCI group over time.Green nodes represent the brain regions that appeared in the results of the node and edge analyses,blue nodes represent the brain regions that appeared only in the results of the node analysis. The results were visualized using the BrainNet Viewer package (http://www.nitrc.org/projects/bnv). SFGdor.L: left dorsolateral superior frontal gyrus;ORBsup.L:left superior frontal gyrus orbital part;MFG.L:left middle frontal gyrus;IFGtriang.L:left triangular part of the inferior frontal gyrus; ORBsupmed.L: left superior frontal gyrus (medial orbital); ORBsupmed.R: right superior frontal gyrus (medial orbital);ACG.L: left inferior cingulate;ACG.R: right inferior cingulate;PCG.L:left posterior cingulate;HIP.R:right hippocampus;CAL.L:left calcarine;CAL.R:right calcarine;CUN.R:right cuneus;LING.L:left lingual gyrus;LING.R:right lingual gyrus;SOG.L:right superior occipital gyrus;SOG.R:left superior occipital gyrus;MOG.R:right middle occipital gyrus;PoCG.R:right postcentral gyrus;SPG.L:left superior parietal gyrus;SPG.R:right superior parietal gyrus;IPL.L:left inferior parietal gyrus;ANG.L:left angular gyrus;PCUN.L:left precuneus;PCUN.R:right precuneus;PCL.L:left paracentral lobule;PCL.R:right paracentral lobule;CAU.R:right caudate;THA.L:left thalamus;THA.R:right thalamus;STG.L:left superior temporal gyrus;TPOsup.L:left temporal pole:superior temporal gyrus;MTG.L:left middle temporal gyrus;MTG.R:right middle temporal gyrus;L:left,R:right.
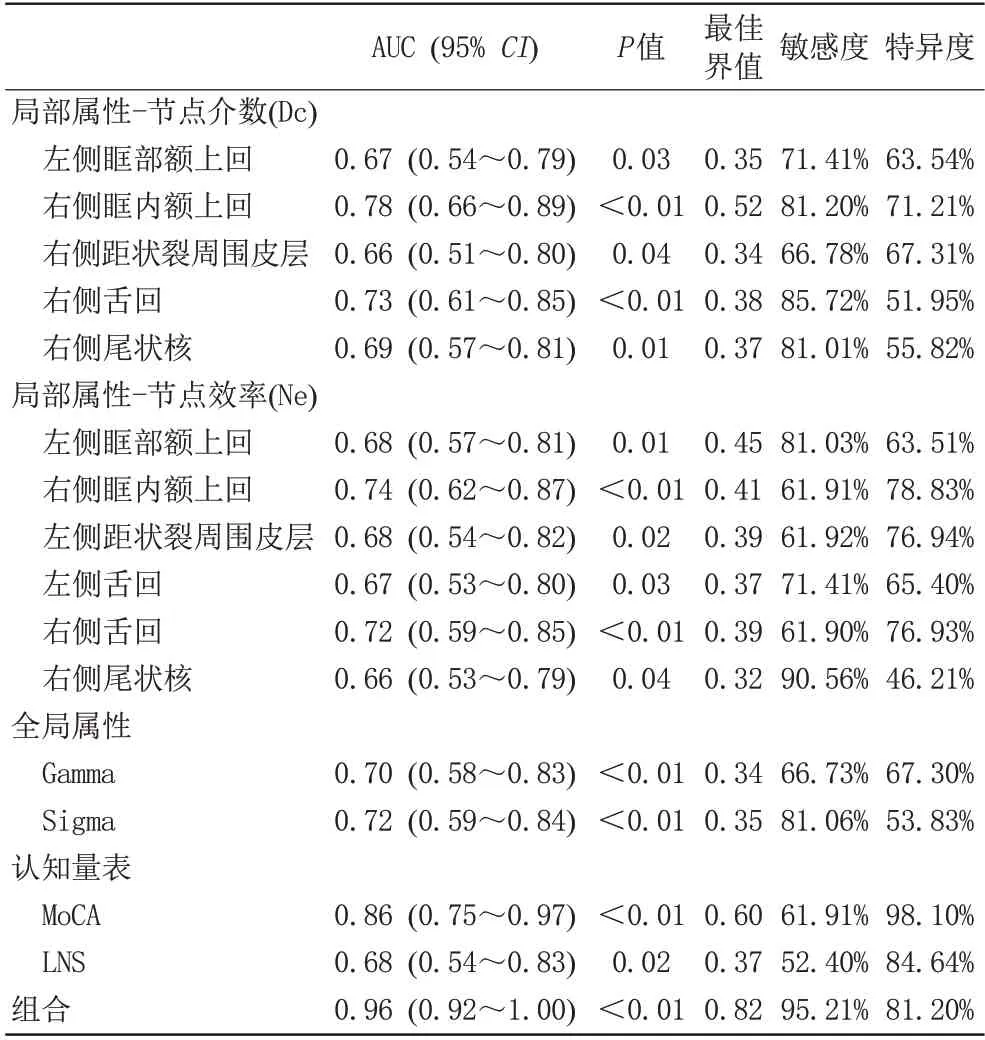
表3 网络拓扑属性和认知数据在区分帕金森病伴轻度认知障碍和帕金森病认知正常的ROC曲线分析Tab.3 ROC curve analysis of network topology attributes and cognitive data distinguishing Parkinson′s disease with mild cognitive impairment and Parkinson′s disease retained normal cognition

图4 区分PD-MCI(帕金森病伴轻度认知障碍)患者和PD-NC(帕金森病认知正常)患者的ROC 曲线。4A:右侧眶内额上回的Dc 和Ne 值的ROC 曲线;4B:MoCA和LNS评分的ROC曲线;4C:上述指标组合的ROC曲线。Dc:节点介数;Ne:节点效率。Fig. 4 The ROC curves for distinguishing PD-MCI (Parkinson′s disease with mild cognitive impairment) from PD-NC (Parkinson′s disease retained normal cognition) patients. 4A: ROC curve of the right medial orbital superior frontal gyrus; 4B: ROC curve of MOCA and LNs scores; 4C: ROC curve of the above index combination.Dc:degree centrality;Ne:nodal efficiency.
2.5 ROC曲线及逻辑回归分析
3 讨论
3.1 PD-MCI患者小世界网络的纵向改变
人脑复杂的网络系统是大脑信息传递和处理的基础[16],且具有“小世界”特征[17];在小世界网络中,网络的功能整合和分化达到最佳的平衡状态,既保证全局效率又具有较高的局部效率。本研究中PD-MCI患者的小世界属性参数较PD-NC 患者差异不大,但PD-MCI组在4年随访后小世界属性显著降低,提示早期PD 患者由认知正常向MCI 转换时网络拓扑结构有一定的破坏。本研究试图通过研究在基线时没有MCI但在4年内发展为MCI的PD患者的结构网络拓扑结构的纵向改变,来揭示PD-MCI 发生的潜在神经生物学机制。
3.2 PD-MCI患者结构网络全局属性的纵向改变
在全局属性分析中,本研究发现PD-MCI 患者4 年随访后的Eg、Eloc 较基线显著降低,同时伴有Lp的增加。Eg、Lp 反映脑结构网络全局水平的信息整合能力,而Eloc 和Cp 反映网络的局部信息处理能力,因此推测早期PD 患者在由认知正常向MCI 转换的过程中白质纤维发生变性,导致网络功能整合和分化能力降低。既往有横向研究也发现PD-MCI患者的Eg 和Eloc 的降低和Lp 的增加[7-9]。由此可以推断脑网络拓扑结构的紊乱可能是PD患者出现认知障碍的原因。
3.3 PD-MCI患者结构网络局部属性的纵向改变
局部属性分析显示,PD-MCI在第4年随访时广泛脑区的节点中心性较PD-NC 患者降低。节点中心性反映了节点与其他脑区相互作用及促进功能整合的能力[18];节点中心性的下降提示该节点可能受到损伤,从而与邻近节点的连接减少。纵向随访中,PD-MCI 患者前额叶、颞叶、枕叶、顶叶及纹状体-边缘系统多个节点的中心性降低,与既往结构网络研究基本相符[7-9]。随后,我们在上述PD-MCI 组纵向显著差异脑区内使用NBS工具,检测出主要涉及三个核心神经认知网络(即DMN,SN 和CEN)、基底神经节(尾状核)和枕叶(距状裂周围皮层、舌回)的异常子网络。人脑三个核心神经认知网络之间的动态相互作用是认知等高级功能实现的基础[19-20];而基底神经节和前额叶皮质及枕叶之间具有广泛的纤维连接。因此,基底神经节的异常可以进一步导致枕叶皮层及DMN的异常,从而引起DMN、SN 和CEN 之间相互作用异常,最终导致认知障碍。因此本研究进一步从结构的角度为PD-MCI 的早期病理损害提供了影像依据。此外,近期两项研究表明,PD-MCI 患者功能网络中DMN 和DEN 的节点中心性降低,功能拓扑网络结构的异常改变也可以导致PD-MCI 的产生[21-22]。本研究PD-MCI 患者的结构网络与上述功能网络的拓扑结构的改变有相似的发现,即PD-MCI 患者全局属性中Eloc、Cp 降低,而Lp 的增加,局部属性中DMN 及CEN节点中心性降低,但两者之间的关联性有待进一步研究。
3.4 结构网络拓扑属性改变对PD-MCI的预测价值
本研究进一步探讨了网络拓扑属性及认知量表区分PD-MCI 患者和PD-NC 患者的能力,结果显示右侧眶内额上回的节点中心性的降低(Dc,Ne)以及MoCA、LNS 评分是早期PD 认知障碍的敏感预测标志物。既往研究发现PD-MCI患者的左侧眶内额上回的节点效率与整体认知及多个认知亚域相关,可能是PD-MCI的病理基础[7]。因此,我们的研究发现进一步扩展了先前的横断面研究,并提示眶内额上回可能是预测PD-MCI 的潜在特征性影像学标志物。此外,本研究发现网络拓扑属性和认知量表的联合使用可以更敏感、更高效地识别向由PC-NC 向PD-MCI 进展的高风险患者,若能及早识别并进行临床干预,可以预防患者由MCI向痴呆进展,极大改善患者预后及生活质量。
3.5 本研究的局限性
本研究存在一定的局限性。首先,本研究中使用确定性纤维示追踪算法进行纤维追踪时,对在交叉纤维追踪可能不准确,下一步研究考虑采用概率性纤维示踪算法进行改善[23];其次,本研究使用AAL90 模板行脑区分割,空间尺度较大,将来可在不同空间尺度下研究PD-MCI 患者的脑网络拓扑结构;最后,PD-MCI 患者样本量小,仍需扩大样本量增加研究结果的可靠性。
综上所述,本研究结果表明脑白质结构网络拓扑属性的异常改变是PD-MCI可能的神经病理机制之一;并发现右侧眶内额上回的网络改变可能是识别早期PD患者由认知正常向MCI转化的潜在影像学标志物,为PD-MCI的早期诊断及治疗提供了新的帮助和依据。
作者利益冲突声明:全部作者均声明无利益冲突。
