新一代广谱肺炎链球菌疫苗的研究进展
2022-05-28杨红涛袁敏学综述张晓姝李津审校
杨红涛,袁敏学 综述,张晓姝,李津,2 审校
1.武汉博沃生物科技有限公司,湖北 武汉 430075;2.华兰生物疫苗股份有限公司,河南 新乡 453003
肺炎链球菌(Streptococcus pneumoniae,S.pn)感染可引起较常见的鼻窦炎和中耳炎等轻症,也可导致严重的侵袭性疾病,如脑膜炎、败血症和肺炎[1],同时也是感染性疾病发病率和致死率居高不下及全球严重疾病负担的主要原因[2]。2007 年,据WHO估算,此后全球每年将有160 万人死于S.pn 引发的疾病,其中70 万~ 100 万为5 岁以下儿童[3]。2000年,美国批准7 价S.pn 多糖结合疫苗(seven-valent pneumococcal conjugate vaccine,PCV7)上市[4];2009年,PCV10 及PCV13 也相继上市,并于2009 — 2011年取代PCV7[5]。但这些疫苗存在血清型替代及年龄组覆盖不全等局限性。2015 年,全球5 岁以下儿童死亡人数估计为583 万,其中由S.pn 感染所致死亡人数为29.4 万[1];2016 年,全球下呼吸道感染导致5 岁以下儿童死亡约65.3 万人,S.pn 仍是引起全球各年龄组下呼吸道感染高发病率和死亡率的首要病原菌[6]。因此,研发能预防更多血清型S.pn 感染所致疾病及中低收入国家可负担的广谱S.pn 疫苗具有重要意义。
基于改造S.pn 毒力因子的新一代广谱S.pn疫苗已处于研发中,其中4 项全细胞疫苗、15 种候选蛋白疫苗已展开临床试验。本文就新一代广谱S.pn疫苗的最新研究进展作一综述。
1 现有肺炎疫苗面临的挑战
1.1 全球普及接种PCV 的困境 澳大利亚、英国等发达国家多项研究证实,接种肺炎疫苗在减少儿童因感染S.pn 住院中起到重要作用[7-8]。据2019 年VIEWhub 报告统计,全球已有144 个国家将接种PCV 纳入国家免疫规划(National Immunization Program,NIP),但仍有35 个中低收入国家未决定是否纳入NIP。2017 年,全球仍有4230 万名婴幼儿(占52%)未接种肺炎疫苗[9]。WHO 建议所有国家将PCV 纳入NIP,但由于PCV 制备工艺复杂及价格昂贵,使该目标至今未能实现。PCV13 通过全球疫苗免疫联盟(The Global Alliance for Vaccines and Immunisation,GAVI)和泛美卫生组织(Pan American Health Organization,PAHO)采购的价格分别为2.90~2.95 和14.5 美元/剂[10-11],私营企业的售价是202 美元/ 剂[12],而全球每年接种PCV 的费用预计约160 亿美元[13]。目前,中高收入国家PCV 覆盖率仅为48%,中低收入国家覆盖率为71%,虽然通过GAVI 采购价格相对低廉,但当一些中低收入国家成为中高收入国家时,GAVI 将结束资助,这些国家也可能无法继续将PCV 疫苗纳入NIP[14],如肯尼亚2027 年将因经济增长成为中收入国家,GAVI 将结束资助,国家会由于资金问题而削减疫苗全民接种计划以减少财政开支[15]。人口总计占全球36.4%的中低收入国家的中国和印度(人口均超13 亿)也未将PCV 纳入NIP[16-17]。
虽然23 价S.pn 多糖疫苗(23-valent pneumococcal polysaccharide vaccine,PPSV23)比PCV13 可预防更多血清型的S.pn 感染,但由于无载体蛋白,疫苗无法有效激发T 细胞依赖的抗体免疫反应及潜在免疫记忆[18],目前仅用于65 岁以上人群和高风险感染S.pn 的2 岁以上儿童[19],同时美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)建议65 岁以上人群接种PCV13 后间隔1 年再接种PPSV23[20]。由于PPSV23 本身的缺陷,不适于在全球范围内进行全年龄段推广接种。
1.2 血清型替代风险 目前,依据荚膜特异性多糖成分可将S.pn 分为96 多种血清型[21],PCV7 可覆盖其中4、6B、9V、14、18C、19F、23F 7 种血清型,PCV10在此基础上增加1、5、7F 3 种型别,PCV13 再增加3、6A、19A 3 种型别[22]。MORENO 等[23]在哥伦比亚首都波哥大对婴幼儿接种PCV10 后展开的一项临床研究发现,疫苗未覆盖的19A 血清型S.pn 导致侵袭性肺炎病例的比例由2008 — 2011 年的4.4%上升至2014—2017 年的32.4%。在普遍接种PCV7或PCV13 的发达国家也存在类似现象,如在美国非PCV 覆盖的6C、15A/B/C、23A、35B 血清型[24-25],挪威和德国的15A、23B 血清型[26-27],法国的12F、15A、24F、35B 血清型[28],流行性均有所增强。因此,疫苗制造厂商纷纷研发覆盖更多血清型的PCV,如德国Merck 公司的PCV15(新增22F、33F 血清型)[29]已成功完成2 项Ⅲ期临床试验(NCT0-3480763,NCT03480802),并计划递交上市申请;美国辉瑞公司于2020 年3 月公布了20vPnC(新增8、10A、11A、12F、15B、22F、33F 血清型)Ⅲ期临床试验结果(NCT-037-60146,NCT03828617,NCT03835975),并准备递交上市申请;美国加州生物公司SutroVax 于2020 年3 月宣布完成1.1 亿美元融资开发24 价PCV。
2 新一代广谱S.pn 疫苗的候选蛋白抗原成分
为克服现有PPSV23 无法保护主要风险群体(2岁以下儿童)及PCV 保护血清型有限且价格昂贵的局限性[30],迫切需要开发具有广谱保护性的S.pn疫苗。S.pn 毒力因子及表面表达的高度保守蛋白抗原能够诱导产生黏膜和血清抗体反应,可作为潜在的蛋白疫苗成分[31]。近年,研究者对众多S.pn蛋白抗原的功能及免疫原性进行了研究,RICHARD等[32]利用生物信息学技术对多达52 种S.pn 保守蛋白抗原进行了动物免疫原性研究,主要的S.pn 蛋白抗原及功能见表1[33-39]。有研究通过对感染S.pn的人群进行抗体筛查,进一步分析感染S.pn 儿童样本检测到的特异性抗体,获得了Ply、PspA、PspC 等蛋白抗原[34,39]。
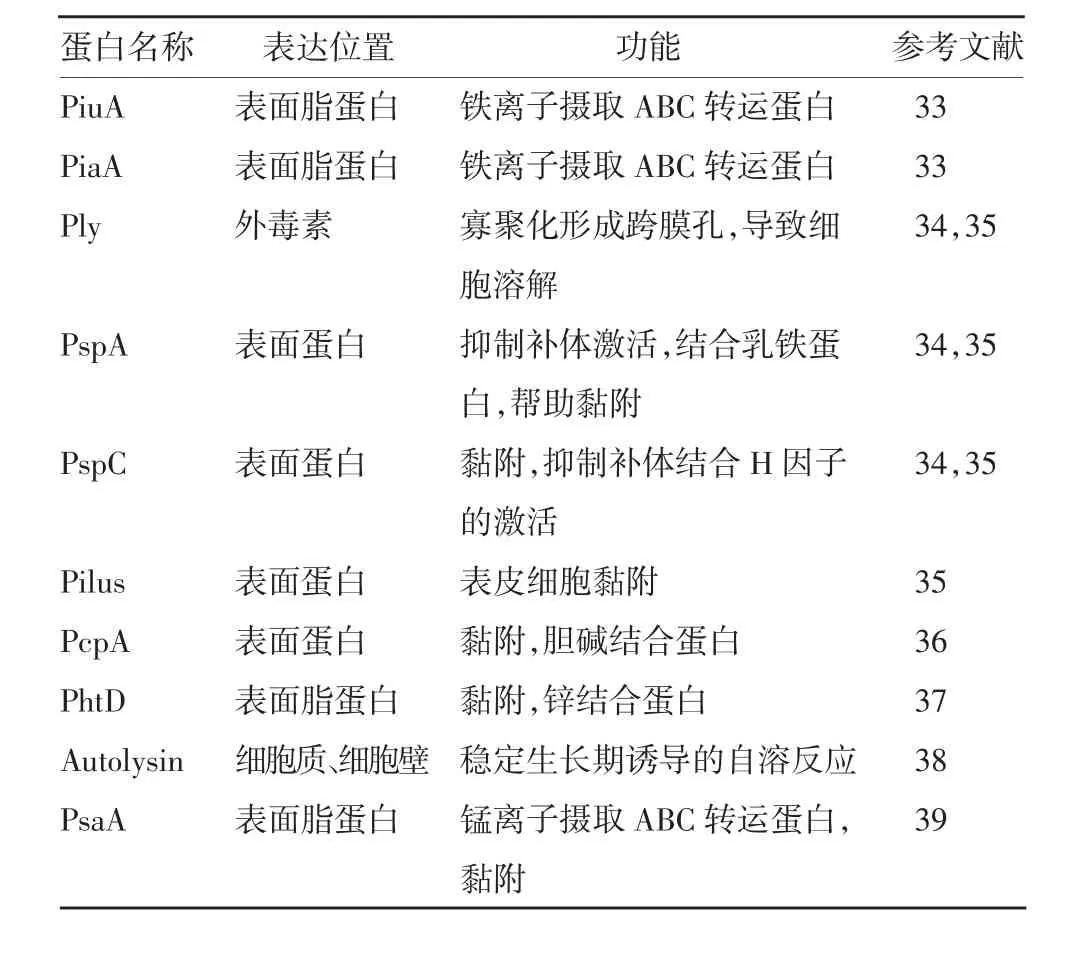
表1 影响S.pn 毒力的主要蛋白及其功能Tab.1 Functions of main proteins influencing virulence of S.pn
目前研究最广泛的为Ply 蛋白,其为一种胆固醇结合蛋白,在菌体自溶时释放并在真核细胞膜上形成孔隙[40],Ply 可通过TLR4、NLRP3 通路激活固有免疫[41-42]。天然的Ply 蛋白具有毒性,其无毒突变体已用于临床试验[34]。另外,PspA 也是一种高度保守的胆固醇结合蛋白,广泛存在于各S.pn 菌株中,并可产生交叉保护反应,该蛋白可抑制C3 补体活性并使后者在菌体表面聚集,同时保护菌体免受乳铁蛋白毒效应[34]。已有动物实验表明,PspA 作为候选疫苗成分可激发抗体免疫保护,具有预防侵袭性S.pn感染的潜在作用[43]。
3 新一代广谱S.pn 疫苗
3.1 S.pn 蛋白疫苗 2017 年,ODUTOLA 等[44]用Ply类毒素(dPly)、PhtD 与10 个S.pn 血清型多糖抗原混合后作为候选疫苗,对冈比亚儿童进行了Ⅱ期临床试验,初步结果显示,其耐受性良好,但在鼻咽部S.pn 载量研究中未发现对非10 个多糖抗原血清型S.pn 的广谱保护效应。2019 年,英国GSK 公司开发的GSK2189242A 候选疫苗(含dPly、PhtD 突变体)已完成其用于预防急性中耳炎(acute otitis media,AOM)的Ⅱ期临床试验[45]。另外,BROOKS 等[46]用重组表达PhtD、PlyD1、PcpA 三价候选疫苗进行的Ⅰ期临床结果显示,该候选疫苗能增强成年人、老年人、儿童对所有S.pn 血清型的抗体水平。目前正在进行的S.pn 蛋白候选疫苗临床试验见表2[47-61]。
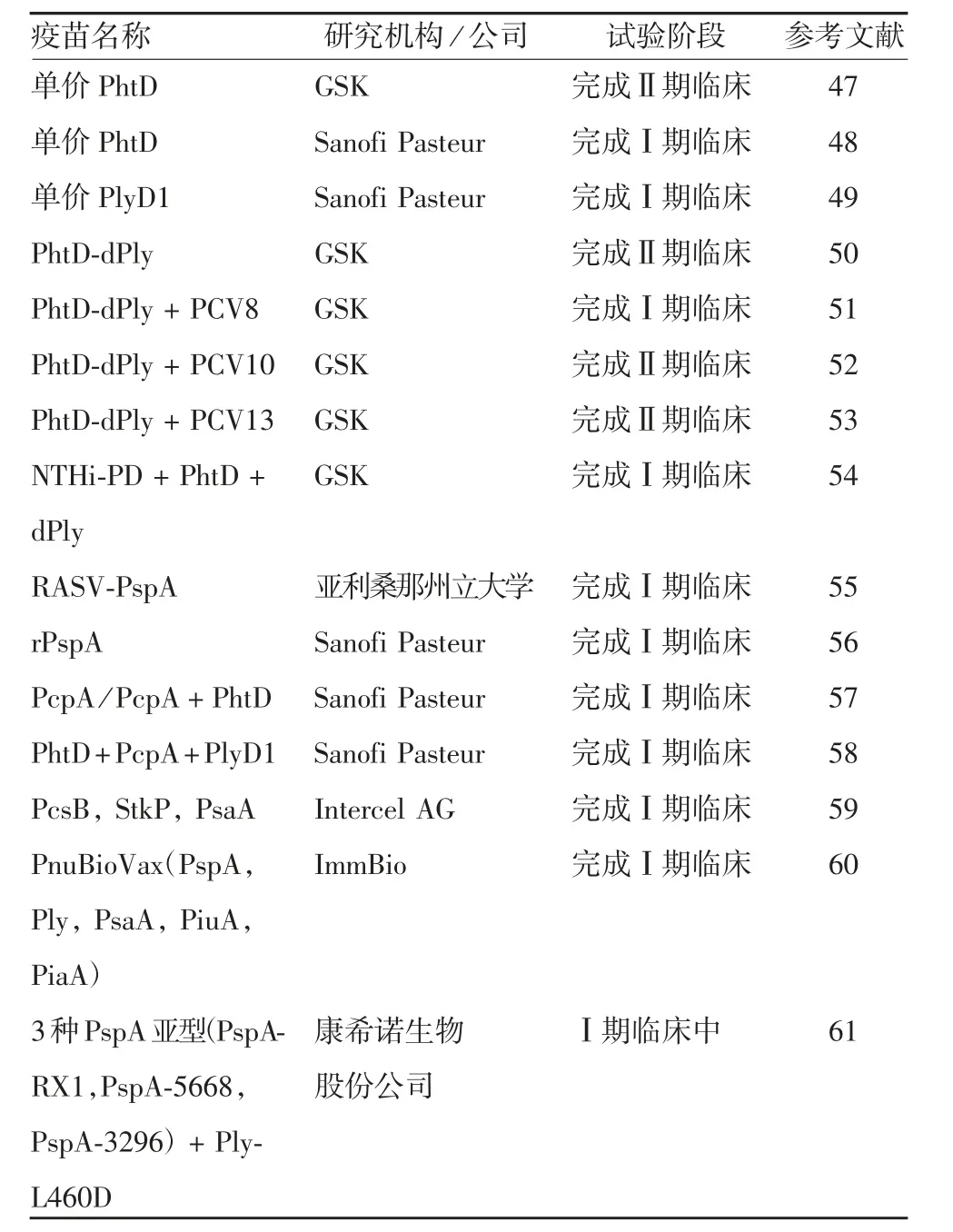
表2 S.pn 蛋白候选疫苗临床研究相关信息Tab.2 Data on clinical trials of candidate S.pn vaccines
目前,国内开展S.pn 蛋白疫苗研究的高校团队均处于基础理论研究阶段,天津康希诺公司自主研发的重组S.pn 蛋白疫苗已进入Ⅰ期临床,预计将在2020 年完成Ⅰa 期临床试验。另外,2019年3 月,兰州生物制品研究所有限责任公司与英国疫苗研发公司ImmunoBiology 签署许可协议,将获得该公司通用型S.pn 疫苗PnuBioVax 在中国的开发和商业化权利。
3.2 S.pn 全细胞疫苗 由于S.pn 全细胞疫苗(pneumococcal whole cell vaccine,PWCV)不需要纯化蛋白抗原的工艺步骤、不涉及多糖-蛋白结合制备工艺、生产成本远低于PCV,适合发展中国家及低收入国家生产及大范围覆盖使用。目前已有动物试验研究证明,无荚膜PWCV 可有效激发体液免疫及细胞免疫,从而预防多种S.pn 感染[62]。
KIM 等[63]将D39 型S.pn 的pep27 基因(△pep27)敲除,获得的减毒菌株无法在肺部、血液及大脑定植。为进一步降低△pep27 减毒株回复突变为野生型毒株的风险,以增加其安全性,研究者进一步敲除其comD基因,获得的双突变减毒株△pep27△comD 可有效诱导PspA 特异性IgG。在对小鼠进行的D39、6B S.pn血清型攻毒试验中发现,与空白对照组比较,该双突变株可有效提高小鼠存活率(>80%);同时,该候选疫苗还可有效抑制其他已分型、未分型S.pn 定植。JANG 等[64]通过敲除荚膜脯氨酸二酰甘油转移酶基因(lgt)获得的TIGR4(TIGR4△lgt)减毒株毒力、炎症活性均降低,该减毒株可在鼻咽部有效诱导黏膜特异性IgA 和IgG2b 抗体反应,小鼠鼻腔给药的2 型S.pn(D39)、3 型(wu2)及6B、9V、19F 和23F 型攻毒挑战试验显示,该减毒株可产生广谱预防效果。TERRA 等[65]将1 型(519/43)S.pn 菌株Ply 基因突变(519/43△Ply)获得丧失溶血能力的减毒株,但随后的动物试验发现,虽然血液中S.pn 定植有所减少,却未能对S.pn 侵袭产生理想的保护效果。
MELLROTH 等[66]将2 型S.pn 突变为无荚膜的RX1 菌株,进一步敲除其自溶素基因(lytA)并用乙醇灭活,在以霍乱毒素(cholera toxin,CT)为候选疫苗佐剂的大鼠、小鼠鼻腔给药挑战试验中发现,该候选疫苗对有荚膜的6B、3 型S.pn 在鼻腔定植及侵袭有保护效果。LU 等[67]将溶血素基因(Ply)突变为减毒的PdT 基因,进而敲除全lytA 基因并换为卡那霉素抗性基因,获高产RM200(RX1EPdT△lytA)菌株。该研究以β-丙内酯灭活,并以氢氧化铝为佐剂制备试验疫苗,对6B 型S.pn 的攻毒试验发现,该候选疫苗可有效预防鼻咽部定植且可激活白介素-17A。帕斯适宜卫生科技组织(Program for Appropriate Technology in Health,PATH)在肯尼亚展开Ⅰ/Ⅱ期临床试验,用于评价此前接种过PCV,而后接种其灭活全细胞铝佐剂候选疫苗(PATH-wSP)的安全性和耐受性[68]。目前正在进行的S.pn 全细胞候选疫苗临床试验见表3[68-71]。
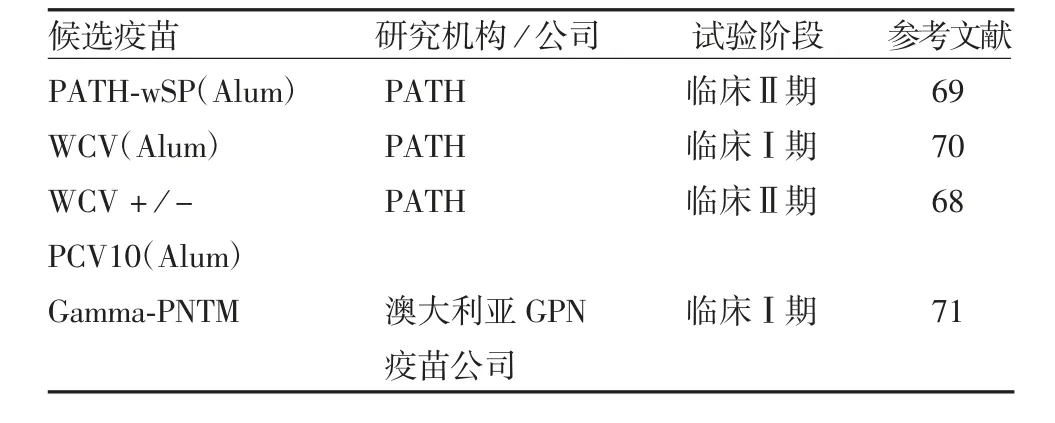
表3 S.pn 全细胞候选疫苗临床研究相关信息Tab.3 Data on clinical trials of candidate whole cell S.pn vaccines
4 小结与展望
目前,全球范围内感染S.pn 导致死亡率仍较高,特别是婴幼儿、老年人、免疫功能低下者(如艾滋病患者)等人群。尽管随着多糖型PPSV23 和蛋白结合型PCV10/13 疫苗在全球的广泛使用,使S.pn 感染人数大幅降低,但仍有问题亟待解决。如针对现有疫苗覆盖以外S.pn 血清型及无荚膜S.pn 的预防效果不足;PPSV23 免疫原性低且无法产生有效的免疫记忆(低龄儿童);面对血清型替代问题,不断增加PCV 抗原以覆盖更多流行株,将面临巨大的技术及经济挑战。重组蛋白、全细胞广谱肺炎疫苗生产成本低,能在发展中国家大规模生产,同时可潜在地覆盖各年龄组人群并诱发免疫记忆,产生非血清型依赖性保护。
虽然目前有众多候选广谱疫苗进入临床Ⅰ/Ⅱ期研究,但全球尚无广谱S.pn 疫苗进入Ⅲ期临床试验。蛋白疫苗的组合方式、递送系统、给药途径,如何保持全细胞疫苗生产批间一致性及减少副反应还有待进一步的临床研究及评价。随着技术的进步,结构生物学、生物信息学的发展,更为精准、有效、安全的短肽纳米颗粒疫苗将会进一步推动广谱肺炎疫苗的研发,快速推动新一代疫苗上市。
