p53 调控成纤维细胞生长因子13 的表达对A549 细胞增殖的影响
2022-05-28赵倩文唐铖铖雷静静张欣然李豆豆曾文先路宏朝
赵倩文,唐铖铖,雷静静,张欣然,李豆豆,曾文先,路宏朝
陕西理工大学生物科学与工程学院,陕西 汉中 723001
肺癌是一种常见的恶性肿瘤,具有较高的侵袭性和转移性,严重威胁患者生命和健康。其中非小细胞型肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%,包括腺癌、鳞状细胞癌和大细胞癌等亚型[1]。研究发现,不同亚型的患者肺癌组织的基因表达差异较大,显著影响化学治疗药物的敏感性,提示了NSCLC 机制的多样性和复杂性[2]。因此,深入研究NSCLC 的分子机制对于改善其诊断及治疗至关重要。
人成纤维细胞生长因子13(fibroblast growth factor 13,FGF13)是FGF 亚家族中的新成员,编码的蛋白质由216 个氨基酸组成,相对分子质量为22000。由于其N-末端不具有自身的信号分泌序列,因此不能分泌至细胞外,仅作为胞内蛋白发挥作用[3]。现已证明,FGF13 可作为一种微管稳定蛋白参与调控神经元的极化和迁移[4],也能够维持正常心肌传导功能,并改善血管韧性[5-6]。研究发现,FGF13 在肿瘤的发生发展过程中起重要调节作用。其在人类胶质瘤细胞、胶质瘤干细胞、胶质瘤组织[7]和前列腺癌组织中表达水平均异常升高,且与前列腺癌术后患者复发风险显著相关[8]。BUBLIK 等[9]研究发现,FGF131a 属于核仁蛋白,可抑制核糖体RNA 转录并减弱蛋白质合成,有利于维持肺癌细胞稳态。p53 是一种十分重要的肿瘤抑制因子,在许多类型的肿瘤细胞中均有突变[10]。作为一种转录因子,在DNA 发生损伤时,野生型p53 通过激活或抑制特异基因的转录,起到阻断细胞周期和诱导细胞凋亡的作用。但也有研究报道,p53 通过介导细胞铁死亡[11-13]、核糖体和核仁应激途径发挥抑制肿瘤生长的作用[14]。然而,在NSCLC 发生发展过程中,p53 是否会通过FGF13 途径抑制细胞增殖仍较少报道。本实验以NSCLC A549 细胞系为研究对象,探讨p53 与FGF13 间的调控关系,以及对A549 细胞增殖的影响和潜在的作用机制,为NSCLC 的治疗寻找有效诊断靶点提供参考。
1 材料与方法
1.1 细胞、质粒及序列 人正常肺上皮细胞(BEAS-2B)和NSCLC 细胞系(A549)购自赛百慷(上海)公司;靶向FGF13 的siRNA 序列(si-FGF13):5′-GCCUCAGCUUAAGGGUAUATT-3′,靶向p53 的siRNA 序列(si-p53):5′-GCUGUGGGUUGAUUCCACATT-3′,对照序列siRNA-NC(si-NC):5′-UUCUCCGAACGUGUCACGUTT-3′,均由北京奥科鼎盛生物有限公司合成并提供;超表达FGF13 的质粒(pcDNA3.1-FGF13)为陕西理工大学分子遗传学实验室前期保存。
1.2 主要试剂及仪器 高糖DMEM 培养基、RPMI-1640 培养基、Opti-MEM 和胎牛血清(fetal bovine serum,FBS)购自美国Corning 公司;青霉素、链霉素、0.25%胰酶、Lipofectamine 2000 购自美国Invitrogen公司;RIPA 裂解液和Trizol 购自上海碧云天生物技术有限公司;CCK-8 试剂盒购自上海翊圣生物科技有限公司;反转录试剂盒、ECL 曝光液和SYBR Premix E × TaqTMⅡ购自日本TaKaRa 公司;辣根过氧化物酶标记的羊抗鼠IgG 购自北京康为世纪生物技术有限公司;β-actin、CyclinE、p21Waf1/Cip1、p53 单克隆抗体购自美国CST 公司;FGF13 单克隆抗体购自英国Abcam 公司;Infinite200pro 酶标仪购自瑞士Tecan公司;FACSVerse 流式细胞仪购自美国BD 公司。
1.3 细胞培养 将液氮中保存的BEAS-2B 和A549细胞于37 ℃温水中快速溶解,2000 × g 离心5 min,弃上清,分别用1 mL 含10% FBS 的DMEM 和1 mL含10% FBS 的RPMI1640 培养基重悬后,转移至培养皿中,37 ℃,5% CO2条件下培养。
1.4 细胞转染 用4 组100 μL 的opti-MEM 分别稀释si-NC、si-FGF13、si-p53 以及同时干扰FGF13 和p53 的siRNA 混合物,混匀,再用4 组100 μL 的opti-MEM 各稀释2 μL 的Lipofectamine 2000,混匀,室温作用5 min;将4 组的2 种溶液分别混合,室温作用20 min,形成DNA-Lipofectamine 复合物;将200 μL复合物加至细胞培养板中,混匀,37 ℃培养12 h;更换新鲜培养基,继续培养72 h;收样检测。pcDNA3.1-FGF13 质粒的转染步骤同上。
1.5 各基因mRNA 转录水平的检测 采用qPCR 法。利用Trizol 法提取细胞总RNA,测定RNA 浓度,反转录为cDNA,以其为模板进行PCR 扩增。引物序列见表1,引物由北京奥科鼎盛生物有限公司合成。20 μL 反应体系:SYBR Premix E × TaqTMⅡ(2 ×)10 μL,上下游引物各1.6 μL,cDNA 模板2 μL,ddH2O 4.8 μL。两步法PCR 反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40 个循环。每个基因重复检测3 次,采用2-ΔΔCT法分析。

表1 qPCR 扩增引物序列Tab.1 Primer sequences for qPCR
1.6 各蛋白表达水平的检测 采用Western blot 法。用RIPA 裂解液裂解细胞提取蛋白,经12% SDSPAGE 分离后,转至PVDF 膜上,5%脱脂牛奶4 ℃封闭2 h;加入一抗(FGF13、P53、CyclinE 均1 ∶1000稀释,β-actin 1 ∶2000 稀释),4 ℃孵育过夜;TBST洗涤,加入辣根过氧化物酶标记的羊抗兔IgG(1 ∶2000 稀释),25 ℃孵育1 h;TBST 洗涤3 次,ECL 试剂盒显影,以β-actin 作为内参,使用Quantity one 软件进行灰度分析定量。
1.7 p53 和FGF13 基因沉默对A549 细胞增殖的影响采用CCK8 法。将转染siRNA(si-FGF13 和si-p53)的A549 细胞作为干扰组,设转染si-NC 的细胞对照组(NC 组)。分别接种96 孔板,3 × 103个细胞/ 孔,每组设5 个复孔,同时设调零孔(仅加培养液),分别培养24、48 和72 h 后,检测细胞增殖能力。检测前换液,加入新鲜培养基和CCK8 试剂,继续培养1 h后,用Infinite200pro 酶标仪检测450 nm 波长处各孔吸光度值。以各孔吸光度值为纵坐标,时间为横坐标,绘制细胞增殖曲线。试验重复3 次。
1.8 FGF13 对A549 细胞周期影响的检测 采用流式细胞术(flow cytometry,FCM)。取对数生长期的各组细胞,无血清培养基培养6 h;用0.25%胰蛋白酶消化后,分别加至PE 管中,2000 × g 离心;收集各组细胞,加入预冷的70%乙醇,4 ℃固定过夜;PI 染色30 min;上流式细胞仪检测细胞周期。
1.9 统计学分析 采用SPSS 19.0 软件进行统计学分析,实验数据用均数± 标准差表示,两样本均数比较采用t 检验,用Origin 2017 进行绘图,以P <0.05 为差异有统计学意义。
2 结果
2.1 两种细胞中p53 基因mRNA 及蛋白表达水平qPCR 检测结果显示,A549 细胞中内源性p53 基因mRNA 转录水平为BEAS-2B 细胞的6 倍以上(t =2.156,P < 0.01);Western blot 分析显示,A549 细胞中p53 蛋白的表达水平也高于BEAS-2B 细胞,与qPCR 结果相似,见图1。

图1 两种细胞中p53 蛋白表达水平的Western blot 分析Fig.1 Determination of expression levels of p53 protein in two kinds of cells by Western blot
2.2 干扰p53 基因对A549 细胞增殖的影响 CCK8法检测结果显示,与NC 组相比,si-p53 干扰组活细胞数量明显增多,尤其是培养72 h 后,细胞的促增殖能力更加明显(t = 1.899,P < 0.01),见图2。qPCR检测结果显示,与NC 组相比,p53 基因干扰后,细胞周期抑制因子p21 的表达水平也降低80%(t =1.830,P < 0.01),表明细胞增殖进程加快。以上结果提示,干扰p53 基因能促进A549 细胞增殖。

图2 干扰p53 基因表达对A549 细胞增殖的影响Fig.2 Effect of interfering with p53 gene expression on proliferation of A549 cells
2.3 干扰p53 基因对FGF13 mRNA 转录及蛋白表达水平的影响 A549 细胞中干扰p53 基因表达后,qPCR 检测结果显示,与NC 组相比FGF13 基因mRNA转录水平上调约8 倍(t = 3.256,P < 0.01);为明确FGF13 在A549 细胞中的功能,首先检测FGF13 基因的内源性表达水平,结果显示,A549 细胞中FGF13基因mRNA 转录水平显著高于BEAS-2B 细胞,达120 倍(t = 3.597,P < 0.001)。Western blot 分析显示,FGF13 蛋白在A549 细胞中呈高水平表达,与BEAS-2B 细胞相比差异有统计学意义(t = 2.965,P < 0.01),见图3。图4 和图5。推测在A549 细胞中p53 抑制FGF13基因的表达。

图3 两种细胞中FGF13 表达水平的Western blot 分析Fig.3 Determination of FGF13 expression level in two kinds of cells by Western blot

图4 A549 细胞中FGF13 和p53 蛋白表达水平的Western blot 分析Fig.4 Determination of expression levels of FGF13 and p53 proteins in A549 cells by Western blot
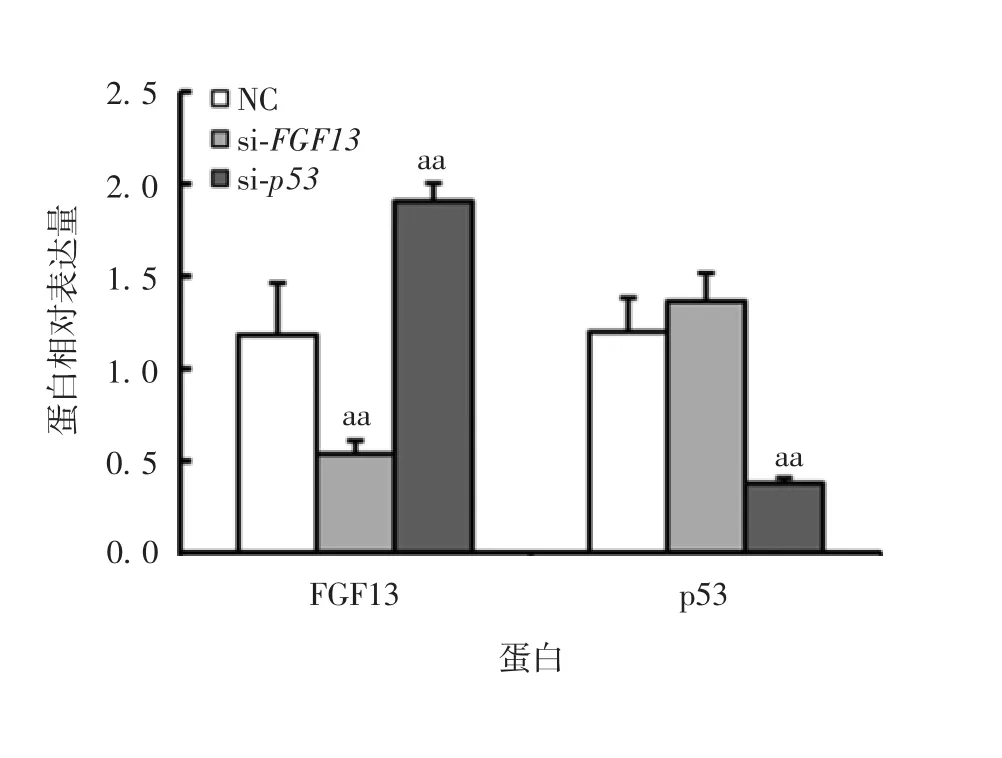
图5 A549 细胞中FGF13 和p53 蛋白的表达水平Fig.5 Expression levels of FGF13 and p53 proteins in A549 cells
2.4 FGF13 对调控G1/S 期转变的p21 蛋白表达的影响 CCK8 检测结果显示,与NC 组相比,si-FGF13干扰组在72 h 时,细胞活力显著降低(t = 1.829,P < 0.01),见图6。表明干扰FGF13 基因抑制A549细胞增殖的速度。
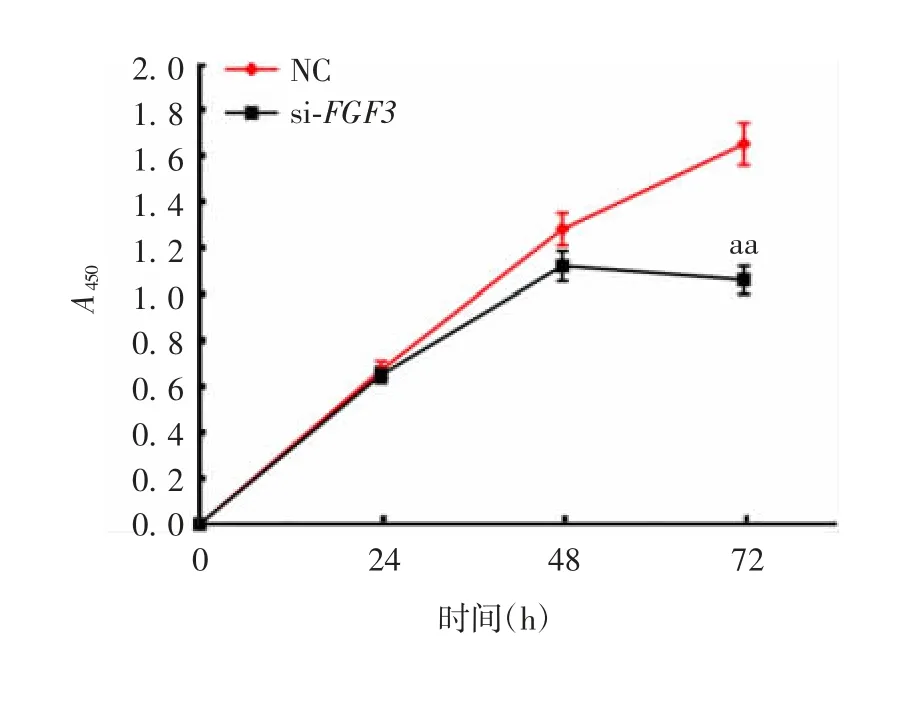
图6 CCK8 法检测FGF3 基因干扰后A549 细胞的活力Fig.6 Determination of A549 cell viability after FGF13 gene interference by CCK8 method
进一步在A549 细胞中转染FGF13 基因的特异性siRNA 干扰序列后,与NC 组比较,FGF13 蛋白表达水平降低50%(t = 1.827,P < 0.01);转染p53基因的特异性siRNA 干扰序列后,p53 基因的干扰效率达到70%(t = 2.306,P < 0.01),FGF13 蛋白的表达水平升高约2 倍(t = 2.376,P < 0.01)。见流式细胞术检测结果显示,当FGF13 蛋白表达降低后,G1 期细胞数量明显升高14%,而S 期细胞数量降低10%,见图7 和图8。表明干扰FGF13 的表达导致A549 细胞周期中G1/S 期的转换减慢,从而使细胞增殖速度减慢。

图7 细胞周期进程的流式细胞图Fig.7 Flow cytometry of cell cycle
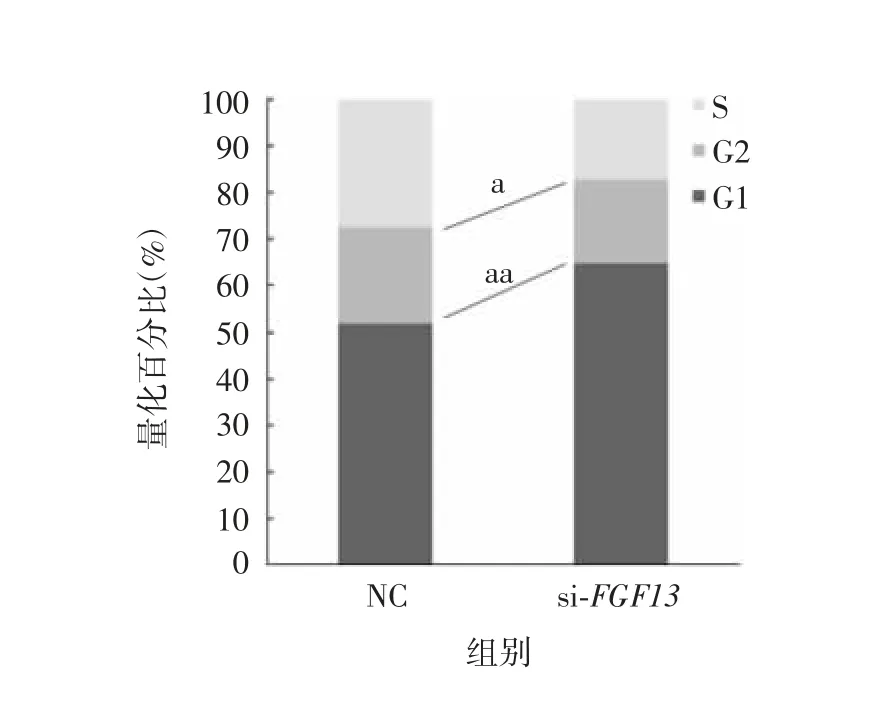
图8 各时期细胞的量化分析Fig.8 Quantitative analysis of cells in various phases
G1/S 期转换主要受CDK2-CyclinE、p21 和p27等细胞周期相关因子的调控。因此,在干扰FGF13表达后,采用qPCR 法检测CDK2、p21 和p27 基因mRNA 转录水平,结果显示,FGF13 表达降低后,p21基因mRNA 转录水平显著升高(t=3.514,P<0.01),CDK2 基因mRNA 转录水平显著降低(t = 2.292,P <0.05),而p27 基因mRNA 转录水平有升高趋势,但差异无统计学意义(t = 1.932,P >0.05),见图9。进一步通过Western blot 分析细胞周期蛋白CyclinE表达量,结果显示,CyclinE 蛋白表达水平明显降低,见图10。表明干扰FGF13 基因可促进p21 表达,抑制CyclinE 表达,从而诱导细胞周期中G1/S 期的阻滞。

图9 A549 细胞中干扰FGF13 表达对p21、p27 和CDK2基因mRNA 转录水平的影响Fig.9 Effect of interfering FGF13 expression in A549 cells on transcription levels of p21,p27 and CDK2 mRNAs

图10 A549 细胞中干扰FGF13 表达对CyclinE 蛋白表达水平影响的Western blot 分析Fig.10 Western blotting of effect of interfering FGF13 expression in A549 cells on expression level of CyclinE protein
当A549 细胞中超表达FGF13 后,与NC 组相比,超表达组中CDK2 基因mRNA 转录水平显著升高,p21 基因mRNA 转录水平显著降低(t = 1.945,P <0.01),而p27 基因mRNA 转录水平无明显变化(t =3.952,P >0.05),见图11;Western blot 分析表明,FGF13 蛋白表达升高后,CyclinE 蛋白表达水平也上调3 倍(t = 3.154,P < 0.01),见图12。以上结果证明,FGF13 是通过抑制p21 的表达促进CyclinE 的表达,有利于细胞周期中G1 期向S 期的转变,从而促进A549 细胞增殖速度加快。

图11 A549 细胞中超表达FGF13 对p21、p27 和CDK2基因mRNA 转录水平的影响Fig.11 Effect of overexpression of FGF13 in A549 cells on transcription levels of p21,p27 and CDK2 mRNAs

图12 A549 细胞中超表达FGF13 对CyclinE 蛋白表达水平影响的Western blot 检测Fig.12 Western blotting of effect of FGF13 overexpression in A549 cells on expression level of CyclinE protein
2.5 p53 对调控细胞增殖的FGF13 蛋白表达的影响分别单独干扰FGF13 和p53 或联合干扰处理A549细胞72 h 后,Western blot 分析结果显示,与NC 组相比,FGF13 干扰后p53 蛋白表达无明显变化,而p53单独干扰及FGF13 与p53 联合干扰后,p53 蛋白表达分别下降76.4%和74.8%(t 分别为1.589 和1.406,P 均< 0.01),与2.3 项干扰效率结果相似。另一方面,与NC 组相比,FGF13 干扰后CyclinE 蛋白的表达降低约70%(t = 2.121,P < 0.01),p53 干扰后CyclinE 蛋白的表达升高4.16 倍(t = 2.892,P < 0.01),表明干扰p53 表达,促进了A549 细胞的增殖;而FGF13 与p53 联合干扰后,CyclinE 蛋白的表达也升高了4.85 倍(t = 3.237,P < 0.01)。见图13 和图14。结合p53 抑制FGF13 表达和FGF13促进CyclinE 表达的结果,可推测p53 基因干扰后,通过促进FGF13 的表达而增加CyclinE 蛋白的表达,从而诱导细胞增殖速度加快。
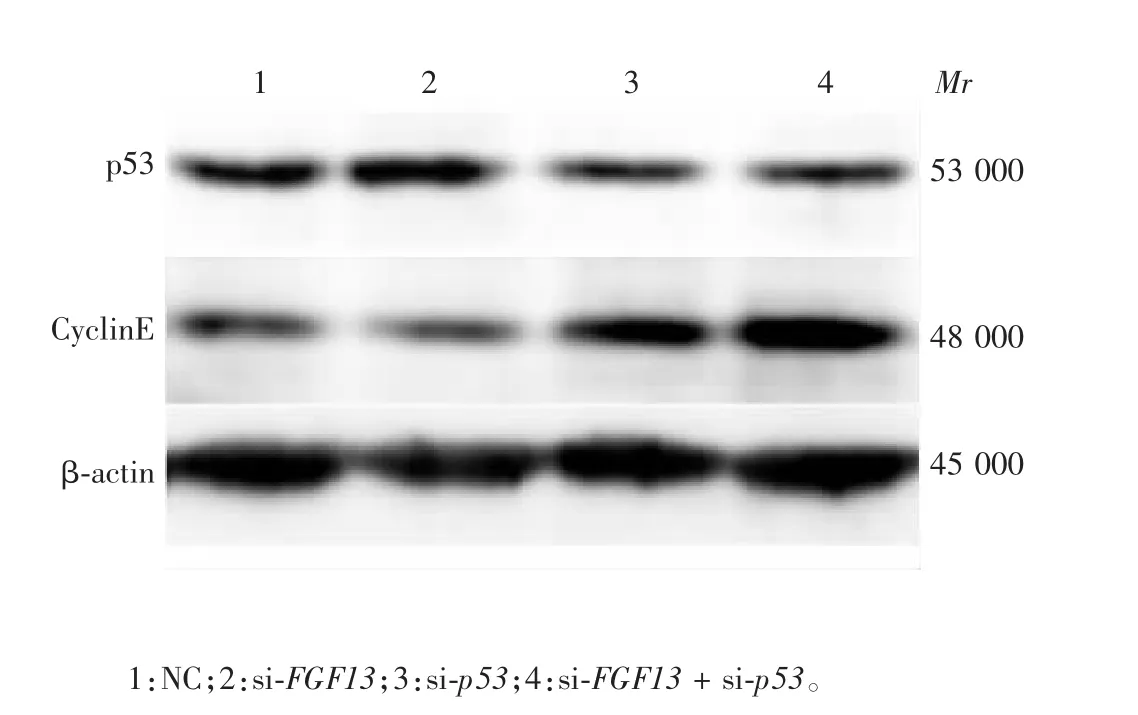
图13 单独FGF13 和p53 或联合干扰处理A549 细胞的Western blot 分析Fig.13 Western blotting of A549 cells with FGF13 and p53 interference alone and in combination

图14 单独FGF13 和p53 或联合干扰处理A549 细胞后p53 和CyclinE 蛋白的表达水平Fig.14 Expression levels of p53 and CyclinE proteins in A549 cells with FGF13 and p53 interference alone and in combination
3 讨论
肺癌的特征是肺组织中细胞生长不受控制,因其早期症状不明显,且诊断技术有限,很难引起人们重视[15]。因此,在过去几十年中,研究人员一直致力于寻找新型分子标记物,用于肺癌的早期诊断。然而,至目前为止,临床上仍未获得可靠的治疗靶标[16]。
细胞增殖是通过细胞周期来实现的,细胞周期的进程受细胞周期检控点的严密调控,从而影响细胞数量的动态平衡[17],检控点基因突变是肿瘤发生的重要原因。因此,正常细胞和肿瘤细胞检控点差异也是肿瘤治疗的关键依据。肿瘤抑制蛋白p53 是一种广泛研究的转录因子,可诱导肿瘤细胞生长停滞或凋亡[18]。研究发现,p53 能激活细胞周期抑制因子p21 的转录,而p21 又是细胞周期依耐性激酶CDK4、CDK2、CDK1 等的抑制因子[19]。通过这种抑制作用,p53 和p21 参与了细胞周期中G1/S 和G2 /M 检控点的调控[20]。本研究发现,在A549 细胞中p53 低表达情况下,p21 基因转录水平也显著降低,且细胞增殖效应明显增强,表明p53 激活p21 的转录,抑制A549 细胞增殖,同时,发现p53 抑制FGF13 的表达。目前研究发现,结直肠癌(colorectal cancer)中miR-10b 靶向FGF13 抑制体内CRC 细胞增殖和迁移[21]。JOHNSTONE 等[22]采用RNA-Seq 对原发肿瘤的基因表达谱分析表明,FGF13 基因在侵袭性转移MDA-MB-231 HM 肿瘤中高度上调。FGF13 的过度表达使细胞能够更有效地应对致癌Ras 蛋白引起的应激[23]。此外,在耐顺铂的宫颈癌细胞中,FGF13表达水平也显著上调,推测FGF13 在铂和铜协同作用下,介导了宫颈癌细胞对铂类药物的耐药性[24]。这些研究结果表明,FGF13 参与肿瘤细胞的增殖、迁移、应激以及耐药性等方面。但FGF13 对恶性肿瘤细胞周期检控点的调控研究仍未见报道,仅在对小鼠C2C12 成肌细胞中的研究中发现,超表达FGF13基因,细胞周期中G1/S 期发生阻滞,导致C2C12成肌细胞增殖速度减慢[25]。因此,本实验研究了A549 细胞中FGF13 对细胞周期检控点的影响,发现FGF13 通过抑制p21 基因的表达,促进CyclinE的表达,从而促进细胞周期中G1 期向S 期的转变,导致A549 细胞增殖速度加快,表明FGF13 在A549 细胞中发挥促癌的作用。
结合前期研究发现,p53 抑制FGF13 的表达,且FGF13 促进细胞周期G1 期向S 期转变,本实验进一步推测FGF13 作为一个促癌因子,是受到肿瘤抑制蛋白p53 的直接调控,通过细胞周期抑制因子p21通路,共同影响A549 细胞周期中G1/S 检控点。但本实验的结果仅来自于A549 细胞系,在NSCLC 其他细胞系和临床组织样品中,p53 和FGF13 是否仍存在这种调控关系尚需进一步研究验证。
