十二指肠贾第虫端粒酶逆转录酶RNA 结合域TRBD 互作蛋白的筛选及验证
2022-05-28明珠张西臣赵春艳张楠程淑琴王晓岑李新李建华宫鹏涛张媛媛
明珠,张西臣,赵春艳,张楠,程淑琴,王晓岑,李新,李建华,宫鹏涛,张媛媛
1.吉林大学动物医学学院,吉林 长春 130062;2.吉林大学人兽共患病研究所,吉林 长春 130062
十二指肠贾第鞭毛虫(Giardia duodenalis)简称贾第虫,是一种机会致病性人兽共患寄生虫,广泛寄生于人和哺乳动物,能引起以腹泻为主要症状的肠道疾病[1],感染率高,严重危害人类健康[2]。贾第虫滋养体结构简单,无线粒体和高尔基体结构,含有两个形态大小和DNA 含量几乎相同的细胞核[3-4],与其他真核生物不同的是,不含有核仁,并具有一部分原核生物特征。因此,贾第虫被认为是原核生物和真核生物的过渡阶段,是一种理想的“模式生物”[5]。贾第虫滋养体以二分裂方式增殖,能够进行体外纯培养及反复传代,呈“永生化”现象。研究显示,细胞的永生化与端粒-端粒酶(telomerase)调控有关[6],因此,研究贾第虫端粒及端粒酶的生物学特性十分必要,可为进一步探索其他真核生物端粒酶调控机制奠定基础。
端粒酶是一种核糖核酸-蛋白质复合物,能够维持染色体端粒的长度及稳定,其活性与细胞的死亡、凋亡、癌变、分裂以及衰老等活动密切相关[7]。其由具有催化活性的端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和端粒酶RNA(telomerase RNA,TER)以及TER 结合蛋白(TER-binding protein,RNP)组成,其中TERT 包含一个高度保守的结构域,即端粒酶逆转录酶RNA 结合域(TERT RNA-binding domain,TRBD),主要参与核糖体蛋白复合物的组装,对端粒酶活性至关重要[8]。端粒酶活性调节受诸多因素的影响,其中端粒酶相关蛋白作为端粒酶的辅助因子,直接或间接参与端粒酶与端粒的调节,对端粒及端粒酶调控具有重要作用。目前已报道贾第虫RFC1 等端粒酶相关蛋白[9],但贾第虫端粒酶调控网络很复杂,目前对端粒酶相关蛋白了解较少。因此,本研究旨在通过构建贾第虫BK-TRBD诱饵质粒,继续筛选新的端粒酶相关蛋白,为进一步研究贾第虫端粒及端粒酶调控机制奠定基础。
1 材料与方法
1.1 虫株、菌株、细胞株及质粒 十二指肠贾第虫WB虫株、贾第虫酵母双杂交cDNA 质粒文库、Y2H Gold酵母株、HEK293T 细胞、酵母双杂交相关质粒pGADT7-Lam、pGBKT7-P53、pGADT7-T 和pGBKT7、原核表达载体pET-32a 和pGEX-4T-1、双分子荧光互补载体pBiFC-bJun 和pBiFC-bFos 均由吉林大学动物医学学院寄生虫课题组保存;感受态大肠埃希菌DH5α购自北京康为世纪生物有限公司。
1.2 主要试剂 rTaq 酶、T4 DNA 连接酶、限制性内切酶NdeⅠ和BamHⅠ均购自北京宝日医生物技术有限公司;-Trp/-His/-Leu/-Ade DO Supplement、LLeucinne、L-Tryptophan、L-Histidine、X-α-Gal、酵母质粒提取试剂盒和无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司;Ni-Agarose 和GST Resin 购自北京康为世纪生物有限公司;His-tag 标签抗体和HRP 标记的山羊抗鼠IgG 购自美国Proteintech 公司。
1.3 贾第虫的培养 从液氮中取出贾第虫WB 虫株,置于37 ℃水浴快速融解。将贾第虫滋养体转接至含改良的TYI-S-33 培养液的培养瓶中,于37 ℃恒温培养箱培养24 ~48 h 至对数生长期,观察虫体生长状态。若虫体生长状态良好,呈贴壁状态,即可进行传代培养。
1.4 贾第虫cDNA 的获得 将生长状态良好的贾第虫滋养体进行纯化,采用Trizol 法提取贾第虫总RNA,反转录获得贾第虫cDNA,于-40 ℃保存。
1.5 诱饵质粒的构建 根据GenBank 中登录的贾第虫端粒酶RNA 结合域TRBD 基因序列(Gen-Bank:AF195121.1),运用Oligo7、SnapGene 软件设计特异性引物,上游引物序列:5′-CATATGGACAAGAAACCCCAATCTCT-3′(斜体部分为NdeⅠ酶切位点),下游引物序列:5′-GGATCCATAGACAAACGATAGCCTACCG-3′(斜体部分为BamHⅠ酶切位点)。引物由库美生物有限公司合成。以贾第虫cDNA 为模板,PCR 扩增TRBD 基因序列,反应条件为:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸45 s,共35 个循环;72 ℃再延伸5 min,4 ℃保存。PCR 产物经1%琼脂糖凝胶电泳鉴定并回收。用限制性内切酶NdeⅠ和BamHⅠ对胶回收产物和pGBKT7 载体进行双酶切,并用T4 DNA 连接酶相连。将连接产物转化至感受态大肠埃希菌DH5α中,涂布于含卡那霉素的固体LB 培养板上。挑取单克隆菌落并扩大培养,提取重组质粒pGBKT7-TRBD,用NdeⅠ和BamHⅠ双酶切鉴定,并送库美生物有限公司测序。
1.6 诱饵蛋白毒性及自激活作用检测
1.6.1 毒性作用检测 将pGBKT7-TRBD 和pGBKT7质粒分别转化至感受态酵母菌,菌液涂布至SD/-Trp营养缺陷培养基上,30 ℃培养3 ~5 d,观察菌落形态。若两组菌落形态和数量无明显变化,则表明诱饵蛋白无毒性作用。
1.6.2 自激活作用检测 将pGBKT7-TRBD、阳性对照pGBKT7-P53/pGADT-7 和阴性对照pGBKT7-Lam/pGADT-7 质粒分别转化至感受态酵母菌,菌液涂布于SD/-Trp/-Leu 营养缺陷培养基中,30 ℃倒置培养3 ~5 d;分别挑取3 组单克隆菌落,点种于SD/-Trp/-Leu/-His/-Ade/X-α-Gal,30 ℃倒置培养2 ~3 d,观察菌落颜色变化。若试验组菌落不显色,则表明诱饵基因无自激活作用。
1.7 TRBD 互作蛋白的筛选及回返验证 采用PEG/LiAc 转化法将诱饵质粒pGBKT7-TRBD 和贾第虫酵母双杂交cDNA 质粒文库共转化至感受态酵母菌,涂布于SD/-Trp/-Leu/-His 培养基上,30 ℃倒置培养3 ~5 d;分别挑取单克隆菌落,点种于SD /-Trp/-Leu/-His/-Ade/X-α-Gal,30 ℃倒置培养2 ~3 d,若试验组菌落显蓝色,则初步判断为阳性菌落。为了降低假阳性结果,对筛选出的基因X 进行回返验证,若试验组菌落生长且显蓝色,对照组不显蓝色,则进一步验证pGBKT7-TRBD 与筛选出的文库质粒的互作关系。
1.8 双分子荧光互补验证 根据GenBank 中TRBD与筛选出的X 基因序列,设计特异性引物序列:pbFos-TRBD-F:5′-GCTAGCCACCATGGACAAGAAACCCCAATCTCT-3′(斜体部分为NheⅠ酶切位点),pbFos-TRBD-R:5′-GGTACCATAGACAAACGATAGCCTACCG-3′(斜体部分为KpnⅠ酶切位点);pbJun-X-F:5′-GCTAGCCACCATGGTTATGCCCGCTGAAGTCTTCGAGT-3′(斜体部分为NheⅠ酶切位点),pbJun-X-R:5′-CTCGAGCTAAGAATTTTCGTGAGAAGGAC-3′(斜体部分为XhoⅠ酶切位点)。以贾第虫cDNA 为模板进行PCR 扩增,pbFos-TRBD 反应条件为:93 ℃3 min;93 ℃30 s,62 ℃30 s,72 ℃50 s,共34 个循环;再延伸5 min。pbJun-X 反应条件为:93 ℃3 min;93 ℃30 s,60 ℃30 s,72 ℃90 s,共34个循环;再延伸5 min。将TRBD 与X 基因分别连接至双分子荧光互补载体pBiFC-bFos 和pBiFC-bJun上,构建重组质粒pbFos-TRBD 和pbJun-X,并送至库美生物有限公司测序。提取无内毒素质粒,通过Lipofectamine 2000 将二者共转染至HEK293T 细胞,24 ~ 36 h 后染色制片,于激光共聚焦显微镜下观察。若二者在HEK293T 细胞内能够发生蛋白互作,则呈红色荧光。
1.9 GST-Pull down 验证 参考1.5 项步骤构建pET-32a-TRBD 和pGEX-4T-1-X 重组质粒,转化至感受态酵母菌中,分别取10 μL 菌液接种于含氨苄青霉素(终浓度为100 μg/mL)的LB 液体培养基中,37 ℃,140 r/min 培养1 ~ 2 h,至产生云雾状现象为止;向菌液中加入1/1000 的IPTG(24 mg/mL),37 ℃,140 r/min 诱导培养6 h。将诱导后的菌体超声破碎,收集蛋白粗提取物,分别通过Ni-Agarose 和GST Resin 填料层析柱分离纯化His 标签融合蛋白和GST 标签融合蛋白。将GST 琼脂糖凝胶分别与纯化后的pGEX-4T-1-X 和pGEX-4T-1 蛋白于4 ℃共孵育4 h 后,离心弃上清,分别加入纯化后的32a-TRBD重组蛋白,4 ℃摇床孵育4 h 后进行Western blot 分析:蛋白经12% SDS-PAGE 分离后,转膜,以5%脱脂奶粉室温封闭1 h;加入His-tag 标签抗体(1 ∶2000稀释),4 ℃孵育过夜;TBST 洗涤5 次,加入HRP 标记的山羊抗鼠IgG(1 ∶5000 稀释),室温孵育1 h;TBST 洗涤5 次,显色。
2 结果
2.1 诱饵质粒的鉴定 TRBD 基因PCR 产物经1%琼脂糖凝胶电泳分析,可见657 bp 的特异条带,大小与预期一致,见图1。重组质粒pGBKT7-TRBD 经NdeⅠ和BamHⅠ双酶切,可见大于4000 bp 的载体条带和657 bp 的目的基因条带,大小均与预期一致,见图2。测序结果经比对,与TRBD 基因序列一致,表明重组质粒pGBKT7-TRBD 构建正确。

图1 TRBD 基因PCR 扩增产物电泳图Fig.1 Electrophoretic profile of PCR product of TRBD gene
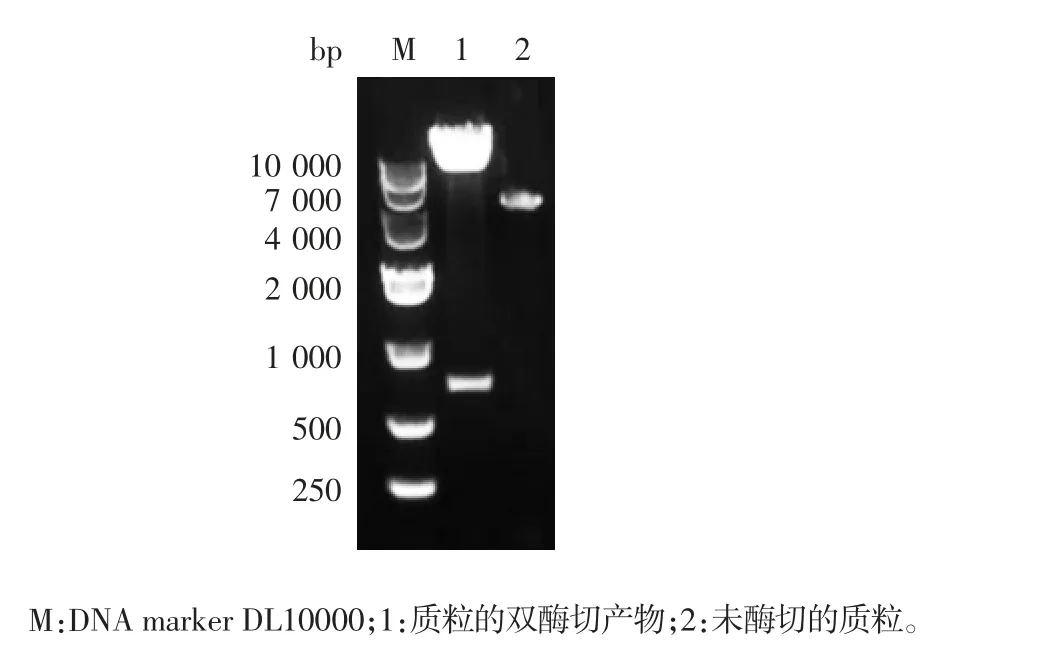
图2 重组质粒pGBKT7-TRBD 的双酶切鉴定Fig.2 Restriction map of recombinant plasmid pGBKT7-TRBD
2.2 诱饵蛋白毒性及自激活作用
2.2.1 毒性作用 pGBKT7-TRBD 与pGBKT7 质粒转化菌液在SD/-Trp 培养板上的菌落形态、大小无明显差异,见图3。表明诱饵质粒pGBKT7-TRBD 对酵母细胞无毒性作用。

图3 诱饵蛋白的毒性作用检测Fig.3 Toxicity test of bait protein
2.2.2 自激活作用 试验结果显示,诱饵质粒pGBKT7-TRBD 不显色,见图4。表明诱饵基因对酵母细胞无自激活反应。

图4 诱饵基因的自激活作用检测Fig.4 Determination of self-activation of bait gene
2.3 TRBD 互作蛋白的筛选 在SD/-Trp/-Leu /-His 营养缺陷型培养基上,阳性对照组pGBKT7-P53/pGADT-7 能稳定生长,阴性对照组不生长,见图5。挑取单克隆菌落点种于SD/-Trp/-Leu/-His/-Ade培养基中,有部分菌落不生长,表明该菌落为假阳性结果,见图6。挑取四缺培养板中单克隆菌落点种于显色板中,在α-半乳糖苷酶作用下,菌落显蓝色,初步判断为阳性菌落,见图7。

图5 酵母双杂交试验Fig.5 Yeast two-hybrid test

图6 阳性菌落的筛选Fig.6 Screening of positive colonies
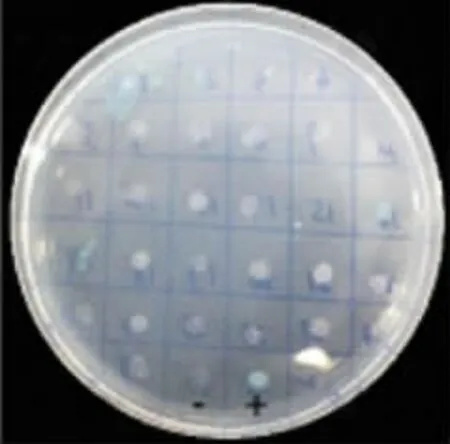
图7 α-半乳糖苷酶显色试验Fig.7 Color development of X-α-Gal
2.4 阳性克隆回返验证 经酵母双杂交系统筛选初步得到5 个阳性基因,见表1。回返验证结果显示,试验组和阳性对照组菌落呈蓝色,阴性对照与空载体组不显色,见图8。表明Heat shock protein 90(Hsp90)与TRBD 存在相互作用关系。

表1 酵母双杂交筛选结果Tab.1 Screening results of yeast two-hybrid system

图8 回返验证Fig.8 Return verification
2.5 双分子荧光互补验证
2.5.1 重组质粒pbJun-Hsp90 和pbFos-TRBD 的鉴定 Hsp90 和TRBD 基因的PCR 产物经1%琼脂糖凝胶电泳分析,分别可见1039 和657 bp 的特异性条带,见图9 和图10。重组质粒pbJun-Hsp90 和pbFos-TRBD 分别经NheⅠ/ XhoⅠ和NheⅠ/ PvuⅠ双酶切验证,均可见相应的目的基因条带和大于5000 bp 的载体条带,见图11 和图12,且测序结果与目的基因序列一致,证明重组质粒构建正确。

图9 Hsp90 基因PCR 扩增产物电泳图Fig.9 Electrophoretic profile of PCR product of Hsp90 gene

图10 TRBD 基因PCR 扩增产物电泳图Fig.10 Electrophoretic profile of PCR product of TRBD gene

图11 重组质粒pbJun-Hsp90 的双酶切鉴定Fig.11 Restriction map of recombinant plasmid pbJun-Hsp90
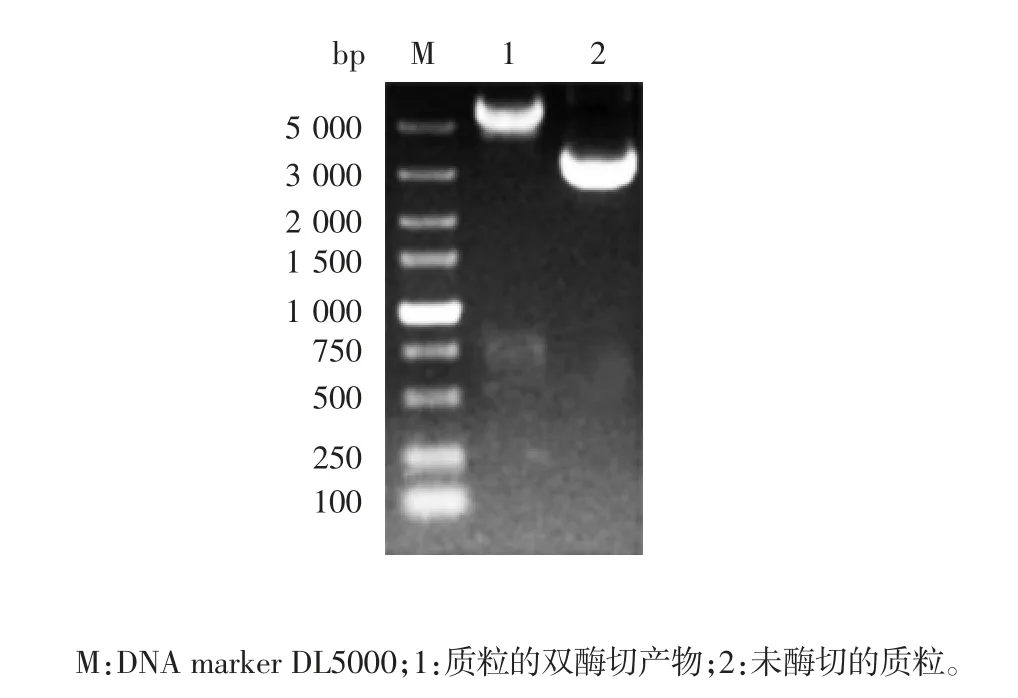
图12 重组质粒pbFos-TRBD 的双酶切鉴定Fig.12 Restriction map of recombinant plasmid pbFos-TRBD
2.5.2 双分子荧光互补试验 激光共聚焦显微镜观察显示,共转染组与阳性对照组显红色荧光,阴性对照组不发光,见图13。表明Hsp90 与TRBD 存在相互作用。

图13 双分子荧光互补试验验证TRBD 与Hsp90 的相互作用Fig.13 Verification for interaction between TRBD and Hsp90 by bimolecular fluorescence complementation test
2.6 GST-Pull down 验证
2.6.1 TRBD 和Hsp90 蛋白的表达及纯化 12%SDS-PAGE 分析显示,纯化后得到相对分子质量约38000 和72000 的32a-TRBD 和Hsp90 重组蛋白,见图14 和图15。

图14 纯化重组蛋白32a-TRBD 的SDS-PAGE 分析Fig.14 SDS-PAGE profile of purified recombinant protein 32a-TRBD

图15 纯化重组蛋白Hsp90 的SDS-PAGE 分析Fig.15 Purification of recombinant protein Hsp90 by SDSPAGE
2.6.2 GST-Pull down 试验 Western blot 分析显示,32a-TRBD 和Hsp90 共孵育组可检测到含有His标签的32a-TRBD 融合蛋白,对照组pGEX-4T-1 和32a-TRBD 共孵育组未检测到32a-TRBD 融合蛋白,见图16。表明TRBD 与Hsp90 存在相互作用。

图16 GST-Pull down 验证TRBD 与Hsp90 的互作Fig.16 Verification for interaction between TRBD and Hsp90 by GST-Pull down test
3 讨论
端粒酶的调控机制是复杂且多层次的,其过程包括端粒酶各组分的合成、转录、翻译修饰以及亚细胞定位,还包括端粒酶装配及运输乃至向端粒末端募集的调控[10]。在许多细胞中发现,端粒酶的活性主要受TERT 基因的表达调控,而端粒酶活性调节及蛋白组装需要多种特异性蛋白质参与,这些蛋白质能瞬时或组成性地与端粒酶结合,从而促进活性端粒酶复合物的形成[8]。目前已报道Sp1、c-Myc、PES1、LARP7、POT1-TPP1 等多种端粒酶活性调节蛋白[11-14]。有研究表明,TERT 的转录水平受Sp1、c-Myc、β-联合蛋白等多种转录因子的调控,Sp1 结合位点的突变能够导致TERT 表达的显著降低,同时,TERT 也可直接与这些转录因子相结合,以辅助激活子的形式调节Wnt/β-catenin、NF-κB 等多种信号通路下游基因的表达,在肿瘤形成、细胞增殖及免疫调节等进程中发挥重要作用[15-16]。在细胞周期调控进程中,端粒酶复合体的装配需要snoRNA 结合蛋白、GAR1、TCAB1 等蛋白的共同参与,从而进一步调控端粒酶运输[15]。但迄今端粒酶的调控机制仍需更多探索。
在寄生虫领域中,对寄生虫端粒酶的相关研究较少,目前已报道14-3-3 蛋白对柔嫩艾美尔球虫端粒酶活性具有负调节作用,而OUT 泛素化蛋白可能正向调控端粒酶活性[17];贾第虫端粒酶TRBD 与复制因子RFC1 和锌指蛋白ZFD 均能正向调控端粒酶活性,进而影响虫体的生长增殖[9,18],但其在端粒酶调控中的作用尚不清楚。端粒酶调控是一个复杂的过程,可能需要多种蛋白因子互作调控,因此,需筛选获得更多参与端粒酶调控的互作蛋白。而贾第虫作为一种理想的真核模式生物,明确其端粒酶及端粒相关蛋白的调控关系,对高等生物端粒酶机制研究具有借鉴作用。因此,本研究利用酵母双杂交技术成功筛选出新的端粒酶相关蛋白,即Hsp90(GenBank:XM_001707939.2)。Hsp90 是一种高度保守的伴侣蛋白,在哺乳动物中可参与蛋白质折叠,维持细胞稳态,能够与众多伴侣蛋白协同调节关键的生理过程,如细胞增殖、细胞周期调控、激素信号传导和细胞凋亡等[19-20]。在人类端粒酶相关研究中发现,Hsp90 和p23 能与hTERT 特异性结合,并影响其与模板RNA 的正确组装[21]。目前,在弓形虫中发现Hsp90 可能参与虫体入侵复制及速殖子-缓殖子相互转化等过程[22]。KAMIKAWA 等[23]研究发现,Hsp90 在贾第虫中能够参与蛋白质折叠,而Hsp90 mRNA 的成熟需要贾第虫中特殊剪接体介导的反式剪接。本研究筛选出端粒酶相关蛋白Hsp90,为进一步探索贾第虫端粒及端粒酶调节机制奠定了基础,同时也为贾第虫的生物学特性研究提供了新的思路。
蛋白质-蛋白质相互作用的研究方法有很多,如免疫层析技术、免疫沉淀联合质谱技术、酵母双杂交、双分子荧光互补技术等[24]。其中,酵母双杂交技术是较常用的一种分子技术,试验操作简单,成本低,适用性广泛。其原理是利用酵母细胞的Gal4 系统含有两个功能结构域,即DNA 特异结合域(DNAbinding domain,BD)和转录激活结构域(transcription activation domain,AD),这两个结构域彼此分割,互不影响,但只有在两个结构域同时存在时才能激活下游基因发生转录[25]。本研究通过构建pGBKT7-TRBD 诱饵质粒,利用酵母双杂交系统初步筛选得到5 个阳性克隆,但由于某些融合基因表达蛋白无需特异性结合即能激活转录系统或某些蛋白与其他蛋白的低亲和力区易结合形成蛋白复合物而引起报告基因表达,会出现“假阳性”结果[26]。因此,需通过回返验证进一步验证是否存在蛋白互作现象,以此降低假阳性结果。此外,在不同组织细胞中,蛋白质之间的相互作用可能会发生改变,不能只通过一种方法判断。因此,本研究利用双分子荧光互补技术和GST-Pull down 技术进一步验证了TRBD与Hsp90 在细胞内和体外均存在互作关系,为探索贾第虫端粒酶调控机制奠定了基础。
