深在性囊性胃炎1例报道并文献复习
2022-05-28罗亚苹李东颖李建生
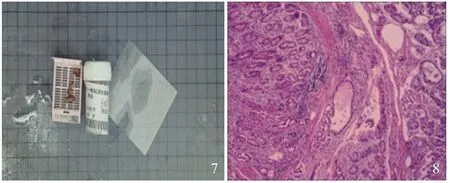
患者,男,60岁,因“间断上腹痛4年余”入院。4年前无明显诱因出现腹痛,为上腹钝痛,持续时间数秒钟,腹痛程度可耐受,变换体位后好转,腹痛与进食无关,无腹胀、腹泻,无反酸、烧心,无恶心、呕吐等不适,至当地医院行胃镜检查:(1)正常胃黏膜;(2)慢性浅表性胃炎;(3)胃底黏膜下肿物,胃底近贲门处大弯侧见一大小约1.5 cm×1.5 cm半球形黏膜下隆起,表面光滑,可见扩张毛细血管团,未取病理。给予对症治疗(具体不详),症状好转。2年前(2019年2月11日)上腹部疼痛症状再次出现至河南省肿瘤医院就诊,于2019年2月13日行超声胃镜检查贲门-胃底:贲门下区-胃底交界部见一大小约1.3 cm×1.4 cm黏膜隆起,顶端毛细血管充盈。EUS小探头贲门-胃底病灶,超声下疑似起源于黏膜下层的无回声影,其一EUS截面最厚处约13.3 mm×6.8 mm;更换环扫超声再次进镜,超声下无回声影结构中未见明确血流信号。诊断:贲门-胃底黏膜下肿物(黏膜下层来源可能,囊肿?),给予对症支持治疗(具体不详)效果不佳。2年前(2019年9月25日)上腹部疼痛症状再次出现至当地新蔡县人民医院行胃镜检查:(1)正常胃黏膜;(2)慢性浅表性胃炎;(3)胃底黏膜下肿物,胃底近贲门处大弯侧见一大小约1.5 cm×1.5 cm半球形黏膜下隆起,表面光滑,可见扩张细血管团,给予对症治疗(具体不详),效差。5 d前于进食后上腹部疼痛症状再次出现,间断服用“奥美拉唑肠溶片”,“泮托拉唑钠肠溶胶囊”药物治疗,症状缓解不明显。既往“脑梗塞”5年,保守治疗后无后遗症。查体无明显阳性体征。于2021年3月8日在郑州大学第一附属医院(河医院区)就诊,在消化内一科住院后,完善血常规、尿常规、粪常规、肝功、肾功、电解质、血脂、凝血功能、血沉、C反应蛋白、降钙素原、甲状腺功能、传染病、幽门螺杆菌抗体、血管内皮生长因子、传染病、肿瘤标志物检验未见明显异常。检查结果,心电图未见异常。64层以上CT平扫加增强(单部位)上腹部(见图1~2):(1)双肾囊肿;(2)肝钙化灶。完善相关检查后行“全麻下胃隆起超声,胃隆起切除术”,进镜距门齿约20 cm以下可见食管前壁黏膜欠光滑,血管纹理紊乱,贲门黏膜正常,齿状线清晰。进镜至胃底前壁可见一黏膜下隆起,表面光滑透亮,顶端可见黏膜稍充血(见图3),胃体黏膜皱襞规整,黏液湖清,胃角光滑锐利,胃窦黏膜红斑样改变,幽门圆,开闭自如。球腔及降段未见异常。超声所见:胃底隆起处呈无回声改变,回声欠均匀,起源于黏膜肌层,横切面大小约15.3 mm×8.9 mm(见图4)。将圈套器置于胃底部分瘤体基底部后,收紧圈套钢丝,通以高频电流,强度35 W,切下瘤体表面部分黏膜后,可见大量黑色及透明样液体流出,瘤体体积缩小,创面无渗血(见图5~6)。内镜黏膜下隆起摘除术后标本(见图7)。胃底隆起切除术后病理诊断:(胃底活检)黏膜慢性炎,黏膜下见数个扩张的囊腔,符合深在性囊性胃炎(gastritis cystica profunda,GCP)(见图8)。行“胃隆起切除术”后给予“艾普拉唑”“复方氨基酸”等抑酸、护胃、营养支持等对症治疗,好转出院。


GCP是一种以良性、囊性胃腺向下生长微黏膜下层为特征的疾病。GCP的病因和发病机制尚未明确,但病变常伴有严重的弥漫性慢性胃炎和幽门螺杆菌感染。目前普遍认为,可能是由于慢性缺血和炎症,炎症引起黏膜肌层的侵蚀,从而导致黏膜下囊肿的形成。GCP可发生在胃黏膜暴露于慢性黏膜炎症后,随后导致增生和化生变化,并增加癌变的风险。Littler等
提出黏膜脱垂和黏膜的炎症在GCP发展中的作用。组织学上有两个明显的阶段,第一阶段:囊腺限于黏膜层(浅层囊性胃炎)。第二阶段:胃腺扩散至黏膜下层(GCP)。病理示,黏膜浅层的囊腺很宽,有柱状和扁平的黏膜内小凹型上皮细胞、幽门腺样细胞和平滑肌细胞产生大量黏液。特征性表现为病变宽大的囊腺,囊腺外的黏膜呈炎症改变。GCP也被认为是癌前病变,少数病例与胃癌相关,胃癌伴淋巴样间质改变
。Roepke等
证明,小鼠Kcne2基因的靶向缺失或损伤可导致严重的胃肿瘤前表型,包括GCP。Kim等
发现,EB病毒(Epstein-Barr virus,EBV)感染引起GCP伴胃癌的异常增生区显示阳性反应。Choi等
发现,GCP胃癌组中EBV阳性率(31.1%)明显高于非GCP胃癌组(5.8%),这表明GCP EBV阳性和胃癌显著相关。此外,还有研究
发现感染幽门螺杆菌的蒙古沙鼠模型动物可发生GCP、胃溃疡和局灶性发育不良。
由于GCP多见于既往手术部位,提示手术或缝合技术本身造成的黏膜损伤导致黏膜脱垂、腺体嵌入黏膜下层,有趣的是,本例患者无腹部手术史,因此,推测有其他因素在起作用。国外研究报道
,在十二指肠反流动物模型中发现GCP样黏膜改变,其中76.2%在80周时发生腺癌。胃黏膜的反复侵蚀可能引起异位囊肿,其表面黏膜可能更易进一步侵蚀。此外,黏膜上皮的再生可能导致胃癌的发展。事实上,GCP病变可能是癌前病变,一些学者
也发现GCP病变中细胞动力学加快,Ki-67、p53、p21等基因突变增强,GCP中的小凹腺体高度增殖,因此,非恶性GCP患者继续监测。
GCP的主要治疗方法是手术切除病变,同时尽量减少胆汁反流进入胃。由于疾病的前恶性性质,组织病理学评估病变是推荐的。此外,国外学者也报道一些手术切除后GCP复发病例。因此,需要仔细的定期随访。本文报道的病例表明,GCP并不局限于曾接受过胃手术的患者,因此,对于胃黏膜异常的病例应予以考虑,需要定期行胃镜检查给予监视,必要时行胃镜下胃黏膜剥离术切除病变。
[1] Littler ER, Gleibermann E.Gastritis cystica polyposa.(Gastric mucosal prolapse at gastroenterostomy site, with cystic and infiltrative epithelial hyperplasia)[J].Cancer, 1972, 29(1): 205-209.DOI: 10.1002/1097-0142(197201)29:1<205::aid-cncr2820290130>3.0.co;2-j.
[2] Roepke TK, Purtell K, King EC, et al.Targeted deletion of Kcne2 causes gastritis cystica profunda and gastric neoplasia[J].PLoS One, 2010, 5(7): e11451.DOI: 10.1371/journal.pone.0011451.
[3] Kim L, Kim JM, Hur YS, et al.Extended gastritis cystica profunda associated with Epstein-Barr virus-positive dysplasia and carcinoma with lymphoid stroma[J].Pathol Int, 2012, 62(5): 351-355.DOI: 10.1111/j.1440-1827.2012.02806.x.
[4] Choi MG, Jeong JY, Kim KM, et al.Clinical significance of gastritis cystica profunda and its association with Epstein-Barr virus in gastric cancer[J].Cancer, 2012, 118(21): 5227-5233.DOI: 10.1002/cncr.27541.
[5] Wiedemann T, Loell E, Mueller S, et al.Helicobacter pylori cag-pathogenicity island-dependent early immunological response triggers later precancerous gastric changes in Mongolian gerbils[J].PLoS One, 2009, 4(3): e4754.DOI: 10.1371/journal.pone.0004754.
[6] 余洋, 赵春临, 常宁.深在性囊性胃炎的诊断与治疗[J].中国实用医刊, 2018, 45(10): 25-27.DOI: 10.3760/cma.j.issn.1674-4756.2018.10.008.
Yu Y, Zhao CL, Chang N.Diagnosis and treatment of gastritis cystica profunda[J].Chinese Journal of Practical Medicine, 2018, 45(10): 25-27.DOI: 10.3760/cma.j.issn.1674-4756.2018.10.008.
