环吡酮胺抑制人胃癌AGS细胞生长、侵袭及其机制研究
2022-05-28王文真夏兴洲
胃癌是全球最常见的癌症之一,也是全球癌症死亡的第3大原因,仅次于肺癌和结肠癌。2020年全球癌症统计报告显示:2020年全球胃癌新发病例约108万,死亡病例约76万例,分别占发病和死亡总数的5.6%和7.7%。其标化发病率和死亡率分别为11.1/10万和7.7/10万
。我国是胃癌高发国家,胃癌发病率和死亡率在所有恶性肿瘤中均居于第2位
。相比之下,远超出世界水平。目前胃癌的临床治疗方案主要是通过手术治疗切除癌变部位以达到根治的目的,辅以放化疗进行术后第二阶段的治疗。但由于缺乏早期常规或标准筛查方式,大多数胃癌患者在早期阶段常无明显症状,确诊时已属中晚期,失去了手术机会,而放化疗无法有效遏制胃癌疾病进展,因此,胃癌患者术后复发率高,总体5年生存率低
。目前临床所使用的大多数化疗药物属于广谱抗肿瘤药物,不仅对癌细胞,对于正常细胞也有非常大的杀伤作用,可发生肝损伤、肾毒性等毒性作用,对患者身体机能影响较大。由于化疗药物疗效有限及个体化差异,肿瘤细胞产生耐药性也较常见,故需要研发治疗胃癌的新型药物。
第二是要求能够培养具有精细化管理理念的管理会计人才。在互联网+视域大数据下的管理人次必须能够是中高层的管理会计人才,其拥有大数据理论知识和应用能力,掌握丰富的管理会计新理论内容。当前要能够通过加强既有管理会计人才的社会培训入手,展开对其大数据应用相关技术的培训,并且严格考核制度,提升管理人才的大数据知识体系;还可以通过完善高校的大数据管理会计人才的培育系统,通过对会计专业设定大数据技术课程,优化管理会计课程内容,并且提供校企合作制度等方式来实现对中高层会计人才的培养。
环吡酮胺(ciclopirox olamine,CPX)是一种广谱抗真菌药物
,临床上主要用于治疗局部皮肤及指甲真菌感染
。近年来被确定为潜在的抗肿瘤药物
。多项体外试验表明,CPX可以抑制横纹肌肉瘤、结肠腺癌、食管鳞癌、人胶质瘤等肿瘤细胞的增殖
,可以通过抑制血管内皮生长因子的表达来抑制人脐静脉内皮细胞的增殖和血管生成
,也可抑制淋巴管的生成
。由于血管和淋巴管的生成在肿瘤的发生和转移中起着至关重要的作用
,这些发现进一步肯定了CPX在肿瘤预防和治疗中的作用,但CPX对胃癌的作用却未见研究和报道。
本研究选取人胃癌AGS细胞为研究对象,使用不同浓度CPX作用于人AGS胃癌细胞,旨在探讨CPX对人胃癌AGS细胞生长、迁移、侵袭、凋亡及细胞周期的影响,以期发现治疗胃癌的新型药物。
1 材料与方法
CPX购自上海笛柏化学品技术有限公司;胰酶细胞消化液、RIPA细胞裂解液、BCA法蛋白定量试剂盒均购自碧云天生物科技有限公司;PBS缓冲液购自美国Hyclone公司;1640培养基、胎牛血清均购自以色列Biological Industries公司;青-链霉素混合液购自索莱宝生物科技有限公司;二甲基亚砜DMSO购自美国Sigma公司;CCK-8细胞增殖试剂盒购自南京诺唯赞生物科技有限公司;SDS凝胶配制试剂盒购自鼎国昌盛公司;Transwell小室购自Corning Costar公司;Matrigel
Basement Membrane购自美国BD公司;细胞周期试剂盒、细胞凋亡试剂盒均购自大连美仑生物技术有限公司。细胞计数仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司;曝光仪购自美国Bio-Rad公司;SDS-PAGE凝胶电泳电转槽购自天能公司。
本研究所用的人胃癌AGS细胞系购自中国科学院上海细胞库。采用含有10%的PBS及青霉素/链霉素双抗混合液的1640培养基在37 ℃、体积分数为5%的CO
、21%的O
和74%的N
培养箱中培养人胃癌AGS细胞。
实验组用不同浓度CPX(5、10、20 μmol/L)处理AGS细胞,对照组加入与最大药物浓度等量的DMSO。将AGS细胞接种于24孔板,加入不同浓度的药物,48 h后,再用胰酶消化收集细胞至流式管中,使用预冷的PBS缓冲液洗2遍。加入预冷的80%乙醇,在4 ℃冰箱固定。第2天,使用预冷的PBS溶液重悬细胞,离心收集细胞,加入500 μl PBS(含50 μg/ml碘化丙啶PI)和50 μg/ml RNase A,孵育30 min,4 ℃避光。上机之前,用300目的筛网过滤样本。流式细胞仪检测,以上实验重复3次,进行数据处理和统计学分析。
迁移能力:梯度浓度的CPX处理AGS细胞12 h后穿膜细胞数如图2所示。随着CPX浓度升高,对AGS细胞迁移的抑制作用逐渐增强,AGS细胞穿膜的能力逐渐下降,差异有统计学意义(
<0.01)。表明CPX对AGS细胞迁移能力的影响呈现浓度依赖效应。显微镜下观察AGS细胞迁移情况如图3所示。以上结果提示,CPX能够明显抑制胃癌AGS细胞的迁移能力,且呈浓度依赖效应。侵袭能力:梯度浓度的CPX处理AGS细胞12 h后穿膜细胞数如表2所示。随着CPX浓度升高,对AGS细胞侵袭的抑制作用逐渐增强,AGS细胞穿过基质胶的能力逐渐下降,差异有统计学意义(
<0.01)。这表明CPX对AGS细胞侵袭能力的影响呈现浓度依赖效应。显微镜下观察AGS细胞侵袭情况如图4所示。无论是AGS细胞的迁移能力还是侵袭能力,在CPX的作用下均显著被抑制,且呈现浓度依赖效应。
将浓度为9.8 mg/ml的基质胶用预冷的F-12培养基按1∶10的比例进行稀释,取40 μl加入到各Transwell的小室中,置于37 ℃细胞培养箱中过夜。再加入50 μl F-12培养基水化基质胶30 min。每个小室接种6×10
个细胞于200 μl无血清F-12培养基中, 在下室中加入600 μl含10% FBS的F-12培养基。以下步骤同上述Transwell测定细胞迁移能力实验。
将处于对数生长期的AGS细胞消化及计数,后以1×10
ml
的密度接种于96孔板中,每孔接种200 μl,置于细胞培养箱中过夜。待细胞贴壁后吸弃原培养基,加入含不同浓度CPX的培养基(2.5、5、10、20、40、80 μmol/L),每种浓度设置6个复孔,同时设置调零孔与对照孔,调零孔只添加CCK-8以消除溶剂对实验结果的影响,对照孔加入与最大药物浓度等量的DMSO以排除溶剂对细胞的影响,加药后继续培养48 h。弃去原有培养基,每孔加入10 μl CCK8,孵育4 h后使用酶标仪检测450 nm波长下的吸光度(
值)。作图并计算
值。
语文课堂注入“人情味”,引导学生与优秀文化接触,与古今中外的高贵灵魂对话,充分发掘课文中的情愫,让学生始终涌动情感的生命源泉,培育热爱祖国、关爱社会、眷念故土、珍爱青春、感恩亲情和悲天悯人的情感,在提高学生语文素养的同时,实现育人目标。例如,教师可以引领学生从《背影》中感受父子深情,从《我与地坛》中体会母子情深,从《边城》中认识祖孙、兄弟之情,从《雨霖铃》中体悟“执手相看泪眼,竟无语凝噎”的离情别绪,从《京口北固亭怀古》中感悟拳拳赤子之情……
收集各组细胞,提取AGS细胞总蛋白,参照BCA检试剂盒测法测定总蛋白的浓度和纯度。将热变性后的蛋白样品按照80 μg/孔上样至10%十二烷基硫酸钠聚丙烯酰胺凝胶孔中行电泳分离。电泳结束后,电转至聚偏二氟乙烯上。质量浓度为50 g/L的脱脂奶粉封膜2 h后,根据抗体说明书将一抗用BSA封闭液稀释至适当浓度后,加入到盛硝酸纤维素(NC)膜的容器里,4 ℃摇床过夜。一抗分别为β-actin、E-cadherin、CDK2、Bcl-2、Bax。次日取出NC膜,用TBST清洗3次,加入二抗,室温孵育1 h后,用TBST清洗3次。将ECL发光液均匀点滴在NC膜上,置于暗室条件下,室温孵育约2 min,放入曝光盒中曝光显影。

2 结果
如图1所示,随着浓度的增加,CPX对AGS细胞的
值逐渐减小,抑制率逐渐增大,与对照组相比,差异有统计学意义(
<0.01)。描绘CPX浓度-抑制率曲线图,计算其
值约为13.6 μmol/L,提示CPX在较小剂量时对AGS细胞即产生毒性作用,且毒性作用的大小与药物浓度成正比。选取不同浓度CPX(0、5、10、20 μmol/L)分别作用于AGS细胞,作用时间分别为24、48、72 h,CCK-8法检测450 nm处
值,根据公式计算不同浓度、不同作用时间下CPX对AGS细胞抑制率的影响。如表1所示,随着CPX浓度的上升及作用时间的延长,CPX对人胃癌AGS细胞的抑制率逐渐升高,呈明显的浓度及时间依赖性;所得抑制率与对照组相比,差异有统计学意义(
<0.01)。以上结果提示,CPX能够明显抑制AGS细胞的增殖活性。
将AGS细胞接种于24孔板中,待12 h细胞贴壁后,用含不同浓度(5、10、20 μmol/L)CPX的培养基继续培养细胞,48 h后用2% BSA的胰酶消化收集至流式管中,2 000 r/min离心5 min,使用预冷的PBS缓冲液4 ℃洗涤细胞,该过程重复2遍,并将细胞过滤成单细胞悬液。用去离子水将10×Binding Buffer 稀释至1×Binding Buffer,每管中加入1×Binding Buffer溶液400 μl重悬细胞,然后加入5 μl FITC和5 μl PI,避光孵育20 min。使用流式细胞仪检测,实验重复3次,并进行统计学分析。
在多媒体教学实践过程中,教师通常需要通过使用U盘、移动硬盘等存储介质将课件导入瘦客户机,然后才能进行PPT讲解、视频播放等一系列教学内容的演示。在经过阶段性的使用和测试过程中,我们会常常遇到瘦客户机连接USB设备无法识别或者识别后无法打开文件的现象。而在连接USB外设实际应用中我们也发现不同类型、不同品牌、不同传输速率的USB外设在瘦客户机上的识别能力和读取速度也不尽相同。综上所述,USB外设识别能力较差的问题已严重影响到正常教学进度和质量。要想有效解决USB外设识别能力问题,我们需要在USB重定向方法和部署上再寻求突破[3-4]。

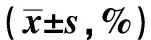
人胃癌AGS细胞经过饥饿培养24 h后,用无血清培养基重悬计数,调整细胞浓度至1×10
ml
种植于细胞侵袭小室(Transwell)。实验组用含有不同浓度CPX的培养基(5、10、20 μmol/L)处理细胞,对照组加入与最大药物浓度等量的DMSO。12 h后用0.1%结晶紫染液染色,然后置于倒置显微镜下随机取6~8个视野观察穿过小室膜的细胞,拍照并计算平均细胞个数。



各组AGS细胞凋亡率如表3所示,随着CPX浓度增大,AGS细胞凋亡率逐渐升高,与对照组相比,差异有统计学意义(
<0.05)。以上结果表明,CPX能够诱导胃癌AGS细胞凋亡,且具有浓度依赖性。各组G
/G
期、S期、G
/M期比例如表4所示。流式细胞仪测定细胞周期如图5所示,与0 μmol/L组相比,CPX处理后G
/G
期所占比例呈浓度依赖性上升趋势,当CPX浓度为20 μmol/L时,差异有统计学意义(
<0.05)。以上结果表明,当CPX浓度较大时,可以阻滞AGS细胞周期于G
期。

以未处理组(0 μmol/L)作为空白对照,实验组采用不同浓度CPX(5、10、20 μmol/L)分别处理AGS细胞。培养12 h后,使用Western blotting方法检测肿瘤迁移相关蛋白E-cadherin、凋亡相关蛋白Bcl-2和BAX、细胞周期蛋白依赖激酶CDK2的表达情况。结果显示,不同浓度CPX处理AGS细胞12 h后,肿瘤迁移相关蛋白E-cadherin表达水平均较空白对照组上调,差异有统计学意义(
<0.05);抗凋亡因子Bcl-2表达水平较空白对照组逐渐下降,而促凋亡因子Bax表达水平则较空白对照组上升,当CPX浓度为10 μmol/L时,Bax表达水平上升最明显,差异有统计学意义(
<0.05);CDK2表达水平较空白对照组逐渐下降,20 μmol/L时下降最明显,差异有统计学意义(
<0.05,见图6)。

3 讨论
贵州省素有“天无三日晴,地无三尺平”的说法,从这句俗语中我们就可以看出该地区雨量充沛,地形地貌复杂多样的特点。这也为贵州省优美的自然环境创造了得天独厚的自然条件。气候和地形条件使得贵州省奇峰怪石处处可见,山、水、洞、林、石交相辉映,浑然一体,形成了动态静态结合的自然奇观,独特的自然景观和丰富的自然资源。[2]贵州省的民族村寨都坐落于这种山水辉映古木参天的自然环境中,其丰富多彩的民族文化也产生于此。
全国家用电器工业信息中心(NAIC)是受中国轻工业联合会委托、经中国轻工业信息中心批准设立的专业信息机构,主要开展行业信息收集、调查、分析研究,并组织编写国内外家用电器行业经济、科技的发展状况、水平、动向、差距和发展趋势,促进行业健康、快速发展。同时,全国家用电器工业信息中心还受中国轻工业信息中心指导,承担家用电器行业科技新成果、新技术的择优推荐工作。
胃癌治疗药物的开发主要是通过诱导细胞坏死、自噬、凋亡等途径而杀伤肿瘤细胞;进一步通过特异性抑制肿瘤细胞增长,从而控制实体肿瘤大小;最后通过某些途径抑制肿瘤细胞迁移和侵袭,达到控制肿瘤细胞远处转移和复发的目的
。本研究选用人胃癌AGS细胞为研究对象,应用CCK-8检测法发现CPX对人胃癌AGS细胞的增殖具有显著的抑制作用,且这种抑制作用具有明显的时间和浓度依赖性。
CPX是一种非专利性的广谱抗真菌药物,用于治疗皮肤、指甲的真菌感染,但近年来被确定具有抗肿瘤作用而引起肿瘤治疗学研究者的广泛关注
。国内外的研究表明,CPX可以诱导多种类型的肿瘤细胞死亡,包括急性髓性白血病(acute myeloid leukemia,AML)、乳腺癌、结直肠癌、神经母细胞瘤,并抑制原代AML细胞异种移植瘤及人乳腺癌MDA-MB-231移植瘤的生长,并且无严重器官毒性或体质量减轻。值得注意的是,先前进行的口服CPX的人体I期研究已经评估了其在难治性血液系统恶性肿瘤患者中的安全性、剂量耐受性、药代动力学和药效学,证明了CPX吸收迅速并显示出良好的治疗指数
。然而,CPX介导的肿瘤生长抑制的详细分子机制仍有待进一步阐明。CPX治疗晚期实体瘤的一期临床试验也在进行当中(NCT03348514),然而其抑癌的具体机制尚未完全阐明,进一步深入研究CPX的抗肿瘤机制将有利于提高其抗肿瘤的疗效,为其在作为临床抗肿瘤药物提供新思路。但有关CPX对胃癌细胞的作用尚未见研究和报道。
细胞凋亡可通过内源性凋亡和外源性凋亡两个主要途径发生。两种凋亡途径最终均通过激活半胱氨酸蛋白酶(caspase),从而导致细胞凋亡
。Bcl-2家族在内源性凋亡途径中发挥主要作用,抑制其表达可以抑制肿瘤细胞的增殖
。Bcl-2蛋白家族通常可以分为两大类。一种为抗凋亡蛋白,包括Bcl-2、Bcl-XL、MCL1等;另一种为促凋亡蛋白,其中Bax、Bak、Bok等蛋白,而另一类促凋亡蛋白亚家族只含有BH3结构域,主要包括Bid、Bim、Noxa、Puma等。在健康细胞中,促凋亡蛋白如Bax处于非激活状态,当促凋亡蛋白Bax和Bak使线粒体外膜通透化时,线粒体通透性增加,线粒体膜间隙蛋白如细胞色素C、线粒体促凋亡蛋白SMAC等释放进入细胞质中,促进凋亡酶激活因子(Apaf-1)寡聚化,后寡集并活化caspase9,SMAC使得caspase从抑制蛋白脱离,导致下游的caspase-3及核酸酶等被活化,维持细胞生存的核酸和蛋白质被降解,诱导细胞凋亡的发生
。抗凋亡蛋白Bcl-2的下游产物为膜蛋白,构成线粒体内膜,产生细胞内活性氧,过度氧化可诱导细胞的凋亡,而Bcl-2可通过抗氧化作用对抗细胞凋亡。本研究应用流式细胞术检测细胞凋亡,实验结果表明,随着CPX浓度的增加,凋亡细胞的比例逐渐增加,呈现出浓度依赖性。这说明CPX能够诱导人胃癌AGS细胞凋亡。Western blotting实验中凋亡相关蛋白Bcl-2和Bax的表达水平显示,抗凋亡因子Bcl-2表达水平较空白对照组逐渐下降,而促凋亡因子BAX表达水平则较空白对照组上升,这一结果也验证了上述凋亡控制基因参与了CPX诱导人胃癌AGS细胞凋亡的过程。
很多瑞士表厂以这些机心为基础机心,增添一些复杂功能来个人化。过去的10年里,在首席执行官兼所有者Miguel Garcia的激励和引导下,Sellita树立了良好口碑,在质量和数量方面都已成长为ETA可靠的替代者和强劲对手。但是,这家公司是否能通过自产擒纵机构来保持价格上的竞争力还有待观察。
细胞周期调控异常是肿瘤发生发展的重要机制,细胞周期进程受到严格控制,调控因素包括细胞周期蛋白(Cyclins)、细胞周期蛋白依赖性激酶(Cyclin dependent kinases,CDKs)和细胞周期蛋白依赖性激酶抑制物(Cyclin dependent kinases inhibitors,CDKIs)
。上述三类物质在G
/S期、G
/M期两个关键点进行调控,前两项属于细胞周期正调控蛋白,而后者属于细胞周期负调控蛋白。CDKs与Cyclin结合后进入细胞周期关键点,细胞周期得以顺利进行,在细胞周期G
/G
期,细胞主要产生CDK2及Cyclin D,三者能够产生络合物从而使细胞通过S期检验点,进入S期(DNA和蛋白质合成期),而此时CDKIs能够与上述络合物结合,从而抑制其活性,使得进入S期进程受阻,细胞周期阻滞在G
/G
期。若CDK2表达下调时,可以引起G
/G
期的延长,延缓G1期向S期转换的进程,更多细胞停滞在G
/G
期。在本研究中流式细胞术表明,随着CPX浓度升高,G
/G
期细胞比例逐渐上升,S期细胞比例逐渐降低。Western blotting结果显示,与空白对照组相比,CDK2表达水平逐渐下降,CPX浓度为20 μmol/L时下降最明显。这些结果表明,CPX能增加G
/G
期细胞比例,降低S期细胞比例。而S期细胞染色体成倍增加,是恶性肿瘤细胞增殖的关键时期。CPX能够抑制人胃癌AGS细胞DNA复制,干扰AGS细胞的增殖。
侵袭和迁移是恶性肿瘤的基本特征之一,其中涉及到多种基因和信号通路的异常,是一个多环节、多步骤的过程,侵袭和迁移会影响恶性肿瘤的治疗效果,也会导致90%以上的患者死亡
。肿瘤在发生转移前,原发灶的肿瘤细胞受到微环境影响会产生一种改变称为上皮-间质转化(epithelial-mesenchymal transition,EMT)。EMT是指生理或病理条件下上皮细胞转换为间质细胞的情况,这一转换使得细胞的迁移运动能力增强。EMT是影响恶性肿瘤侵袭、迁移能力的重要机制。上皮细胞标志物的丢失是EMT发生的重要环节,包括E-cadherin、β-连环蛋白(β-catenin)及细胞角蛋白(cytokeratin)等。上皮细胞的粘附蛋白E-cadherin,在细胞之间起黏附作用,发生EMT时,肿瘤组织E-cadherin表达呈现出不同程度下降,导致肿瘤细胞之间粘附力降低,易脱离原发病灶,最终导致肿瘤的浸润和转移
。本研究结果发现,随着CPX浓度升高,人胃癌AGS细胞迁移、侵袭能力逐渐降低,表明CPX能够抑制胃癌AGS细胞迁移。Western blotting结果显示,随着CPX浓度升高,E-cadherin表达上调,表明E-cadherin在CPX抑制胃癌浸润和转移过程中可能发挥重要作用。
本实验证实了CPX能够显著影响人胃癌AGS细胞的增殖、迁移、侵袭、凋亡和细胞周期,初步探讨了其分子机制,尚未能深入了解CPX对胃癌细胞抗肿瘤作用的分子机制,需要我们在今后的研究中进一步探讨。我们计划在后续实验中使用裸鼠的胃癌移植瘤模型来检测CPX的体内抗肿瘤效果及探讨其分子机制。
综上所述,CPX具有一定的抑制人胃癌AGS细胞增殖和迁移的能力,低剂量的CPX即能够显著抑制人胃癌AGS细胞的增殖和迁移,CPX有望成为治疗胃癌的新型药物。随着研究的日趋深入,CPX的抗肿瘤作用及机制将会进一步细致深入,为CPX在胃癌治疗中的临床应用提供理论依据。
[1] 刘宗超, 李哲轩, 张阳, 等.2020全球癌症统计报告解读[J].肿瘤综合治疗电子杂志, 2021, 7(2): 1-14.DOI: 10.12151/JMCM.2021.02-01.
Liu ZC, Li ZX , Zhang Y, et al.Interpretation on the report of Global Cancer Statistics 2020[J].Journal of Multidisciplinary Cancer Management(Electronic Version), 2021, 7(2): 1-14.DOI: 10.12151/JMCM.2021.02-01.
[2] 周家琛, 郑荣寿, 庄贵华, 等.2000-2015年中国肿瘤登记地区胃癌发病趋势及年龄变化[J].实用肿瘤学杂志, 2020, 34(1): 1-5.DOI: 10.11904/j.issn.1002-3070.2020.01.001.
Zhou JC, Zheng RS, Zhuang GH, et al.Analysis on the trend of gastric cancer incidence and age change in cancer registration regions of China, 2000 to 2015[J].Practical Oncology Journal, 2020, 34(1): 1-5.DOI: 10.11904/j.issn.1002-3070.2020.01.001.
[3] 冯彦虎, 陈昊, 李玉民.循环肿瘤细胞及循环核酸检测在胃癌中的研究进展[J].兰州大学学报(医学版), 2016, 42(5): 48-54.DOI: 10.13885/j.issn.1000-2812.2016.05.010.
Feng YH, Chen H, Li YM.Research progression of circulating tumor cells and circulating nucleic acids in gastric cancer[J].Journal of Lanzhou University(Medical Sciences), 2016, 42(5): 48-54.DOI: 10.13885/j.issn.1000-2812.2016.05.010.
[4] Gupta AK, Plott T.Ciclopirox: a broad-spectrum antifungal with antibacterial and anti-inflammatory properties[J].Int J Dermatol, 2010, 43 Suppl 1: 3-8.DOI: 10.1111/j.1461-1244.2004.02380.x.
[5] Abrams BB, Hänel H, Hoehler T.Ciclopirox olamine: a hydroxypyridone antifungal agent[J].Clin Dermatol, 1991, 9(4): 471-477.DOI: 10.1016/0738-081x(91)90075-v.
[6] Huang S, Shen T.Repositioning the old fungicide ciclopirox for new medical uses[J].Curr Pharm Des, 2016, 22(28): 4443-4450.DOI: 10.2174/1381612822666160530151209.
[7] Zhou H, Shang C, Wang M, et al.Ciclopirox olamine inhibits mTORC1 signaling by activation of AMPK[J].Biochem Pharmacol, 2016, 116: 39-50.DOI: 10.1016/j.bcp.2016.07.005.
[8] Zhou J, Zhang L, Wang M, et al.CPX targeting DJ-1 triggers ROS-induced cell death and protective autophagy in colorectal cancer[J].Theranostics, 2019, 9(19): 5577-5594.DOI: 10.7150/thno.34663.
[9] 李淑洋, 韩胜男, 上官福根, 等.环吡酮胺对食管鳞癌细胞增殖和迁移的影响[J].生命的化学, 2019, 39(4): 785-794.DOI: 10.13488/j.smhx.20190215.
Li SY, Han SN, shangguan FG, et al.Effects of ciclopirox olamine on cell proliferation and migration of esophageal squamous carcinoma cells[J].Chemistry of Life, 2019, 39(4): 785-794.DOI: 10.13488/j.smhx.20190215.
[10] 韩胜男, 龚世伟, 费明明, 等.环吡酮胺抑制人胶质瘤细胞SHG44生长及其机制研究[J].中国细胞生物学学报, 2019, 41(5): 155-163.DOI: 10.11844/cjcb.2019.05.0017.
Han SN, Gong SW, Fei MM, et al.Study of ciclopirox olamine inhibiting human glioma cell SHG44 growth and the underlying mechanism[J].Chinese Journal of Cell Biology, 2019, 41(5): 155-163.DOI: 10.11844/cjcb.2019.05.0017.
[11] Linden T, Wenger RH.Iron chelation, angiogenesis and tumor therapy[J].Int J Cancer, 2010, 106(3): 458-459.DOI: 10.1002/ijc.11223.
[12] Luo Y, Zhou H, Liu L, et al.The fungicide ciclopirox inhibits lymphatic endothelial cell tube formation by suppressing VEGFR-3-mediated ERK signaling pathway[J].Oncogene, 2011, 30(18): 2098-2107.DOI: 10.1038/onc.2010.590.
[13] Folkman J.Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol, 2002, 29(6 Suppl 16): 15-18.DOI: 10.1053/sonc.2002.37263.
[14] Sundar SS, Ganesan TS.Role of lymphangiogenesis in cancer[J].J Clin Oncol, 2007, 25(27): 4298-4307.DOI: 10.1200/JCO.2006.07.1092.
[15] Singh SK, Banerjee S, Acosta EP, et al.Resveratrol induces cell cycle arrest and apoptosis with docetaxel in prostate cancer cells via a p53/p21 WAF1/CIP1 and p27 KIP1 pathway[J].Oncotarget, 2017, 8(10): 17216-17228.DOI: 10.18632/oncotarget.15303.
[16] Siriwarin B, Weerapreeyakul N.Sesamol induced apoptotic effect in lung adenocarcinoma cells through both intrinsic and extrinsic pathways[J].Chem Biol Interact, 2016, 254: 109-116.DOI: 10.1016/j.cbi.2016.06.001.
[17] Gibson CJ, Davids MS.BCL-2 antagonism to target the intrinsic mitochondrial pathway of apoptosis[J].Clin Cancer Res, 2015, 21(22): 5021-5029.DOI: 10.1158/1078-0432.CCR-15-0364.
[18] Du C, Fang M, Li Y, et al.Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J].Cell, 2000, 102(1): 33-42.DOI: 10.1016/s0092-8674(00)00008-8.
[19] 周开梅, 郭瑞珍.细胞周期蛋白在恶性肿瘤中的表达[J].医学综述, 2010, 16(4): 533-536.DOI: 10.3969/j.issn.1006-2084.2010.04.019.
Zhou KM, Guo RZ.Expresssion of Cyclins in malignant tumors[J].Medical Recapitulate, 2010, 16(4): 533-536.DOI: 10.3969/j.issn.1006-2084.2010.04.019.
[20] Bravo-Cordero JJ, Hodgson L, Condeelis J.Directed cell invasion and migration during metastasis[J].Curr Opin Cell Biol, 2011, 24(2): 277-283.DOI: 10.1016/j.ceb.2011.12.004.
[21] Ye Z, Zhou M, Tian B, et al.Expression of lncRNA-CCAT1, E-cadherin and N-cadherin in colorectal cancer and its clinical significance[J].Int J Clin Exp Med, 2015, 8(3): 3707-3715.PMID: 26064266.
