肺泡-动脉血氧分压差、动脉-ETCO2差值、校正D 二聚体对急性肺栓塞危险分层及短期预后的评估价值
2022-05-27程相阁常晓铁宋宝珠
程相阁,常晓铁,文 博,宋宝珠
急性肺栓塞(Acute Pulmonary Embolism,APE)在胸痛中心疾病诊治中与急性心肌梗死、主动脉夹层同属致命性胸痛,会导致胸痛、胸闷、晕厥、休克、甚至猝死等一系列临床表现[1]。APE病情凶险,漏诊率高,死亡率高,预后差。临床中早期识别、早期诊断、合适的溶栓治疗时机、预后的评估策略始终贯穿于APE诊疗思维中。目前临床上依据不断更新的急性肺栓塞诊治指南,涉及血流动力学、超声评估、多种评分预测等[2],实施较为复杂、繁琐,如何床旁快速、精准、简易进行危险分层并评价预后,需不断深入研究,本文从肺泡动脉血氧分压差、动脉-ETCO2差值、校正D-二聚体三个重要指标对急性肺栓塞危险分层及短期预后的评估价值进行了探索,临床中实施取得了一定的效果,具体如下。
1 资料与方法
1.1 临床资料 选择纳入2018年10月至2021年10月黄河三门峡医院心脏重症监护室(Cardiac Intensive Care Unit,CCU)收治的APE患者98例,男性68例,女性30例,年龄18~76岁,平均(48±8.2)岁,其中原发病创伤骨折术后患者25例、脓毒症患者15例、慢性阻塞性肺疾病患者18例、口服避孕药5例、糖尿病患者5例、心脏术后患者10例、肿瘤及肿瘤术后患者20例。依据2018版中国《肺血栓栓塞症诊治与预防指南》[3]进行筛选和危险分层:
1.1.1 纳入标准 符合行肺动脉电子计算机断层扫描(Computed Tomography,CT)造影(Computed Tomography of the Pulmonary Artery,CTPA)确诊。
1.1.2 排除标准 (1)小于18岁;(2)恶性血液病;(3)妊娠;(4)慢性血栓性肺动脉高压患者;(5)入院前已行抗凝治疗患者。
1.1.3 危险分层标准 (1)高危:血流动力学不稳定(包括心脏骤停、梗阻性休克和持续低血压,收缩压<90 mmHg或收缩压下降≥40mmHg)。(2)中危:胸壁超声心动图或肺血管造影,评估右心功能不全或实验室指标心脏生物学标志物升高。(3)低危:血流动力学稳定,影像学或心脏生物标志物评估阴性。危险分层分为低危组(48例)、中危组(32例)、高危组(18例),三组患者入院时的基线资料,包括性别、年龄、体重指数、原发病构成差异无统计学意义(均P>0.05),具有可比性,见表1。本研究收集的肺栓塞患者诊疗措施取得患者或其家属知情同意,部分出院后资料通过电话回访获得,告知匿名处理,通过医院伦理委员会批准获得豁免知情同意权。
1.2 临床观察指标 收集患者入住CCU时的重要呼吸参数肺泡动脉血氧分压差(Alveolar-arterial Oxygen Partial Pressure Difference,PA-aO2)、动脉血二氧化碳分压(Arterial Carbon Dioxide Partial Pressure,PaCO2)、氧 合 指 数(Oxygenation Index,OI)、血流动力学参数(Blood Pressure,BP)、心率(Heart Rate,HR)、APACHEII评分、SOFA评分、严重程度评分取24 h内最差值;应用动脉血气分析监测PA-aO2、快速ELISA法测定D-二聚体、微旁流呼气末CO2监测(Microbypass flow end-tidal CO2monitoring,PETCO2),计算动脉-ETCO2差值(Arterial-ETCO2Difference,PaCO2-PETCO2);同时使用年龄校正的D-二聚体临界值:50岁以下患者D-二聚体临界值设为500μg/L,50岁以上患者的D-二聚体临界值设为(年龄×10)μg/L[4-5];入住CCU后除积极处理原发病外,给予呼吸循环支持,针对不同危险分层肺栓塞患者给予抗凝、静脉溶栓及介入碎栓溶栓等治疗。
1.3 统计学分析 (1)应用SPSS 25.0软件进行统计学分析和图形设计,正态分布的定量资料以均数±标准差(±s)表示,两组间比较采用t检验,三组间比较采用F检验,非正态分布资料定量资料采用中位数-四分位间距[M(P25,P75)]表示,两组比较秩和Z检验,三组比较采用秩和H检验;定性资料用率(%)表示,定性资料比较采用χ2检验或Fisher确切概率法;多因素分析采用cox回归分析筛选独立预测因素,采用ROC曲线分析PA-aO2、PaCO2-PETCO2、校正D-二聚体单独和联合指标对APE短期预后的评估价值。P<0.05为具有统计学差异。
2 结果
2.1 三组不同危险分层患者基线资料比较 三组患者入院时的基线资料,包括性别、年龄、体重指数、原发病构成差异无统计学意义(均P>0.05),见表1。
表1 三组不同危险分层患者基线资料比较[±s/n(%)]
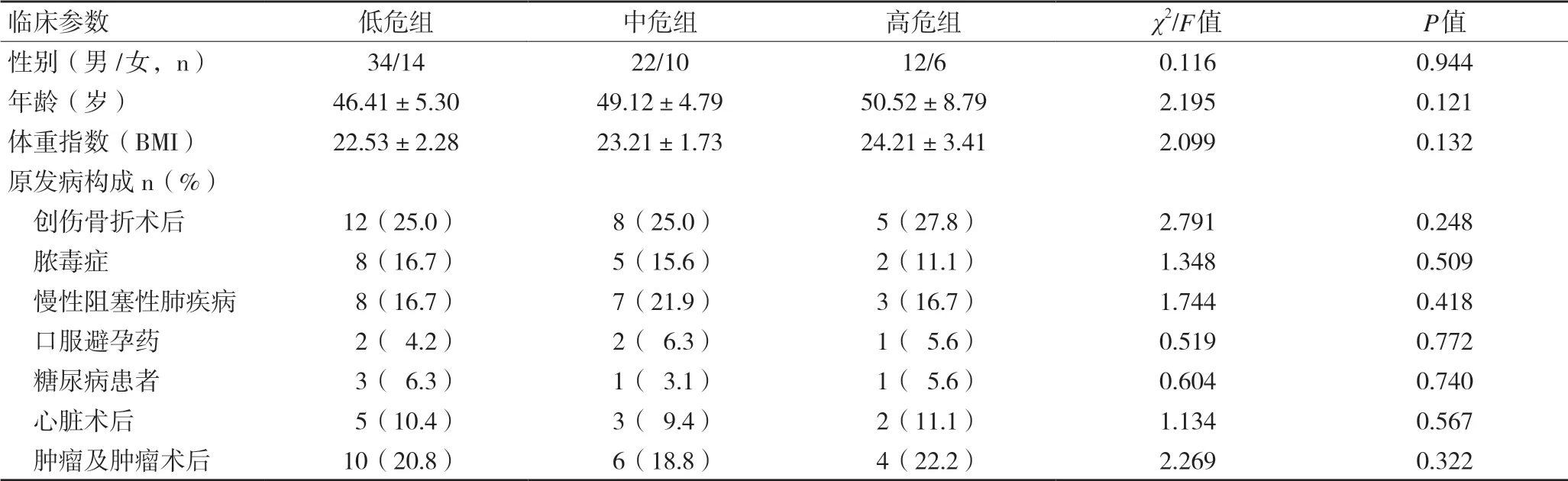
表1 三组不同危险分层患者基线资料比较[±s/n(%)]
临床参数 低危组 中危组 高危组 χ2/F值 P值性别(男/女,n) 34/1422/1012/60.1160.944年龄(岁) 46.41±5.3049.12±4.7950.52±8.792.1950.121体重指数(BMI) 22.53±2.2823.21±1.7324.21±3.412.0990.132原发病构成n(%) 创伤骨折术后 12(25.0) 8(25.0) 5(27.8) 2.7910.248 脓毒症 8(16.7) 5(15.6) 2(11.1) 1.3480.509 慢性阻塞性肺疾病 8(16.7) 7(21.9) 3(16.7) 1.7440.418 口服避孕药 2( 4.2) 2( 6.3) 1( 5.6) 0.5190.772 糖尿病患者 3( 6.3) 1( 3.1) 1( 5.6) 0.6040.740 心脏术后 5(10.4) 3( 9.4) 2(11.1) 1.1340.567 肿瘤及肿瘤术后 10(20.8) 6(18.8) 4(22.2) 2.2690.322
2.2 三组不同危险分层患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较 因危险层级不同,高危组PA-aO2、PaCO2-PETCO2、校正D-二聚体水平均高于中、低危组,差异有统计学意义(P<0.001),见表2。
表2 三组不同危险分层患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较 ( ±s)

表2 三组不同危险分层患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较 ( ±s)
注:(1)PA-aO2:肺泡动脉血氧分压;(2)PaCO2-PETCO2:动脉CO2与呼气末CO2差值
参数 低危组 中危组 高危组 F值 P值PA-aO2(mmHg) 29.02±2.8437.24±3.5041.67±7.2569.88 <0.001 PaCO2-PETCO2(mmHg) 5.52±1.227.82±1.5010.89±1.6194.39 <0.001校正D二聚体(mg/L) 2.85±0.876.13±1.519.48±2.88109.74 <0.001
2.3 不同预后患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较 死亡组的PA-aO2、PaCO2-PETCO2、校正D-二聚体水平均高于存活组,差异有统计学意义(P<0.001),见表3。
表3 不同预后患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较( ±s)
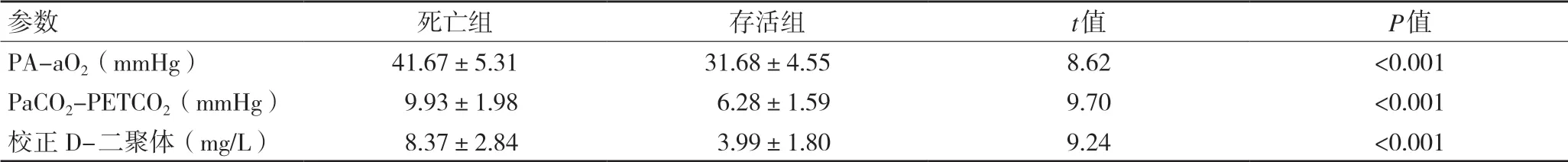
表3 不同预后患者PA-aO2、PaCO2-PETCO2、校正D-二聚体比较( ±s)
注:(1)PA-aO2:肺泡动脉血氧分压;(2)PaCO2-PETCO2:动脉CO2与呼气末CO2差值
参数 死亡组 存活组 t值 P值PA-aO2(mmHg) 41.67±5.3131.68±4.558.62 <0.001 PaCO2-PETCO2(mmHg) 9.93±1.986.28±1.599.70 <0.001校正D-二聚体(mg/L) 8.37±2.843.99±1.809.24 <0.001
2.4 影响APE患者预后的多因素cox回归分析 多因素cox回归分析显示PA-aO2、PaCO2-PETCO2、校正D-二聚体、PLT、APACHEII、SOFA评分是APE患者28 d内死亡的独立危险因素,其中PA-aO2、PaCO2-PETCO2、校正D-二聚体HR均大于1,相比PLT、APACHEII、SOFA评分风险指数明显异常且易于监测计算,差异具有统计学意义(P<0.05),见表4。

表4 影响APE患者预后的多因素cox回归分析
2.5 PA-aO2、PaCO2-PETCO2、校 正D-二 聚 体 对 急 性肺栓塞28 d内死亡的预测价值 通过ROC曲线分析,PAaO2、PaCO2-PETCO2、校正D-二聚体对急性肺栓塞28 d内死亡的预测分别为AUC值:0.924、0.919、0.905,灵敏度:76.67%、90%、73.33%,特 异 度:92.65%、79.41%、92.65%,约登指数:0.693、0.694、0.659,最佳截断值38.50、7.50、6.48。通过COX风险模型针对三个独立危险因素,通过各自回归系数拟合方程得到联合值,三者联合指标预测下的AUC:0.946,灵敏度:86.67%,特异度:89.31%,约登指数:0.764,均高于三者单独检测,见表5。联合指标下的AUC面积大于三者单独的AUC面积,见图1。
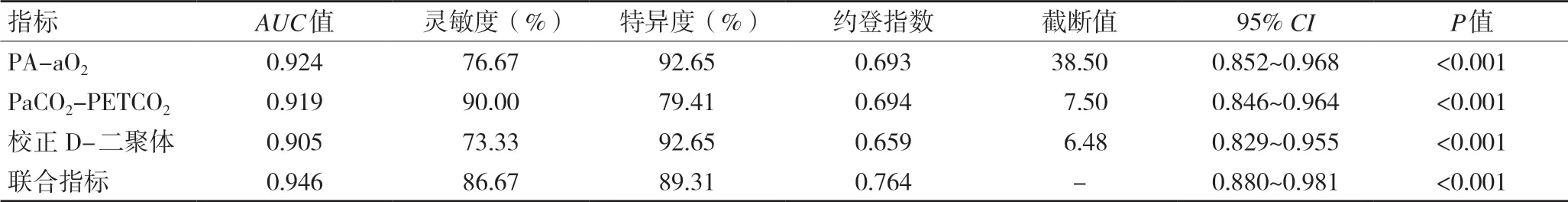
表5 PA-aO2、PaCO2-PETCO2、校正D-二聚体对急性肺栓塞28 d内死亡的预测价值
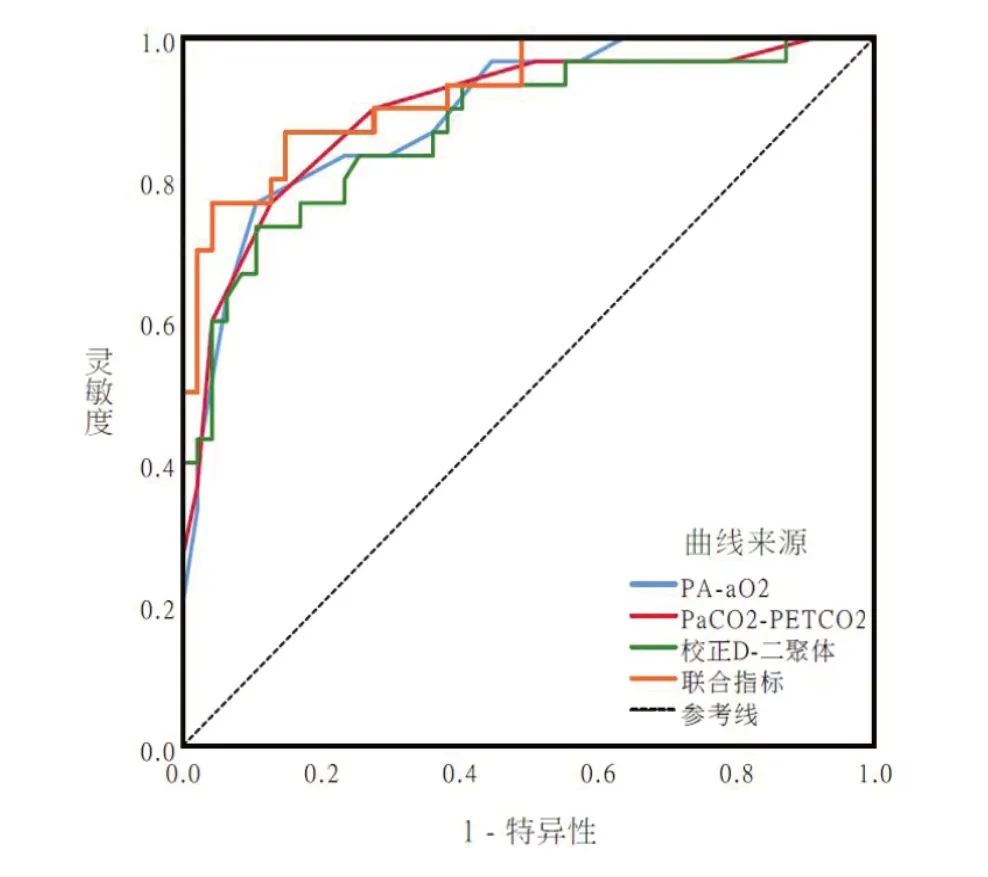
图1 预测急性肺栓塞患者28 d死亡的ROC曲线图
3 讨论
APE是临床中严重的心肺血管疾病之一,临床表现隐匿多样、缺乏特异性,容易误诊漏诊。APE病情突发,尤其中高危APE进展快,常导致猝死。随着医院胸痛中心的建设,APE的临床诊治、危险分层及预后评估对时间的要求不断加强。APE患者主要表现为肺血管床容积减少、肺动脉高压、血流动力学障碍、严重低氧血症、通气血流比例失调等特征[6],以往我们常规按照追溯病史、心电图特征、右室舒张末/左室舒张末直径之比(RV end-diastolic/left ventricular enddiastolic diameter ratio,RVED/LVED)[7]、wells评 分、改 良Geneva评分等辅助诊断,通过CPTA确诊,后通过血流动力学变化、肺栓塞严重指数、心脏血清学指标等进行危险分层[8]。上述诊断、分层、评分难免繁杂,对于血流动力学不稳定、随时抢救、不易搬动患者的部分检查可能难以施行,且为有创、费用高、耗时耗力。鉴于以上原因,临床医师在工作中需不断探究更加简易、快速、床旁实时的监测方法,从而能及时、准确地发现APE患者。本文从APE病理生理学上寻求敏感、特异的指标突破口,筛选出PA-aO2、PaCO2-PETCO2、校正D-二聚体三个具有独立风险因素的变量,对APE的诊断、分层、预后具有很好的适用性。同时一定程度上还可以避免胸部影像学带来的辐射暴露及造影剂反应[9]。
急性肺栓塞因肺泡毛细血管膜进行性弥散功能异常导致换气障碍,出现缺氧表现,由于CO2的弥散能力比O2大20倍,换气障碍用PA-aO2来判断,较PaO2更为敏感,更早反映摄取氧情况[10]。许春杰等[11]收集了确诊APE的数据信息,采用COX回归模型分析PA-aO2水平与APE患者出院后死亡的关系,提示PA-aO2水平可以预示APE患者的预后。Marconi L等[12]学者在评估肺栓塞不同时间肺灌注扫描变化与PA-aO2水平呈高度相关性;Subramanian M[13]等研究也报道了肺动脉阻塞指数与PA-aO2有显著的相关性,并证实缺氧是APM患者右心室功能障碍和30 d死亡率的独立预测因素。其次APE出现通气血流比例失调,正常情况下无效腔量(Dead Space,VD)与潮气量(Tidal Volume,VT)比值为0.3,肺栓塞时VD/VT明显增加,Kreit JW[14]等研究发现VD/VT可以床旁评估肺栓塞严重程度,而通过Frankenfield DC等[15]研究VD/VT=0.320+0.0106(PaCO2-PETCO2)+0.003(RR)+0.0015(age),我们发现VD/VT值与PaCO2-PETCO2明显相关,而PaCO2-PETCO2更易床旁计算,可以作为VD/VT的替代指标来评估APE。Wang J[16]等在评价APE机械通气时的一项横断面研究也显示PaCO2-PETCO2的差值变化与APE的预后明显相关,并且在不同氧合指数条件下,这种相关性无明显差异。Aagaard R[17]报道肺栓塞D二聚体是急性肺栓塞的敏感标志物,然而D-二聚体的诊断敏感度随着年龄的升高而逐渐降低,2019版《ESC急性肺栓塞诊断与管理指南》明确指出采用年龄校正的D-二聚体临界值(年龄×10μg/L)可提高其特异度和灵敏度[18]。黄隽敏等[19]学者研究表明急性肺栓塞的患病人群多为老年人,D-二聚体的浓度随年龄增加而增高,根据年龄校正的D-二聚体临界值标准可提高其对APE的诊断效率,减少漏诊,尤其适用于50岁以上人群[20]。
近年来随着APE研究的不断深入,国内外学者通过联合不同指标在准确评估APE上进行了多种探索,王蕾等[21]报道了D-二聚体联合PA-aO2检测在诊断全麻术后急性肺栓塞的临床价值;Weatherald J等[22]通过联合PA-aO2、PaCO2-PETCO2可替代的VD/VT用来评估心肺疾病的气体交换效率,PA-aO2从O2弥散(入)的角度评估肺换气功能,而PaCO2-PETCO2从CO2(出)的角度通过通气效率间接反映肺换气功能,两者从不同角度联合对APE病情进行反馈。本文在上述指标的基础上进一步延伸和扩展,从PA-aO2、PaCO2-PETCO2、校正D-二聚体三个联合指标来诊断、评估、分析APE是合理可行的方法。验证了三指标在APE不同危险分层中的变化以及在APE预后评估方面具有较高的灵敏度、特异度。
综上所述,APE患者PA-aO2、PaCO2-PETCO2、校正D-二聚体三者水平的变化反映病情的程度及短期预后,在临床治疗中有一定的应用价值,值得推广。当然本研究方法为单中心、历史性队列研究,后期需要多中心、前瞻性、大样本RCT研究进一步证实三指标联合的价值。
