药对三七-丹参对外伤血瘀证大鼠血浆和尿液代谢组的影响
2022-05-27张越凡曾锐张海霞王敏施建丰陈斌
张越凡,曾锐,张海霞,王敏,施建丰,陈斌✉
(1.南京中医药大学附属中西医结合医院,江苏 南京 210028;2.江苏省中医药研究院国家中医药管理局中药释药系统重点研究室,江苏 南京 210028;3.南京中医药大学第三临床医学院,江苏 南京 210028;4.南京大学医学院附属鼓楼医院药学部,江苏 南京 210008)
外伤血瘀证是由创伤、跌打损伤及金刃损伤等多种原因[1]所致的脉管破损,血液溢于脉外的病证[2],属于血瘀证的一种[3]。机体存在外伤血瘀症状时,会导致血液流变学异常、伤处淤斑或病理性改变、微循环障碍等[4],从而使机体处于慢性疼痛的不适状态[5]。
三七[Panax notoginseng(Buekill)F.H.Chen ex C.H.Chow]和丹参(Salviae miltiorrhizae)为临床常用活血中药,两药许多药理活性均相同,常以配伍药对[6]形式出现在血瘀、血栓、冠心病等疾病的治疗中,使活血消瘀之效倍增[7]。
目前外伤血瘀证的相关研究主要集中在血管内皮细胞功能、血小板功能、炎症反应、微循环障碍和血液流变学变化等方面[8-11],而关于外伤血瘀证对机体内源性物质代谢的影响研究较少。因此,本研究复制了大鼠外伤血瘀证模型,并基于UPLC-Q-TOF-MS/MS技术研究经典活血中药三七、丹参及两者不同比例配伍药对对外伤血瘀证大鼠血液流变学、病理组织形态及血浆、尿液内源性代谢物质的影响,分析并比较了三七、丹参单味入药或以不同比例配伍药对入药对外伤血瘀证模型大鼠血浆和尿液中血瘀差异代谢物的回调作用,以期从代谢组学角度探究三七、丹参及其不同比例配伍药对的活血化瘀作用机制,丰富三七-丹参活血作用的研究。
1 材料
1.1 药品与试剂
三七(亳州万珍中药饮片厂,批号:2008065)、丹参(贵州同德药业有限公司,批号:20191101-01)经江苏省中医药研究院黄一平研究员鉴定,均符合2020年版《中华人民共和国药典》规定。活血止痛胶囊(珠海安生凤凰制药有限公司);羧甲基纤维素钠(上海麦克林生化科技有限公司,批号:107001134);肝素钠注射液(常州千红生化制药有限公司);甲醇和乙腈(色谱纯,德国Merk公司);甲酸(色谱纯,ACS公司)。
1.2 仪器
超高效液相色谱-四极杆飞行时间质谱(AB SCIEX Triple TOF 5600+,美国AB 公司);冰箱(BCD-530WDEAU1,海尔智家股份有限公司);手提高速粉碎机(DFT-100A,温岭市林大机械有限公司);台式高速冷冻离心机(5430R,Eppendorf 公司);涡旋仪(IKA®VORTEX,德国IKA 公司);海尔低温保存箱(DW-86L578S,青岛海尔生物医疗股份有限公司);数控超声波清洗器(KQ2200DV,昆山市超声仪器有限公司);千分之一电子天平(LE403E型,梅特勒-托利多仪器上海有限公司);氮吹仪(N-EVAP-112,美国Organomation公司);倒置显微镜(Ⅸ73,Olympus 公司);自动血流变分析仪(SA-9000,北京赛科希德公司)。
1.3 动物
48 只SD 大鼠,雌雄各半,体质量(250 ± 20)g,购自南通大学,动物许可证号:SCXK(苏)2019-0001,饲养于江苏省中医药研究院动物实验中心(温度23~24 ℃,湿度40%~45%)。所有大鼠适应性饲养1 周后再进行实验。本实验对动物所有操作均符合江苏省中医药研究院动物伦理委员会标准。
1.4 灌胃药物制备
三七、丹参分别打粉过80 目筛得三七药粉和丹参药粉,将三七药粉和丹参药粉分别按3∶1、1∶1、1∶3 的比例混匀,得不同比例三七-丹参药对粉末,活血止痛胶囊除去胶囊外壳得阳性药粉末,用0.1% CMC-Na溶液分别将三七、丹参和不同配比的三七-丹参药对配制为生药浓度0.243 g/mL 的混悬药液(以生药含量计),阳性药粉末配制为0.081 g/mL的混悬药液。
2 方法
2.1 动物分组、造模与给药
将48 只SD 大鼠随机分为空白组、模型组、活血止痛胶囊组(阳性药组)、三七组、丹参组以及三七-丹参3∶1 组、三七-丹参1∶1 组和三七-丹参1∶3 组,每组6 只。实验前1 d 固定全部大鼠,将各组大鼠右后肢脱毛,除空白组外,其余各组大鼠均参考文献[12]复制大鼠外伤血瘀证模型,空白组大鼠固定相同时间。各给药组根据体表面积折算法换算为成人临床剂量(9 g)的3 倍量(2.43 g/kg)给药,阳性药组按照体表面积折算法换算为成人日用量(每粒0.5 g,1 次3 粒,每日2 次)的3 倍量(0.81 g/kg)给药,混悬药液灌胃量均为10 mL/kg;空白组和模型组大鼠灌胃等体积的0.1%CMC-Na溶液,每日1次,连续给药5 d。
2.2 血液流变学指标检测
各组大鼠采用肝素锂负压采血管经腹主动脉采血,手持采血管中部上下颠倒5~8 次,使全血与肝素锂充分混匀后,4 h 内用自动血流变分析仪测定200、50、30、5、1 1/s 切变率下的全血黏度及全血高切、低切相对黏度。
2.3 病理标本留取
取大鼠伤肢肌肉组织,在10%甲醛溶液中固定24 h,石蜡制片,用苏木精-伊红染色(HE 染色),树胶固封,显微镜下进行病理观察。
2.4 生物样本收集、制备与检测
2.4.1 生物样本采集
末次给药12 h 后,大鼠均单只放于代谢笼内禁食不禁水,收集大鼠12~24 h 尿液后,经眼眶静脉丛采血至涂有1%肝素钠生理盐水的离心管内。上述生物样本均离心10 min(4 ℃,3 000 r/min),转移上清液至新的离心管内,得血浆和尿液样本,于-80 ℃保存。
2.4.2 生物样本制备
分析前取出血浆和尿液样本,4 ℃解冻。精确吸取200 μL 血浆,加入4 倍量预冷24 h 乙腈,涡旋60 s,4 ℃静置10 min 后,13 000 r/min 离心15 min,转移上清液至新的离心管中,4 ℃下氮气吹干后用200 μL乙腈水溶液(乙腈∶水=8∶2,V/V)复溶,涡旋60 s,13 000 r/min离心15 min,取上清液进样检测。
精确吸取200 μL 尿液,加入4倍量预冷24 h乙腈,涡旋60 s,4 ℃静置10 min后,13 000 r/min离心15 min,转移上清液至新的离心管中,4 ℃下氮气吹干后用200 μL乙腈水溶液(乙腈∶水=8∶2,V/V)复溶,涡旋60 s,13 000 r/min离心15 min,取上清液进样检测。
2.4.3 质控样本(quality control samples,QC samples)
分别等量吸取每份血浆和尿液样本30 μL,混合均匀,得到血浆QC 样本和尿液QC 样本,用于检测仪器稳定性和重复性。
2.4.4 色谱条件
色谱柱为Acquity UPLC BEH C18(1.7 μm,2.1 mm×100 mm,Waters 公司);柱温40 ℃,流速0.3 mL/min,进样量2 μL;流动相A为0.1%甲酸水,流动相B 为乙腈溶液。洗脱条件[13]:0~1 min,30% B;1~2 min,30%~60% B;2~3 min,60%~70% B;3~6 min,70%~95% B;6~7.5 min,95% B;7.5~7.6 min,30%B;7.6~10 min,30%B。
2.4.5 质谱条件
采用TOF MS-IDA-MS/MS,电喷雾离子源(ESI),正、负离子扫描,扫描范围50~1 250 m/z。检测方式[13]:气帘气(CUR)40 psi,雾化气(GS1)55 psi,辅助气(GS2)55 psi,电喷雾电压(ISVF)5 500 eV,离子源温度(TEM)550 ℃,去簇电压(DP)± 100 eV;TOF MS 模式下设置碰撞电压±10 eV,IDA-MS/MS 条件下设置碰撞电压±40 eV,碰撞电压差20 eV。
2.4.6 进样步骤
血浆和尿液样本分开进样,分析前先进10 次相应QC 样本平衡分析系统后,正式进样。每进样6 个样品,进1 针相应QC 样本以平衡系统,从而降低进样次序对分析结果的影响。
2.5 数据处理及统计学分析
UPLC-Q-TOF-MS/MS 采集的原始质谱数据经Marker-ViewTM软件进行峰提取,峰对齐,峰滤波和归一化预处理,将得到的数据矩阵导入SIMCA-P 软件进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),筛选差异代谢物。将差异代谢物的质荷比、保留时间以及质谱碎片等信息与公共数据库KEGG(http://www.genome.jp/kegg/)、HMDB(http://www.hmdb.ca/)及文献报道进行比对和确认,鉴定差异代谢物。合并正、负离子模式下的血浆和尿液差异代谢物。通过MetaboAnalyst 5.0(http://www.metaboanalyst.ca/)基于网络的高通量代谢组学数据库综合分析差异代谢物的代谢途径。
血液流变学指标和差异代谢物含量差异通过SPSS 25.0 软件进行单因素方差分析和t检验,血液流变学指标结果以±s表示,差异代谢物含量的变化趋势用“↑”表示上调,“↓”表示下调,以P<0.05表示差异具有统计学意义。
3 结果
3.1 外伤血瘀证模型评价分析
3.1.1 各组大鼠血液流变学结果比较
模型组大鼠造模后血液流变学相关指标均显著高于空白组(P<0.01),说明造模成功;与模型组相比,不同药物组血液流变学相关指标均显著降低(P<0.05,P<0.01);与阳性药组相比,三七-丹参3∶1 组所有血液流变学指标均显著降低(P<0.05,P<0.01),其余药物组血液流变学指标与阳性药组比较差异无统计学意义。综上,三七、丹参单味入药及三七-丹参不同比例配伍的药对均能改善外伤血瘀证的血液黏稠状态,且三七-丹参3∶1 组改善血液黏稠的效果最好。见表1。
表1 各组大鼠血液流变学结果比较(±s,n=6)

表1 各组大鼠血液流变学结果比较(±s,n=6)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阳性药组比较,ΔP<0.05,ΔΔP<0.01。
组别空白组模型组阳性药组三七组丹参组三七-丹参3∶1组三七-丹参1∶1组三七-丹参1∶3组全血黏度(mPa·s)低切16.07±2.40 22.70±7.49**9.98±2.06##11.57±1.11##15.04±1.35##9.02±2.58##Δ 10.64±1.63##11.43±1.74##200 1/s 3.71±0.15 5.08±0.13**3.31±0.27##3.16±0.33##3.52±0.14#2.82±0.57##Δ 3.31±0.30##3.36±0.20##50 1/s 4.49±0.23 6.02±0.23**3.88±0.21##3.73±0.40##4.24±0.17#3.03±0.73##Δ 3.90±0.37##4.02±0.28##30 1/s 4.98±0.28 6.62±0.21**4.23±0.19##4.08±0.44##4.69±0.18#3.64±0.24##Δ 4.27±0.42##4.42±0.36##5 1/s 8.70±0.77 10.22±1.11**6.48±1.21##6.75±0.76##8.12±0.33##5.57±0.43##Δ 7.03±0.82##7.54±0.83##1 1/s 19.80±2.46 24.28±4.01**14.23±3.19##14.47±1.74##18.30±0.88##12.94±4.28##ΔΔ 15.00±2.12##16.71±2.50##全血相对黏度(mPa·s)高切3.01±0.16 5.82±1.19**2.43±0.25##2.52±0.20##2.89±0.16##1.98±0.34##Δ 2.34±0.27##2.30±0.13##
3.1.2 各组大鼠伤肢肌肉组织病理分析比较
空白组肌束和肌纤维形状完整,清晰可见,肌浆染色均匀,细胞核正常,未见炎细胞浸润;模型组肌束消失,肌纤维溶解消失,肌浆颜色极浅,细胞核碎裂严重,视野中可见大量炎细胞浸润;不同药物可在不同程度上改善伤肢肌肉组织病变,且三七-丹参3∶1 组恢复程度最接近空白组。见图1。

图1 各组大鼠伤肢肌肉组织HE染色结果(HE,×400)
3.2 代谢组学分析
3.2.1 代谢轮廓分析
各组大鼠血浆和尿液正、负离子模式下的总离子流图见图2。可见各组大鼠血浆和尿液初步代谢轮廓相似,但不同时间下的离子强度各有差异,提示不同保留时间下的血浆和尿液内源性成分的含量有差异。
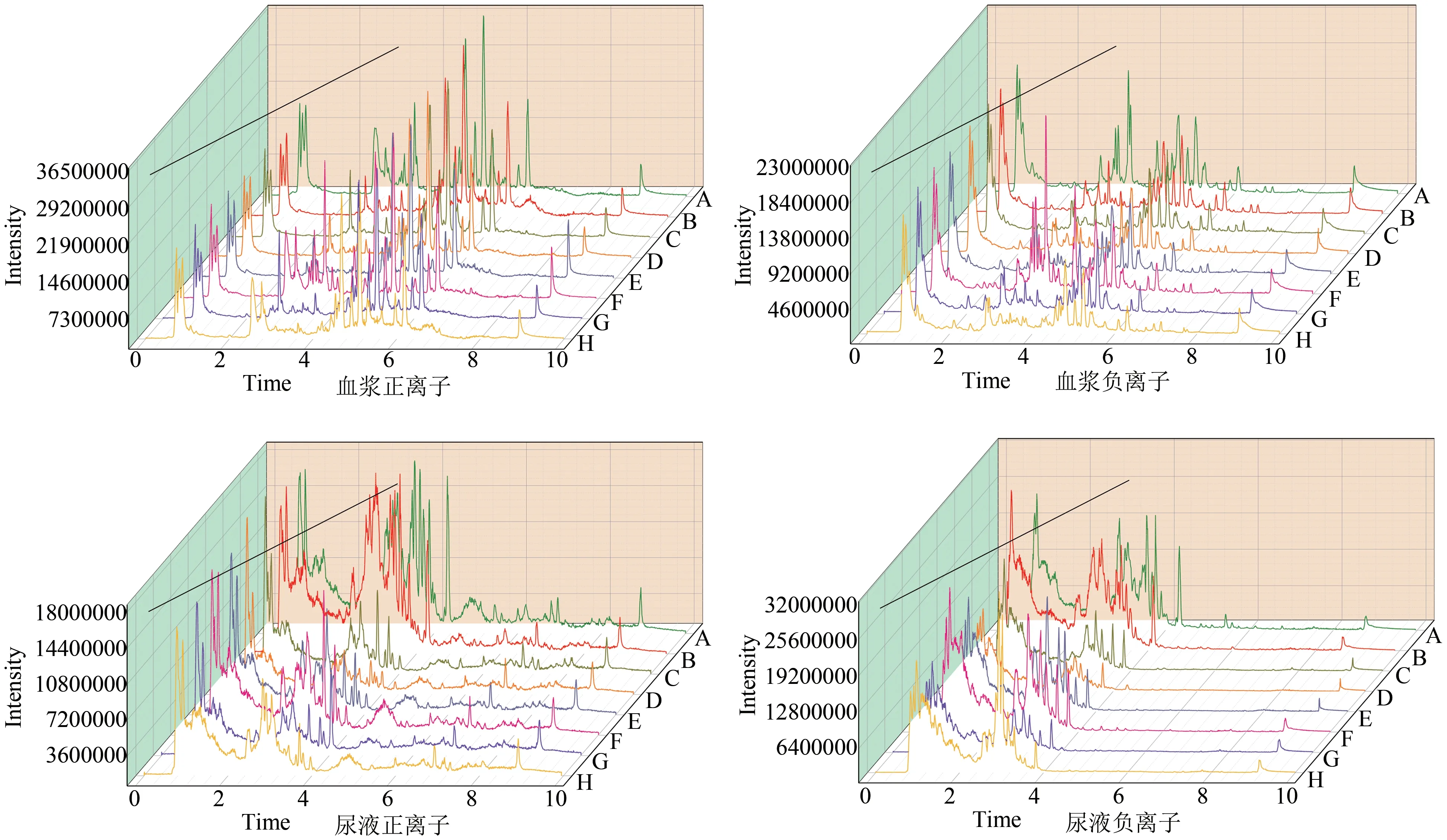
图2 各组大鼠血浆、尿液总离子流图
3.2.2 各组大鼠质谱数据主成分分析(PCA分析)
UPLC-Q-TOF-MS/MS 检测后将正、负离子模式下血浆和尿液样本及对应的QC 样本质谱数据用Marker-ViewTM预处理后,将所得数据矩阵导入SIMCA-P 进行PCA 分析。正、负离子模式下血浆及尿液QC 样本聚集良好,说明仪器方法稳定。正离子模式下,各组血浆和尿液样本实现较好聚集,且模型组与空白组完全分离,不同给药组均有向空白组靠近趋势;负离子模式下,各组血浆和尿液样本较集中,总体差异不明显,见图3。因此进一步采用区分能力更强的有监督的正交偏最小(OPLS-DA)二乘判别分析。

图3 各组大鼠PCA得分图
3.2.3 外伤血瘀证大鼠差异代谢物OPLS-DA分析
分别将空白组和模型组正、负离子下血浆和尿液质谱数据进行OPLS-DA 建模分析。设定置换检验参数为200,对模型进行检验(血浆正:Q2=0.805、R2X=0.976、R2Y=0.949;血浆负:Q2=0.891、R2X=0.954、R2Y=0.956;尿液正:Q2=0.885、R2X=0.922、R2Y=0.999;尿液负:Q2=0.851、R2X=0.901、R2Y=0.999),模型没有过度拟合,解释能力较好,数据分析可靠。血浆和尿液样本正、负离子模式下空白组与模型组分开,外伤血瘀证大鼠造模后血浆和尿液内源性成分发生改变,说明造模成功,见图4。以VIP>1 且t检验后P<0.05 为标准筛选差异变量。将筛选出的差异变量的质荷比、保留时间和质谱碎片信息,结合HMDB、KEGG 及相关文献报道进行比对分析和鉴定,共鉴定出34 个外伤血瘀证的差异代谢物,其中血浆差异代谢物22 个,尿液差异代谢物12 个,见表2。

表2 外伤血瘀证模型大鼠差异代谢物

图4 OPLS-DA得分图
3.2.4 阳性药、三七、丹参及三七-丹参不同配比药对对差异代谢物的影响
各药物组血浆和尿液质谱数据经Marker-ViewTM预处理,分别对上述差异代谢物进行提取,将各差异代谢物在各药物组内的响应值与模型组进行比较,以不同药物对差异代谢物的回调个数来比较治疗效果。结果显示,阳性药、三七、丹参和三七-丹参不同比例药对均干预了血浆和尿液内源性成分代谢,分别回调了23、17、17、26、23、21 个差异代谢物,见表3。综上,不同药物均可以通过回调外伤血瘀证模型大鼠差异代谢物,且三七-丹参3∶1 组回调差异代谢物最多。

表3 各药物组对血浆和尿液差异代谢物的回调结果
3.2.5 分层聚类分析
聚类分析热图能更加直观地反映各组间34 个差异代谢物的含量差异及变化趋势。血浆和尿液样本经Marker-ViewTM提取上述差异代谢物对应响应值,所得响应值矩阵经微生信在线数据库(http://www.bioinformatics.com.cn/)进行分层聚类分析。其中,横向代表样本信息,纵向代表差异代谢物信息,颜色的深浅则代表差异代谢物含量的高低,红色表示含量高响应值大,绿色表示含量低响应值低。空白组与模型组分于左右两侧,表明造模后上述差异代谢物含量出现变化;给予阳性药、三七、丹参和三七-丹参不同比例药对后,不同药物组均有偏离模型组向空白组靠近的趋势,说明给予药物治疗后上述差异代谢物含量有向空白组回调的趋势;且阳性药组和三七-丹参3∶1组较模型组偏离程度最大,更靠近空白组;三七、丹参组较模型组偏离程度低,离模型组最近;三七-丹参1∶1、1∶3 组较模型组偏离程度中等。上述结果提示三七、丹参及三七-丹参不同配比均可改善外伤血瘀证大鼠血浆和尿液内源性成分代谢紊乱,且三七-丹参3∶1组的改善 效果优于两者单用和其他配比组。见图5。
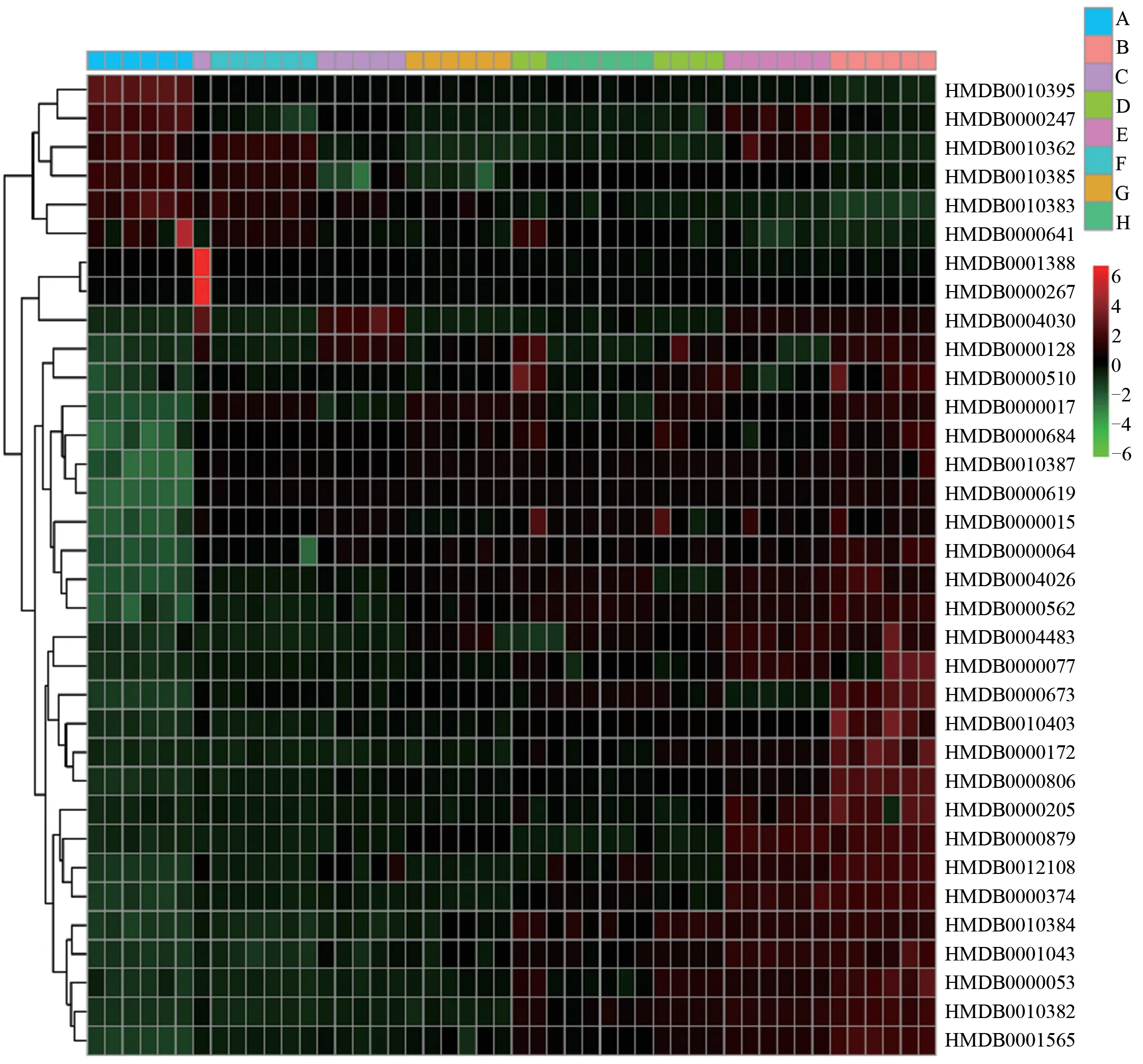
图5 血浆样本聚类分析图
3.2.6 差异代谢物的通路分析
基于MetaboAnalyst 数据库Pathway analysis 模块,导入34个外伤血瘀证差异代谢物进行KEGG代谢通路富集分析,选择通路影响值(Pathway Impact)>0.1 的代谢通路作为外伤血瘀证干预的靶标代谢通路。外伤血瘀证大鼠血浆和尿液差异代谢物的含量变化主要干扰了亚油酸代谢,类固醇激素生物合成,α-亚麻酸代谢,花生四烯酸代谢,苯丙氨酸代谢,戊糖和葡萄糖醛酸转化,赖氨酸降解,丙氨酸、天冬氨酸和谷氨酸代谢,共8条代谢通路(Impact>0.1),见图6。分别导入阳性药、三七、丹参以及三七-丹参药对回调的差异代谢物,得到不同药物对上述外伤血瘀证干预的代谢通路的调控结果,见表4。阳性药组、三七组、丹参组以及三七-丹参3∶1组、三七-丹参1∶1组、三七-丹参1∶3组分别调控了7、5、5、8、6、5条上述代谢通路(Impact>0.1),见表4。综上,三七、丹参单用或三七-丹参不同配比的药对均可调节外伤血瘀证大鼠紊乱的代谢通路,且三七-丹参3∶1组调节的通路最多,干预范围更大。

表4 不同药物组调节血瘀干预通路Impact值

图6 代谢通路图
4 讨论
本研究复制了大鼠外伤血瘀证模型并且通过UPLC-Q-TOF-MS/MS 技术对外伤血瘀证大鼠血浆和尿液代谢组进行分析。发现大鼠外伤致血瘀后,血液黏度上升,伤肢肌肉组织病变,在血浆和尿液中共鉴定出34 个差异代谢物,给予阳性药、三七、丹参以及三七-丹参药对不同配比(3∶1、1∶1、1∶3)后,血液黏度和组织病变发生不同程度改善,分别回调了23、17、17、26、23、21 个差异代谢物,干预了7、5、5、8、6、5 条代谢通路,且均显示三七-丹参比例为3∶1 时改善和回调结果最好,主要涉及:①炎症相关通路,如亚油酸代谢、α-亚麻酸代谢及花生四烯酸代谢通路;②氨基酸代谢相关通路,如苯丙氨酸代谢、赖氨酸降解及丙氨酸、天冬氨酸和谷氨酸代谢;③类固醇激素生物合成;④糖代谢相关通路,如戊糖和葡萄糖醛酸转化。
4.1 与血瘀相关的炎症通路
外伤血瘀证模型大鼠血浆中亚油酸和花生四烯酸含量均显著上升,亚油酸是脂肪酸代谢的关键物质,也是花生四烯酸合成的前体物质,花生四烯酸可以介导炎症,而炎症和血瘀呈正相关[14],因此模型组中亚油酸和花生四烯酸含量升高导致炎症加强,从而诱导大鼠出现外伤血瘀证的相关症状。α-亚麻酸可以生成二十碳五烯酸(EPA),可以通过靶向IL-6和TNF-α,从而抑制炎症[15]。因此模型组血浆中α-亚麻酸含量降低,减少了EPA 的生成,机体对炎症的抑制减弱,从而导致血瘀。阳性药组、三七组及三七-丹参不同配比药对组中,花生四烯酸含量均向空白组回调;在阳性药组、三七组及三七-丹参3∶1组和药对三七-丹参1∶1组中α-亚麻酸含量向空白组回调;在所有给药组中亚油酸含量均向空白组回调。以上结果表明各给药组可以不同程度地调控外伤血瘀证模型大鼠相关的炎症通路,从而达到治疗外伤血瘀证的目的。
4.2 与血瘀相关的氨基酸代谢通路
谷氨酰胺作为一种条件必需氨基酸,正常情况下通过摄食和体内合成就能满足机体需求[16]。但当机体处于创伤、术后、烧伤及肿瘤等严重消耗性疾病状态时,机体谷氨酰胺的需求增大,血浆中谷氨酰胺浓度下降[17-18],模型组经外伤造模后,血浆样本中L-谷氨酰胺含量显著下降,是因为机体处于创伤状态增加了L-谷氨酰胺的消耗。苯丙酮酸作为苯丙氨酸代谢通路的关键物质,可以生成L-苯丙氨酸。而L-苯丙氨酸可以在机体内生成酪氨酸,从而促进肾上腺素和去甲肾上腺素的生成,两者会导致血管收缩,血液黏度增加,产生血瘀[15]。模型组大鼠尿液中苯丙酮酸含量显著上升,外伤引起的血瘀则导致机体苯丙氨酸代谢紊乱。同时,研究表明血瘀状态的存在会导致机体氨基己二酸水平明显上升[19],而氨基己二酸是赖氨酸降解途径的中间产物,模型组大鼠尿液中氨基己二酸水平显著上升表明外伤致瘀导致大鼠体内赖氨酸降解通路紊乱。给予丹参、三七-丹参3∶1及三七-丹参1∶3药对后外伤血瘀证模型大鼠血浆中L-谷氨酰胺含量显著上升;给予阳性药、三七及不同比例三七-丹参后血瘀证模型大鼠尿液中苯丙酮酸含量显著降低;给予阳性药、丹参、三七-丹参3∶1及三七-丹参1∶1药对后尿液中氨基己二酸含量显著降低。以上研究结果表明,给予三七、丹参和三七-丹参不同比例药对均可调控外伤血瘀证相关的氨基酸代谢通路,从而达到治疗外伤血瘀证的目的。
4.3 与血瘀相关的类固醇生物激素合成
血瘀导致上述亚油酸代谢及花生四烯酸代谢紊乱后,花生四烯酸含量会上升,其可诱导类固醇合成急性调节蛋白(StAR)生成,从而导致类固醇激素生物合成通路上的代谢物含量增加[20],因此,外伤导致血瘀后,模型组血浆中类固醇类物质代谢物21-脱氧皮质酮和雄烯二酮含量显著上升,尿液中17-羟基孕酮、21-羟基孕烯醇酮、脱氢表雄酮、雌酮葡糖苷酸和四氢脱氧皮质酮含量上升,以上结果表明外伤导致的血瘀可使亚油酸代谢及花生四烯酸代谢通路紊乱,然后会间接干扰机体内的类固醇生物激素合成通路,导致类固醇生物激素合成代谢紊乱。给予阳性药、丹参及三七-丹参不同比例药对治疗后,外伤血瘀证模型大鼠血浆中21-脱氧皮质酮和雄烯二酮含量显著降低;给予阳性药、三七及三七-丹参不同比例药对治疗后,外伤血瘀证模型大鼠尿液中17-羟基孕酮、21-羟基孕烯醇酮、脱氢表雄酮、雌酮葡糖苷酸和四氢脱氧皮质酮含量降低,说明上述不同药物均可以通过调节类固醇生物激素合成从而治疗外伤血瘀证。
4.4 与血瘀相关的戊糖和葡萄糖醛酸相互转化
血瘀会导致多条糖代谢紊乱,提示机体存在糖氧化供能障碍[21]。戊糖和葡萄糖醛酸相互转化属糖代谢途径的一种,模型组尿液中6-羟基-5-甲氧基吲哚葡萄糖醛酸含量降低,说明机体发生血瘀症状时,戊糖和葡萄糖相互转化通路发生紊乱。而给予阳性药、丹参和三七-丹参3∶1药对后6-羟基-5-甲氧基吲哚葡萄糖醛酸含量向空白组回调,说明上述药物可以通过调节戊糖和葡萄糖醛酸相互转化治疗外伤血瘀证。
综上,外伤血瘀证的发生将导致大鼠体内多条代谢通路紊乱,三七、丹参及三七-丹参不同配比药对均能在一定程度上治疗外伤血瘀证,发挥一定的活血功效。但在回调差异代谢物数量上来看,三七-丹参3∶1 组>三七-丹参1∶1 组=阳性药组>三七-丹参1∶3组>三七组=丹参组;从干预的重要代谢通路来看,三七-丹参3∶1 组>阳性药组>三七-丹参1∶1 组>三七-丹参1∶3 组=三七组=丹参组。以上结果显示,三七、丹参及其不同比例配伍回调外伤血瘀证大鼠血浆和尿液差异代谢物的作用不尽相同,三七-丹参3∶1配伍时治疗外伤血瘀证的作用更好。
