基于TGF-β/Smads通路研究芍药苷对慢性盆腔炎大鼠的抗纤维化和抗炎作用
2022-05-27乔文艳邓克红张娟杨宝娟
乔文艳,邓克红,张娟,杨宝娟
(1.河南省省立医院,河南 郑州 450000;2.郑州大学第二附属医院,河南 郑州 450003;3.焦作市第二人民医院,河南 焦作 454001)
盆腔炎(pelvic inflammatory disease,PID)是一种由上行感染引起的女性上生殖系统炎症性疾病,其特征表现为子宫、子宫颈及附件的炎症和压痛,可导致不孕、异位妊娠和慢性盆腔疼痛[1-2]。慢性盆腔炎(chronic pelvic inflammatory disease,CPID)也被称为PID 后遗症,主要原因为患者患有PID 但未得到及时、有效的治疗,CPID 患者常有腹痛、腹部坠胀、月经异常、腰骶酸痛等症状,病理组织检查可见病灶有慢性的炎症和纤维化样改变[3-4]。目前,CPID 以抗生素、激素类药物及手术治疗为主,其治疗效果欠佳,因此,寻找新的药物或疗法至关重要[5-6]。芍药苷是从芍药科植物中提取的具有抗炎和免疫调节作用的有效成分,还具有镇痛、保肝、抗肿瘤、抗抑郁及心脏保护等药理学作用,具有广阔的应用前景[7-8]。芍药苷也已被证明是治疗妇科疾病经典方剂——桂枝茯苓方中起主要抗炎和免疫调节作用的活性物质,但其对CPID的治疗作用仍然不明确,机制亦有待探讨[9]。本研究建立了大鼠CPID 模型,评价芍药苷对CPID 的治疗作用,并探究其作用机制。
1 材料与方法
1.1 动物
8周龄SPF级SD大鼠,健康未孕雌性,体质量220~250 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
1.2 药品与试剂
芍药苷(纯度≥90%,宁波德康生物制品有限公司,批号:20200815);地塞米松片(广东华南药业集团有限公司,国药准字H44024469,规格:0.75 mg×100 片,批号:19100232);HE 染色试剂盒(上海碧云天生物技术有限公司,批号:C0105S);Masson 三色染色试剂盒(北京索莱宝科技有限公司,批号:G1340);实验所需ELISA 试剂盒均购自南京建成生物工程研究所;转化生长因子-β1(transforming growth factor-β1,TGF-β1)、Smad7、Smad2/3、p-Smad2/3 兔抗[艾博抗(上海)贸易有限公司,批号:ab215715、ab216428、ab207447、ab272332];苯酚(上海沃凯化学试剂有限公司,批号:100153008);甘油(国药集团化学试剂有限公司,批号:T20191030);黄蓍树胶粉(上海沪试化工有限公司,批号:69013261)。
1.3 仪器
HistoCore NANOCUTR 切片机(德国Leica 公司);FlexA-200 全波长酶标分析仪(杭州奥盛仪器有限公司);HH-S26S 六孔水浴锅(济南欧莱博科学仪器有限公司);IS-AX 恒温振荡器(美国精骐有限公司);转印、垂直电泳仪、电泳仪电源及凝胶成像仪(北京六一生物科技有限公司)。
1.4 方法
1.4.1 分组与造模
本研究使用苯酚胶浆法建立CPID 模型,方法参考文献[10],取50 只未孕雌鼠麻醉后,于下腹正中作一个2 cm 的切口,暴露出子宫,从大鼠的左侧子宫向卵巢注入0.1 mL 提前制备好的15%的苯酚胶浆,然后缝合切口并消毒,术后动物按照之前的饲养条件正常喂养。模型建立后依据随机数字表随机分为模型组,地塞米松组和芍药苷高、中、低剂量组。另取10 只大鼠为假手术组,仅在其腹部作一切口,不进行药物注射。
1.4.2 给药方法
造模10 d后开始给药,地塞米松组大鼠灌胃2 mg/kg地塞米松,芍药苷低、中、高剂量组大鼠灌胃25、50、100 mg/kg 芍药苷,所有药物均用0.5%CMC-Na 进行混悬,假手术组和模型组大鼠灌胃等体积的0.5%CMC-Na,各组实验动物均每天给药1次,给药30 d。
1.5 观察指标
1.5.1 一般情况
治疗期间每天对各组大鼠的精神、活动、毛发、饮食及排泄情况和体质量变化进行观察记录。
1.5.2 ELISA检测
实验结束前1日,所有大鼠禁食12 h,第2 天给药后2 h 将动物麻醉,腹主动脉取血,血液置EP 管放入4 ℃冰箱中静置4 h,移液器吸取上层血清放于-80 ℃中冻存,临用前解冻,根据试剂盒说明书对血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C-反应蛋白-1(C-reactive protein-1,CRP-1)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)的含量进行检测。
1.5.3 子宫系数
取血后处死大鼠,取大鼠子宫组织进行称重,计算其子宫系数。
子宫系数(%)=子宫组织质量/体质量×100%
1.5.4 HE染色
取大鼠子宫组织(左侧),用生理盐水清洗至无血丝,分割成大小适宜的组织块,浸泡在4%多聚甲醛溶液中固定,用于石蜡组织包埋和病理切片的制作。将组织制作成石蜡标本后进行切片,厚度为5 μm,随后进行常规HE染色,观察子宫病变情况。
1.5.5 Masson染色
取“1.5.4”中制备的石蜡组织切片,进行常规Masson 染色,观察子宫组织中被蓝染的胶原纤维的增生情况。
1.5.6 Western Blot
取适量大鼠子宫组织,置于研磨器中进行低温研磨匀浆,加入RIPA 和PMSF 提取组织蛋白,BCA 法测定蛋白浓度,将蛋白作变性处理后进行SDS-PAGE电泳,湿转至PVDF 膜,封闭2 h,4 ℃孵育TGF-β1(1∶1 000)、Smad2/3(1∶1 000)、p∶Smad2/3(1∶800)、Smad7(1∶800)一抗稀释液,过夜后洗膜,37 ℃孵育二抗(1∶1 000),再次清洗后滴加发光试剂,放入凝胶成像仪中成像,使用Image J 软件对各个目的蛋白灰度值进行量化,计算蛋白相对表达量。
蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值
1.6 统计学方法
本实验的数据均通过SPSS 25.0 软件分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠的一般情况
在造模前后及治疗期间,假手术组大鼠的精神状态尚可,毛发有光泽、整齐,活动正常,饮食饮水和排便正常,体质量持续增加。造模后,模型大鼠可见明显的毛发枯燥、无光泽,有脱毛现象,精神倦怠,不喜动,进食少,阴道分泌物多,尿液色深,粪便形态黏稠,异味重,体质量增加缓慢。经过药物干预后,造模大鼠的上述表现得到了不同程度改善,体质量高于模型组(P<0.05),以芍药苷高剂量组的改善最为明显。见表1。
表1 各组大鼠体质量变化情况比较(±s,g)

表1 各组大鼠体质量变化情况比较(±s,g)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;与芍药苷高剂量组比较,▲P<0.05;与芍药苷中剂量组比较,○P<0.05。
给药第30天304.91±9.76 267.05±6.37*277.51±5.98*#286.20±7.24*#△279.36±6.32*#270.24±7.11*▲○组别假手术组模型组地塞米松组芍药苷高剂量组芍药苷中剂量组芍药苷低剂量组n 10 10 10 10 10 10造模前248.62±7.87 246.58±6.24 247.35±6.83 248.26±7.90 248.73±6.82 246.94±7.01造模第5天254.47±6.94 235.91±6.65*233.47±7.36*235.82±8.63*234.71±7.15*235.36±7.92*造模第10天268.12±8.36 247.30±7.08*244.85±6.32*245.48±7.21*245.97±7.26*246.21±7.54*给药第10天275.94±9.77 250.26±6.54*255.98±6.82*256.62±7.81*253.84±7.35*253.72±6.85*给药第20天287.39±7.59 255.64±7.13*267.13±7.28*#269.42±7.93*#263.84±8.54*#257.92±6.96*
2.2 对CPID大鼠子宫系数的影响
模型组大鼠子宫系数显著高于假手术组,各个治疗组大鼠的子宫系数与模型组比较均有所降低(P<0.05)。其中,芍药苷高剂量组和中剂量组大鼠子宫系数与地塞米松组比较,无统计学意义(P>0.05),芍药苷低剂量组子宫系数高于地塞米松组、芍药苷高剂量和中剂量组(P<0.05)。见表2。
表2 各组大鼠子宫系数比较(±s,%)
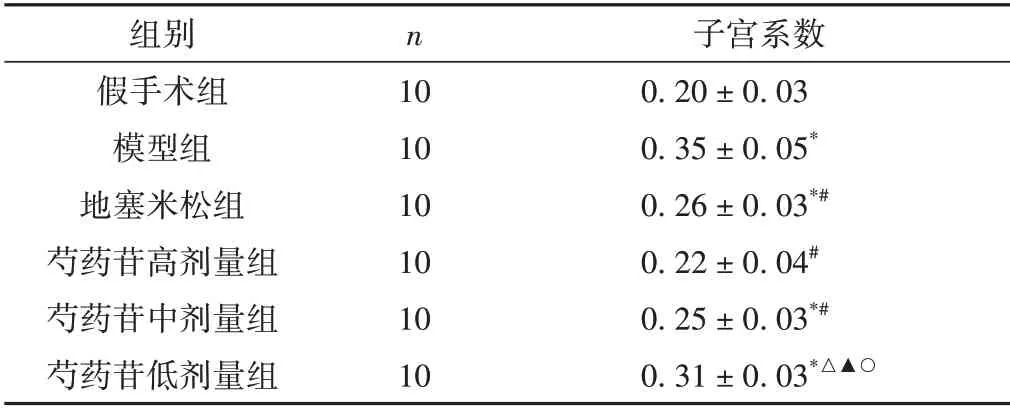
表2 各组大鼠子宫系数比较(±s,%)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;与芍药苷高剂量组比较,▲P<0.05;与芍药苷中剂量组比较,○P<0.05。
子宫系数0.20±0.03 0.35±0.05*0.26±0.03*#0.22±0.04#0.25±0.03*#0.31±0.03*△▲○组别假手术组模型组地塞米松组芍药苷高剂量组芍药苷中剂量组芍药苷低剂量组n 10 10 10 10 10 10
2.3 对CPID大鼠血清炎症因子的影响
模型组大鼠TNF-α、CRP-1、IL-1β、IL-6 的水平显著高于假手术组(P<0.05)。各个治疗组大鼠的血清炎症因子与模型组比较均降低(P<0.05)。其中,芍药苷各剂量组的炎症因子水平高于地塞米松组(P<0.05)。芍药苷中剂量组CRP-1、IL-1β 水平高于芍药苷高剂量组,芍药苷低剂量组TNF-α、CRP-1、IL-1β、IL-6 水平高于芍药苷高剂量组(P<0.05)。芍药苷低剂量组TNF-α、CRP-1、IL-1β、IL-6 水平高于芍药苷中剂量组(P<0.05)。见表3。
表3 各组大鼠血清炎症因子水平比较(±s,pg/mL)
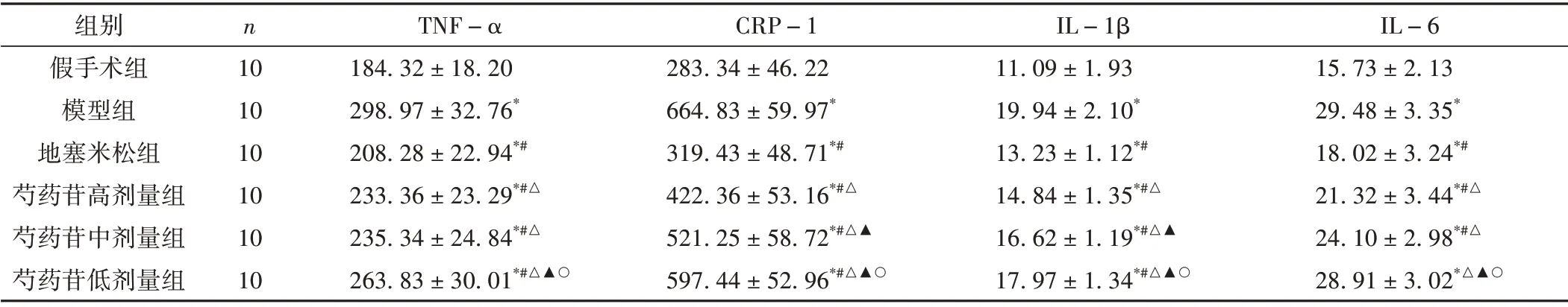
表3 各组大鼠血清炎症因子水平比较(±s,pg/mL)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;与芍药苷高剂量组比较,▲P<0.05;与芍药苷中剂量组比较,○P<0.05。
IL-6 15.73±2.13 29.48±3.35*18.02±3.24*#21.32±3.44*#△24.10±2.98*#△28.91±3.02*△▲○组别假手术组模型组地塞米松组芍药苷高剂量组芍药苷中剂量组芍药苷低剂量组n 10 10 10 10 10 10 TNF-α 184.32±18.20 298.97±32.76*208.28±22.94*#233.36±23.29*#△235.34±24.84*#△263.83±30.01*#△▲○CRP-1 283.34±46.22 664.83±59.97*319.43±48.71*#422.36±53.16*#△521.25±58.72*#△▲597.44±52.96*#△▲○IL-1β 11.09±1.93 19.94±2.10*13.23±1.12*#14.84±1.35*#△16.62±1.19*#△▲17.97±1.34*#△▲○
2.4 对CPID大鼠子宫病变的影响
染色结果显示,假手术组大鼠子宫内膜和腺体的结构数量均正常,存在一定量的呈蓝色的胶原纤维,其排列较规则,结构整齐。CPID 模型大鼠子宫组织层次紊乱,有充血和水肿现象,固有层和肌层的分布不清晰,宫腔可见有明显缩窄,局部的腔壁增厚、内膜缺失,腺体减少,并可见大量炎性细胞的浸润,同时可见子宫内膜间质及肌层形成了大量呈蓝色、形态紊乱的胶原纤维。各药物治疗组大鼠子宫内膜炎性浸润和充血、水肿程度均得到了一定程度的改善,蓝色胶原纤维的沉积量减少。见图1~2。

图1 HE染色结果图(200×)
2.5 对CPID大鼠子宫组织TGF-β1、Smad2/3、p-Smad2/3、Smad7蛋白表达的影响
结果显示,模型组大鼠子宫组织TGF-β1、p-Smad2/3 的表达显著高于假手术组,Smad7 的表达低于假手术组。各治疗组TGF-β1、p-Smad2/3表达与模型组比较均降低,Smad7 的表达均增高(P<0.05)。其中,芍药苷高剂量组TGF-β1、p-Smad2/3、Smad7蛋白表达与地塞米松组比较,无统计学意义(P>0.05),芍药苷中剂量和低剂量组TGF-β1、p-Smad2/3 的表达高于地塞米松组,Smad7 的表达低于地塞米松组(P<0.05)。且芍药苷对TGF-β1、p-Smad2/3、Smad7 蛋白表达的影响呈剂量依赖性(P<0.05)。见图3和表4。
表4 各组大鼠子宫组织蛋白表达水平比较(±s)

表4 各组大鼠子宫组织蛋白表达水平比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;与芍药苷高剂量组比较,▲P<0.05;与芍药苷中剂量组比较,○P<0.05。
Smad7 0.94±0.09 0.16±0.04*0.44±0.05*#0.47±0.07*#0.33±0.05*#△▲0.25±0.03*#△▲○组别假手术组模型组地塞米松组芍药苷高剂量组芍药苷中剂量组芍药苷低剂量组TGF-β1 0.15±0.03 0.98±0.07*0.28±0.04*#0.26±0.03*#0.49±0.05*#△▲0.75±0.06*#△▲○p-Smad2/3 0.23±0.04 1.89±0.09*0.35±0.05*#0.37±0.03*#0.52±0.07*#△▲1.29±0.08*#△▲○

图2 Masson染色结果图(200×)

图3 Western Blot法检测蛋白表达水平
3 讨论
PID 作为妇科常见病,若未得到及时治疗可发展为CPID。CPID 难以被治愈,治疗后复发率较高,患者常伴有生殖器官、腹膜及结缔组织的增生、纤维化、粘连等病变,可导致患者异位妊娠和不孕的发病率升高,并常伴有疼痛和月经异常[11-12]。芍药主治妇女月经不调、崩漏、血虚腹痛等症,在临床应用广泛[13]。芍药苷是芍药的主要有效成分,具有多种药理学活性,但其对女性CPID 的治疗作用尚不清楚[14]。为了探究芍药苷对CPID 的作用,本研究采用苯酚胶浆法建立大鼠CPID 模型,该模型发病机制虽与临床实际发病机制不同,但可造成与CPID相似的临床表现,易于操作,造模所需时间较短[15]。结果显示,模型组大鼠精神倦怠,不喜动,进食少,阴道分泌物多且异味重,体质量增加缓慢,生存状态较差,子宫系数显著高于假手术组,血清炎症因子(TNF-α、CRP-1、IL-1β 和IL-6)的水平升高,子宫宫腔可见有明显缩窄,炎症和纤维化程度明显,表明CPID模型建立成功。
给予不同剂量芍药苷治疗后,大鼠的生存状态得到改善,体质量缓慢增加,子宫系数降低。炎症反应贯穿了CPID整个发病过程,患者始终存在炎性细胞因子过度表达和信号通路异常转导的情况,这些反应在调节CPID炎症反应、组织增生和纤维化的过程中相互作用,使机体在CPID疾病发展过程中出现过度甚至失控的损伤修复,使细胞外基质的合成过多,沉积于组织细胞之间,病理切片检查往往可见组织纤维化增生明显,因此,调节CPID相关细胞因子及信号通路蛋白表达平衡是治疗CPID 的目标[16-17]。在本研究中,使用不同剂量芍药苷对CPID大鼠进行干预治疗后,大鼠血清炎症因子(TNF-α、CRP-1、IL-1β 和IL-6)的水平降低,子宫内膜的炎性浸润和充血、水肿均得到了一定程度的改善,蓝色胶原纤维的沉积量减少,且其作用呈剂量依赖性。以上结果表明,芍药苷可减轻CPID大鼠的炎症反应,改善CPID相关的子宫炎性细胞浸润和组织纤维化病变现象。
现代研究发现,TGF-β1 是TGF-βs 家族中含量和活性均最高的成员,具有强效的促纤维化作用,TGF-β1的水平升高常在发生不受控制的纤维化反应的组织中出现[18]。Smad是参与TGF-β信号细胞内传导的蛋白家族,Smad2及Smad3是TGF-β 通路的关键下游蛋白,Smad2 及Smad3 的活化可调控靶基因的转录,进一步调控疾病中的炎症反应和纤维化过程[19]。Smad7 为Smad 家族的抑制性蛋白,可阻止Smad2 及Smad3 的磷酸化,在TGF-β/Smads 通路中起负调节作用[20]。在本研究中,CPID模型大鼠子宫组织TGF-β1、p-Smad2/3 的表达显著高于假手术组,Smad7 的表达低于假手术组。使用不同剂量芍药苷对CPID 大鼠进行治疗后,各个治疗组大鼠子宫组织TGF-β1 蛋白表达量降低,Smad2/3 磷酸化水平降低,Smad7 的表达升高,提示芍药苷可抑制TGF-β/Smads 通路的活化,其抗炎和抗纤维化的作用可能与上述机制有关。
综上所述,芍药苷可能通过抑制TGF-β/Smads通路的活化改善CPID相关炎性反应和纤维化病变,初步揭示了芍药苷治疗CPID 的作用机制。但CPID 是一种多因素疾病,病机复杂,其疗效及机制仍需进一步联合体外实验及临床研究加以阐明。
