2020 年河南省猪繁殖与呼吸综合征病毒的分子流行病学调查及ORF5 基因变异分析
2022-05-27郭占达杜季梅郭子仪王新港张彦华
郭占达,杜季梅,郭子仪,王新港,张彦华
(1. 河南省大河农畜牧科技有限公司,河南 郑州 450000;2. 河南农业大学 动物医学院,河南 郑州 450000;3. 商丘美兰生物工程有限公司,河南 柘城 476200;4. 河南农业大学 动物科学院,河南 郑州 450000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)俗称猪蓝耳病,主要引起母猪的繁殖性能障碍,表现为发情推迟,怀孕母猪的流产、死胎、木乃伊胎以及仔猪的呼吸道症状,每年给养猪业造成重大损失[1]。该病首次于1987年在美国发现,随后德国、荷兰、加拿大等国家也相继报道发生该病[2]。1991年,WENSVOORT 等[3]分离出首株猪繁殖与呼吸综合征病毒(PRRSV),命名为Lelystad virus(LV);1992 年,SNIJDER 等[4]分 离 到1株PRRSV,命名为VR2332。上述2 个分离株分别是欧洲型和美洲型的代表毒株。1996 年,郭宝清等[5]分离到国内首株PRRSV,命名为CH-1a。2006年,我国南方地区暴发“高热病”,最终确定为高致病性PRRS(HP-PRRS)[6]。
PRRSV 可分为欧洲型(基因Ⅰ型)和美洲型(基因Ⅱ型),2 个基因型间的核苷酸同源性约60%,但引起的临床症状相似[7]。SHI 等根据ORF5 基因将美洲型PRRSV 进一步分为谱系1—9(Lineage1—9)[8]。我 国 的 美 洲 型PRRSV 流 行 毒 株 包 括4 个 谱系,谱系1(代表毒株NADC30)、谱系3(代表毒株GM2)、谱系5(代表毒株VR2332)和谱系8(代表毒株JXA1)[9]。多个谱系的流行给我国防控PRRS 带来了巨大的挑战,同时重组毒株和疫苗返强毒株更加剧了防控的难度。
为了解河南省PRRSV 的最新流行现状及遗传演化情况,于2020 年收集河南省疑似PRRS 发病猪的病料,通过TaqMan 荧光定量PCR(FQ-PCR)进行PRRSV ORF7 基因检测,并对18 份阳性样品进行PRRSV ORF5 基因测序、同源性比对和遗传进化分析,对PRRSV GP5 蛋白进行氨基酸序列比对分析,旨在为河南省PRRS 防控工作和新疫苗研发提供依据。
1 材料和方法
1.1 材料
1.1.1 样品来源与处理 收集河南省不同区域401份疑似PRRS 发病猪的病料,其中豫东58 份、豫西55份、豫南100份、豫北109份、豫中79份,由河南农业大学动物疫病检测诊断中心保存。取发病猪肺脏、脾脏、淋巴结等组织,以1∶5(m/V)的比例加入PBS,用研磨仪充分研磨后,反复冻融2次,12 000 r/min离心10 min,取其上清保存于-70 ℃备用。
1.1.2 主要仪器 研磨仪购自上海净信科技公司;生物安全柜购自北京东联哈尔仪器制造有限公司;荧光定量PCR 扩增仪、PCR 扩增仪购自美国BIORAD 公司;核酸电泳仪购自北京六一生物科技有限公司;凝胶成像仪购自上海天能科技有限公司;核酸提取仪购自西安天隆科技公司;-70 ℃超低温冰箱为安徽中科都菱商用电器股份有限公司产品;微量移液器为Eppendorf公司产品。
1.1.3 主要试剂 M-MLV 反转录酶、dNTP、Recombinant RNase Inhibitor、2×TaqPCR Mix、DNA Marker、2×Probe PCR Mix 等均购自宝日医生物技术(北京)有限公司(Takara,中国);Oligo dT(18)、Random primer 由生工生物工程(上海)股份有限公司合成;病毒基因组DNA/RNA 提取试剂盒购自西安天隆有限公司。
1.2 方法
1.2.1 引物设计 参考OIE公布的PRRSV ORF7引物,作为FQ-PCR 检测引物,进行临床样品检测;参考文献[10]中的PRRSV ORF5 引物序列,合成后作为测序引物。引物由生工生物工程(上海)股份有限公司合成,详细信息见表1。
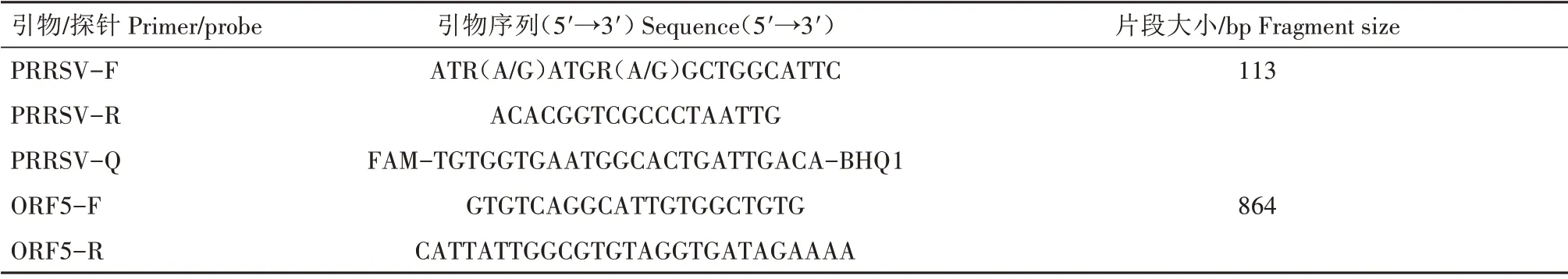
表1 PRRSV FQ-PCR检测引物、ORF5测序引物Tab.1 The FQ-PCR detection primer and ORF5 sequencing primer for PRRSV
1.2.2 病毒RNA 扩增及测序 按照核酸提取仪及其试剂说明书(磁珠法)提取核酸,-70 ℃保存备用。反 转 录 体 系:5×M-MLV Buffer 4 µL、dNTP(2.5 mmol/L)4 µL、Oligo dT(18)(20 µmol/L)0.5 µL、Random primer(20 µmol/L)0.5 µL、M-MLV 反转录酶(200 U/µL)0.5 µL、Recombinant RNase Inhibitor(40 U/µL)0.5 µL、RNA 200 ng,DEPC 水 补 足 至20µL。混匀后置于PCR 仪上,反应采用如下程序:42 ℃处理1 h,70 ℃处理15 min。
FQ-PCR 扩增采用20 µL 反应体系:2×Probe PCR Mix 10 µL、上下游引物(10 µmol/L)各0.5 µL、cDNA 2µL,ddH2O 补足。PCR 反应条件:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火、延伸30 s,45 个循环。
ORF5 基因扩增采用50µL 反应体系:25µL 2×TaqPCR Mix、上下游引物(25 µmol/L)各1 µL、cDNA 2µL,ddH2O 补足至50 µL。PCR 反应条件:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30 个循环;最后72 ℃延伸5 min。反应结束后,取10 µL PCR 扩增产物进行1%琼脂糖凝胶电泳检测。然后将扩增产物进行胶回收并克隆于pMD18-T载体,挑取阳性质粒送生工生物工程(上海)股份有限公司测序,共成功测序18 株PRRSV ORF5基因。
1.2.3 PRRSV ORF5基因序列分析 将所测序列采用DNAStar 软件中的MegAlign 程序进行同源性比较,采用MEGA 7.0 软件进行遗传进化分析,参考毒株及本研究测序信息见表2。
表2 PRRSV参考毒株及本研究测序毒株信息Tab.2 Reference and sequenced strain information of PRRSV

续表2 PRRSV参考毒株及本研究测序毒株信息Tab.2(Continued) Reference and sequenced strain information of PRRSV
2 结果与分析
2.1 PRRSV ORF7基因FQ-PCR结果
用FQ-PCR 检测引物对401 份疑似样品抽提的RNA 进行扩增,检测结果若出现典型S 形扩增曲线,表明样品PRRSV检测结果为阳性。部分样品结果见图1,各地区样品检测结果见表3。结果显示,共检测出PRRSV阳性样品100份,阳性率为24.9%。

图1 PRRSV ORF7基因FQ-PCR扩增结果Fig.1 FQ-PCR amplification of PRRSV ORF7 gene
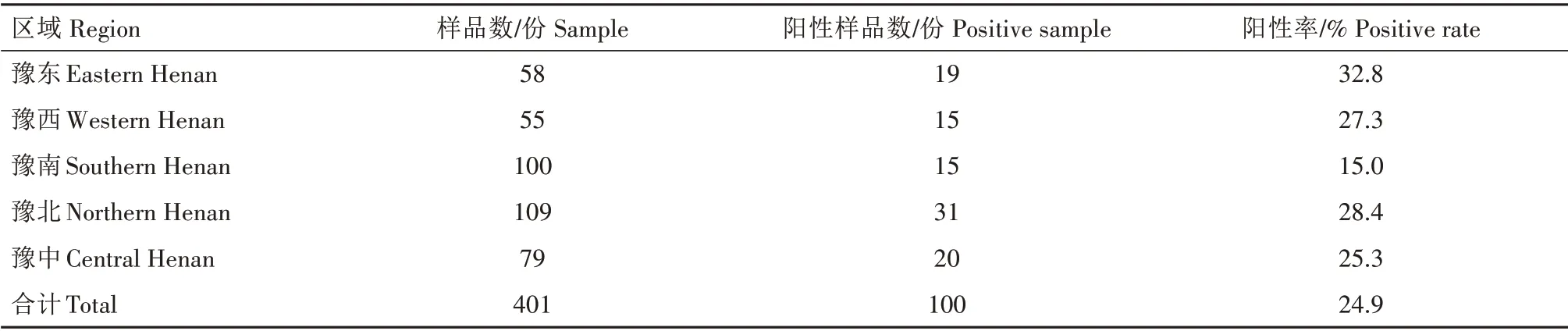
表3 河南省不同区域PRRSV阳性率Tab.3 Positive rate of PRRSV in different regions of Henan
2.2 PRRSV ORF5基因遗传进化分析
2.2.1 PRRSV ORF5 基因遗传进化树分析 用MEGA 7.0 软件(N-J 法,步点值为1 000)对测序获得核苷酸序列与国内外已发表的参考毒株ORF5基因序列构建分子遗传进化树(图2)。结果显示,分子遗传进化树可分为4 个分支,分别为以NADC30毒株为代表的谱系1,以GM2 毒株为代表的谱系3,以VR2332 毒株为代表的谱系5 和以CH-1a/JXA1毒株为代表的谱系8。本研究检测的18 株PRRSV中,HN-XC1 属 于 谱 系5,HN-LY1-2020、HNZMD1-2020属于谱系8,其余15株均属于谱系1。
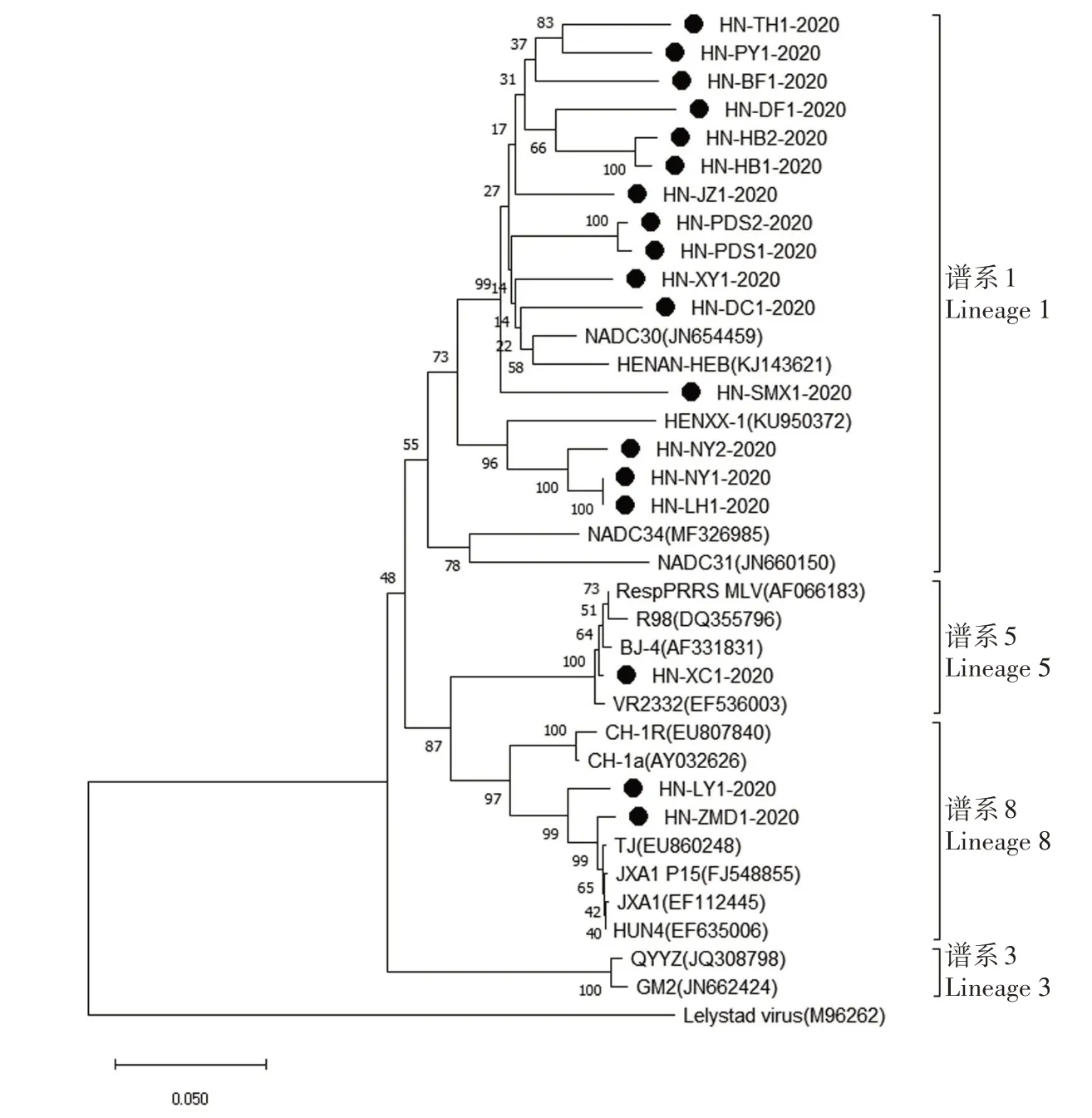
图2 基于ORF5基因的PRRSV遗传进化树Fig.2 Phylogenetic analysis of PRRSV ORF5 gene
2.2.2 PRRSV ORF5基因核苷酸同源性分析 应用MegAligen 程序将测序获得的18 株ORF5 基因序列与国内外已发表的参考毒株ORF5基因序列进行核苷酸同源性对比(图3)。结果表明,本研究中的18株PRRSV ORF5基因的核苷酸同源性均在83.4%以上,与参考毒株的ORF5 基因核苷酸同源性为82.9%~99.7%,与欧洲型代表毒株Lelystad virus 株同源性为61.1%~64.5%,与美洲型代表毒株VR2332同源性为84.6%~99.3%,与国内分离株CH-1a 同源性为84.9~94.7%,与高致病性毒株JXA1 同源性为83.7~99.2%,与NADC30毒株同源性为85.7~94.9%。

图3 PRRSV ORF5基因核苷酸同源性分析Fig.3 Homology analysis of PRRSV ORF5 gene
2.2.3 PRRSV GP5 蛋白氨基酸序列比对分析 根据GP5 蛋白的结构将其分为6 个区域,分别是信号肽 区(Signal peptide)位 于1—26 位aa、胞 外 区(Extravirion)位 于 27—65 位 aa、跨 膜 区 1(Transmembrane 1,TMl)位于66—83 位aa、跨膜区2(Transmembrane 2,TM2)位于95—104 位aa、跨膜区3(Transmembrane 3,TM3)位于112—128 位aa 和胞内区(Intravirion)位于129—200 位aa[11]。其胞外区结构域有2 个主要的独立的抗原表位。其中,诱骗表位由27A/(V)L28V29N30组成,诱导抗体迅速上升而不具有中和活性[12];另外一个相对保守的中和表位(Primary neutralizing epitope,PNE),由S37H38F39/L39Q40L41I42Y43N44组成,H38F39/L39是中和抗体结合位点,被认为是中和表位的关键氨基酸[13]。第13 位和第151 位氨基酸与毒力相关。从图4 可以看出,不同PRRSV毒株GP5蛋白差异主要出现在信号肽区、胞内区和胞外区。其中,HN-TH1-2020、HY-PY1-2020、HN-XY1-2020 毒株的等13 位氨基酸毒力相关位点出现R/Q→S/H 突变,HN-XC1-2020 毒株的第151 位氨基酸出现R/G→I 突变。高变异的诱骗表位,HN-HB1-2020 毒株出现L28→F 突变,HNPDS1-2020 毒株出现糖基化位点N30→D 的突变;保守性高的中和表位,HN-SMX1-2020、HN-NY2-2020 出现H38→N 突变,HN-DC1-2020 毒株出现糖基化位点N44→D的突变。

图4 PRRSV GP5蛋白序列比对分析Fig.4 Alignment analysis of PRRSV GP5 amino acids
3 结论与讨论
自郭宝清等[5]于1996 年首次报道国内PRRSV之后,PRRSV 就一直在国内流行和传播,GAO 等[14]发现1 株由我国早期CH-1a 向高致病性HP-PRRS过渡的中间毒株,TIAN 等[15]分离出HP-PRRS 毒株,以上毒株的报道,前后间隔时间短,且分离毒株的致病性有进一步增强趋势。此后,HP-PRRS成为我国长期流行的主要毒株。ZHOU 等[16]首次分离出NADC30-like毒株,同时发现病毒的重组频频发生,导致田间新的变异毒株越来越多[17]。历史数据显示,新毒株出现后短短几年就会成为某些地区的优势毒株。
本研究共检测401 份疑似PRRS 临床样品,阳性100 份,阳性率为24.9%,其中豫东阳性率为32.8%,豫西阳性率为27.3%,豫南阳性率为15.0%,豫北阳性率为28.4%,豫中阳性率为25.3%,与郭天准[18]2014—2015 年、王新港[19]2016—2017 年、赵小月[20]2018—2019 年报道的阳性率[分别为29.7%(123/414)、32.4%(44/136)、24.6%(151/613)]相比,未见明显下降趋势,说明PRRS 仍是河南省猪场面临的重要疫病。本研究测序的18 株PRRSV 中,HN-LY1-2020、HN-ZMD1-2020 毒株属于以JXA1为代表的谱系8,HN-XC1-2020 毒株属于以VR2332 为代表的谱系5,其余15 株属于以NADC30为代表的谱系1。与郭天准[18]的研究结果相符,提示河南省NADC30-like 毒株呈逐步上升趋势。陈盛楠等[21]的研究结果表明,广东省以谱系8 为主,而谱系3 流行有增加趋势。以上研究结果提示,国内不同地区流行毒株呈复杂多样化趋势。由于本研究测序数量有限,在检测阳性样品中是否有欧洲株或其他谱系毒株流行需进一步研究。
GP5蛋白氨基酸序列的任何改变都可能影响病毒的感染性和疫苗的交叉保护率,甚至引起免疫失败[22]。病毒感染早期,诱骗表位[27A/(V)L28V29N30]起主导作用,可抑制中和表位(S37H38F39/L39Q40L41I42Y43N44)被免疫系统识别,使中和抗体的产生延后,进而导致病毒免疫逃逸。本研究中,HN-HB1-2020 毒株诱骗表位发生了L28→F 突变,HN-PDS1-2020 毒株发生了糖基化位点N30→D 突变;保守性高的中和表位,HN-SMX1-2020、HN-NY2-2020 毒 株 发 生 了H38→N突变,HN-DC1毒株发生了糖基化位点N44→D突变,以上突变对病毒免疫逃逸作用、中和抗体的产生及作用有待进一步研究。此外,HN-TH1-2020、HY-PY1-2020、HN-XY1-2020 毒株的第13 位氨基酸毒力位点出现R/Q→S/H 突变,HN-XC1-2020 毒株的第151 位氨基酸毒力位点出现R/G→I 突变。本研究仅从氨基酸序列水平进行了分析,未进行致病性研究,对这些存在毒力位点变异的毒株,需进行更加深入的研究。
综上,河南省现阶段PRRSV 呈多样化、复杂化趋势,其中NADC30-like PRRSV 毒株已成为优势毒株,且有经典毒株和高致病毒株同时存在。PRRS作为危害养猪业的重要疫病,主要采取综合性预防和控制措施,最根本的办法是消除病猪、带毒猪和彻底消毒,切断传播途径。此外,应加强进口猪、猪群流动的检疫和该病监测,以防扩散。
