不同病理分型肝母细胞瘤的多层螺旋CT征象与鉴别
2022-05-26刘雨晴向永华李理马秋红金科
刘雨晴 向永华 李理 马秋红 金科
1南华大学儿科学院,长沙 410007;2湖南省儿童医院放射科,长沙 410007
肝母细胞瘤(hepatoblastoma,HB)属于胚胎性肿瘤,其组织学构成决定了其病理分型,而病理分型与肿瘤的治疗和预后密切相关[1-2]。根据2016版HB多学科诊疗专家共识(CCCG-HB-2016),不同危险度的HB有不同的术前化疗及术后化疗方案,其中分化良好的低有丝分裂纯胎儿型属于极低危组,可完整手术切除且无需化疗[3-4]。混合性上皮间叶型HB中的间叶成分具有对化疗不敏感的特点,且通常发现时已分期较晚,临床进展较快,故预后较差[2,5]。因此,如何早期判定HB分型,尽早进行临床干预成为治疗的重要一环。本研究利用多层螺旋CT(multi-slice spiral computed tomography,MSCT)检查技术,分析HB不同病理分型的CT征象差异,为HB的临床诊断及治疗提供参考。
材料与方法
一、临床资料
收集2015年10月至2021年5月经病理检查证实的71例HB患儿CT及临床资料。病例纳入标准:①经手术或穿刺活检确诊为HB;②术前行CT平扫及动态三期增强扫描,图像清晰可用;③CT检查前未进行辅助化疗及介入治疗。排除标准:①临床或病理资料不完整;②CT扫描不规范或图像质量不能满足诊断要求。最终符合纳入标准的HB患儿共71例,男44例,女27例,年龄2 d至10岁,中位月龄18个月;本研究以3岁为分界进行年龄分组,其中年龄小于3岁者共46例。本研究获得湖南省儿童医院伦理委员会审核批准(编号:KS2022-22/2022-03-31)。
本组71例HB患儿中,37例行手术治疗,34例行穿刺活检;病理结果包括完全上皮细胞型50例,混合性上皮间叶型21例;其中完全上皮细胞型50例中单纯胎儿型16例,胚胎型34例。研究将71例HB患儿按病理分型分为三组,包括胎儿型组16例、胚胎型组34例、混合型组21例。Von等[6]研究表明,血清AFP水平>10 000μg/L或<100μg/L为儿童肝母细胞瘤预后不良的危险因素,因此本研究将AFP水平>10 000μg/L及<100μg/L定义为预后不良组,AFP水平100~10 000μg/L定义为预后良好组(表1)。
二、仪器与方法
检查前准备:对不能配合检查的患儿在检查前30~40 min给予10%水合氯醛口服镇静,剂量为0.5 mL/kg。CT检查使用Philips Brilliance 64排CT扫描仪。扫描范围从膈顶至肝脏或肿瘤下缘,行肝脏CT平扫及动脉(8~10 s)、门脉(25~35 s)及延时(180~300 s)三期增强扫描。扫描参数:管电压120 kV,管电流80~100 mA,层厚5.0 mm,层间距5.0 mm,螺距1.5。动态增强扫描前自肘静脉经高压注射器注射非离子型对比剂碘克沙醇(320 mg/mL),剂量1.0~1.5 mL/kg,注射流率1~2.0 mL/s。扫描完成后利用系统软件进行冠状面和矢状面图像重建,层厚5.0 mm。
三、图像分析
由两位中级及以上职称的儿科影像医师进行双盲阅片,结果出现分歧时,经协商达成一致,内容包括:①CT图像观察指标:肿瘤边缘是否规则,是否外生,PRETEXT分期,是否多发结节融合,有无瘤内出血、坏死或囊变、钙化,肿瘤假包膜是否光滑连续,有无包膜回缩征、包膜下积液、多发纤维分隔、高危影像特征(肝内多发病灶及肝内转移、肝外腹部侵袭、淋巴结转移、腹腔内出血、肿瘤破裂、门静脉、肝静脉和/或下腔静脉受累);②CT图像测量指标:肿瘤大小、各期实性成分CT值。肿瘤大小以最大横截面的最长径(cm)表示。选取肿瘤实质部分勾画感兴趣区(region of interest,ROI),尽量避开囊变、坏死及周围血管区,保证各期图像勾画ROI的大小和位置相同,重复测量3次并计算3次测得值的平均值[7]。病灶各期绝对强化程度定义为病灶在增强各期的CT值-病灶平扫CT值;病灶增强后的比值比定义为病灶在增强任意一期的CT值/病灶周围正常肝脏实质在同一期的CT值。
四、统计学处理
采用SPSS 25.0进行数据分析。符合正态分布的计量资料用x±s表示,采用单因素方差分析比较三组间肿瘤最大径及各期扫描CT值,两两比较采用LSD检验;计数资料用n(%)表示,采用χ2检验或Fisher精确概率法比较三组间一般资料及病灶形态特征的差异。
结 果
一、临床资料
本组71例HB中,男44例(44/71,61.9%),女27例(27/71,38.1%),57例因发现腹部隆起就诊,14例因发热、呕吐、腹痛、腹胀就诊。71例血清甲胎蛋白(alpha fetoprotein,AFP)均高于正常值,阳性率100%。不同病理类型HB患儿性别、年龄、血清AFP水平差异均无统计学意义(表1)。

表1 不同病理分型肝母细胞瘤患儿组间一般资料比较[例(%)]Table 1 Comparison of clinical data among different pathological type groups of hepatoblastoma[n(%)]
二、不同病理分型肝母细胞瘤CT征象
胎儿型、胚胎型、混合型的CT观察指标中,边缘规则、瘤内多发结节融合、出血、坏死或囊变、钙化、包膜回缩征、多发纤维分隔的阳性率差异有统计学意义(P<0.05),PRETEXT分期、外生、肿瘤假包膜光滑连续、包膜下积液、高危影像征象的阳性率差异无统计学意义(P>0.05);CT测量指标中,肿瘤最大径、病灶门脉期绝对强化程度三组间差异有统计学意义(P<0.05),病灶平扫CT值、病灶动脉期绝对强化程度、病灶延迟期绝对强化程度、动脉期比值比、门脉期比值比、延迟期比值比三组差异无统计学意义(P>0.05)。详见表2、表3。

表2 不同病理分型肝母细胞瘤CT形态特征的组间比较[例(%)]Table 2 Comparison of CT features among different pathological type groups of hepatoblastoma[n(%)]

表3 不同病理分型肝母细胞瘤最大径及各期扫描CT值组间比较(x±s)Table 3 Comparison of tumor size and CT value for each phase among different pathological type groups of hepatoblastoma(x±s)
胎儿型肝母细胞瘤的CT表现特征主要为肿瘤直径较小,瘤内出血、囊变及坏死、钙化少见,肿瘤密度大致均匀(图1);胚胎型肝母细胞瘤的CT特征主要为肿瘤多呈多灶性结节改变,瘤内多发坏死及囊性变(图2);混合性上皮间叶型CT特征主要为出血,钙化率高,延迟期多发纤维分隔及包膜回缩征较常见(图3)。
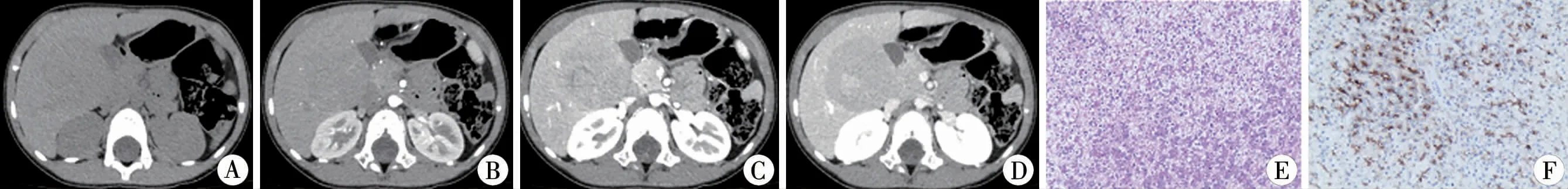
图1 1例2岁女性分化良好的胎儿型肝母细胞瘤患儿影像学及病理检查结果 A:CT平扫轴位示肝内类圆形稍低密度影,边缘规则,未见出血及钙化灶;B、C:动态增强扫描示病灶实性部分强化大致均匀,强化程度低于肝实质;D:延迟期可见中央结节状更高强化影;E;显微镜下显示肿瘤无纤维间隔(苏木素-伊红染色,×200),F:免疫组化结果:Ki-67(4%+),Glypican(+),P53(-),AFP(-),CD34(-),β-catenin(胞膜+)Fig.1 Well-differentiated fetal type HB

图2 1例1岁男性胚胎型肝母细胞瘤患儿影像学及病理检查结果 A:CT平扫轴位示肝内巨大不规则肿块影,肿块内密度不均匀;B、C、D:动态增强扫描示肝内肿块呈分叶状,瘤内多发结节融合,肿块实性部分可见明显不均匀强化,可见多发未强化坏死区;E:显微镜下可见大部分区域缺血坏死(苏木素-伊红染色,×200);F:免疫组化结果:Ki-67(30%+),Glypican(+),P53(+),AFP(+),CD34(血管+),β-catenin(+)Fig.2 Embryonal type HB

图3 1例10月龄男性混合性上皮间叶型肝母细胞瘤患儿影像学及病理检查结果 A:CT平扫轴位示肿块内多发斑片状钙化(箭头);B、C:动态增强扫描示病灶实性部分呈明显不均匀强化,其内可见多条增粗迂曲血管影;D:延迟期轴位可见多发纤维分隔(细箭头)及包膜回缩征(粗箭头);E:显微镜下可见肿瘤内小灶骨质及软骨,局部有出血及坏死(苏木素-伊红染色,×200);F:免疫组化结果:Ki-67(50%~60%+),Glypican(胞质颗粒状+),P53(-),AFP(+),CD34(血管+),β-catenin(+)Fig.3 Mixed epithelial and mesenchymal type HB
讨 论
一、HB临床与病理特征
HB是婴幼儿时期最常见的原发性肝脏恶性肿瘤,大多出现于3岁以下儿童,男女比例为1.5∶1~2∶1[8-9]。本组资料中,年龄小于3岁者46例(46/71,64.7%),男女比例为1.6∶1,与上述文献报道基本相符。血清AFP是HB的重要肿瘤学标志物,常用于评估阶段性疗效及预测复发。据Czauderna等[10]报道,5%~10%的患儿会出现AFP正常甚至低于正常的情况。本组71例AFP均为阳性,可能是AFP阴性通常提示特殊的病理类型,即INI-1缺失的小细胞未分化型肝母细胞瘤,而本研究病例中并未包含此亚型[11]。
镜下HB可分为完全上皮型和混合性上皮间叶型,完全上皮型由不同分化程度的肝脏上皮细胞构成,混合性上皮间叶型由不同程度的上皮细胞和间叶细胞混合构成,可分为间质来源(不伴畸胎样特征)的混合型以及伴畸胎样特征的混合型2种,其中不伴畸胎样特征亚型中的间叶成分,通常为成熟或未成熟的纤维成分、骨样或软骨样组织,伴畸胎特征亚型还可出现原始内胚层、黑色素、鳞状上皮和腺上皮等非肝来源的成分[12]。本组21例混合型HB中,肿瘤以上皮组织为主,61.9%(13/21)的肿瘤内出现骨样和(或)软骨样组织,47.6%(10/21)的病例出现不同分化程度的纤维组织成分。
二、不同病理分型肝母细胞瘤CT征象
HB起病较隐匿,早期多无症状,被发现时肿瘤体积已较大,HB的包膜是较大的肿块推压邻近肝实质形成的假包膜。文献显示HB肿瘤体积越大,瘤内越容易出现囊变、坏死及出血征象,且更容易向肝外生长[13]。本研究结果显示,与胎儿型比较,胚胎型多发结节融合(P=0.027)及囊变坏死的发生率(P=0.002)差异有统计学意义,可以认为胚胎型HB多发结节融合、囊变坏死CT特征的人数占比更高;与胎儿型比较,混合型HB瘤内出血(P=0.01)及包膜回缩征(P=0.027)的发生率差异有统计学意义,可以认为混合型出现出血、包膜回缩征CT特征的人数占比更高;与胎儿型、胚胎型比较,混合型HB钙化(P=0.002)、延迟期多发纤维分隔(P=0.002)的发生率差异有统计学意义,可以认为混合型HB中出现钙化及多发纤维分隔CT特征的人数占比更高。本组胎儿型肿瘤边缘较规则,密度均匀,这可能是由于其分化程度较高,成分较单一的缘故。Baheti等[14]发现HB病灶边缘不规则提示肿瘤更具侵袭性且预后较差,即胎儿型HB的预后较其他亚型良好。胎儿型HB结节内坏死形态较规则,且多位于结节中央,中央坏死区可表现为无强化或延迟强化明显,延迟强化可能是坏死后纤维瘢痕形成所致。本组中混合型组钙化率较高,且钙化多为条片、斑片状不规则钙化灶,对应于混合型中部分间叶成分中的骨样或软骨样组织[15]。混合型在延迟期出现纤维分隔强化明显及肝包膜回缩的频率更高,这与张龚巍等[16]的研究结论基本一致,这可能是由于部分体积较大的肿瘤因缺血坏死,周围可产生大量增生的纤维组织,邻近肝外周的纤维组织牵拉包膜所致。
腹部CT扫描是诊断和鉴别肝母细胞瘤的重要影像学方法。本研究发现,胚胎型组病灶门脉期绝对强化程度小于胎儿型组、混合型组,提示门脉期为观察不同病理类型肝母细胞瘤的最佳时相。因CT多期相扫描方案对患儿有较大的辐射损伤,白凤森等[17]认为拟诊HB的患儿术前CT扫描动脉和静脉两期即可满足临床需求。
胎儿型HB细胞间质血窦丰富,对比剂多存留于血窦内[13]。另外,d'Assignies等[18]利用CT灌注技术,提出肿瘤病理分化程度与其内部血运呈正相关的观点,即肿瘤分化程度越好,肿瘤内部血供越丰富。本研究中胎儿型动脉期绝对强化程度以及动脉期CT比值比虽高于其他亚型,但差异均无统计学意义,今后还需扩大样本量来验证以上结果。本研究中不同病理类型HB患儿的动脉期CT比值比均大于1,表明动脉期肿瘤实质强化较周围正常肝实质明显,这种强化方式与吴恩惠等[19]认为的病灶强化程度低于肝实质不一致,这可能与本研究中ROI的勾画位置有关。
三、本研究的局限性
本研究的局限在于仅选取了3种常见的HB病理类型进行分析,胎儿型HB样本量偏少,可能存在一定偏倚,今后将增大样本量或进行多中心研究。
综上所述,不同病理分型HB的CT影像存在一定差异。胎儿型HB肿瘤内密度更均匀,肿瘤直径较小,边缘更规则;胚胎型HB多呈多灶性结节改变,坏死及囊性变的发生率较高;混合性上皮间叶型HB瘤内出血、钙化多见,且延迟期多发纤维分隔、包膜回缩征的阳性率高。CT表现可在一定程度上鉴别HB的病理亚型。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为刘雨晴、马秋红,论文调查设计为刘雨晴、金科、向永华、李理,数据收集与分析为刘雨晴、马秋红,论文结果编撰为刘雨晴、金科、向永华,论文讨论分析为刘雨晴、金科、向永华
