水中运动联合中药内治对糖尿病动脉粥样硬化大鼠动脉细胞凋亡的影响
2022-05-26黄光明蒋晓凤陈佳俊符显昭
黄光明,蒋晓凤,陈佳俊,符显昭
(右江民族医学院临床医学院,广西 百色 533099)
我国成人糖尿病患病率高达11.2%,患者数量约1.298亿,高居世界首位[1]。糖尿病本身对患者影响较小,造成糖尿病患者住院、死亡的主要原因为糖尿病各种急、慢性并发症,其中以心血管类并发症影响最为广泛和严重[2]。动脉粥样硬化(atherosclerosis,AS)是冠心病、脑卒中、外周动脉疾病等糖尿病大、中血管类并发症致死、致残的重要原因,内质网应激(endoplasmic reticulum stress,ERS)所介导的动脉细胞凋亡则是AS重要的病理基础和潜在治疗靶点[3]。糖尿病可通过高血糖、高血脂、炎症反应与AS相联系并加速其进展[4],抑制动脉细胞内质网应激,对抗动脉细胞凋亡有望成为防控糖尿病AS的重要途径。水中运动治疗兼具物理因子与运动综合康复效益,可缓解运动不耐受,有效改善动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的病情[5]。中药内治是传统康复医学的重要手段,相关中药在AS治疗中具有抗炎、抗凋亡、调节代谢紊乱等多重功效和整体性作用优势[6]。本研究旨在探讨水中运动联合中药内治对糖尿病AS大鼠动脉细胞凋亡的影响,并探究其可能机制。
1 材料与方法
1.1 实验大鼠
雄性SPF级SD大鼠125只,体质量(240±10)g,购自广西医科大学实验动物中心,许可证编号SCXK(桂)2014-002,饲养于右江民族医学院动物实验中心(温度20 ℃±2 ℃,相对湿度50%~60%,每天12 h循环照明),进食、饮水自由。实验过程严格遵循动物实验伦理相关准则,并获取右江民族医学院实验动物伦理委员会批准。
1.2 主要试剂与仪器
链脲佐菌素(北京华越洋生物公司),高脂饲料(江苏省协同生物工程有限公司),TUNEL试剂盒(北京华越洋生物公司),糖化血红蛋白(glycated hemoglobin,GHb)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、C反应蛋白(c-reactive protein,CRP)试剂盒(武汉博士德生物工程有限公司),4%多聚甲醛、磷酸盐缓冲液、乙醇溶液、二甲苯、过氧化氢溶液、生理盐水(成都市科隆化学品有限公司),葡萄糖调节蛋白78(glucose-regulated protein78,GRP 78)、CCAAT增强子结合蛋白同源蛋白(CCAAT/enhance-binding protein homologous protein,CHOP)、甘 油 醛-3-磷 酸 脱 氢 酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物合成及相关试剂(上海吉凯基因生物科技有限公司)。全自动生化仪( BS-400型,深圳迈瑞生物医疗电子股份有限公司) ,酶 标 仪 (美国珀金埃尔默股份有限公司),超净工作台(山东博科生物科技有限公司),高速低温离心机[艾本德(上海)国际贸易有限公司],-80 ℃超低温冰箱(中国海尔),光学显微镜(日本奥林巴斯公司),冷冻切片机(德国徕卡公司)。
1.3 动物分组与造模
造模方法参考已发表的相关文献[7],实验大鼠经适应性喂养1周后,按照随机数表法将其分为空白组、模型组、水中运动组、中药内治组、水中运动联合中药内治组(综合康复组),每组25只,空腹10 h后,除空白组外,各组按照50 mg/kg腹腔注射链脲佐菌素,空白组腹腔注射相当剂量柠檬酸钠缓冲液。3 d后检测大鼠空腹血糖(fasting blood glucose,FBG),选择连续2次FBG≥16.7 mmol/L大鼠,高脂饲养3个月后作为糖尿病动脉粥样硬化模型。造模成功后,各组进行8周相应灌胃、水中运动处理,期间继续高脂饲养(高脂饲料组成:普通饲料78.2%、猪胆盐0.3%、猪油10%、胆固醇1.5%、蛋黄粉10%)。喂养空白组大鼠所用普通饲料与上述高脂饲料中的普通饲料成分完全一致。
1.4 水中运动方案
水中运动组及综合康复组利用自制大鼠水疗运动池进行游泳运动,水疗运动池水深≥30 cm,维持水温32 ℃~35 ℃,每次使用前消毒,确保水质安全。每周运动6次,第1周为适应期,运动时间为10 min/次;第2周为延长运动适应期,运动时间逐渐增至30 min/次;第3~8周运动时间为60 min/次。
1.5 灌胃处理方案
将中药复方(人参、麦冬、黄芪、地黄、大黄、山茱萸、丹皮、黄连、桃仁、五味子、鳖甲,购自右江民族医学院附属医院,符合《中华人民共和国药典》药品质量控制标准)制成浸膏,每1 g浸膏剂量等同于原生药10 g,中药内治组与综合康复组按照1.0 g/(kg·d)确定剂量后,将浸膏置于EP管中,加入生理盐水,经涡旋震荡配制成2 ml混悬液灌服,模型组与水中运动组每天给予等体积生理盐水灌胃处理,连续灌胃8周,各组灌胃处理在运动前2 h进行。
1.6 实验取材
各组完成最后一次灌胃、运动处理后,给予戊巴比妥50 mg/kg腹腔注射麻醉大鼠。收集颈静脉血,4 ℃、3 500 转/min下分离血清,-20 ℃冰箱保存,用于各项生化指标检测。处死大鼠、剥离大鼠主动脉,部分经多聚甲醛固定,石蜡包埋和切片后用于原位末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)检测动脉细胞凋亡指数,另一部分在-80 ℃冰箱保存,用于实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)检测。
1.7 指标检测
1.7.1 血清生化指标检测 利用全自动生化仪检测血清甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平。严格按照试剂盒操作说明采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELASA)染色检测血清GHb、IL-6、TNF-α、CRP水平。
1.7.2 TUNEL染色检测动脉细胞凋亡水平 (1)将主动脉组织石蜡切片在二甲苯中浸泡10 min,清除切片中的石蜡。(2)用100%乙醇溶液、85%乙醇溶液、75%乙醇溶液、蒸馏水依次浸泡,各5 min,进行水化处理。(3)滴加蛋白酶K,室温下反应15 min,磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗15 min。(4)3%过氧化氢溶液浸泡10 min,PBS清洗5 min。(5)添加TUNEL工作液,37℃,反应60 min,PBS清洗15 min。(6)添加二氨基联苯氨(diaminobenzidin,DAB)显色剂。(7)85%、95%、100%乙醇溶液逐级脱水。(8)使用二甲苯进行透明处理,最后滴加中性树胶封片,显微镜下观察、拍照。凋亡阳性动脉细胞核呈黄棕色,正常动脉细胞核呈蓝色,每张切片选择5个不重复视野对细胞核总数和凋亡细胞核数目进行统计,并计算动脉细胞凋亡指数(cell apoptosis index,CAI)。CAI=凋亡动脉细胞核数/总细胞核数×100%。计算每个视野内的CAI,并取平均值。
1.7.3 qRT-PCR测定主动脉组织中GRP-78、CHOP mRNA表达水平 取主动脉组织,液氮研磨后利用总RNA抽提试剂(total RNA extractor,Trizol)提取大鼠主动脉组织总RNA,经琼脂糖凝胶电泳检测完整性后按照试剂盒说明书逆转录为cDNA,获取目的基因。qRT-PCR测定GRP78、CHOP mRNA 相对表达水平,反应条件为96 ℃ 4 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共计40个循环。目的基因的相对表达标准化为甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH),各项数据使用2_△△Ct法进行分析、计算。扩增目的基因所用引物见表1。

表1 引物及序列Table 1 Primers sequence
1.8 统计学处理
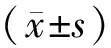
2 结 果
2.1 5组大鼠血糖与血脂水平比较
与空白组比较,其余各组GHb、TG、LDL-C显著升高,HDL-C显著降低,差异均有统计学意义(均P<0.01)。与模型组比较,各治疗组GHb、TG、LDL-C明显降低,HDL-C明显升高,差异均有统计学意义(均P<0.05)。与水中运动组相比,综合康复组GHb、TG、LDL-C水平明显降低,HDL-C明显升高,差异均有统计学意义(均P<0.05;表2)。

表2 5组大鼠血糖与血脂水平比较
2.2 5组大鼠炎症因子水平比较
与空白组比较,其余各组IL-6、TNF-α、CRP水平显著升高,差异均有统计学意义(均P<0.01)。与模型组比较,各治疗组IL-6、TNF-α、CRP水平明显降低,差异均有统计学意义(均P<0.05)。与水中运动组比较,综合康复组IL-6、TNF-α、CRP明显降低,差异均有统计学意义(均P<0.05;表3)。
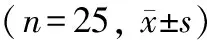
表3 5组大鼠血清IL-6与TNF-α与CRP水平比较
2.3 5组大鼠GRP78 mRNA与CHOP mRNA表达水平比较
与空白组比较,其余各组GRP78、CHOP mRNA表达水平显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各个治疗组GRP78、CHOP mRNA表达水平明显降低,差异均有统计学意义(P<0.05)。与水中运动组比较,综合康复组GRP78、CHOP mRNA表达水平明显降低,差异均有统计学意义(P<0.05;表4)。
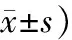
表4 5组大鼠GRP78 mRNA与CHOP mRNA表达水平比较
2.4 5组大鼠动脉细胞凋亡情况比较
光镜下TUNEL法检测结果显示,与空白组比较,模型组、水中运动组、中药内治组、综合康复组动脉CAI显著升高,差异均有统计学意义(P<0.01)。与模型组比较,水中运动组、中药内治组、综合康复组心肌细胞凋亡率明显降低,差异均有统计学意义(P<0.05)。与水中运动组比较,综合康复组动脉CAI明显降低,差异均有统计学意义(P<0.05;图1;表5)。
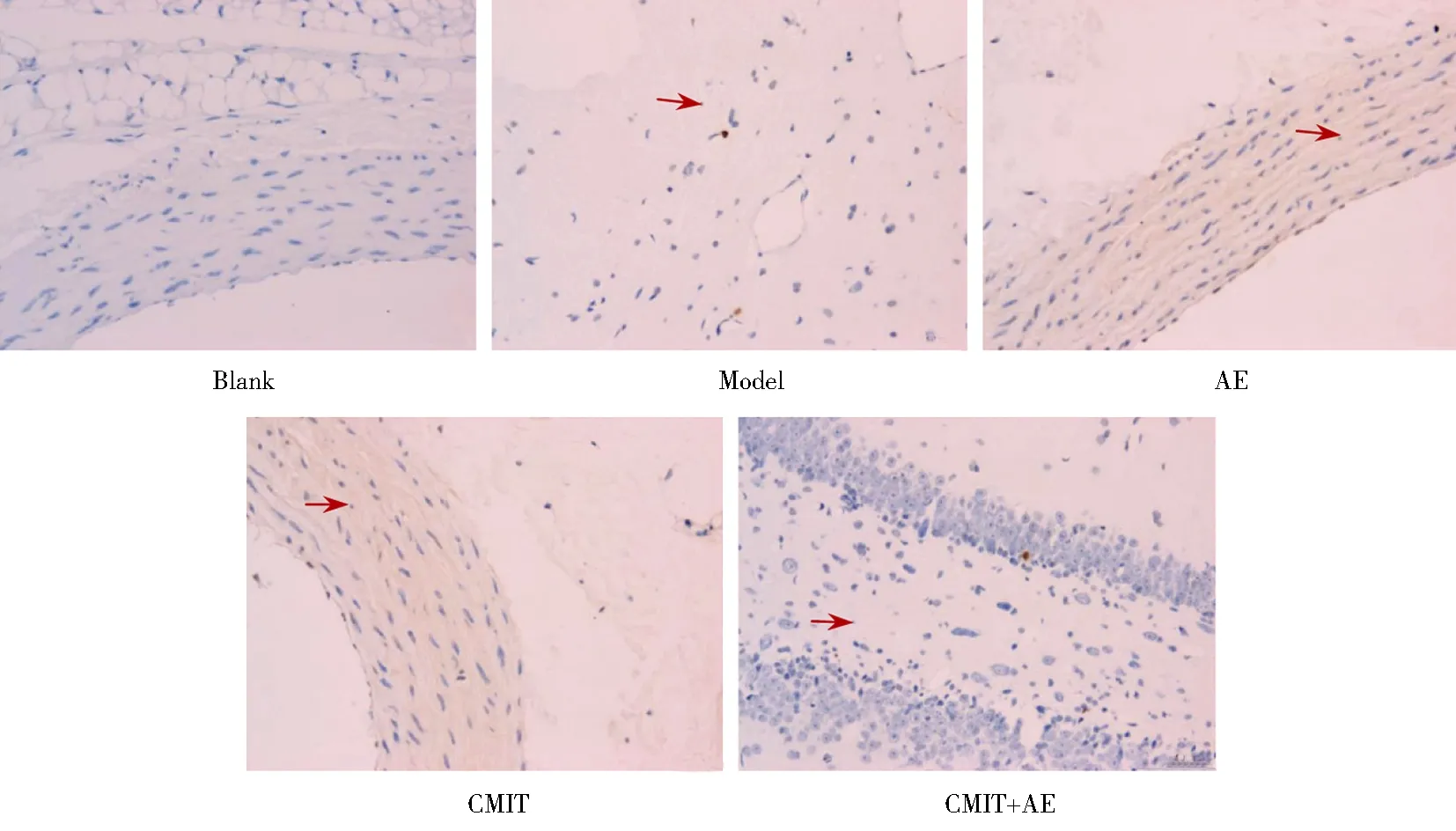
图1 5组大鼠动脉细胞凋亡情况Figure 1 Aorta cell apoptosis in five groups(TUNEL×200)The nucleus of normal cells were blue, the nucleus of apoptotic cells brown, and the nucleus of normal cells were larger than that of apoptotic cells. The red arrows indicate apoptotic cells; few apoptotic cells can be observed in the blank group; lots of apoptotic cells can be observed in the model group; less apoptotic cells can be observed in AE group, CMIT group and CMIT+AE group. AE: aquatic exercise; CMIT: Chinese medicine internal treatment; TUNEL: terminal-deoxynucleoitidyl transferase mediated nick end labeling.
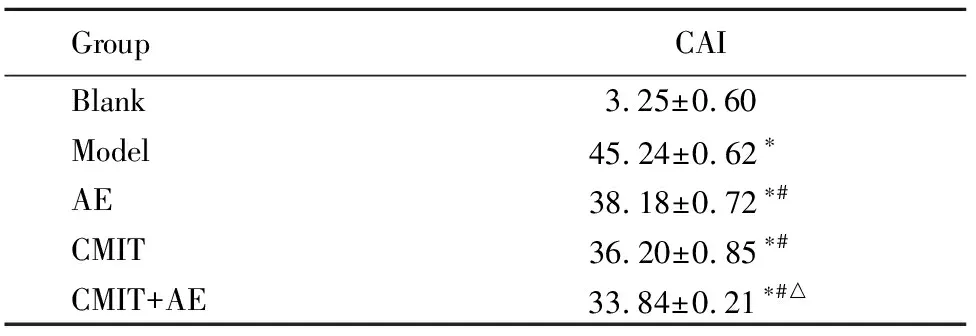
表5 各组大鼠动脉细胞凋亡情况比较Table 5 Comparison of CAI in aorta tissue among five groups (n=25,%, ±s)
3 讨 论
内质网是合成蛋白质、脂质及调控钙离子平衡的细胞器,细胞内外病理性刺激均可扰乱内质网稳态,使内质网中未/错误折叠蛋白质蓄积,导致ERS发生[8]。ERS发生时内质网中GRP78与内质网膜上的跨膜蛋白感受器肌醇需求酶1(inositol-requiring enzyme1,IRE-1)、活化转录因子6(activating transcription factor6,ATF6)及蛋白激酶样内质网应激酶(protein kinase R-like ER kinase,PERK)分离,以激活未折叠蛋白反应,恢复内质网稳态[9],但持续的ERS未被纠正时,IRE-1、ATF6及PERK将激活下游的凋亡信号分子半胱氨酸天冬氨酸蛋白酶-12(cysteine-containing aspartate specific protease 12,Caspase-12)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,c-JNK)、CHOP,启动相应Caspases-12、c-JNK、CHOP 3条ERS凋亡路径,导致细胞凋亡[10]。
本研究利用链脲佐菌素破坏大鼠胰岛β细胞并联合高脂饲养诱导AS病变,以模拟糖尿病并发AS的病理过程。实验结束后,主动脉TUNEL染色观察到模型组大量动脉细胞凋亡,而经过8周康复治疗干预的3个治疗组动脉细胞凋亡水平较模型组均明显降低,其中以综合康复组下降程度最为明显。同时qRT-PCR结果显示,各实验组动脉细胞中ERS标志物分子GRP78、CHOP的mRNA转录水平依次为模型组>水中运动组>中药内治组>综合康复组,表明实验中糖尿病AS大鼠动脉细胞发生过度ERS,并存在CHOP凋亡通路激活,而水中运动和中药内治干预均可降低动脉细胞ERS,抑制CHOP凋亡通路,减少动脉细胞凋亡,且两者抗凋亡效果可叠加。实验进一步对综合康复疗法对抗糖尿病AS的可能机制进行了探究,ELISA及全自动生化仪检测结果显示,模型组大鼠存在显著的高血糖、高血脂及高炎症水平状态。长期血糖变异将增加动脉僵硬风险[11],持续血脂代谢紊乱也使ASCVD风险大幅升高[12],AS合并糖尿病的病理机制和治疗也更为复杂,此时单纯降脂疗法对AS病变改善不佳,但当联合降糖治疗时可观察到粥样斑块缩小[13]。本研究中综合康复组GHb、TG均明显降低,同时动脉细胞凋亡水平明显下降,提示综合康复方案具有改善糖尿病AS的潜在临床应用价值。LDL-C水平升高可直接损伤动脉平滑肌细胞,氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)可激活CHOP凋亡通路,引发内皮细胞凋亡[14],HDL-C则可抑制LDL-C氧化修饰,对抗LDL-C危害[15],本研究综合康复组LDL-C降低的同时,可观察到HDL-C水平的升高。AS也被认为是一种炎症性疾病,IL-6、TNF-α与粥样斑块形成、破裂及血栓形成有关,其所参与的炎症反应贯穿AS全程,由巨噬细胞分泌的TNF-α可使平滑肌细胞凋亡[16]。血清CRP水平异常可影响内皮细胞一氧化氮(nitricoxide,NO)生物利用,促发内皮细胞功能障碍[17],而本研究3个治疗组均可观察到IL-6、TNF-α及CRP水平明显降低。此外,大量研究表明ERS所介导的动脉细胞凋亡机制虽然复杂,但与血糖、血脂代谢紊乱和炎症反应密切相关[18],因此改善糖尿病基础病情也可能是本研究中糖尿病AS大鼠动脉细胞凋亡水平降低的重要原因。
综上所述,水中运动联合中药内治可改善糖尿病AS大鼠的血糖、血脂代谢异常及炎症反应,抑制ERS,下调促凋亡信号分子GRP78、CHOP的mRNA表达水平,减少动脉细胞凋亡,对糖尿病AS发挥治疗作用。
