多杀性巴氏杆菌与禽白血病病毒亚群混合感染诊断及相关基因分析
2022-05-26罗东还吴强温贵兰胡璇张小波文明欧德渊龚新勇
罗东还 吴强 温贵兰 胡璇 张小波 文明 欧德渊 龚新勇


摘要:【目的】明確引起贵州某规模化(20万羽)养殖场三黄鸡群发病的病因及科学用药,最大限度减轻经济损失,同时为规模化养殖场防控禽白血病和净化鸡群提供参考依据。【方法】无菌采集送检病鸡的心脏、肝脏和脾脏等组织进行细菌分离培养、生化试验、荚膜分型、毒力基因和耐药基因等分子生物学检测,同时对采集病料进行禽白血病病毒(ALV)PCR检测及gp85基因克隆测序分析。【结果】成功分离获得1株多杀性巴氏杆菌(Pasteurella multocida,Pm),命名为Pm-GZXF2021;Pm-GZXF2021为荚膜A型Pm,具有黏附素(ptfA、hsf-1、hsf-2、pfhA、fimA和tadD)、超氧化物歧化酶(sodA)、外膜蛋白(ompA、ompH、plpB和oma87)和铁摄取(exbB、exbD、tonB、Fur、hgbB和hgbA)相关的毒力基因,同时携带有喹诺酮类的gyrB耐药基因和内酰胺类的tem耐药基因;药敏试验结果表明,Pm-GZXF2021对米诺环素、丁胺卡那、哌拉西林、庆大霉素、多西环素、氧氟沙星、新霉素、头孢拉定、麦迪霉素及头孢哌酮等药物敏感,而对头孢他啶、苯唑西林、羧苄西林及头孢曲松等药物已产生耐药性;健康昆明小鼠在接种Pm-GZXF2021纯培养菌液(1.7×108 CFU/mL)后12 h内全部死亡,剖检可见昆明小鼠小肠均出现胶冻样浸润,肝脏肿大且伴有白色坏死灶。从病鸡的组织样品检测出ALV,命名为ALV-GZXF2021;由基于gp85基因核苷酸序列相似性构建的ALV系统发育进化树可知,ALV-GZXF2021与5株ALV-K参考毒株处于同一分支,与A、B、D、E、J亚群处于不同分支,即ALV-GZXF2021属于K亚群。【结论】贵州某规模化养殖场三黄鸡群发病是由Pm与K亚群外源性ALV混合感染所致。因此,养殖场应采取相应的防控措施,一般包括加强饲养管理,做好生物安全措施及疫苗接种等,尤其是建立无禽白血病的种鸡群。
关键词: 多杀性巴氏杆菌(Pm);禽白血病病毒(ALV);K亚群;混合感染;基因分析
中图分类号: S858.31 文献标志码: A 文章编号:2095-1191(2022)02-0526-12
Diagnosis and gene analysis of mixed infection of Pasteurella multocida and avian leukemia virus-K subgroup
LUO Dong-huan WU Qiang WEN Gui-lan HU Xuan ZHANG Xiao-bo WEN Ming OU De-yuan GONG Xin-yong
(1College of Animal Science, Guizhou University/ Guizhou Animal Biological Products Engineering Technology Research Center, Guiyang 550025, China; 2Sinan Agriculture and Rural Bureau, Tongren, Guizhou 565100, China)
Abstract:【Objective】To clarify the etiology of Sanhuang chickens in a large-scale (200000 feather) breeding farm in Guizhou, scientifically used medicine to minimize economic loss, and provide reference for prevention and control of avian leukemia and purification of chickens in large-scale breeding farms. 【Method】The heart, liver and spleen tissues of chickens were collected aseptically for bacterial isolation and identification, biochemical test, capsule typing, virulence gene and drug resistance gene detection, avian leukemia virus(ALV) PCR detection, gp85 gene cloning and sequencing analysis, etc. 【Result】A Pasteurella multocida(Pm) strain was isolated and named as Pm-GZXF2021. Pm-GZXF2021 was type A capsulatus of Pm with the associated virulence genes of adhesin(ptfA, hsf-1, hsf-2, pfhA, fimA and tadD), superoxide dismutase(sodA), outer membrane protein(ompA, ompH, plpB and oma87) and iron uptake(exbB, exbD, tonB, Fur, hgbB and hgbA). Meanwhile, the isolate strain carried a gyrB resistance gene for quinolones and a tem resistance gene for lactamides. Drug sensitivity test showed that Pm-GZXF2021 was sensitive to minocycline, mikacin, pipe-racillin, gentamicin, doxycycline, levofloxacin, neomycin, cefradine, medicin and cefoperazone, but resistant to ceftazidime, oxacillin, carbenicillin and ceftriaxone sodium. In addition, all healthy Kunming mice died within 12 h after inoculation with Pm-GZXF2021 pure culture broth (1.7×108 CFU/mL). By necropsy, the small intestine of Kunming mice showed jelly infiltration, and the liver was enlarged with white necrosis. ALV was detected from tissue samples of sick chickens and named ALV-GZXF2021. The ALV phylogenetic tree constructed based on the nucleotide sequence similarity of the gp85 gene showed that ALV-GZXF2021 was in the same branch as the five ALV-K reference strains and was in different branches with subgroups A, B, D, E, and J. In other words, ALV-GZXF2021 belonged to ALV-K. 【Conclusion】The incidence of Sanhuang chicken group in a large-scale farm in Guizhou is caused by exogenous ALV infection of Pm and K subgroups. Therefore, the farm should take corresponding prevention and control measures, generally including strengthening feeding management, biosafety measures and vaccination, especially the establishment of breeding chickens without avian leukemia.
Key words: Pasteurella multocida(Pm); avian leucosis virus(ALV); K subgroup; mixed infection; genetic analysis
Foundation items: Guizhou Science and Technology Support Project (QKHZC〔2021〕General 164); Guizhou Provincial Agricultural Science and Technology Support Project(QKHZC〔2019〕2286); Reform Project of Teaching Content and Curriculum System in Higher Education Institutions of Guizhou (GZJG20200035)
0 引言
【研究意义】多杀性巴氏杆菌(Pasteurella multocida,Pm)两端钝圆、中央微突,呈短杆状或球杆状,有荚膜、无鞭毛、不形成芽孢,可导致多种动物发病,发生在鸡、鸭等禽类上又称为禽霍乱(唐沙等,2017;陶娅等,2019;陈国权等,2020)。该病传染性强,发病率和死亡率极高,是严重危害养鸡业健康发展的常见疾病之一(李继成,2018;黄萃等,2019;刘杰等,2019)。禽白血病是由禽白血病病毒(Avian leukosis virus,ALV)引起的一种肿瘤性疾病,ALV感染时会显著降低疫苗的免疫效果,造成鸡群无法有效抵抗其他病毒感染而继发相关疾病,对家禽养殖危害极大(张民秀等,2021)。Pm和ALV是家禽养殖业中常见的病原微生物,二者发生混合感染的危害远比单一病原体导致的危害更严重。此外,引起鸡群发病的病原微生物众多,彼此间常发生混合感染,导致鸡群大批量死亡或蛋鸡产蛋量下降等,给养殖场带来重大的经济损失。因此,开展相应的病原学检查及相关基因分析,对确保养禽业健康发展具有重要意义。【前人研究进展】Pm属于条件性致病菌,可在某些健康家禽的呼吸道中常年存在,在应激反应、营养不良及其他疾病等因素的作用下,导致机体抵抗力下降而发病(仇桂玲等,2021)。ALV属于反转录病毒,根据病毒囊膜糖蛋白抗原特异性、病毒干扰模式及宿主范围的不同将其分为A~K等11个亚群,从鸡群中分离获得的有A~E、J、K亚群,其中E亚群为内源性病毒,致病性弱或无致病性,其余亚群则为外源性病毒(葛成等,2020)。K亚群是近年新发现的一种外源性ALV亚群,主要存在于我国地方鸡群中,具有病毒增殖慢、感染范围广的特点,是我国地方鸡群的主要防控对象之一(王呈呈,2021)。禽霍乱发病急,死亡率高,且在全球大部分地区呈地方性流行(蔡芳华,2021;尹广,2021;尹家珍和于泓,2021),一旦暴发即导致鸡群大批量死亡。禽白血病潜伏期较长,以免疫抑制、生长迟缓和多器官组织出现肿瘤为主要临床特征,也可引起蛋鸡的产蛋率和孵化率下降;同时禽白血病的临床诊断较困难,目前尚无特效治疗药物,且易与其他细菌病或病毒病发生混合感染,对养鸡业危害极大(蔡景明,2020;冯岭等,2020;杨荣坤等,2020;邹敏妮等,2020)。若禽霍乱与禽白血病發生混合感染,会导致鸡群极高的死亡率(李迎晓等,2015)。因此,快速诊断和科学防疗这2种疾病对确保我国禽类养殖的健康发展至关重要。近年来,关于细菌与病毒混合感染的病例时有报道,如常见商品肉鸡中的J亚群ALV与科氏葡萄球菌及肠炎沙门氏菌混合感染,鸡法氏囊病毒与沙门氏菌混合感染等(范志为等,2021);以及国外报道的副鸡嗜血杆菌和禽腺病毒在蛋鸡中并发感染、鸡沙门氏菌与禽流感病毒的共感染等(Arafat et al.,2020;Mei et al.,2020)。细菌与病毒混合感染会极大提高鸡群的发病率和死亡率,严重阻碍养鸡业的健康发展。【本研究切入点】贵州某规模化(20万羽)养殖场于2021年7月5日开始出现鸡群发病,之后每天死亡200羽左右,截止7月9日已累计死亡800羽,剖检发现肝脏质地变脆,且表面有针尖状的灰白色坏死点。发病期间曾使用新霉素和卡那霉素进行治疗,但用药后病情又反复发作,因此亟待明确引起该养殖场鸡群发病的病因,并科学用药以减轻经济损失。【拟解决的关键问题】对送检的死亡蛋鸡进行细菌分离鉴定,以确定该养殖场是否达到国家规定的禽白血病净化要求,同时对采集病料进行ALV核酸检测及gp85基因克隆测序分析,为规模化养殖场防控禽白血病和净化鸡群提供参考依据。
1 材料与方法
1. 1 病料及试验动物
78日龄的患病三黄鸡来源于贵州某规模化养殖场。该养殖场于2021年7月5日开始出现鸡群发病,每天死亡200羽左右,至7月9日已累计死亡800羽,发病期间养殖场曾使用新霉素和卡那霉素进行治疗,但用药后鸡群病情又反复发作;临床观察鸡群存在发热、咳嗽及精神萎靡等症状;同时该养殖场已免疫禽流感H5、禽流感H7和新城疫等。致病性试验所用昆明小鼠购自贵州医科大学。
1. 2 主要试剂及培养基
2×Taq PCR Master Mix、RNA提取试剂盒、逆转录试剂盒、DNA胶回收试剂盒、大肠杆菌DH5α感受态细胞、pMD19-T载体及质粒提取试剂盒购自天根生化科技(北京)有限公司;细菌微量生化鉴定管、抗生素药敏纸片及革兰氏染液购自杭州微生物试剂有限公司;瑞氏染液、DL2000 DNA Marker及配制培养基所需的胰蛋白胨和琼脂等购自北京索莱宝科技有限公司。
1. 3 病理剖检
剖检患病鸡,观察其病理变化,无菌采集心脏、肝脏和脾脏等组织。
1. 4 细菌分离培养
无菌挑取送检病鸡的心脏、肝脏和脾脏,划线接种于鲜血琼脂培养基上,置于37 ℃恒温培养箱中培养,培养8~16 h后无菌挑取单个菌落划线接种于LB固体培养基上进行纯培养,置于37 ℃恒温培养箱继续培养8~16 h。对纯化后的分离菌株进行革兰染色和瑞氏染色,光学显微镜下观察菌体的染色特性及形态特征;同时从LB固体培养基上再次挑取单个菌落,接种于LB液体培养基中进行扩大培养,37 ℃下摇床(170 r/min)培养16 h。
1. 5 细菌鉴定
1. 5. 1 细菌16S rRNA序列分析 以纯化的菌液为模板进行PCR扩增,16S rRNA通用引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGCTACCTTGTTACGACTT-3')。PCR反应体系40.0 μL:2×Taq PCR Master Mix 20.0 μL,DNA模板(菌液)4.0 μL,上、下游引物各2.0 μL,ddH2O 12.0 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min,预扩增片段大小1450 bp。PCR扩增产物委托生工生物工程(上海)股份有限公司测序,测序结果与GenBank中的已有序列进行BLAST比对。
1. 5. 2 细菌生化鉴定 按照细菌微量生化鉴定管使用说明,将纯化的菌株分别接种至各细菌微量生化鉴定管中,37 ℃恒温培养14~20 h,观察并根据使用说明判定反应结果。
1. 5. 3 荚膜分型鉴定 根据李伟杰等(2020)的方法,合成鉴定荚膜血清型分型的引物(表1),并委托生工生物工程(上海)股份有限公司合成。PCR反应体系及扩增程序同1.5.1,退火温度参考表1。PCR扩增产物采用1.2%琼脂糖凝胶电泳进行检测。
1. 6 毒力基因和耐药基因检测
根据文献(Khamesipour et al.,2014;Shirzad Aski and Tabatabaei,2016)合成鉴定巴氏杆菌毒力基因的引物(表2);并依据金彪等(2013)、杨慧君等(2018)、曹冶等(2020)、冯涛等(2020)、张召兴等(2019)、李海利等(2020,2021)的方法设计引物(表3)进行耐药基因检测。PCR反应体系及扩增程序同1.5.1,退火温度分别参考表2和表3。PCR扩增产物采用1.2%琼脂糖凝胶电泳进行检测。
1. 7 药敏试验
选取常用药敏纸片通过K-B法测定分离菌株的药物敏感性,取100.0 μL纯化培养菌液涂布于LB固体培养基上,再贴入细菌药敏纸片,37 ℃培养18~20 h后测量抑菌圈直径并做好记录,参照WS/T 125—1999《纸片法抗菌药物敏感试验标准》进行判定。
1. 8 致病性试验
将试验昆明小鼠分为2组,每组5只。试验组每只昆明小鼠腹腔注射0.3 mL纯培养菌液(1.7×108 CFU/mL),对照组注射0.3 mL灭菌PBS,注射后观察昆明小鼠状态。若试验组昆明小鼠出现死亡,则进行剖检并从肝脏中再次分离细菌。
1. 9 ALV检测及亚群鉴定
1. 9. 1 病毒核酸提取及反转录 根据RNA提取试剂盒说明,从采集的组织样品中提取总RNA,再按逆转录试剂盒说明合成cDNA。
1. 9. 2 PCR检测 根据梁雄燕(2018)的方法合成检测ALV的env基因引物(F:5'-GACTAAGAAAG ATGAGGCGAGCC-3',R:5'-CAACCCAGGTGCA CACCAATG-3'),预扩增片段大小为2.2~2.5 kb。以合成的cDNA为模板,进行PCR扩增。PCR反应体系及扩增程序同1.5.1,退火温度为56 ℃。PCR扩增产物送至生工生物工程(上海)股份有限公司测序,将测序结果与GenBank中的已有序列进行BLAST比对。
1. 9. 3 ALV亚群鉴定 根据袁丽霞等(2017)的方法合成鉴定ALV亚群的gp85基因引物。上游引物为5'-CGGGATCCATGCACTTACTCGAGCAGCCA GG-3',下游引物为5'-ACGCGTCGACTTAGGTGC TTCGTTTACGTCTCATACC-3',预扩增片段约1005 bp。PCR反应体系及扩增程序同1.5.1,退火温度为59 ℃。PCR扩增产物经1.2%琼脂糖凝胶电泳检测,并进行胶回收;然后与pMD19-T载体连接,再转化DH5α感受态细胞,培养2 h后涂布接种于含氨苄抗性的LB固体培养基上。37 ℃培养12 h后挑取单菌落进行增菌培养,12 h后通过菌液PCR筛选出克隆成功的阳性菌液。将阳性克隆质粒送至生工生物工程(上海)股份有限公司测序,根据分离毒株的gp85基因序列确定其亚群类型。
1. 9. 4 gp85基因遗传进化分析 将克隆获得的基因序列拼接后进行BLAST比对,运用DNAStar将分离毒株的gp85基因序列分别与GenBank中已有的不同亞群ALV代表株进行相似性比对,并以MEGA 6.0构建系统发育进化树。
2 结果与分析
2. 1 病理剖检结果
临床观察发现鸡群存在发热、咳嗽等症状。剖检可见肝脏有灰白色坏死点,伴有浅黄色渗出物;心脏黄色伪膜;脾脏肿大,有灰白色坏死点(图1)。
2. 2 细菌分离培养及染色结果
挑取纯培养菌株进行革兰氏染色和瑞氏染色,镜检可见革兰氏染色呈阴性的短小杆菌,单个或成对存在(图2-A);瑞氏染色表现为两极浓染的短小杆菌(图2-B)。
2. 3 分离菌株16S rRNA序列分析结果
以通用引物27F/1492R扩增分离菌株16S rRNA序列,结果在1450 bp附近出现特异性扩增条带(图3),扩增片段大小与预期结果相符。经测序得知,分离菌株16S rRNA序列长1443 bp,与GenBank中的已有序列进行BLAST比对,发现其与Pm的相似性均在99%以上,证实分离得到的菌株为Pm,命名为Pm-GZXF2021。
2. 4 分离菌株生化鉴定结果
由表4可知,Pm-GZXF2021能发酵葡萄糖、蔗糖、水杨素、山梨醇和甘露醇,以及分解乳糖、鸟氨酸和氨基酸,符合Pm的基本生化特征。
2. 5 分離菌株荚膜分型鉴定结果
PCR扩增结果(图4)显示,约在1048 bp处出现特异性扩增条带,与引物capA的预期扩增结果相符,因此判定Pm-GZXF2021为荚膜A型Pm。
2. 6 分离菌株毒力基因及耐药基因检测结果
毒力基因检测结果(图5)显示,Pm-GZXF2021具有黏附素(ptfA、hsf-1、hsf-2、pfhA、fimA和tadD)、超氧化物歧化酶(sodA)、外膜蛋白(ompA、ompH、plpB和oma87)和铁摄取(exbB、exbD、tonB、Fur、hgbB和hgbA)相关的毒力基因;耐药基因检测结果(图6)显示,Pm-GZXF2021携带有gyrB和tem耐药基因。
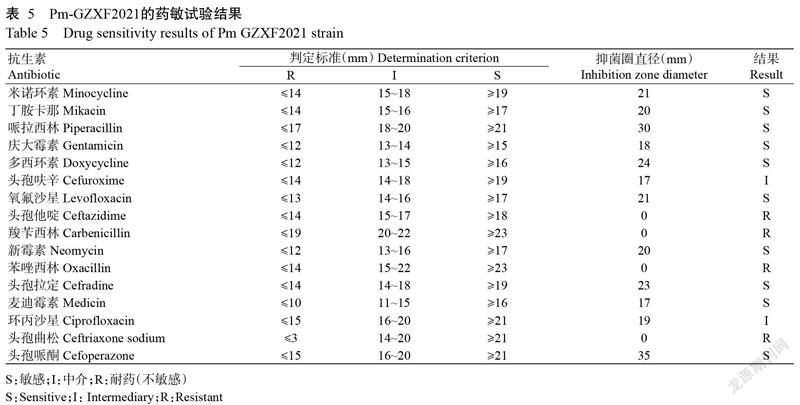
2. 7 分离菌株药敏试验结果
药敏试验结果(表5)显示,Pm-GZXF2021对米诺环素、丁胺卡那、哌拉西林、庆大霉素、多西环素、氧氟沙星、新霉素、头孢拉定、麦迪霉素及头孢哌酮等药物敏感,而对头孢他啶、苯唑西林、羧苄西林及头孢曲松等药物已产生耐药性。
2. 8 分离菌株致病性试验结果
昆明小鼠在接种Pm-GZXF2021纯培养菌液后12 h内全部死亡,剖检可见昆明小鼠小肠出现胶冻样浸润,肝脏肿大且伴有白色坏死灶(图7)。用接种环从死亡昆明小鼠的肝脏取样进行细菌分离培养,经鉴定均回收得到与Pm-GZXF2021一致的菌株。
2. 9 ALV的PCR检测结果
以合成的cDNA为模板对ALV的env基因进行PCR扩增,结果(图8)获得约2300 bp的目的条带。经测序得知,PCR扩增获得的目的条带长2305 bp,将其与GenBank中的已有序列进行BLAST比对,发现其与ALV的相似性均在99%以上,可鉴定分离毒株即为ALV,命名为ALV-GZXF2021。
2. 10 ALV-GZXF2021亚群鉴定及gp85基因克隆结果
分离毒株的gp85基因PCR扩增电泳结果显示,在约1005 bp处出现特异性目的条带(图9),与预期结果相符。回收PCR扩增产物进行T-A克隆,菌液PCR鉴定结果也显示克隆成功;将测序获得的gp85基因序列与GenBank中的已有序列进行BLAST比对分析,发现其与ALV-K亚群代表株的相似性均在99%以上,综合构建的系统发育进化树(图10),证实ALV-GZXF2021即为K亚群ALV。
3 讨论
Pm是一种宿主广泛的病原体,能引起多种家畜、野生动物及人类和灵长类动物感染发病(王喜等,2021)。Pm可引起反刍动物的出血性败血症、猪的传染性萎缩性鼻炎、牛的呼吸道疾病,以及禽类的禽霍乱等(尹媛媛等,2021)。其中,禽霍乱可发生在各年龄阶段的鸡群中,且发病率和死亡率均较高(朱善欢和张丽华,2014;秦晓冰,2019),对养禽业的危害极大。对于禽霍乱,药物治疗和预防有明显效果,良好的饲养管理和严格的卫生消毒制度也有助于降低其发病率,但目前主要依赖于疫苗接种(郝大春,2013)。禽白血病易导致动物机体免疫力下降,引发多重感染(廖卓锋等,2019),是养禽业中的常见疾病之一。ALV可垂直传播,导致鸡群长期处于带毒感染(崔治中等,2009)。在ALV的各亚群中,以ALV-K亚群的复制能力较弱,蛋白表达水平较低力,但自2012年被发现以来,在国内鸡群中感染的报道逐年增多,且易与其他亚群ALV混合感染(殷方芝等,2011)。目前,针对禽白血病尚缺乏有效的治疗方法,其主要防控措施是对鸡群进行净化,培育无外源性ALV感染的鸡群(庄长楠等,2019;陈子召和罗海燕,2020;胡璇等,2021)。国内关于禽白血病与细菌性疾病混合感染的案例时有报道,其中以消化道细菌的混合感染最常见(黄建强,2013;常超越等,2018;王宝剑等,2018)。
本研究通过对分离菌株耐药基因的检测,发现Pm-GZXF2021携带有喹诺酮类的gyrB耐药基因和内酰胺类的tem耐药基因;其药敏试验结果也显示对头孢他啶、苯唑西林、羧苄西林及头孢曲松等药物已产生耐药性;昆明小鼠致病性试验证实Pm-GZXF2021具有较强的致病性,携带有黏附素(ptfA、hsf-1、hsf-2、pfhA、fimA和tadD)、超氧化物歧化酶(sodA)、外膜蛋白(ompA、ompH、plpB和oma87)和铁摄取(exbB、exbD、tonB、Fur、hgbB和hgbA)相关的毒力基因。此外,荚膜分型鉴定及生化特性鉴定结果等均对后续进一步研究Pm具有重要参考价值。本研究的ALV-GZXF2021亚群鉴定结果表明存在ALV-K亚群感染,通过基于gp85基因核苷酸序列相似性构建的ALV系统发育进化树可知,ALV可分为以J亚群AHaq02 KF534753.1和K亚群GDFX0603 KP686144.1为代表的两大分支,ALV-GZXF2021与5株ALV-K参考毒株处于同一分支,与A、B、D、E、J亚群处于不同分支,即ALV-GZXF2021属于K亚群。综合上述诊断结果,可判定贵州某规模化(20万羽)养殖场鸡群发病是由Pm与K亚群外源性ALV混合感染所致。禽霍乱会导致鸡群大量死亡,而禽白血病造成感染鸡群发生免疫抑制、生长抑制等,二者混合感染给养殖场带来巨大经济损失。因此,养殖场应采取相应的防控措施,一般包括加强饲养管理,做好生物安全措施及疫苗接种等。此外,防控禽白血病最重要的是实现鸡群净化,建立无禽白血病的种鸡群。
4 结论
贵州某规模化养殖场三黄鸡群发病是由Pm与K亚群外源性ALV混合感染所致。因此,养殖场应采取相应的防控措施,一般包括加强饲养管理,做好生物安全措施及疫苗接种等,尤其是建立无禽白血病的种鸡群。
参考文献:
蔡芳华. 2021. 鸡霍乱的流行特点及防治对策[J]. 畜牧兽医科技信息,(1):173. [Cai F H. 2021. Epidemiological characteristics of cholera in chickens and countermeasures for prevention and control[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,(1):173.] doi:10.3969/J.ISSN.1671-6027.2021.01.155.
蔡景明. 2020. 鸡白血病的防治[J]. 养殖与饲料,(6):109-110. [Cai J M. 2020. Prevention and treatment of chicken leukemia[J]. Animals Breeding and Feed,(6):109-110.] doi:10.3969/j.issn.1671-427X.2020.06.047.
曹冶,于吉峰,谢晶,康润敏,叶勇刚,肖璐,李兴玉,魏勇,戴卓建,林毅,叶建强,潘梦,廖党金. 2020. 大肠杆菌磺胺类抗生素耐药基因二重PCR技术的建立[J]. 中国动物检疫,37(1):91-93. [Cao Y,Yu J F,Xie J,Kang R M,Ye Y G,Xiao L,Li X Y,Wei Y,Dai Z J,Lin Y,Ye J Q,Pan M,Liao D J. 2020. Establishment of a duplex PCR technology for detection of sulfonamide antibiotics resistance genes of E.coli[J]. China Animal Health Inspection,37(1):91-93.] doi:10.3969/j.issn.1005-944X.2020.01.019.
常超越,闫艳娟,李蕴玉,张召兴,李佩国,史秋梅,贾青辉,张香斋,吴同垒,张志强. 2018. 蛋种鸡禽白血病与大肠杆菌病混合感染的诊治[J]. 黑龙江畜牧兽医,(14):130-132. [Chang C Y,Yan Y J,Li Y Y,Zhang Z X,Li P G,Shi Q M,Jia Q H,Zhang X Z,Wu T L,Zhang Z Q. 2018. Diagnosis and treatment of mixed infection of avian leukemia and E. coli disease in egg breeders[J]. Heilong-jiang Animal Science and Veterinary Medicine,(14):130-132.] doi:10.13881/j.cnki.hljxmsy.2017.07.0293.
陳国权,张旭,阎朝华,周碧君,王开功,程振涛,文明. 2020. 鸭源多杀性巴氏杆菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医,47(2):620-628. [Chen G Q,Zhang X,Yan C H,Zhou B J,Wang K G,Cheng Z T,Wen M. 2020. Isolation,identification and drug resistance analysis of Pasteurella multocida from ducks[J]. China Animal Husbandry & Veterinary Medicine,47(2):620-628.] doi:10.16431/j.cnki.1671-7236.2020.02.035.
陈子召,罗海燕. 2020. 禽白血病净化进展及分析[J]. 养禽与禽病防治,(10):40-45. [Chen Z Z,Luo H Y. 2020. Pro-gress and analysis of avian leukemia purification[J]. Poultry Husbandry and Disease Control,(10):40-45.]
崔治中,郭惠君,孙淑红. 2009. 鸡白血病的流行现状和防制对策[J]. 中国兽药杂志,43(10):37-41. [Cui Z Z,Guo H J,Sun S H. 2009. Prevalence situation and prevention and control of avian leukosis[J]. Chinese Journal of Ve-terinary Medicine,43(10):37-41.] doi:10.3969/j.issn. 1002-1280.2009.10.008.
范志为,叶德春,王国岩,黄云鹤,刘有. 2021. 鸡传染性法氏囊与鸡白痢病混合感染的防控与诊治[J]. 吉林畜牧兽医,42(9):45. [Fan Z W,Ye D C,Wang G Y,Huang Y H,Liu Y. 2021. Prevention,control and diagnosis and treatment of infectious bursa and chicken dysentery mixed infection[J]. Jilin Animal Husbandry and Veterinary Medicine,42(9):45.] doi:10.3969/j.issn.1672-2078.2021.09.032
冯岭,刘勃兴,张志强,史秋梅. 2020. 蛋鸡白血病的诊断[J]. 兽医导刊,(13):28-29. [Feng L,Liu B X,Zhang Z Q,Shi Q M. 2020. Diagnosis of leukemia in layer hens[J]. Veterinary Orientation,(13):28-29.]
冯涛,富景宁,薛原. 2020. 狐源大肠杆菌中氯霉素类抗生素耐药基因的检测[J]. 野生动物学报,41(4):1075-1079. [Feng T,Fu J N,Xue Y. 2020. Investigation of chloramphenicol resistant genotype among Escherichia coli from fox[J]. Chinese Journal of Wildlife,41(4):1075-1079.] doi:10.19711/j.cnki.issn2310-1490.2020.04.034.
葛成,张海龙,陈玥,焦贺静,李蕴玉,李佩国,张志强,张香斋. 2020. 禽白血病的研究现状[J]. 河北科技师范学院学报,34(3):47-52. [Ge C,Zhang H L,Chen Y,Jiao H J,Li Y Y,Li P G,Zhang Z Q,Zhang X Z. 2020. The research status of avian leukosis[J]. Journal of Hebei Normal University of Science and Technology,34(3):47-52.] doi:10.3969/J.ISSN.1672-7983.2020.03.008.
郝大春. 2013. 家禽禽霍乱病的综合防制[J]. 北京农业,(36):170-171. [Hao D C. 2013. Comprehensive control of cholera disease in poultry[J]. Beijing Agriculture,(36):170-171.] doi:10.3969/j.issn.1000-6966.2013.36.143.
胡璇,温贵兰,张喜懿,欧德渊,李涛. 2021. 禽白血病的研究进展[J]. 贵州畜牧兽医,45(1):36-40. [Hu X,Wen G L,Zhang X Y,Ou D Y,Li T. 2021. Research progress of avian leukemia[J]. Guizhou Journal of Animal Husban-dry & Veterinary Medicine,45(1):36-40.] doi:10.3969/j.issn.1007-1474.2021.01.012.
黃萃,伍思华,李钰,邓贤才,邬向东. 2019. 乌鸡源多杀性巴氏杆菌杀禽亚种16S rDNA鉴定及药敏分析[J]. 生物灾害科学,42(3):243-247. [Huang C,Wu S H,Li Y,Deng X C,Wu X D. 2019. 16S rDNA identification and drug sensitivity analysis of Pasteurella multocida subsp. Gallicida[J]. Biological Disaster Science,42(3):243-247.] doi:10.3969/j.issn.2095-3704.2019.03.52.
黄建强. 2013. 鸡白血病病毒与白痢沙门氏菌的混合感染[D]. 泰安:山东农业大学. [Huang J Q. 2013. Mixed infection of avian leukosis virus and Salmonella pullorum[D]. Taian:Shandong Agricultural University.] doi:10. 7666/d.Y2304018.
金彪,伍成奇,唐攀,邱渊皓,刘万华,武宁,王晶钰. 2013. 肉鸡源致病性大肠埃希菌中β-内酰胺类抗生素耐药基因的检测[J]. 动物医学进展,34(4):65-69. [Jin B,Wu C Q,Tang P,Qiu Y H,Liu W H,Wu N,Wang J Y. 2013. Detection of aminoglycosides resistance genes among pathogenic Escherichia coli from broilers[J]. Progress in Ve-terinary Medicine,34(4):65-69.] doi:10.3969/j.issn. 1007-5038.2013.04.015.
李海利,冯丽丽,王英华,徐引弟,张青娴,王治方,朱文豪,许峰,游一,王克领. 2020. 猪传染性胸膜肺炎放线杆菌氨基糖苷类抗生素耐药基因的检测[J]. 河南农业科学,49(11):141-146. [Li H L,Feng L L,Wang Y H,Xu Y D,Zhang Q X,Wang Z F,Zhu W H,Xu F,You Y,Wang K L. 2020. Detection of aminoglycoside antibiotic resistance genes in pig infectious porcine contagious pleuropneumonia Actinobacillus pleuropneumoniae isolated from pigs[J]. Journal of Henan Agricultural Sciences,49(11):141-146.] doi:10.15933/j.cnki.1004-3268.2020.11.018.
李海利,朱文豪,张青娴,游一,方剑玉,焦文强,徐引弟,许峰,王治方,郎利敏,张立宪,王克领. 2021. 胸膜肺炎放线杆菌对四环素类抗生素的耐药分析及相关基因检测[J]. 畜牧与兽医,53(1):121-124. [Li H L,Zhu W H,Zhang Q X,You Y,Fang J Y,Jiao W Q,Xu Y D,Xu F,Wang Z F,Lang L M,Zhang L X,Wang K L. 2021. Analyses of tetracycline resistance and associated genes in Actinobacillus pleuropneumoniae[J]. Animal Husban-dry and Veterinary Medicine,53(1):121-124.]
李继成. 2018. 禽霍乱的流行与综合防治[J]. 畜牧兽医科技信息,(4):109. [Li J C. 2018. Epidemic and comprehensive control of avian cholera[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,(4):109.] doi:10.3969/J.ISSN.1671-6027.2018.04.093.
李伟杰,祁鑫,田野,岂晓鑫,蒋桃珍. 2020. 1株致禽霍乱多杀性巴氏杆菌的病原学与分子生物学鉴定[J]. 畜牧与兽医,52(6):89-93. [Li W J,Qi X,Tian Y,Qi X X,Jiang T Z. 2020. Identification of Pasteurella multocida cau-sing fowl cholera by etiology and molecular biology[J]. Animal Husbandry & Veterinary Medicine,52(6):89-93.]
李迎晓,焦凤超,李明彦,陈培荣,赵瑜,李洵,董海聚. 2015. 规模化土鸡养殖场主要疫病流行病学调查[J]. 中国家禽,37(5):66-68. [Li Y X,Jiao F C,Li M Y,Chen P R,Zhao Y,Li X,Dong H J. 2015. Epidemiological investigation of major epidemics in large-scale native chicken farms[J]. China Poultry,37(5):66-68.] doi:10.16372/j.issn.1004-6364.2015.05.017.
梁雄燕. 2018. 髓细胞瘤相关A和K亚群禽白血病病毒分离株的生物学特性[D]. 荆州:长江大学.[Liang X Y. 2018. Biological characteristics of the isolates of avian leukosis virus subgroup A and K associated with myeloid avian leukosis[D]. Jingzhou:Yangtze University.]
廖卓锋,刘永,谢强明,杨柳平,杨润. 2019. 禽白血病研究进展[J]. 当代畜牧,(8):65-67. [Liao Z F,Liu Y,Xie Q M,Yang L P,Yang R. 2019. Research progress of avian leukemia[J]. Contemporary Animal Husbandry,(8):65-67.]
刘杰,王志紅,刘守川,习向锋,赵坤坤,孙哲. 2019. 禽霍乱多杀性巴氏杆菌的分离鉴定[J]. 动物医学进展,40(1):130-134. [Liu J,Wang Z H,Liu S C,Xi X F,Zhao K K,Sun Z. 2019. Isolation and identification of Pasteurella multocida from fowl cholera[J]. Progress in Veterinary Medicine,40(1):130-134.] doi:10.3969/j.issn.1007-5038. 2019.01.028.
秦晓冰. 2019. 鸡源巴氏杆菌的分离鉴定及致病性研究[J]. 安徽农业科学,47(18):88-89. [Qin X B. 2019. Isolation and identification of Pasteurella multocida from chicken and its pathogenicity research[J]. Journal of Anhui Agricultural Sciences,47(18):88-89.] doi:10.3969/j.issn.0517- 6611.2019.18.021.
仇桂玲,钟嘉诚,谭结敏,邓银燕,姚红清,张溢珊,朱婉君,王贺,刘英慧,陈济铛,张济培. 2021. 20株禽多杀性巴氏杆菌的分离及荚膜与脂多糖的分型鉴定[J]. 广东畜牧兽医科技,46(1):43-49. [Qiu G L,Zhong J C,Tan J M,Deng Y Y,Yao H Q,Zhang Y S,Zhu W J,Wang H,Liu Y H,Chen J D,Zhang J P. 2021. Isolation and identification of capsular and lipopolysaccharid of 20 Pasteurella multocida strains[J]. Guangdong Journal of Animal and Veterinary Science,46(1):43-49.] doi:10.3969/j.issn. 1005-8567.2021.01.012.
唐沙,袁海文,杨源,张云丹,王军,程振涛,唐英秀,陈波. 2017. 禽霍乱巴氏杆菌的分离鉴定及基因分型[J]. 中国畜牧兽医,44(9):2724-2730. [Tang S,Yuan H W,Yang Y,Zhang Y D,Wang J,Cheng Z T,Tang Y X,Chen B. 2017. Isolation,identification and genotyping of Pasteurella multocida from fowl cholera[J]. China Animal Husbandry and Veterinary Medicine,44(9):2724-2730.] doi:10.16431/j.cnki.1671-7236.2017.09.026.
陶娅,王铉皓,李军朝,徐磊,朱永江,吴铁花,刘慧谋,王彦红. 2019. 禽源多杀性巴氏杆菌的分离及生物学鉴定[J]. 中国兽医杂志,55(4):92-94. [Tao Y,Wang X H,Li J C,Xu L,Zhu Y J,Wu T H,Liu H M,Wang Y H. 2019. Analysis of epidemic characteristics of Pasteurella multocida from avian[J]. Chinese Journal of Veterinary Medicine,55(4):92-94.]
王宝剑,田春雨,董航,李姜,任锐,邵洪泽,曹利利. 2018. 黄羽肉鸡禽白血病与致病性大肠杆菌混合感染的诊治[J]. 吉林畜牧兽医,39(6):31-32. [Wang B J,Tian C Y,Dong H,Li J,Ren R,Shao H Z,Cao L L. 2018. Diagnosis and treatment of yellow-feathered broiler avian leukemia and pathogenic Escherichia coli mixed infection[J]. Jilin Animal Husbandry and Veterinary Medicine,39(6):31-32.]
王呈呈. 2021. K亚群禽白血病病毒gp85表面蛋白的特异基因表达及应用[D]. 泰安:山东农业大学. [Wang C C. 2021. Expression of subgroup K avian leukosis virus gp85 gene specific fragment and its application[D]. Taian:Shandong Agricultural University.] doi:10.27277/d.cnki.gsdnu.2021.000449.
王喜,元正菊,张信艳,李珂,严红亚,常志顺,高洪,信爱国. 2021. 鸡源多杀性巴氏杆菌的分离鉴定及生物学特性分析[J]. 中国兽医科学,51(11):1411-1419. [Wang X,Yuan Z J,Zhang X Y,Li K,Yan H Y,Chang Z S,Gao H,Xin A Q. 2021. Isolation,identification and biological characteristic analysis of Pasteurella multocida from chi-cken[J]. Chinese Veterinary Science,51(11):1411-1419.] doi:10.16656/j.issn.1673-4696.2021.0204.
杨慧君,王艺晖,李晓娜,陈程,吴帆,王桂琴. 2018. 宁夏地区牛源金黄色葡萄球菌毒力基因和大环内酯类抗生素耐药基因的检测及诱导耐药[J]. 中国兽医学报,38(5):962-967. [Yang H J,Wang Y H,Li X N,Chen C,Wu F,Wang G Q. 2018. Detection of virulence genes and resistance genes to macrolide antibiotics and inducible resistance among bovine Staphylococcus aureus in Ningxia[J]. Chinese Journal of Veterinary Science,38(5):962-967.] doi: 10.16303/j.cnki.1005-4545.2018.05.20.
杨荣坤,许青荣,崔卫涛,肖运才,李自力,周祖涛. 2020. 地方鸡禽白血病病毒感染调查及主要流行亚群分析[J]. 华中农业大学学报,39(3):89-93. [Yang R K,Xu Q R,Cui W T,Xiao Y C,Li Z L,Zhou Z T. 2020. Investigation of avian leukosis virus infection and analysis of main epidemic subgroups in indigenous chicken[J]. Journal of Huazhong Agricultural University,39(3):89-93.] doi:10.13300/j.cnki.hnlkxb.2020.03.012.
殷方芝,陶军,马玉玲,黄忠,朱兰. 2011. 禽白血病的病原学特征和国内流行现状[J]. 上海畜牧兽医通讯,(1):67. [Yin F Z,Tao J,Ma Y L,Huang Z,Zhu L. 2011. Etiologi-cal characteristics and domestic epidemiological status of avian leukemia in China[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,(1):67.] doi:10.3969/ j.issn.1000-7725.2011.01.040.
尹廣. 2021. 禽霍乱的流行、诊断和防治[J]. 现代畜牧科技,(10):141-142. [Yin G. 2021. Prevalence,diagnosis and control of avian cholera[J]. Modern Animal Husbandry Science & Technology,(10):141-142.] doi:10.19369/j.cnki.2095-9737.2021.10.072
尹家珍,于泓. 2021. 一例鸡禽霍乱疫情诊断及防治[J]. 畜牧兽医科学(电子版),(13):84-85. [Yin J Z,Yu H. 2021. Diagnosis and control of an epidemic situation of fowl cholera[J]. Graziery Veterinary Sciences (Electronic Version),(13):84-85.] doi:10.3969/j.issn.2096-3637.2021. 13.039.
尹媛媛,何芳,赵光夫,李攀,李能章,彭远义. 2021. 多杀性巴氏杆菌主要毒力因子研究进展[J]. 中国兽医学报,41(6):1210-1218. [Yin Y Y,He F,Zhao G F,Li P,Li N Z,Peng Y Y. 2021. Research progress on the main virulence factors of Pasteurella multocida[J]. Chinese Journal of Veterinary Science,41(6):1210-1218.] doi:10.16303/j.cnki.1005-4545.2021.06.27.
袁麗霞,饶明章,张杰,赵子君,陈建,陈杨一骏,严立福,郑晓翠,谢暮晴,曹伟胜. 2017. K亚群禽白血病病毒抗体间接ELISA检测方法的建立[J]. 中国兽医科学,47(11):1349-1356. [Yuan L X,Rao M Z,Zhang J,Zhao Z J,Chen J,Chen Y Y J,Yan L F,Zheng X C,Xie M Q,Cao W S. 2017. Indirect ELISA for detection of antibodies against subgroup K avian leukosis virus[J]. Chinese Ve-terinary Science,47(11):1349-1356.] doi:10.16656/j.issn. 1673-4696.2017.11.002.
张民秀,谢芝勋,谢志勤,谢丽基,张艳芳,邓显文,曾婷婷,范晴,罗思思,黄娇玲. 2021. 禽白血病病毒和鸡传染性贫血病毒二重荧光LAMP检测方法的建立及应用[J]. 南方农业学报,52(7):2007-2014. [Zhang M X,Xie Z X,Xie Z Q,Xie L J,Zhang Y F,Deng X W,Zeng T T,Fan Q,Luo S S,Huang J L. 2021. A duplex fluorescence LAMP assay for identification of avian leukosis virus and chi-cken infectious anemia virus[J]. Journal of Southern Agriculture,52(7):2007-2014.] doi:10.3969/j.issn.2095-1191. 2021.07.031.
张召兴,刘少杰,苏硕青,周琦,贾青辉,张艳英,史秋梅. 2019. 貉源致病性肺炎克雷伯氏菌对喹诺酮类药物耐药表型及耐药基因检测[J]. 野生动物学报,40(4):906-911. [Zhang Z X,Liu S J,Su S Q,Zhou Q,Jia Q H,Zhang Y Y,Shi Q M. 2019. Detection of quinolone resistance phenotype and the gene resistant to Klebsiella pneumoniae from Raccoon dog(Nyctereutes procyonoides)[J]. Chinese Journal of Wildlife,40(4):906-911.] doi:10. 19711/j.cnki.issn2310-1490.2019.04.013.
朱善欢,张丽华. 2014. 某养禽场禽霍乱流行情况分析[J]. 畜禽业,(10):73-74. [Zhu S H,Zhang L H. 2014. Epidemio-logical analysis of avian cholera in a poultry farm[J]. Livestock and Poultry Industry,(10):73-74.] doi:10.19567/j.cnki.1008-0414.2014.10.047.
庄长楠,高佳滨,王树文,王海英,潘庆君,左辉,刘宇,鲁英. 2019. 禽白血病的研究进展[J]. 吉林畜牧兽医,40(1):9. [Zhuang C N,Gao J B,Wang S W,Wang H Y,Pan Q J,Zuo H,Liu Y,Lu Y. 2019. Research advances in avian leukemia[J]. Jilin Animal Husbandry and Veterinary Medicine,40(1):9.] doi:10.3969/j.issn.1672-2078. 2019.01.002.
邹敏妮,范颖,张泽颖,贺健,周丽华,雷红宇. 2020. 禽白血病病毒致病分子机制的研究进展[J].中国家禽,42(8):88-92. [Zou M N,Fan Y,Zhang Z Y,He J,Zhou L H,Lei H Y. 2020. Research progress on molecular mechanism of avian leukosis virus[J]. China Poultry,42(8):88-92.] doi:10.16372/j.issn.1004-6364.2020.08.016.
Arafat N, El-Rahman S A,Naguib D,El-Shafei R A,Abdo W,Eladl A H. 2020. Co-infection of Salmonella enteritidis with H9N2 avian influenza virus in chickens[J]. Avian Pathology,49(5):496-506. doi:10.1080/03079457.2020. 1778162.
Khamesipour F,Momtaz H,Mamoreh A M. 2014. Occurrence of virulence factors and antimicrobial resistance in Pasteurella multocida strains isolated from slaughter cattle in Iran[J]. Frontiers in Microbiology,5:536. doi:10.3389/fmicb.2014.00536.
Mei C,Xian H,Blackall P J,Hu W,Zhang X,Wang H J. 2020. Concurrent infection of Avibacterium paragallinarum and fowl adenovirus in layer chickens[J]. Poultry Science,99(12):6525-6532. doi:10.1016/j.psj.2020.09. 033.
Shirzad Aski H,Tabatabaei M. 2016. Occurrence of virulence-associated genes in Pasteurella multocida isolates obtained from different hosts[J]. Microbial Pathogenesis,96:52-57. doi:10.1016/j.micpath.2016.04.008.
(责任编辑 兰宗宝)
