胃肝样腺癌CT及临床表现
2022-05-25李莉明黄文鹏赵慧萍高剑波
李莉明,黄文鹏,赵慧萍,王 睿,梁 盼,高剑波
(郑州大学第一附属医院放射科 河南省消化肿瘤影像重点实验室,河南 郑州 450052)
肝样腺癌(hepatoid adenocarcinoma, HA)是发生于肝脏外组织器官的罕见特殊类型恶性肿瘤,其形态学及免疫组织化学表现与肝细胞癌类似;最常见于胃,亦可发生于食管、十二指肠、空肠、结肠、腹膜、胰腺、肺、卵巢、胆囊及子宫等处[1-4]。胃肝样腺癌(hepatoid adenocarcinoma of the stomach, HAS)占胃癌的0.17%~15.00%,临床症状不典型,误诊率较高,而其恶性程度及侵袭性均高于其他胃腺癌(gastric adenocarcinoma, GA),且预后更差[1]。本研究观察HAS的临床及CT表现,并与非HAS GA相比较,以期提高对该病的认识。
1 资料与方法
1.1 一般资料 收集2013年2月—2021年2月30例郑州大学第一附属医院术后病理确诊的HAS患者(HAS组),男22例,女8例,年龄50~81岁,平均(62.9±7.5)岁;根据HAS组T分期,按照1∶1比例选取同期具有相同T分期的30例经术后病理确诊的非HAS GA患者(非HAS组),男24例,女6例,年龄25~76岁,平均(60.6±12.8)岁。纳入标准:①术前接受腹部CT平扫及增强扫描;②临床及病理资料完整;③术后规律复查并接受随访。排除标准:①术前接受新辅助化学治疗等其他抗肿瘤治疗;②图像存在明显伪影;③病灶过小,CT未能显示;④其他恶性肿瘤病史。检查前患者均签署知情同意书。
1.2 仪器与方法 采用GE Discovery 750 HD CT扫描仪。嘱患者仰卧,行全腹扫描,范围为膈肌至耻骨联合上缘水平;参数:管电压120 kV,自动管电流(自动毫安秒技术);完成平扫后,采用高压注射器以3 ml/s流率经肘静脉注入对比剂碘海醇(350 mgI/ml)90~100 ml行增强扫描:采用小剂量触发技术,于监测腹主动脉CT值达100 HU后延迟10 s采集动脉期图像,间隔30 s采集静脉期图像,范围同平扫。之后将图像上传至GE ADW 4.6工作站进行重建,层厚和层间距均为3 mm。
1.3 图像分析 由2名有5年以上腹部影像学诊断经验的放射科医师独立阅片,观察病灶位置、形态、强化方式及程度,并测量病灶最大径3次,取平均值;计算增强扫描动、静脉期病灶与同层面主动脉的CT值比值(CT值病灶/主动脉)、动脉期与平扫病灶CT值差值(CT值动脉期-平扫)及静脉期与动脉期CT值差值(CT值静脉期-动脉期)。2名医师意见存在分歧时,经协商达成共识。
1.4 随访 以疾病进展或患者死亡作为随访终点事件,截止时间为2021年6月1日。
1.5 统计学分析 采用SPSS 23.0统计分析软件。以±s表示符合正态分布的计量资料,行独立样本t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,行Mann-WhitneyU检验;以频数表示计数资料,行χ2检验或Fisher精确检验。采用Kaplan-Meier法比较无进展生存期和总生存期。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 HAS组与非HAS组患者性别、年龄、病程及主要症状差异均无统计学意义(P均>0.05),见表1。肿瘤标志物检查显示,HAS组17例(56.67%,17/30)血清甲胎蛋白(alpha fetal protein, AFP)升高,9例(30.00%,9/30)糖类抗原724(carbohydrate antigen-724, CA-724)升高,7例(23.33%,7/30)癌胚抗原(carcinoembryonic antigen, CEA)升高,5例(16.67%,5/30)糖类抗原125(carbohydrate antigen-125, CA-125)升高,4例(13.33%,4/30)糖类抗原199(carbohydrate antigen-199, CA-199)升高。
2.2 CT HAS组病灶最大径大于、而CT值静脉期-动脉期小于非HAS组(P均<0.05),且组间病灶强化程度及强化方式差异均有统计学意义(P均<0.05)。见表2及图1。
2.3 手术及病理学检查 HAS组转移淋巴结短径及术后转移率均高于非HAS组(P均<0.05),而分化程度低于非HAS组(P<0.05)。见表3。光镜下HAS存在肝样分化区及普通腺癌分化区,部分伴肠母细胞分化或神经内分泌细胞分化(图1D);免疫组织化学结果显示HAS组25例(83.33%,25/30)Ki-67(>50%+),25例(83.33%,25/30)AFP(+),21例(70.00%,21/30)Hepatocyte(+),20例(66.67%,20/30)Glypican(+)。
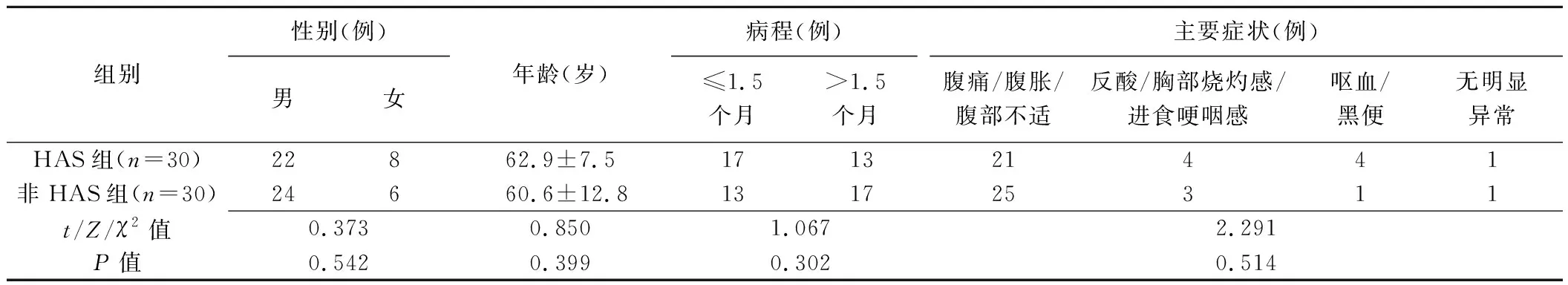
表1 HAS与非HAS GA患者一般资料比较
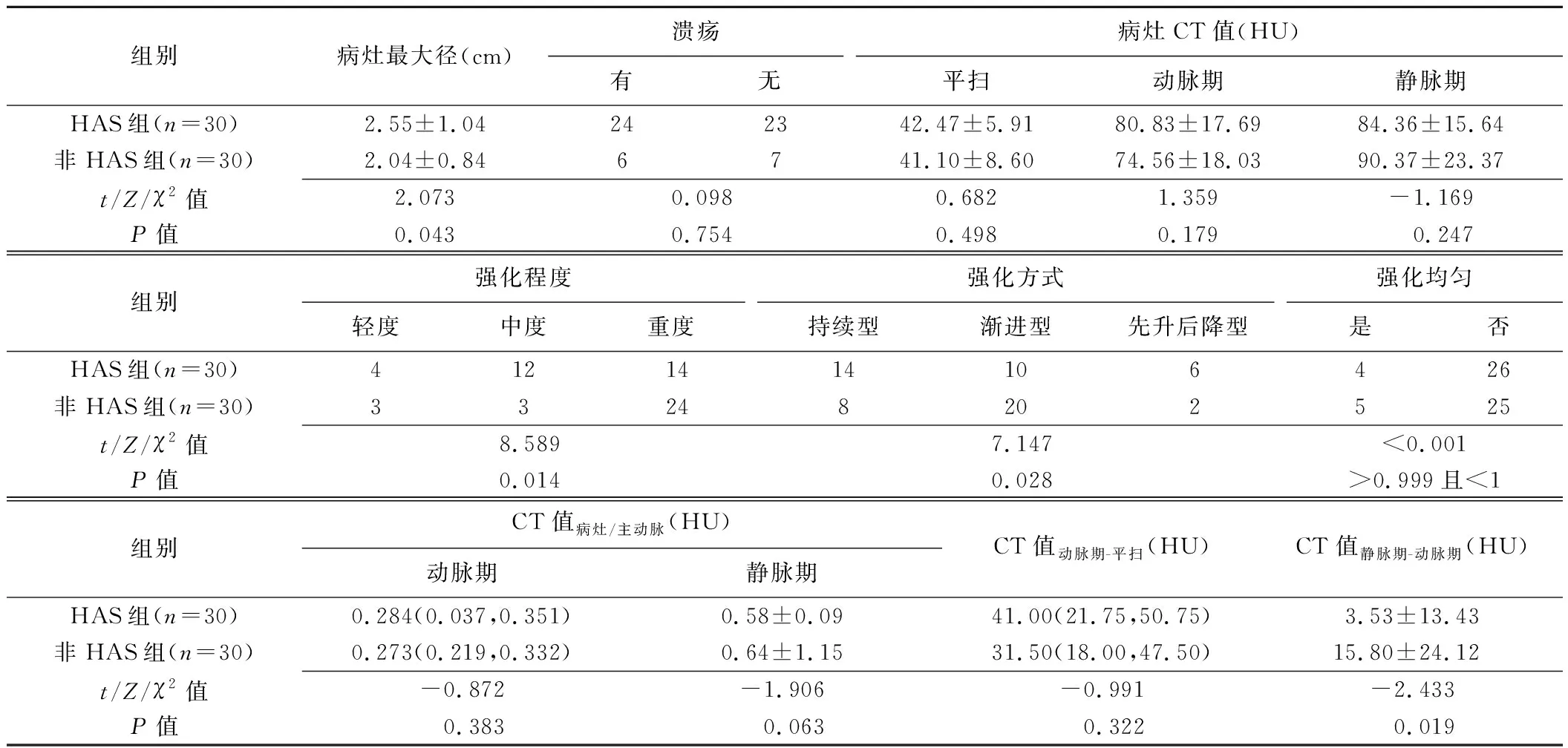
表2 HAS与非HAS GA 的CT特征比较

图1 HAS组患者,男,65岁 A.平扫轴位CT图示胃窦部弥漫性软组织肿块(箭),CT值约49 HU; B、C.增强静脉期轴位(B)及冠状位(C)CT图示病灶呈中度强化(箭),最大径约3.9 cm,CT值约75 HU; D.病理图示肿瘤细胞胞浆丰富,呈嗜酸性,核仁大而明显、位于细胞中央(HE,×100)
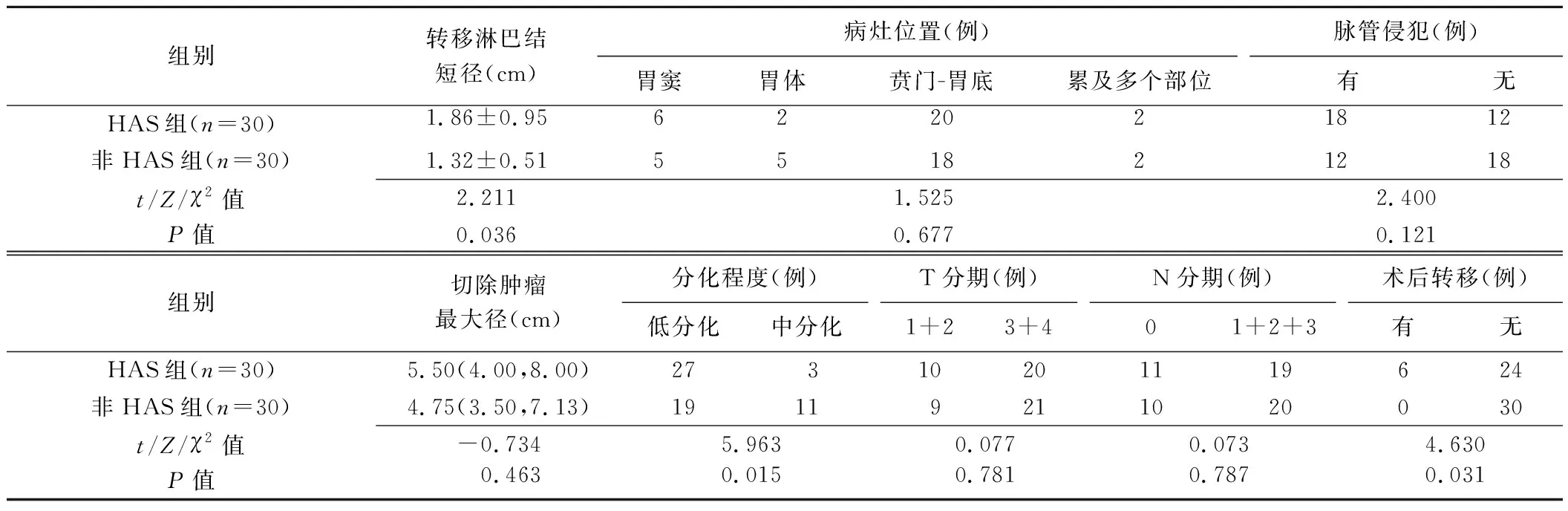
表3 HAS与非HAS GA手术及病理资料比较
2.4 随访 截止随访终点,HAS组30例中,16例疾病进展,其中14例死亡;非HAS组30例中,20例一般情况良好,6例疾病进展,其中4例死亡。
HAS组患者中位无进展生存期(8个月)及中位总生存期(12个月)均小于非HAS组(均为13.5个月;χ2=7.570,P=0.006;χ2=10.824,P=0.001)。
3 讨论
HAS为GA的一种亚型,具有侵袭性强、预后差、易转移等特点;多见于老年男性,临床表现与GA类似,主要为腹痛及腹胀等腹部不适症状,部分可伴消化道出血[5-7]。HAS病因及发病机制尚不明确,有假说认为胃和肝脏均起源于内胚层干细胞和原始前肠,故HAS具有向肝样细胞和肠道细胞双向分化的潜能[8-9];部分胃肿瘤细胞向肝细胞发展而出现肝样分化,导致APF升高。既往研究[8,10]发现,检测血清AFP对及早诊断及治疗HAS具有重要意义;但并非所有HAS患者均可见AFP升高,且胃癌伴肠化生亦可出现AFP升高[11]。确诊HAS还主要依靠病理学检查,即光镜下可见肝样分化区[2,12-14]。
本研究HAS组56.67%(17/30)患者AFP升高,且多为老年男性,与既往报道基本相符;病灶多位于贲门-胃底,与既往报道[3]的胃窦部有所差异,有待扩大样本量进一步观察。孔玲婷等[15]报道1例HAS可见局部间质过度增生及收缩,胃壁局限性凹陷而形成“脐凹征”;本组1例亦见“脐凹征”。本组HAS增强后多呈持续性中重度不均匀强化,CT值静脉期-动脉期较小,与既往报道[16]相符,可能与肝样分化区组织病理学特点有关;6例术后出现肝转移或腹膜转移;可能与c-Met基因表达有关:肝细胞生长因子与c-Met受体结合可刺激肿瘤细胞增殖[17]。
HAS出现肝转移灶伴AFP升高时,易误诊为肝细胞癌而忽视胃部原发病灶;但HAS患者多无肝炎病史及肝硬化表现,且肝转移灶常为多发结节,胃部原发病灶多伴胃周淋巴结转移,而原发性肝细胞癌多表现为较大的单发肿块,常可见肝硬化表现,多伴肝内转移灶及门脉癌栓形成。胃淋巴瘤致胃壁增厚范围较大,而胃壁扩张性尚可,且少见明显AFP升高。
治疗HAS以根治性手术为主;若错失手术机会,则多以奥沙利铂和氟尿嘧啶为基础进行化学治疗[3],是改善HAS患者预后、提高生存率的重要手段[18]。有学者[19]认为HAS预后较非HAS GA更差;本研究 HAS组中位无进展生存期及中位总生存期均小于非HAS组,与之基本相符。
综上所述,HAS多见于老年男性,好发于贲门-胃底部,临床表现不典型,多伴血清AFP升高,预后较差;其CT表现具有一定特征性,可与非HAS GA相鉴别。但本组样本量小,有待加大样本量进一步观察。
