Sin-QuEChERS Nano净化柱结合气相色谱-串联质谱法快速筛查石斛中84种农药残留
2022-05-24吴玉田周贻兵刘利亚刘文政陈庆园
张 权, 毕 珊, 吴玉田, 李 磊, 周贻兵, 刘利亚, 刘文政, 陈庆园, 周 雪, 郭 华*
(1.贵州省疾病预防控制中心实验中心,贵州 贵阳 550004;2.贵州医科大学药学院,贵州 贵阳 550025)
兰科(Orchidaceae)石斛属(DendrobiumSw.)植物为多年生草本[1]。石斛属在全世界大约有150种,划分为40个组,主要分布于亚洲及大洋洲的热带和亚热带区域,部分种类也分布于亚高山地区[2]。在中国石斛种属有78种,主要分布于华南、华东及西南等地[3]。贵州省有25种属,常见的主要以铁皮石斛、金钗石斛为主,其中铁皮石斛被誉为“九大仙草之首”,为历年版《中华人民共和国药典》收载的珍稀名贵中药材[4]。现代药理研究表明,石斛中含有多糖、生物碱、氨基酸等多种活性成分,具有抗氧化、抗肿瘤、增强免疫等诸多作用[5-8]。近些年石斛不仅作为传统中药使用,更作为原料广泛用于食品、保健品等行业[9,10]。由于过度采挖,野生石斛资源已濒临枯竭,目前主要以大面积人工仿野生栽培来满足市场需求,但在种植过程中常用农药来防治各种害虫,而过量使用农药不仅会造成环境污染,还会残留在药材内,危害人类健康[11]。因此,为保障石斛原材料的用药安全,建立多种农药残留快速筛查的方法就显得非常重要。
农药残留分析是一项复杂的痕量分析技术,随着检测样品基质的复杂化现象越来越突出,传统的提取净化技术已远远满足不了现代农药残留分析的要求[12,13],如何应对日益复杂的样品基质前处理及其痕量分析已成为业内一大挑战[14]。通常样品前处理是农药残留检测的关键,占整个分析过程2/3的时间[15]。方法主要有固相萃取法(SPE)[16]、凝胶渗透色谱法(GPC)[17]、QuEChERS[18]、分散固相萃取法(dSPE)[19]等,其中QuEChERS方法问世后目前已逐步成为多组分农药残留测定最流行的前处理方法[20]。原理是利用吸附剂填料与基质中的杂质相互作用,吸附杂质,从而达到除杂净化的目的。常用的净化剂填料主要有N-丙基乙二胺(PSA)[21]、十八烷基硅烷键合硅胶(C18)[22]及石墨化炭黑(GCB)[23]等。而Sin-QuEChERS Nano疏水型净化柱、MPFC-QuEChERS超滤型净化柱[24]是通过QuEChERS法进行技术改良后的产品,它是将一种具备强度高、韧性大及比表面积大等多种优点的新型多壁碳纳米管净化填料(multi-walled carbon nanotubes,MWCNTs)与其他净化填料结合[25],巧妙地将底部为漏斗状的柱体与实验室常用的50 mL离心管组成密封体系,将传统QuEChERS方法中萃取、净化两步“化简唯一”,从而避免因溶剂转移所带来的结果损失,真正实现一步净化。
目前Sin-QuEChERS Nano法在蔬菜及水果基质中有少数的应用[26,27],但是在石斛等复杂基质中的应用还未见报道。所以本研究以石斛基质为代表,通过比较本实验室所建立的几种经典样品前处理方法(SPE、dSPE、QuEChERS)的净化效果及回收率差异,突出Sin-QuEChERS Nano法在石斛基质净化过程中的优势性。以目前实际用于石斛种植中的农药种类,选择涵盖有机氯类、有机磷类、菊酯类、氨基甲酸酯类等84种代表性农药作为目标物,通过对质谱、色谱条件、基质效应、提取方式及净化方法的考察与优化,建立了Sin-QuEChERS Nano结合GC-MS/MS对石斛中多种农药残留的快速筛查方法,对不同产地、不同部位的80份金钗石斛和铁皮石斛开展监测,为后续中国国家标准修订石斛中农药最大残留限量提供参考。
1 实验部分
1.1 仪器与试剂
Scion-TQ三重四极杆质谱联用仪(美国BRUKER公司);FW100型高速万能粉碎机(天津市泰斯特仪器有限公司);GL-22MS型高速冷冻离心机(上海卢湘仪离心机仪器有限公司)。
33种药典中农药定制标准溶液(溶液丙酮,天津阿尔塔科技有限公司);10种氨基甲酸酯标准溶液(溶液丙酮,农业部环境保护科研监测所);16种有机磷标准溶液(溶液丙酮,农业部环境保护科研监测所);7种菊酯标准溶液(溶液正己烷,100 μg/mL,美国O2si公司),其余26种农药标准品均购自农业部环境保护科研监测所(溶液丙酮,100 μg/mL);乙腈、正己烷、丙酮(色谱纯,美国TEDIA公司);CNW dSPE萃取包及纯化管(萃取包内填料为6 g硫酸镁及1.5 g醋酸钠,纯化管内含150 mg MgSO4、50 mg PSA、50 mg GCB、50 mg C18)、缓冲盐萃取包(含4 g MgSO4、1 g NaCl、0.5 g柠檬酸氢二钠、1.5 g柠檬酸钠)(上海安谱实验科技股份有限公司);Cleanert PC/NH2固相萃取柱(1 000 mg/6 mL,天津博纳艾杰尔公司);LUMTECH M-PFC复杂基质超滤柱(3 mL)、LUMTECH Sin-QuEChERS Nano-Herb中药农残净化柱(内含MWCNTs、PSA及GCB填料)(北京绿绵科技有限公司)。金钗石斛、铁皮石斛样品采集于中国贵州省安龙县、荔波县、独山县、沿河县。
1.2 标准储备液的配制
分别用1 mL胖度移液管吸取上述4种混合标准溶液及26种单标准溶液各1 mL后混匀,合并后的农药混合标准储备液总体积为30 mL,于-4 ℃冷藏保存备用,其中84种目标组分中甲萘威、灭多威及甲胺磷等8个组分在混合标准储备液中重复,所以在后续计算时已把浓度做加和处理。临用前使用倍比稀释法经1.3节中Sin-QuEChERS Nano法处理的空白提取液稀释成基质匹配混合标准工作溶液。
1.3 样品前处理过程
选取500 g以上代表性样品,利用高速粉碎机粉碎后置于自封袋中,标注样品编号,备用。
dSPE法:准确称取2.00 g试样于50 mL离心管中,加入10 mL 1%乙酸乙腈涡旋振荡2 min,超声提取15 min,然后加入萃取包(填料为6.0 g硫酸镁及1.5 g乙酸钠),涡旋振荡1 min,以10 000 r/min离心5 min,准确吸取上清液1 mL加入到纯化管中(150 mg MgSO4、50 mg PSA、50 mg GCB、50 mg C18),然后加入30 μg/mL环氧七氯内标40 μL,涡旋振荡1 min,以10 000 r/min离心5 min,上清液过0.22 μm滤膜后待GC-MS/MS分析。
M-PFC法:准确称取2.00 g试样于5 mL离心管中,加入3 mL乙腈,超声提取10 min,以10 000 r/min离心5 min。移取上述提取液2 mL置于5 mL离心管中,向上缓慢抽动M-PFC柱的注射杆,使2 mL提取液全部经过填料层,往复过柱两次,M-PFC柱注射器端连接0.22 μm滤膜,置于进样小瓶上方,然后缓慢推动注射杆,即得待测液,待GC-MS/MS分析。
Sin-QuEChERS Nano法:准确称取2.00 g试样,加入5 mL水混匀后浸泡20 min,再加入10 mL 1%乙酸乙腈和缓冲盐萃取包,超声提取10 min,以10 000 r/min离心5 min,将Sin-QuEChERS Nano柱插入50 mL离心管内,缓慢按压至刻度处(储液管内净化液约4 mL),用注射器吸取上清液过0.22 μm滤膜,待GC-MS/MS分析。具体Sin-QuEChERS Nano结构示意图如图1所示。
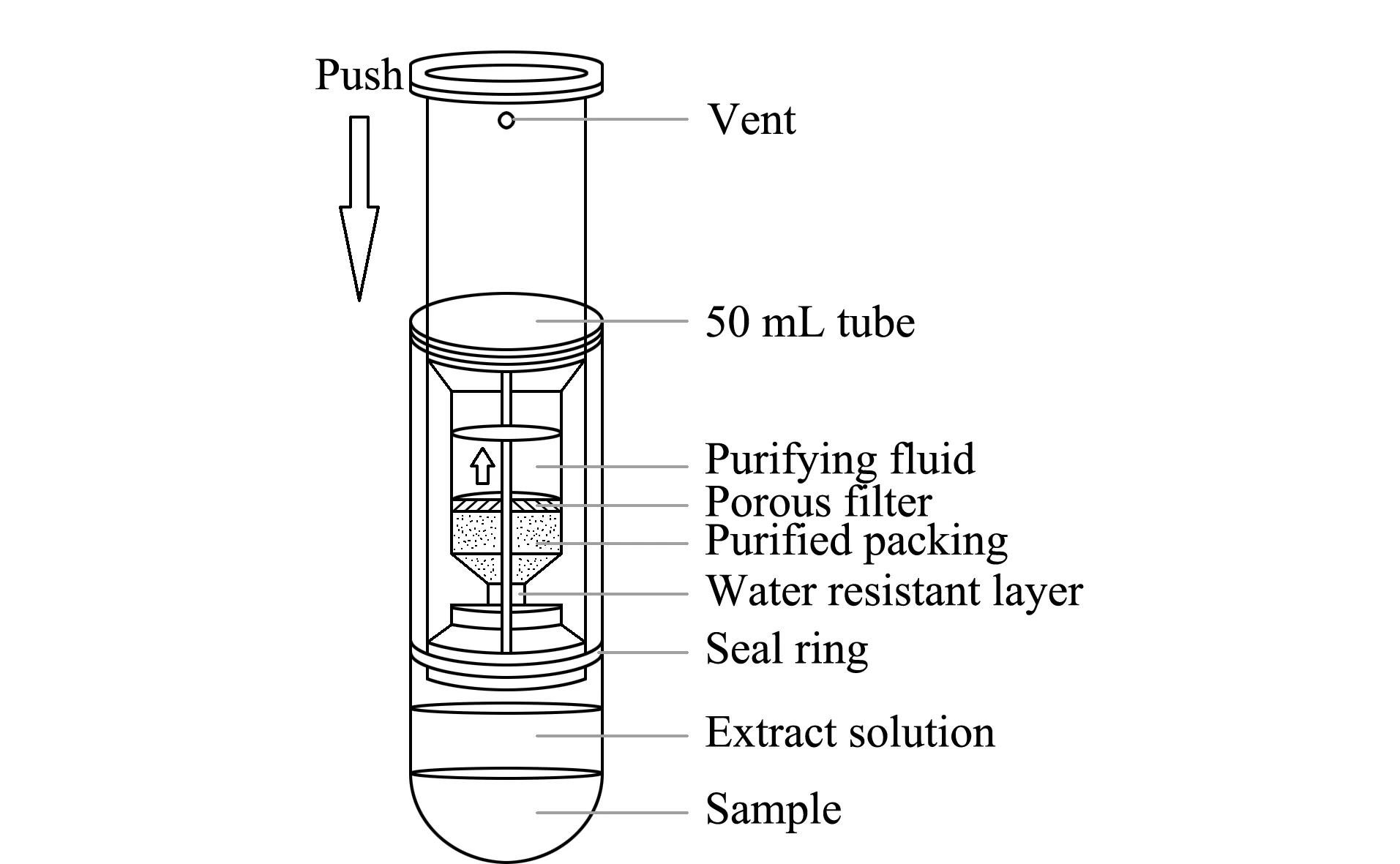
图1 Sin-QuEChERS Nano净化柱的示意图Fig.1 Schematic of the Sin-QuEChERS Nano purification column
SPE法:准确称取2.00 g试样,加入5 mL水混匀后浸泡20 min,再加入10 mL乙腈和3 g氯化钠,超声提取10 min,振荡0.5 min,待液液分层后加入4 g无水硫酸镁,迅速旋上瓶盖,涡旋振荡1 min,以10 000 r/min离心5 min,取上清液5 mL,浓缩至1 mL。先用5 mL淋洗液活化PC/NH2柱,然后用3 mL淋洗液溶解平底烧瓶中的蒸发残留物,合并洗涤液并转移到PC/NH2柱上,当液面降低到固相萃取柱筛板表面后加入淋洗液10 mL,收集淋洗液于15 mL离心管中,浓缩液用氮气吹至近干后用加入1.0 mL丙酮,过0.22 μm滤膜,待GC-MS/MS分析。
1.4 仪器条件
1.4.1色谱条件
色谱柱:Agilent DB-1701MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm),载气:高纯氦气,纯度≥99.999%;碰撞气(CID):氩气,分流模式:不分流进样,进样口温度:250 ℃,程序升温条件:起始温度60 ℃,保持1 min,以40 ℃/min升至120 ℃,再以5 ℃/min升至280 ℃,保持8.5 min,共43 min。流速:1 mL/min;进样量:1.0 μL。
1.4.2质谱条件
电离模式:电子轰击电离(EI);电离能量:70 eV;离子监测模式:多反应监测(MRM);离子源温度:220 ℃;传输线温度:280 ℃;溶剂延迟:5.0 min。目标物的质谱参数见表1。石斛加标样品的总离子流图见图2。
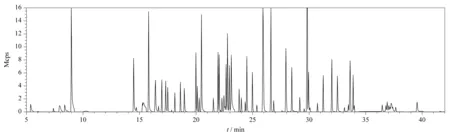
图2 石斛加标样品的总离子流图Fig.2 Total ion chromatogram of spiked dendrobium sample
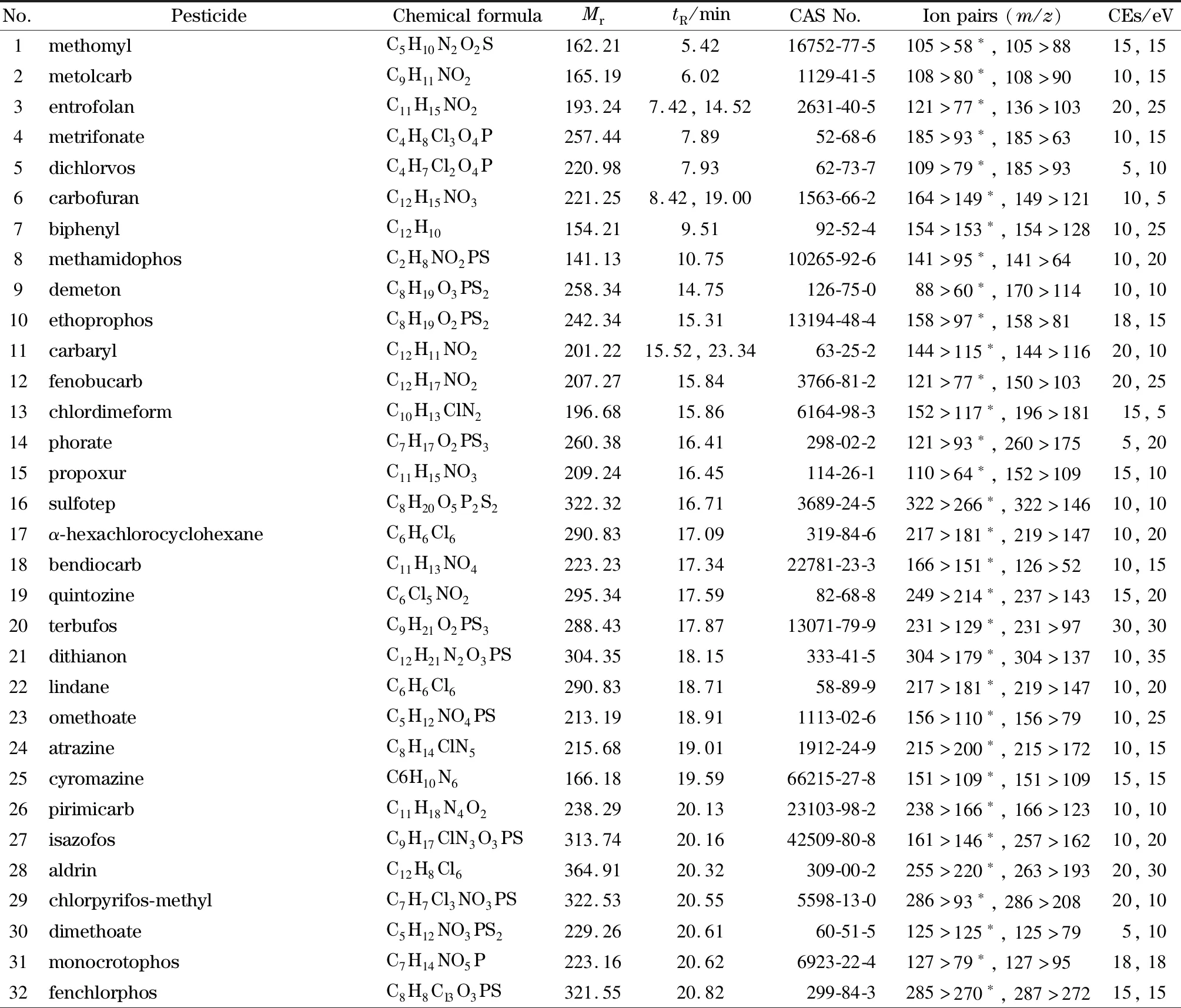
表1 84种农药的保留时间及质谱参数Table 1 Retention times and MS parameters of the 84 pesticides
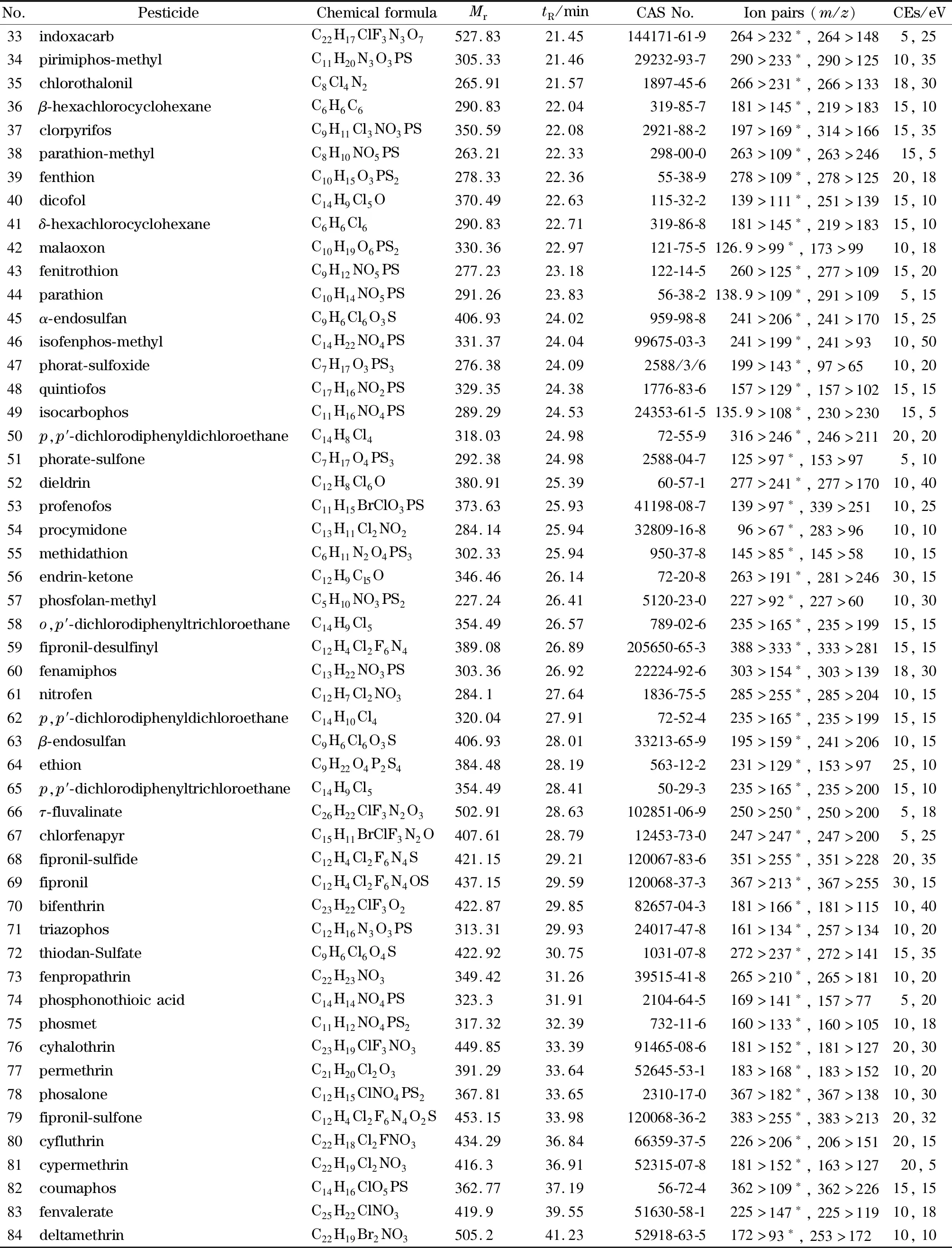
表1 (续)Table 1 (Continued)
2 结果与讨论
2.1 净化方式的比较与优化
石斛类基质中含有色素、糖类、生物碱和有机酸等物质,这些干扰物在提取过程中会和目标物一起浸提出[28]。如果不进行后续的净化处理,不仅会对目标物的定性定量结果造成干扰,而且还会减少衬管的使用寿命和加重离子源的污染程度[29]。目前比较常用的净化方法主要有SPE法、QuEChERS法、dSPE法等。首先将石斛样品在全扫描(Full Scan)模式下进样分析比较,4种净化方式的净化效果,具体如图3所示;将石斛加标样品在MRM模式下进样分析,比较4种净化方式的平均回收率差异。

图3 经不同净化方式处理后石斛提取液在全扫描模式下的总离子流色谱图Fig.3 Total ion chromatograms in full scan mode of the dendrobium extracts cleaned-up by different purification methods
Sin-QuEChERS Nano法、M-PFC法、dSPE法及SPE法的平均回收率分别为90.5%、82.8%、71.2%和65.3%。从图3可以看出,石斛基质经Sin-QuEChERS Nano法及dSPE法净化后的效果较好,但dSPE法的平均回收率远低于Sin-QuEChERS Nano法,而且前处理操作中dSPE法比Sin-QuEChERS Nano法多了一步纯化管净化步骤,单个样品前处理时间需多耗时10 min,不适于批量样品的“萃取净化一体式”检测。其次,dSPE中的萃取管内含有高含量石墨化炭黑,对平面结构农药有一定的吸附[30],导致菊酯类目标农药的回收率偏低,而Sin-QuEChERS Nano净化柱中PSA等固相吸附材料与MWCNTs有效聚合,比石墨化炭黑具有更强的吸附和净化能力[31]。同时,Sin-QuEChERS Nano法加入的缓冲盐萃取包也能有效控制有机相的酸碱度,改善对酸敏感农药的回收率,提取效果也优于普通盐包。
另外本研究分别比较了3款市售Sin-QuEChERS Nano商品化柱,分别是简单基质净化柱、复杂基质净化柱及中药净化柱,从净化效果及回收率结果来看,只有中药净化柱(Sin-QuEChERS Nano柱)可以满足石斛类基质的净化。其次,为了突出本净化方法的适用范围广,研究中分别选取不同部位(茎、叶、花)的金钗石斛样品,经提取后过Sin-QuEChERS Nano柱净化,观察其净化效果,具体如图4所示。

图4 采用Sin-QuEChERS Nano柱净化后石斛样品的净化效果图Fig.4 Purification effect maps of the dendrobium samples cleaned-up by Sin-QuEChERS Nano column a.dendrobium stem;b.dendrobium leaves;c.dendrobium flowers.
从图4可以看出,Sin-QuEChERS Nano柱储液管内净化液均为澄清透明液体,对金钗石斛的茎、叶、花净化效果都较为显著,所以后续实验将Sin-QuEChERS Nano柱作为首选石斛样品净化柱。
2.2 提取方式及提取溶剂的选择
Sin-QuEChERS Nano法是在QuEChERS法基础上改良出的一种全新的样品前处理方法,常应用于含水量较大的蔬菜和水果,当基质的含水量小于20%时,该法会影响细胞间的通透性,不利于农药组分的析出。但是加入水量过多会导致后续液液分层不明显,加入水量过少又达不到改变通透性的效果,在本研究中只有加入5 mL水浸泡20 min后才能全部浸没不同性状及部位的石斛样品(粉状、叶、花、鲜茎等)。其次,本研究石斛样品前处理过程中以加5 mL水及未加水两种操作方式下的平均回收率作为考察指标,进一步考察了目标组分的提取效率。结果显示:样品加入5 mL水浸泡20 min再进行后续操作后,19种水溶性农药回收率有所提高,其回收率范围由62.6%~107.6%提高至68.7%~115.5%,其平均回收率提高了11.3%。所以本研究称量样品后需加入5 mL水浸泡20 min后再进行后续的前处理操作。
此外,提取农药的有机溶剂选择性很多,根据目标组分极性的不同及基质的影响使用较多的试剂主要有1%乙酸乙腈、丙酮等,本研究考察Sin-QuEChERS Nano法中这两种不同提取溶剂的提取效果,结合提取液颜色及提取率作为考察指标。结果如图5所示:当用1%乙酸乙腈、丙酮作为提取溶剂时,各目标组分的提取率均大于68.7%,但用丙酮作为提取溶剂时,提取液的颜色较深且体积较少,不利于后续的净化操作,所以后续的实验操作均以1%乙酸乙腈作为提取溶剂。
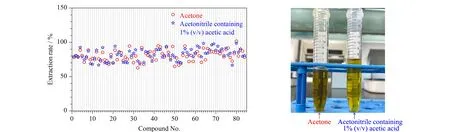
图5 不同提取溶剂对提取率的影响及提取液颜色的比较Fig.5 Effect of different extraction solvents on the extraction rates and comparison of the color of the extractsCompound Nos.were the same as those in Table 1.
2.3 基质效应
本研究为考察84种农药的基质效应,分别采用净化效果较好的dSPE法和Sin-QuEChERS Nano法进行前处理操作,石斛中目标农药的基质效果如图6所示。结果显示:Sin-QuEChERS Nano法的ME为101%~158%,其中40种农药的ME>120%,而dSPE法的ME范围为109%~189%,其中54种农药的ME>120%。由此可见,与液相色谱-质谱法不同的是,气相色谱-串联质谱法的基质效应大多数以增强为主,Sin-QuEChERS Nano法比dSPE法更有效减小了基质效应。所以本研究为了减少基质效应对定量的影响而采用基质匹配工作曲线外标法定量[32]。
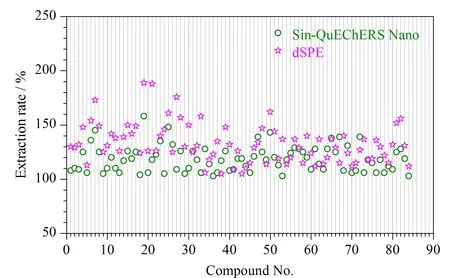
图6 使用不同净化方法时石斛中目标农药的基质效应Fig.6 MEs of the target pesticides in dendrobium using different purification methods
2.4 线性范围、检出限、定量限及加标回收率
在GC-MS/MS确证的实验条件下,取石斛空白样品按样品制备处理后得到空白基质,分别加入6个不同浓度的混合标准溶液,在上述的质谱条件下进行测定。以目标农药的峰面积Y为纵坐标,相对应的质量浓度X(μg/L)为横坐标绘制标准曲线。同时,采用空白石斛样品中添加目标物的方法,以3倍和10倍信噪比(S/N)对应的含量确定检出限(LOD)和定量限(LOQ)。取数份经GC-MS/MS验证无目标物的石斛空白样品,分别添加50 μL和250 μL不同质量浓度的混合标准使用液,按照上述优化后的方法进行样品前处理,并上机分析,平行测定6次。
84种化合物的线性方程、线性范围、相关系数(r2)、检出限、定量限、加标回收率及相对标准偏差如表2所示。84种目标物线性关系良好(r2>0.99)。采用加标回收的方法确定方法的检出限及定量限分别为1.5~5.8 μg/kg和5.0~15.0 μg/kg;84种化合物加标回收率为68.7%~116.2%,RSD(n=6)为5.2%~14.8%。表明本方法重复性良好,可满足实际检测的需要。
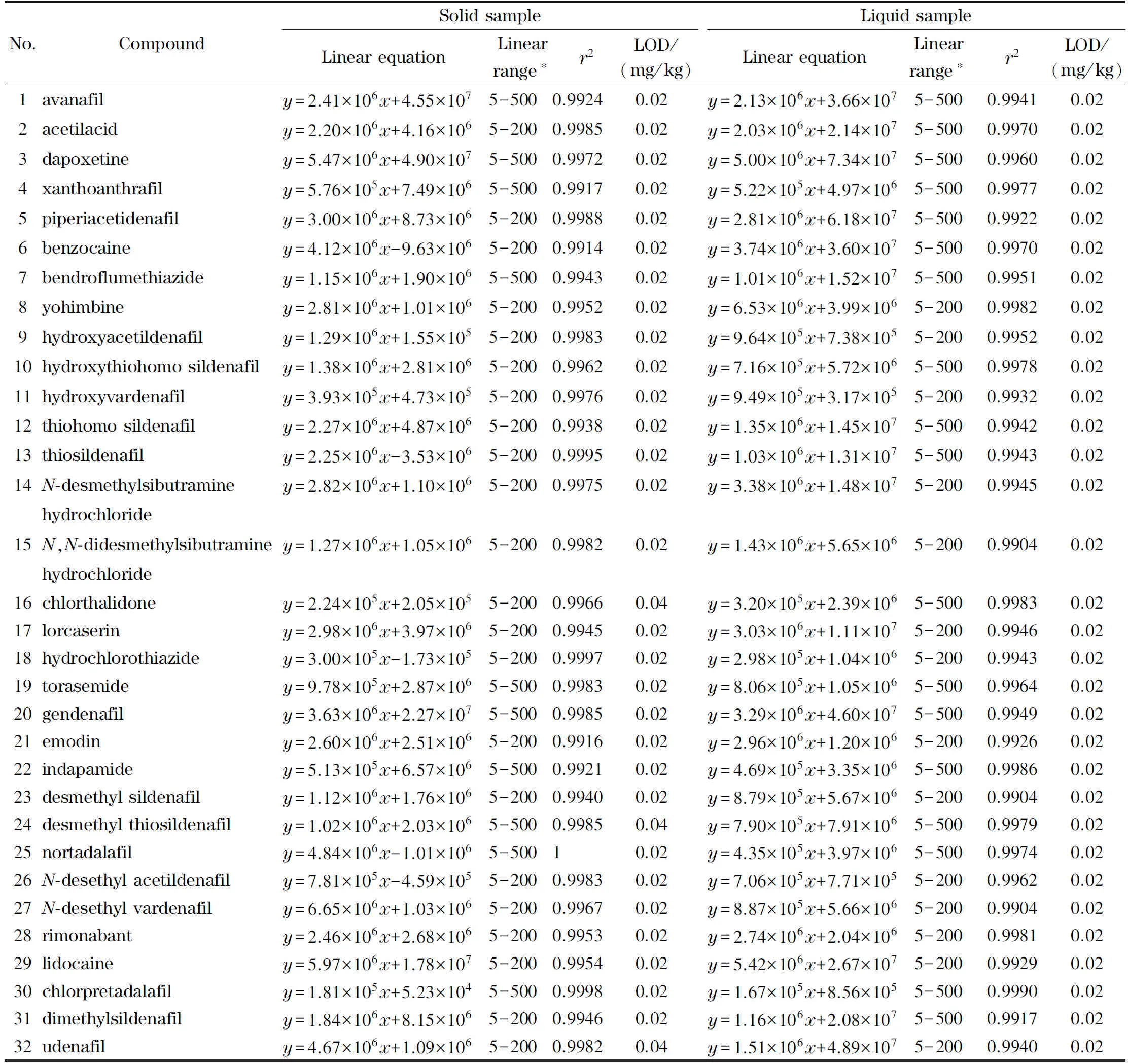
表2 84种化合物的线性方程、线性范围、相关系数、检出限、定量限、加标回收率及相对标准偏差(n=6)Table 2 Regression equations,linear ranges,correlation coefficients (r2),LODs,LOQs,spiked recoveries and RSDs of the 84 pesticides (n=6)

表2 (续)Table 2 (Continued)
2.5 实际样品测试
采用本研究建立的方法对贵州省安龙县、荔波县、独山县、沿河县采集的共80份样品进行监测,样品类别包含石斛枫斗、金钗石斛(花、茎、叶)及铁皮石斛(花、茎、叶、粉、片)。
结果表明,其中12份样品中检出农药残留,检出率为15%,检出的农药频次较高的有毒死蜱(0.08~0.5 mg/kg)、百菌清(0.06~3.2 mg/kg)、腐霉利(0.03~0.15 mg/kg)、甲基对硫磷(0.04~0.23 mg/kg)、氯氟氰菊酯(0.10~2.68 mg/kg)、克百威(0.015~0.02 mg/kg),同时检出农药的残留量均未超过国家标准GB 2763-2021《食品安全国家标准食品中农药最大残留限量》及地方标准DBS 52/048-2020《食品安全地方标准铁皮石斛茎》规定的最大残留限量值。图7为阳性样品中典型目标物的总离子流图。

图7 阳性样品中典型目标物的总离子流图Fig.7 Total ion chromatograms of typical targets in positive samples
3 结论
本研究基于Sin-QuEChERS Nano柱开发了一种快速筛查石斛中多种农药残留的方法。通过对Sin-QuEChERS Nano与经典dSPE、SPE、QuEChERS法的净化效果、提取回收率进行比较及方法学参数验证,表明Sin-QuEChERS Nano柱在净化效果方面表现更好。该法充分简化了样品的净化过程,同时提高了检测效率和准确性,更加适合批量样品中多组分农药残留的筛查及确证工作。
