白木香响应真菌侵染与机械损伤胁迫的生理机制
2022-05-24薛世玉李小飞徐大平崔之益
张 鹏,薛世玉,李小飞,徐大平,崔之益
(中国林业科学研究院热带林业研究所,广东 广州 510520)
白木香(Aquilaria sinensis(Lour.) Spreng.)又称土沉香、香树、女儿香、牙香树,是瑞香科(Thymelaeaceae)沉香属(Aquilaria)常绿乔木,为我国特有珍贵药用植物、国家二级重点保护野生植物[1-2]。白木香受到外界胁迫后能产生沉香,是我国生产沉香的重要植物资源。沉香是名贵的传统中药材[3],也是一种天然的高级香料[4-6],同时在世界五大宗教中备受推崇[7]。由于沉香在药用、香料、宗教、收藏等方面的广泛用途,使其在国内外供不应求[8-9]。为了沉香资源的可持续利用,培育沉香人工林与人工诱导结香是目前解决沉香紧缺的有效途径。
物理机械损伤、化学物质刺激以及微生物与病虫害侵染均能诱导沉香形成。物理、化学或生物因素都是沉香形成的诱因,它们作为激发子诱导沉香树防御反应的发生,使沉香树体产生具有防御作用的次生代谢产物(倍半萜和2-(2-苯乙基)色酮类物质),这些次生代谢产物与细胞其他组分复合形成导管填充物(侵填体),对沉香次生木质部导管造成堵塞,从而抵御外界物理机械损伤、化学物质刺激以及微生物与病虫害侵染对沉香树体的进一步伤害,最终形成沉香[10]。
目前,关于白木香的结香机理尚未有定论,对沉香形成的研究主要集中在沉香组成成分分析[11-12]、沉香形成机理假说验证[10,13-14]、人工诱导结香方法[15-16]、沉香物质合成代谢途径以及形成过程信号调控机制等方面[17-18]。虽然前人对白木香结香过程中的防御反应已有大量研究[19-20],但对与其生长相关的内源激素、光合、荧光等生理特性缺乏关注。鉴于白木香的结香过程不仅是沉香属植物进行胁迫防御的过程,也是一种防御与生长的动态平衡过程。因此,研究白木香结香过程的防御与生长的动态平衡状态,对揭示其结香机制,促进白木香结香具有重要意义。
本研究应用注射真菌菌剂与机械损伤2 种诱导结香方法对白木香进行胁迫制香,通过分析其调控生长与防御的激素含量、抗氧化酶活性、防御物质总酚与总萜含量以及光合与叶绿素荧光特性等,研究白木香对真菌侵染及机械损伤胁迫的生理响应,以期探明白木香结香过程的生长与防御过程,揭示其结香过程的生理响应机制,为促进白木香结香提供理论依据。
1 研究方法
1.1 试验材料与设计
试验于2020 年9 月在广西省北流市石窝镇良冲沉香产业示范园进行(22°15′ N, 110°50′ E, 海拔426 m)。选取生长健壮、无病虫害、生长环境相同、长势一致的3 年生普通白木香,分别设置生物诱导(注射真菌菌剂)、物理诱导(树干钻孔)与空白对照3 种处理,每组处理选取10 株样本,3 次重复,共计30 株。普通白木香平均树高与地径(距地面10 cm 直径)分别为(2.95±0.66)m、(6.44±1.49)cm。
1.1.1 真菌胁迫组设置 采用直径0.5 cm 钻头的电钻在树干两侧距离地面80 cm 处分别钻孔,以打点滴输液方式注入配好的菌液(黑绿木霉菌 +腐皮镰孢菌 + 龙眼焦腐菌(菌液体积比1:1:1))250 mL,真菌诱导结香实验菌液配比方法参照宋晓琛等[21]方法,略有改动。
1.1.2 机械损伤胁迫组设置 采用直径0.5 cm 钻头的电钻在树体的基部0.5 m 处直至树干顶端(直径约5 cm)全面打洞钻孔,上下洞口相距5 cm。
分别于处理后第1、3、6 个月,选取中上部枝条顶端下第3~4 片生长健壮的成熟功能叶,进行光合及荧光指标测定;同时,每个处理随机选择6 株树,将其钻孔伤口上方1 cm 处的适量木块取下,取样后用锡箔纸包好,迅速放入液氮中直至冷冻彻底,运回实验室后,将液氮速冻样品放置于−80 ℃的超低温冰箱中保存,用于生理生化指标测定。
1.2 生理指标测定
1.2.1 激素含量、抗氧化酶活性与防御物质含量测定 使用酶联免疫法测定白木香茎干内源激素(茉莉酸(JA)、水杨酸(SA)、乙烯前体(ACC))的含量和抗氧化酶(过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、多酚氧化酶(PPO)、抗坏血酸氧化酶(APX)、谷胱甘肽还原酶(GR))活性。次生代谢防御物质总酚类(Phenol)与总萜类(Terpene)分别以没食子酸、芳樟醇作为标准品,使用分光光度测定其含量[22-23],且均以鲜质量计。
1.2.2 光合指标测定 在晴朗天气的上午9:00—11:30,利用光合仪(Li-6400 XT),在饱和光强下完成光诱导,稳定后测定叶内气体交换参数,包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),每组测定3 株,每株测定3 次。测定时设定光合有效辐射为1 500 μmol·m−2·s−1,相对湿度为60%~70%,叶室温度为20 ℃,CO2浓度为400~410 μmol∙mol−1[24]。
1.2.3 叶绿素荧光参数测定 利用便携式脉冲调制叶绿素荧光仪(OPTI-Sciences OS5P,USA)于天气晴朗的上午9:00—11:30 进行叶绿素荧光参数测定,每组测定3 株,每株测定3 次,取平均值。在光照充足下进行,将叶夹夹在叶片中部,叶片暗适应30 min 后,先测定吸光系数、初始荧光(F0),照射一个饱和脉冲光(2 500 μmol·m−2·s−1)后,测量最大荧光(Fm)、可变荧光(Fv)、PS Ⅱ原初光能转化效率(Fv/Fm)和PSⅡ潜在活性(Fv/F0)等。
1.3 数据处理
采用SPSS 22.0 软件进行显著性分析,单因素方差分析(One-way ANOVA)白木香不同胁迫处理间与受胁迫不同时间各指标的差异,Duncan法进行多重比较,显著性检验α=0.05,Excel 2016制表做图。
2 结果与分析
2.1 真菌侵染(BS)及机械损伤(AS)对白木香内源激素含量的影响
图1 表明:与对照相比,在受胁迫1 个月与3 个月时,激活防御反应的激素茉莉酸、水杨酸、乙烯前体含量都上调,含量基本显著高于对照(胁迫3 个月的水杨酸除外),而负责协调植物生长的赤霉素与生长素的含量显著低于对照;在受胁迫6 个月后,水杨酸与赤霉素含量在AS 处理中与对照差异不显著,同时生长素含量在3 组处理间均无显著差异。

注:图中数据为平均值±标准误,不同大写字母表示处理间在同一时间差异显著(p<0. 05)。不同小写字母表示同一处理在不同时间间差异显著(p<0. 05)。CK: 对照;BS:真菌侵染;AS:机械损伤。下同。Notes: Data are presented in the mean ± SE.Different capital letters indicate the significant differences atp<0. 05 level among treatments at the sampling time.Different small letters indicate that the same treatment has significant differences atp<0. 05 level in the different sampling time. CK: control check; BS: biological Stress; AS: abiotic stress. The same below.
随胁迫处理时间的延长,茉莉酸、水杨酸与乙烯前体含量逐步降低,而赤霉素与生长素的含量在白木香茎干中逐渐增加。胁迫第6 个月与第1 个月相比,茉莉酸含量在BS 和AS 胁迫中分别显著降低了20.78%、18.00%,水杨酸含量分别显著降低了18.22%、15.98%;而赤霉素含量分别显著增高了33.98%、34.63%,生长素含量分别显著增高了17.55%、16.92%。
2.2 真菌侵染(BS)及机械损伤(AS)胁迫对白木香抗氧化酶活性的影响
由图2 可知:在胁迫1 个月时,BS 和AS 的6 种抗氧化酶活性都显著高于对照;在胁迫3 个月时,除APX 与GR 外,其余4 种抗氧化酶活性也显著高于对照;在胁迫6 个月时,SOD,CAT,PPO,APX 的活性均与对照无显著差异。

图2 不同胁迫对白木香抗氧化酶活性的影响Fig. 2 Effect of different stress on the antioxidant enzyme activity ofAquilaria sinensis
2.3 真菌侵染(BS)及机械损伤(AS)胁迫对白木香防御物质的影响
图3 表明:在胁迫1 个月时,总酚与总萜含量与对照差异显著,其中,BS 和AS 的总酚含量分别比对照增加了57.10%、33.10%,总萜含量分别增加了54.02%、27.33%;当胁迫6 个月时,BS 和AS 的总酚含量分别是对照的1.90、1.71倍,总萜含量分别是对照的2.24、2.20 倍。

图3 不同胁迫对白木香总酚和总萜含量的影响Fig. 3 Effect of different stress on the total phenols and total terpenes ofAquilaria sinensis
在受胁迫过程中,总酚和总萜含量随时间的延长而增加,其中,BS 的总酚含量第3 个月与第6 个月分别比第1 个月增加了26.34%、42.32%,总萜类含量分别比第1 个月增加了16.39%、35.54%;AS 的总酚含量第3 个月与第6 个月分别比第1 个月增加了40.10%、50.78%,总萜含量分别比第1 个月增加了13.83%、61.36%。
2.4 真菌侵染(BS)及机械损伤(AS)胁迫对白木香光合作用的影响
由图4 可知:与对照相比,在BS 和AS 胁迫1 个月时,白木香叶片的Pn、Gs、Tr和WUEi均下降,而Ls增加,其中,BS 和AS 胁迫的Pn分别下降了27.47%、25.23%,Gs分别下降了28.97%、20.11%,Tr分别下降了23.90%、11.63%,WUEi分别下降了4.83%、15.50%,Ls分别增加了14.61%、6.96%。

图4 不同胁迫对白木香光合参数的影响Fig. 4 Effect of different stress on photosynthetic parameters ofAquilaria sinensis
在胁迫6 个月时,AS 处理的Pn与对照无显著差异,BS 胁迫的Pn与对照差异显著,BS 和AS 处理的Gs、Ci、Tr显著高于对照,而Ls比对照分别降低了11.45%、25.70%。
2.5 真菌侵染(BS)及机械损伤(AS)胁迫对白木香叶绿素荧光的影响
由表1 可知:受到胁迫后F0较对照显著增加,但随时间的延长增幅变小;胁迫1 个月时,BS 和AS 处理的F0较对照分别增加了37.19%、33.02%;胁迫3 个月时,BS 和AS 处理的F0较对照分别增加了25.25%、18.83%;胁迫6 个月时,BS 和AS 处理的F0较对照分别增加了7.30%、12.04%。
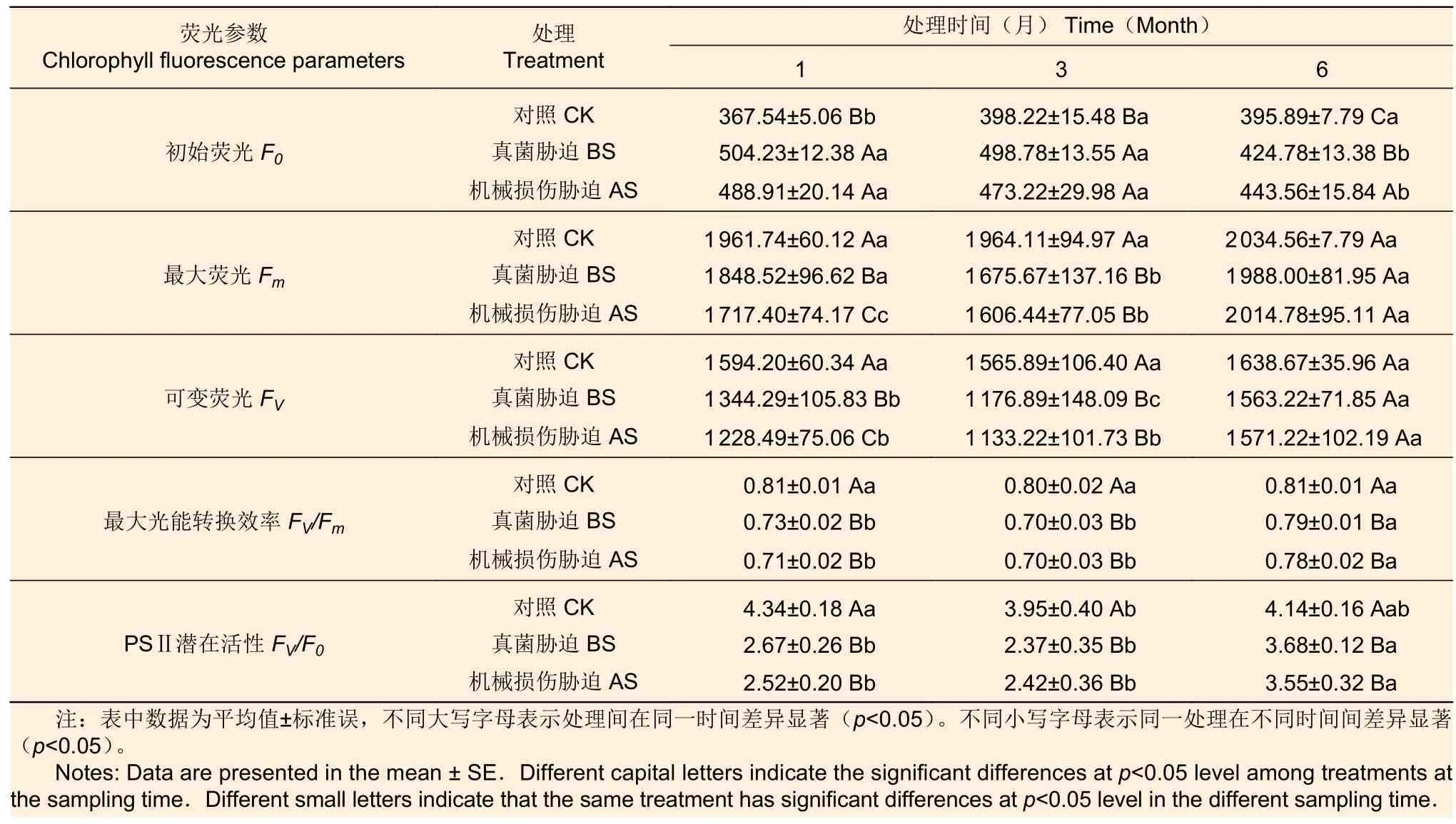
表1 不同胁迫对白木香叶绿素荧光的影响Table 1 Effect of different stress on chlorophyll fluorescence parameters ofAquilaria sinensis
胁迫1 个月与3 个月时,BS 和AS 处理的Fm、Fv与对照差异显著,而胁迫6 个月时,BS 和AS 处理的Fm、Fv与对照差异不显著。
BS 和AS 处理后,叶片叶绿素荧光参数Fv/Fm与Fv/F0均显著下降,随处理时间的延长降幅减小;胁迫1 个月时,BS 和AS 处理的Fv/Fm较对照分别下降9.88%、12.35%;胁迫6 个月时, BS和AS 处理的Fv/Fm较对照分别下降了2.47%、3.70%。胁迫1 个月时,BS 和AS 处理的Fv/F0较对照分别下降了38.48%、41.94%。胁迫6 个月后, BS 和AS 处理的Fv/F0较对照分别下降了11.11%、14.25%。
3 讨论
3.1 真菌侵染(BS)及机械损伤(AS)胁迫对白木香内源激素的影响
植物的防御反应依赖于各种信号通路的复杂相互作用,每一种激素启动一个特定的分子途径,这些不同的激素途径被整合在一个协同、拮抗和相互作用的复杂网络中[25]。在胁迫条件下,防御反应会被激活,然而,作为防御反应的一部分,植物生长会受到抑制。此外,防御反应中的植物激素(包括茉莉酸、水杨酸、乙烯、脱落酸)通常与生长相关的激素(如赤霉素、油菜素内酯、细胞分裂素和生长素)起拮抗作用[26-27]。
本研究中,在胁迫初期,防御相关的激素含量上调,而负责生长的激素含量降低,表明白木香的防御反应被激活,防御反应占主导地位。在胁迫6 个月后,很多激素含量处理与对照之间差异不显著,表明无论是防御类激素还是生长类激素都朝着正常生长状态靠近。研究表明,随着胁迫持续时间和强度的变化,各激素信号通路的拮抗和协同互作,在植物应对各种胁迫时平衡着生长与防御,调节植物生长发育[28]。
3.2 真菌侵染(BS)及机械损伤(AS)胁迫对白木香抗氧化酶的影响
植物在逆境胁迫下产生的超氧阴离子自由基(O2▪-)等易造成膜脂过氧化,而植物抗氧化酶系统能够降低产生的O2▪-量,从而维持植株的正常生长[29]。通过抗氧化酶系统中的过氧化氢酶、过氧化物酶以及超氧化物歧化酶能将植物体内过氧化物自由基分解清理[30]。多酚氧化酶与酚类物质反应生成醌类物质,可增加植物对生物胁迫和非生物胁迫的抗性[31]。抗坏血酸氧化酶与其它氧化还原反应相偶联起到末端氧化酶的作用,能催化抗坏血酸的氧化[32]。谷胱甘肽还原酶将氧化型谷胱甘肽还原成还原型谷胱甘肽,从而为活性氧的清除提供还原力,保护植物免受伤害[33]。
本研究中,随着胁迫时间的延长,抗氧化酶活性随着减少。植物的胁迫反应涉及动态的生长调节,胁迫条件下生长受到限制,当条件改善后,迅速恢复[34]。夏蕴等[35]研究也表明,当植物胁迫条件减轻或者消失时,其抗氧化酶活性增幅也随之减少,与本研究结果类似。
3.3 真菌侵染(BS)及机械损伤(AS)胁迫对白木香防御物质的影响
植物受到胁迫时能激活自身防御反应,启动次生代谢合成,可产生萜类、酚类、含氮化合物,有利于防御自身和抵御生物和氧化物质的伤害[36]。张争等[37]在白木香的研究中表明,萜类含量增多是植物启动相应的防御反应和抵御伤害胁迫的重要机制。
与对照相比,受胁迫白木香中的总酚与总萜含量差异显著,且随胁迫时间的延长总酚和总萜含量增加。此外,BS 处理的总酚与总萜含量高于AS处理,表明真菌侵染对于白木香来说胁迫强度可能更大,对其损伤更严重。白木香防御外界伤害的次生代谢产物,凝结于木材内,形成了沉香,而随胁迫时间的累积,沉香物质也在不断积累,从而使沉香的产量增加[6]。
3.4 真菌侵染(BS)及机械损(AS)伤胁迫对白木香光合作用的影响
当植物受到胁迫时光合作用受阻,净光合速率降低[38]。本研究中,BS 和AS 胁迫3 个月时,白木香叶片的Pn、Gs、Tr 和WUEi较对照基本下降,而Ls增加。Pn、Gs和Ci值三者同时降低,说明光合作用受气孔限制影响[39]。BS 和AS 胁迫对白木香茎干部分造成了损伤,影响了植物水分运输,减少光合作用原料供给,从而使气孔部分关闭,进而影响植物的光合速率。在AS 胁迫6 个月时,Pn与对照无显著差异,BS 胁迫的Pn与对照差异显著。相对于AS,BS 处理可能对白木香所造成的胁迫强度更大,损伤更严重,意味着白木香在受到胁迫后也在不断的修复损伤情况,恢复最佳生长的状态。华建峰等[40]对胁迫解除后中山杉的生长和光合特性进行研究,发现其能够通过合理调整生长和光合策略得到恢复。
3.5 真菌侵染(BS)及机械损伤(AS)胁迫对叶绿素荧光的影响
叶绿素荧光参数可用来评价植物生理变化和光能利用[39,41]。BS 和AS 处理的叶绿素荧光参数较对照差异显著,但随胁迫时间的延长差异变小,其中,F0值增加,说明PSⅡ受到损伤[42]。Fv/Fm与Fv/F0均显著下降,说明真菌及机械损伤胁迫使白木香PSⅡ等光合机构遭受伤害,光化学活性降低,产生了光抑制。光能在叶片中不能顺利转化为化学能,过剩的激发能易使光合机构受到损伤从而导致光破坏[43]。在受胁迫6 个月时,Fv/Fm与Fv/F0降幅减小,表明白木香光合组织的光系统(PSⅡ)在损伤后得到了一定修复[44]。
4 结论
综上所述,当白木香受到真菌侵染与机械损伤胁迫时,激活防御反应的激素含量显著升高,抗氧化酶活性增加,同时防御次生代谢产物酚类与萜类增加,光合作用受到抑制;而随着时间的推移,白木香生长获得恢复,胁迫得到缓解,表明白木香结香过程是生长与防御的动态平衡过程。本文研究了白木香对真菌侵染与机械损伤胁迫的生理响应特征,初步阐述了白木香结香过程的生长与防御过程,为进一步揭示其结香生理机制奠定基础,为促进白木香结香提供理论依据。在今后的研究中可考虑定期对白木香进行胁迫,使其维持高强度防御状态,提高沉香成分等次生代谢产物的合成,进而促进白木香结香。
