以癫为主要表型的16p11.2微缺失综合征11例病例系列报告
2022-05-24叶园珍麦嘉卉胡湛棋廖建湘
叶园珍 麦嘉卉 胡湛棋 陈 黎 廖建湘 段 婧

1 方法

1.3 资料截取 从病历系统中截取患儿的临床表型,常规实验室检查结果;血液串联质谱和尿液气相色谱质谱检测,视听觉诱发电位,影像学检查报告(脑电图和头颅MR),神经心理评估结果,治疗和随访情况。
1.4 随访 患儿出院后常规行门诊随访,未至门诊随访者行电话随访。本文随访截止日期为2021年12月。
1.5 遗传学检测方法 在取得患儿父母的知情同意后,采集患儿及其父母的外周静脉血,送安吉康尔医学检验实验室进行核心家系的全外显子检测或全基因组检测。
全基因组检测方法:采用全血DNA提取试剂盒提取基因组DNA,超声随机打断为200~300 bp的DNA片段,纯化后构建全基因组测序文库,在Illumina高通量测序平台进行全基因组测序,平均覆盖深度为30×。得出数据后进行基因序列的生物信息学分析,突变命名参考人类参考基因组GRCh37。
全外显子检测方法:提取基因组DNA,采用全外显子高通量测序技术通过靶向探针捕获和高通量二代测序对人类近2万个基因的外显子及其上下游约20 bp的区域进行测序。获得原始测序序列(fastq文件)后,首先使用BWA将reads比对到人参考基因组(GRCH37/hg19)上,并使用SAMtools进行reads信息统计及排序。使用Picard对比对结果进行去重处理。再使用GATK标准变异检测流程检测变异,突变命名参考人类参考基因组GRCh37。
2 结果

2.2 体格检查及辅助检查 表1显示,11例头围及体重均在正常范围,未见特殊面容,例3发色黄,例7和11各有牛奶咖啡斑1块。血液串联质谱和尿液气相色谱质谱检测、视听觉诱发电位均未见异常。8例脑电图见间期放电,放电部位不定,分布于额区、枕区、颞区;3例脑电图背景正常或界限。11例均行头颅MR,例9胼胝体、双侧侧脑室前脚旁及扣带回见白质异常信号,余10例未见异常。
9例行神经心理评估,7例<6岁者行2016版儿童神经心理行为检查量表(简称儿心量表)[9]评估,平均DQ值为90.6±7.0;其中平均语言值76.3±10.6,警示行为均为0。例5在9岁时行韦氏智力测试,提示智力发育落后,语言相当于同年龄同性别的P1水平。例7行韦氏学龄前儿童智力测验量表测试,提示语言63分。例4、6和10生长发育同正常同龄儿,未见落后表现。
2.3 遗传学分析 图1基因检测显示,11例均提示16p11.2微缺失,缺失范围524~908 kb,8例为新发突变,例11和9分别遗传自无症状的父亲和母亲,例8来源不明。

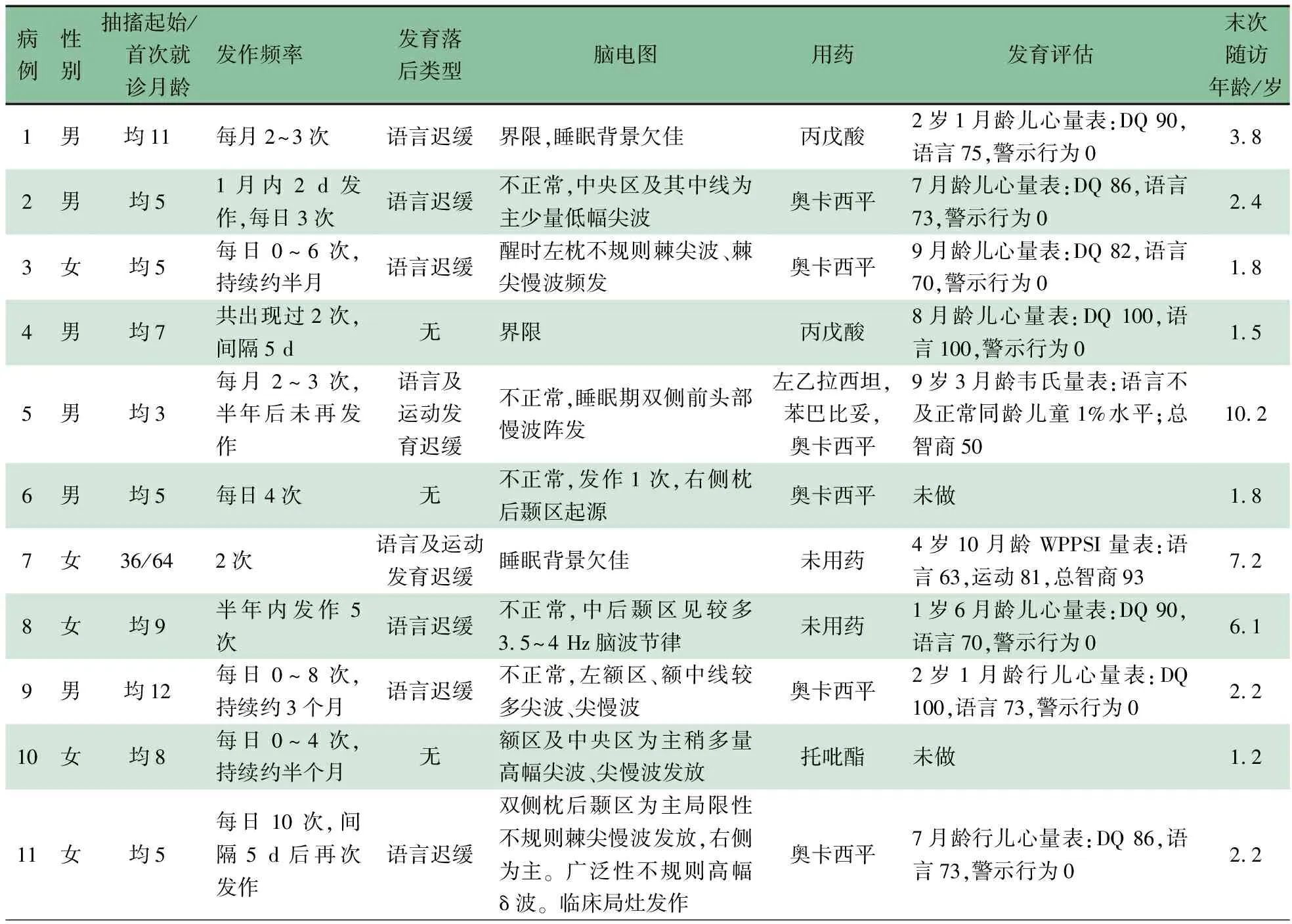
表1 11例16p11.2微缺失综合征患儿的临床特征
3 讨论

本文例5在9岁6月时出现PKD,亦考虑与缺失染色体含有PRRT2基因相关,结合病史,确诊为16p11.2微缺失综合征及PKD,加用奥卡西平治疗,疗效佳。目前仅有9例报道16p11.2微缺失综合征表现为PKD[4],发生率较PRRT2基因变异率低,可能与16p11.2微缺失综合征外显率有关。本文病例提示16p11.2微缺失综合征为引起PKD的遗传学病因之一,需引起重视。同时,本文其他病例需警惕后期有PKD可能,应注意随访。
16p11.2 微缺失综合征是ASD最常见的已知遗传病因之一(0.5%)[22]。ASD患者的遗传筛查中发现16p11.2缺失或重复,提示其为ASD较强的遗传危险因素[2]。多项研究显示,16.1%~25.6%的16p11.2缺失携带者有ASD特征或被确诊为ASD[2]。此外,在16p11.2微缺失综合征患者中,伴有发育迟缓(包括运动及语言)占50%~57%[19, 23]。本文11例患儿中9例行神经心理评估,发现8例患儿语言发育迟缓。例5出现智力发育障碍,9岁时韦氏智力量表检测总分50,符合16p11.2微缺失综合征表现。例6和例10未行神经心理评估检查,生长发育同正常同龄儿。11例均经评估后未发现ASD倾向。


